化学专题7硫酸亚铁铵制备练习
- 格式:doc
- 大小:260.07 KB
- 文档页数:6
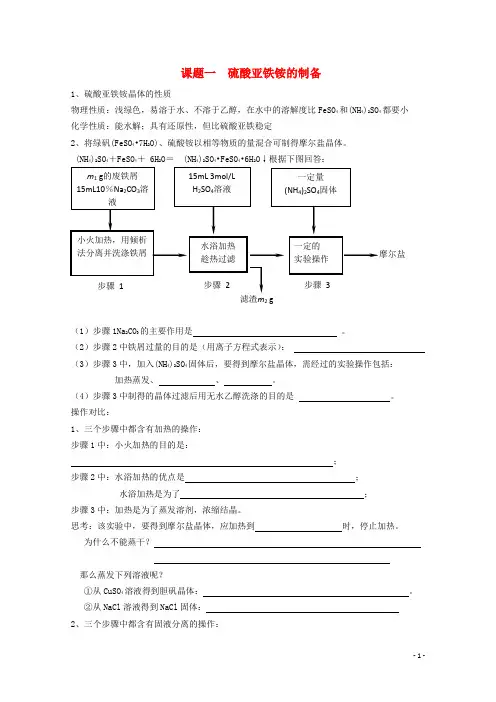
课题一硫酸亚铁铵的制备1、硫酸亚铁铵晶体的性质物理性质:浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小化学性质:能水解;具有还原性,但比硫酸亚铁稳定2、将绿矾(FeSO4•7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体。
(NH4)2SO4+FeSO4+ 6H2O= (NH4)2SO4•FeSO4•6H2O↓根据下图回答:(1)步骤1Na2CO3的主要作用是。
(2)步骤2中铁屑过量的目的是(用离子方程式表示):(3)步骤3中,加入(NH4)2SO4固体后,要得到摩尔盐晶体,需经过的实验操作包括:加热蒸发、、。
(4)步骤3中制得的晶体过滤后用无水乙醇洗涤的目的是。
操作对比:1、三个步骤中都含有加热的操作:步骤1中:小火加热的目的是:;步骤2中:水浴加热的优点是;水浴加热是为了;步骤3中:加热是为了蒸发溶剂,浓缩结晶。
思考:该实验中,要得到摩尔盐晶体,应加热到时,停止加热。
为什么不能蒸干?那么蒸发下列溶液呢?①从CuSO4溶液得到胆矾晶体:。
②从NaCl溶液得到NaCl固体:2、三个步骤中都含有固液分离的操作:步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有:A、沉淀的颗粒较大B、沉淀容易沉降C、沉淀呈胶状D、沉淀呈絮状步骤2中溶液趁热过滤的原因是。
步骤3中可以用如下装置进行过滤:(1)这种过滤方式称为:(2)这种过滤跟普通过滤相比,除了过滤速度快外,还有一个优点是:。
(3)你能讲出仪器A、B、C的名称么?摩尔盐产品中离子的检验:例:为检验硫酸亚铁铵晶体中的NH4+、Fe2+、SO42-,(1)甲同学提出可以用湿润的试纸、稀盐酸和溶液检验出这三种离子。
(2)乙同学提出检验产品中的Fe2+ 、可以用KSCN溶液和另一种试剂来检验,试简述操作和现象:。
但是实际操作中,乙加入KSCN溶液后发现溶液变为浅红色,于是对自己提出的方法产生怀疑。
丙同学仔细思考后认为,可以从另一现象证明产品中的Fe2+,该现象是:。

高中化学精选内容重点知识精选高中更注重自学的能力,到大学之后这一能力会得到升华。
在开学之前就自己学习,不仅能纠正初中的学习方式,也能做到先人一步,做到温故而知新。
而对于升高二的同学,如果已经偏科了,那么可以利用假期把知识点巩固复习,不然后期就更难学习了!今天给大家整理了《高中化学全册笔记》每一章的基础知识点都有。
化学基础打好,内容知识熟记,肯定可以拿高分哟!高中化学和你一起共同进步学业有成!TB:小初高题库班级:姓名:硫酸亚铁铵的制备2013/3/13一、硫酸亚铁铵的性质1、分子式为、_____ _色晶体,商品名为______ ___,是一种______盐,溶于水,溶于乙醇2、一般亚铁盐在空气中易被____ __,形成复盐后就比较稳定,被氧化3、与其他复盐一样,(NH4)2 SO4·FeSO4·6H2O在水中的溶解度比组成它的每一种盐FeSO4或(NH4)2SO4都要__ __二、硫酸亚铁铵的制备1、制备原理(1)(NH4)2 SO4·FeSO4·6H2O在水中的溶解度比组成它的每一种盐FeSO4或(NH4)2SO4都要__ __。
将等物质的量的FeSO4、(NH4)2SO4溶液___ ___,冷却至室温,则析出______ ___晶体。
FeSO4可由与稀硫酸反应制得化学方程式如下:_______ ____________________,______ ___________________________________ (2)主要原料:硫酸铵、铁屑、稀硫酸2、硫酸亚铁铵的制备(1)铁屑的净化5g铁屑→15mL1mol/LNa2CO3溶液浸泡(煮沸)→倾析法分离→洗涤→晾干1)N a2CO3溶液浸泡的目的:2)将碱液倒掉的方法:【倾析法】①当沉淀的结晶颗粒时,静置后容易沉降至容器底部,此时将上层清夜沿倒入另一容器,即可使沉淀和清夜分离②若沉淀要洗涤,可注入水(或其他洗涤剂),充分搅拌后使沉淀沉降,再用倾析法分离,重复数次。


课题一硫酸亚铁铵的制备(时间:45分钟)1.工业上用硫酸和废铁屑制备硫酸亚铁时,为了提高产品的质量,常采取的措施是( ) A.硫酸过量B.铁屑过量C.硫酸和铁的物质的量之比为1∶1D.需要用浓硫酸解析铁屑过量可以还原氧化生成的Fe3+,Fe+2Fe3+===3Fe2+,保证Fe2+稳定、纯净地存在,减少产物中的Fe3+杂质。
答案 B2.用倾析法进行分离适用于( )A.沉淀的结晶颗粒较小B.沉淀的结晶颗粒较大C.沉淀不容易沉降D.沉淀的质量较小解析当沉淀的结晶颗粒较大,静置后容易沉降至容器底部时,常用倾析法(也称倾注法)进行分离或洗涤。
答案 B3.用硫酸和铁屑制备硫酸亚铁,反应结束后,需将反应液进行过滤,但过滤时常出现漏斗颈下端管口堵塞的现象,可采取的措施是( )A.将普通漏斗改为分液漏斗B.将漏斗预热,进行热过滤C.增加滤纸层数D.向溶液中加一些稀硫酸解析反应后的溶液是几乎饱和的硫酸亚铁溶液,进行过滤时常出现漏斗颈下端管口堵塞的现象,是由于滤液在漏斗颈下端遇冷析出晶体造成的,可采取的措施是将漏斗预热,进行热过滤。
答案 B4.下列装置适用于实验室制氨气并验证氨气的某化学性质,其中能达到实验目的的是( )A .用装置甲制取氨气B .用装置乙除去氨气中的水蒸气C .用装置丙验证氨气具有还原性D .用装置丁吸收尾气解析 A 项,NH 3的溶解度较大,不加热,NH 3不会从溶液中出来,错误;B 项,NH 3显碱性,会被浓H 2SO 4吸收,故不可用浓H 2SO 4作干燥剂,错误;C 项,发生的反应为3CuO +2NH 3=====△3Cu +N 2+3H 2O ,反应中NH 3作还原剂,正确;D 项,NH 3通入溶液中,首先接触的是水,故会发生倒吸,错误。
答案 C5.在实验室进行物质制备,下列从原料及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是( )A .C ――————→在空气中点燃CO ――——→CuO △CO 2――————→NaOH 溶液Na 2CO 3B .Cu ―——―→AgNO 3Cu(NO 3)2溶液―——―→NaOH 溶液Cu(OH)2 C .Fe ――——→点燃Fe 2O 3―——―→H 2SO 4溶液Fe 2(SO 4)3溶液 D .CaO ―——―→H 2O Ca(OH)2溶液―——―→Na 2CO 3溶液NaOH 溶液解析 A 在操作上不可行,经济上也不合理;B 在经济上不合理;C 中Fe 在氧气中燃烧的产物是Fe 3O 4,而不是Fe 2O 3,理论上不正确。

课题一 硫酸亚铁铵的制备(时间:45分钟)1.工业上用硫酸和废铁屑制备硫酸亚铁时,为了提高产品的质量,常采取的措施是( ) A.硫酸过量B.铁屑过量C.硫酸和铁的物质的量之比为1∶1D.需要用浓硫酸解析 铁屑过量可以还原氧化生成的Fe3+,Fe+2Fe3+===3Fe2+,保证Fe2+稳定、纯净地存在,减少产物中的Fe3+杂质。
答案 B2.用倾析法进行分离适用于( )A.沉淀的结晶颗粒较小B.沉淀的结晶颗粒较大C.沉淀不容易沉降D.沉淀的质量较小解析 当沉淀的结晶颗粒较大,静置后容易沉降至容器底部时,常用倾析法(也称倾注法)进行分离或洗涤。
答案 B3.将硫酸亚铁溶液和硫酸铵溶液按溶质物质的量之比为1∶1混合,加热浓缩,再冷却结晶,最先析出的晶体是( )A.硫酸亚铁B.硫酸铵C.硫酸亚铁铵D.硫酸亚铁和硫酸铵的混合晶体解析 由于复盐在水中的溶解度比组成它的每一种盐都要小,因此,将硫酸亚铁溶液和硫酸铵溶液按溶质物质的量之比为1∶1混合,加热浓缩,冷却结晶,最先析出的晶体是硫酸亚铁铵。
答案 C4.下列装置适用于实验室制氨气并验证氨气的某化学性质,其中能达到实验目的的是( ) A.用装置甲制取氨气B .用装置乙除去氨气中的水蒸气C .用装置丙验证氨气具有还原性D .用装置丁吸收尾气解析 A 项,NH 3的溶解度较大,不加热,NH 3不会从溶液中出来,错误;B 项,NH 3显碱性,会被浓H 2SO 4吸收,故不可用浓H 2SO 4作干燥剂,错误;C 项,发生的反应为3CuO +2NH 33Cu +N 2+3H 2O ,反应中NH 3作还原剂,正确;D 项,NH 3通入溶液中,首先接=====△ 触的是水,故会发生倒吸,错误。
答案 C5.在制备硫酸亚铁铵晶体的过程中,下列说法不正确的是( )A .应保持H 2SO 4适当过量,避免Fe 2+、NH 的水解+4B .将铁屑放入Na 2CO 3溶液中浸泡数分钟是为了除去铁屑表面的油污C .将FeSO 4和(NH 4)2SO 4的混合溶液加热蒸干即可得到硫酸亚铁铵D .洗涤硫酸亚铁铵晶体时,应用少量酒精洗去晶体表面附着的水分解析 将FeSO 4和(NH 4)2SO 4的混合溶液蒸发浓缩至溶液表面出现晶膜为止,不能蒸干。

学案一:课题一硫酸亚铁铵的制备信息提示:物理性质:浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小化学性质:能水解;具有还原性,但比硫酸亚铁稳定反应原理:实验过程1.Fe屑的处理【操作】称取约5g铁屑,放入锥形瓶,加入15 mL10%Na2CO3溶液,浸泡数分钟后,倒掉碱液,用倾析法分离并洗涤铁屑,晾干。
【采取措施及目的】2.FeSO4的制备【操作】将铁屑放入洁净的锥形瓶中,加入3 mol/L H2SO4溶液,加热并不断振荡,反应过程中应适当补充水,待反应基本完成后,再加1 mL 3 mol/L H2SO4溶液,趁热过滤。
滤液转移至蒸发皿。
【采取措施及目的】3.(NH4)2SO4·FeSO4·6HO的制备【操作】将(NH4)2SO4 晶体配成饱和溶液,倒入硫酸亚铁溶液中,搅拌,小火加热至溶液表面刚出现晶膜为止,静置自然冷却待晶体析出【采取措施及目的】4.分离提纯减压过滤,用少量酒精洗去附着的水分。
取出晶体,用干净的滤纸吸干【采取措施及目的】二:前三年浙江理综高考卷28题总结三(我来试试)2013高考样卷28(14分)随着铅蓄电池的广泛应用,使回收利用铅资源成为重要课题。
某研究性学习小组利用废旧铅蓄电池阴、阳极填充物(铅膏)制备塑料加工热稳定剂三盐基硫酸铅,实验流程如下:27.(2010) (15分)一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO 4·H2O 是一种重要的染料及农药中间体。
某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为:相关信息如下: ①[Cu(NH 3)4]SO 4·H 2O 在溶液中存在以下电离(解离)过程:[Cu(NH 3)4]SO 4·H 2O =[Cu(NH 3)4]2+ + SO 42―+ H 2O [Cu(NH 3)4]2+ Cu 2++4NH 3② (N H 4)2S O 4在水中可溶,在乙醇中难溶。


课题1硫酸亚铁铵的制备1.硫酸亚铁铵,商品名称为摩尔盐,其化学式为,色晶体。
是一种盐。
溶于水,溶于酒精。
(NH4)2SO4和硫酸亚铁溶液混合,加热浓缩即可制得硫酸亚铁铵,其主要原因是。
写出反应式根据硫酸亚铁铵的制备知识要点完成下列空格⑴Na2CO3溶液可以除油污的原因是,加热更有利于提高去污能力的原因是,将剩余的碱液倒掉的方法是。
⑵将称量好的Fe屑放入锥形瓶中,加入25 mL 3 mol·L-1 H2SO4 ,放在水浴中加热至不再有气体生成为止,再加入1 mL 3 mol·L-1 H2SO4,趁热过滤,将滤液转移至中。
趁热过滤的目的是。
反应结束时再加入1 mL 3 mol·L-1 H2SO4的作用是。
在制备FeSO4过程中常会出现黄色现象,避免这种现象的有效方法是。
⑶(NH4)2SO4与FeSO4混合后,缓缓加热,浓缩至。
浓缩时能否蒸发至干,为什么?不能。
①蒸干时溶液中的杂质离子会被带入晶体中,②。
制得的晶体过滤后用洗涤而不用蒸馏水的原因是①减少晶体在洗涤时的溶解,②。
⑷加热浓缩硫酸亚铁铵溶液的过程中,可能形成Fe3+,为什么?常见问题:①制备FeSO4时,硫酸为什么要过量___________________________________________________。
②制备(NH4)2SO4·FeSO4·6H2O 时,为什么要采用水浴加热浓缩______________________________。
③如何计算(NH4)2SO4的质量和硫酸亚铁铵的理论产量及产率_______________________________。
④如何制备不含氧的蒸馏水?为什么配制硫酸亚铁铵试液时要用不含氧的蒸馏水________________________________________________________________________。

课题一硫酸亚铁较的制备尹课时限时训练全优化・递进・达标 ____________________________________________________________________________(时间:45分钟)1. 工业上用硫酸和废铁屑制备硫酸亚铁时,为了提高产品的质量,常采取的措施是( )A. 硫酸过量B. 铁屑过量C. 硫酸和铁的物质的量之比为1 : 1D. 需要用浓硫酸解析 铁屑过量可以还原氧化生成的Fe3+, Fe+2Fe3+二=3Fe 才,保证Fe”稳定、纯净地 存在,减少产物中的Fe3+杂质。
答案B2. 用倾析法进行分离适用于(A. 沉淀的结晶颗粒较小 C.沉淀不容易沉降进行分离或洗涤。
答案B3. 将硫酸亚铁溶液和硫酸钱溶液按溶质物质的量之比为1 : 1混合,加热浓缩,再冷却结晶,最先析出的晶体是() A. 硫酸亚铁 B. 硫酸钱 C. 硫酸亚铁钱D. 硫酸亚铁和硫酸钱的混合晶体解析由于复盐在水中的溶解度比组成它的每一种盐都要小,因此,将硫酸亚铁溶液和 硫酸镀溶液按溶质物质的量之比为1 : 1混合,加热浓缩,冷却结晶,最先析出的晶体是 硫酸亚铁镀。
答案C4.下列装置适用于实验室制氨气并验证氨气的某化学性质,其中能达到实验目的的是()B.沉淀的结晶颗粒较大 D.沉淀的质量较小解析 当沉淀的结晶颗粒较大,静置后容易沉降至容器底部时,常用倾析法(也称倾注法)NaOH溶液气体------ A< 至:-浓H^SOsNHiCl溶液LT甲A.用装置甲制取氨气B.用装置乙除去氨气中的水蒸气C.用装置丙验证氨气具有还原性D.用装置丁吸收尾气解析A项,旧3的溶解度较大,不加热, NH3不会从溶液中出来,错误;B项,NH3显碱性,会被浓%S0;吸收,故不可用浓导0」乍干燥剂,错误;C项,发生的反应为3CuO+△2NH==3C U+N2+3H20,反应中阻作还原剂,正确;D项,阻通入溶液中,首先接触的是水,故会发生倒吸,错误。

第一章认识有机化合物第四节研究有机化合物的一般步骤和方法第1课时分离、提纯经典精做1.下列物质中的杂质(括号中是杂质)分别可以用什么方法除去。
(1)酒精(水)____________________________________________;(2)KNO3(NaCl) ____________________________________________;(3)乙酸乙酯(乙醇) ____________________________________________;(4)淀粉水溶液(乙醇) ____________________________________________;(5)NaCl(泥沙) ____________________________________________;(6)溴水(水) ____________________________________________;(7)CO2(HCl) ____________________________________________;(8)乙烷(丁烷) ____________________________________________。
2.某化学课外小组以海带为原料制取了少量碘水。
现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液,其实验操作可分解为如下几步:(A)把盛有溶液的分液漏斗放在铁架台的铁圈中;(B)把50 mL碘水和15 mL CCl4加入分液漏斗中,并塞好玻璃塞;(C)检验分液漏斗的活塞和上口的玻璃塞是否漏液;(D)倒置漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;(E)旋开活塞,用烧杯接收溶液;(F)从分液漏斗上口倒出上层水溶液;(G)将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;(H)静置,分层。
就此实验,完成下列各题:(1)正确操作步骤的顺序是:(用上述各操作的编号字母填写)________→________→________→ A →G →________→E→F。

专题7 物质的制备与合成课题1 硫酸亚铁铵的制备某小组利用铁屑、稀硫酸和硫酸铵制备硫酸亚铁铵,具体实验步骤如下:1.Fe屑的处理和称量【操作】称取约5g铁屑,放入锥形瓶,加入15 mL10%Na2CO3溶液,小火加热10 min以除去Fe屑表面的油污,将剩余的碱液倒掉,用蒸馏水把Fe冲洗干净,干燥后称其质量,记为m1(Fe),备用。
【问题】Na2CO3溶液用以除油污的原因是,加热更有利于提高去污能力的原因是,将剩余的碱液倒掉的方法是2.FeSO4的制备【操作】将称量好的Fe屑放入锥形瓶中,加入25 mL 3mol/L H2SO4 ,放在水浴中加热至不再有气体生成为止,再加入1 mL 3mol/L H2SO4,趁热过滤,将滤液转移至蒸发皿中。
【问题】反应反应的化学方程式为,趁热过滤的目的是,反应结束时再加入1 mL 3mol/L H2SO4的作用是,在制备FeSO4过程中常会出现黄色现象,避免这种现象的有效方法是3.(NH4)2SO4·FeSO4·6HO的制备【操作】称取一定量的(NH4)2SO4并将其加入上面实验的蒸发皿中,缓缓加热,浓缩至表面出现结晶薄膜为止。
放置冷却,得到硫酸亚铁铵的晶体。
抽滤后,用无水乙醇洗涤晶体,除去其表面的水分,观察生成的硫酸亚铁铵的颜色和状态。
称量为m2g。
【问题】制得的晶体过滤后用无水乙醇洗涤而不用蒸馏水,根据是,硫酸亚铁铵,商品名称为摩尔盐,其化学式为,色晶体是一种复盐。
溶于水,溶于酒精。
(NH4)2SO4和硫酸亚铁溶液混合,加热浓缩即可制得硫酸亚铁铵,其主要原理是硫酸亚铁铵的产率为。
【对位专练】按照下列方案进行“由废铝(只含杂质铁)制备硫酸铝晶体”的实验:步骤1:取ag含铁废铝(含杂质铁b%),加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
课题一硫酸亚铁铵的制备(时间:45分钟)1.工业上用硫酸和废铁屑制备硫酸亚铁时,为了提高产品的质量,常采取的措施是( )A.硫酸过量B.铁屑过量C.硫酸和铁的物质的量之比为1∶1D.需要用浓硫酸纯净地Fe+2Fe===3Fe,保证Fe 解析铁屑过量可以还原氧化生成的,Fe+3Fe杂质。
3+3+2+2+稳定、存在,减少产物中的B答案) 2.用倾析法进行分离适用于(.沉淀的结晶颗粒较小 A B.沉淀的结晶颗粒较大.沉淀的质量较小D C.沉淀不容易沉降解析当沉淀的结晶颗粒较大,静置后容易沉降至容器底部时,常用倾析法(也称倾注法)进行分离或洗涤。
答案 B3.将硫酸亚铁溶液和硫酸铵溶液按溶质物质的量之比为1∶1混合,加热浓缩,再冷却结晶,最先析出的晶体是( )A.硫酸亚铁B.硫酸铵C.硫酸亚铁铵D.硫酸亚铁和硫酸铵的混合晶体解析由于复盐在水中的溶解度比组成它的每一种盐都要小,因此,将硫酸亚铁溶液和硫酸铵溶液按溶质物质的量之比为1∶1混合,加热浓缩,冷却结晶,最先析出的晶体是硫酸亚铁铵。
答案 C)( 其中能达到实验目的的是下列装置适用于实验室制氨气并验证氨气的某化学性质,.4.A.用装置甲制取氨气B.用装置乙除去氨气中的水蒸气C.用装置丙验证氨气具有还原性D.用装置丁吸收尾气解析 A项,NH的溶解度较大,不加热,NH不会从溶液中出来,错误;B项,NH显碱333性,会被浓HSO吸收,故不可用浓HSO作干燥剂,错误;C项,发生的反应为3CuO+4224△2NH=====3Cu +N+3HO,反应中NH作还原剂,正确;D项,NH通入溶液中,首先接触33322的是水,故会发生倒吸,错误。
答案 C5.在制备硫酸亚铁铵晶体的过程中,下列说法不正确的是( )SOH适当过量,避免Fe、NH A.应保持424溶液中浸泡数分钟是为了除去铁屑表面的++2的水解油污B.将铁屑放入NaCO 32)SO的混合溶液加热蒸干即可得到硫酸亚铁铵(NH C.将FeSO和4442D.洗涤硫酸亚铁铵晶体时,应用少量酒精洗去晶体表面附着的水分的混合溶液蒸发浓缩至溶液表面出现晶膜为止,不能蒸干。
(浙江专用)2018年高中化学专题7 物质的制备与合成课题一硫酸亚铁铵的制备同步课时限时训练苏教版选修6编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((浙江专用)2018年高中化学专题7 物质的制备与合成课题一硫酸亚铁铵的制备同步课时限时训练苏教版选修6)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(浙江专用)2018年高中化学专题7 物质的制备与合成课题一硫酸亚铁铵的制备同步课时限时训练苏教版选修6的全部内容。
课题一硫酸亚铁铵的制备(时间:45分钟)1.工业上用硫酸和废铁屑制备硫酸亚铁时,为了提高产品的质量,常采取的措施是( )A.硫酸过量B.铁屑过量C.硫酸和铁的物质的量之比为1∶1D.需要用浓硫酸解析铁屑过量可以还原氧化生成的Fe3+,Fe+2Fe3+===3Fe2+,保证Fe2+稳定、纯净地存在,减少产物中的Fe3+杂质。
答案B2.用倾析法进行分离适用于( )A.沉淀的结晶颗粒较小B.沉淀的结晶颗粒较大C.沉淀不容易沉降D.沉淀的质量较小解析当沉淀的结晶颗粒较大,静置后容易沉降至容器底部时,常用倾析法(也称倾注法)进行分离或洗涤.答案B3.用硫酸和铁屑制备硫酸亚铁,反应结束后,需将反应液进行过滤,但过滤时常出现漏斗颈下端管口堵塞的现象,可采取的措施是()A.将普通漏斗改为分液漏斗B.将漏斗预热,进行热过滤C.增加滤纸层数D.向溶液中加一些稀硫酸解析反应后的溶液是几乎饱和的硫酸亚铁溶液,进行过滤时常出现漏斗颈下端管口堵塞的现象,是由于滤液在漏斗颈下端遇冷析出晶体造成的,可采取的措施是将漏斗预热,进行热过滤。
答案B4.下列装置适用于实验室制氨气并验证氨气的某化学性质,其中能达到实验目的的是()A.用装置甲制取氨气B.用装置乙除去氨气中的水蒸气C.用装置丙验证氨气具有还原性D.用装置丁吸收尾气解析A项,NH3的溶解度较大,不加热,NH3不会从溶液中出来,错误;B项,NH3显碱性,会被浓H2SO4吸收,故不可用浓H2SO4作干燥剂,错误;C项,发生的反应为3CuO+2NH3错误!3Cu +N2+3H2O,反应中NH3作还原剂,正确;D项,NH3通入溶液中,首先接触的是水,故会发生倒吸,错误.答案C5.在实验室进行物质制备,下列从原料及试剂分别制取相应的最终产物的设计中,理论上正确、操作上可行、经济上合理的是( )A.C错误!CO错误!CO2错误!Na2CO3B.Cu错误!Cu(NO3)2溶液错误!Cu(OH)2C.Fe错误!Fe2O3错误!Fe2(SO4)3溶液D.CaO错误!Ca(OH)2溶液错误!NaOH溶液解析A在操作上不可行,经济上也不合理;B在经济上不合理;C中Fe在氧气中燃烧的产物是Fe3O4,而不是Fe2O3,理论上不正确。
《实验化学》专题7 硫酸亚铁铵制备练习班级姓名学号一、硫酸亚铁铵的制备知识要点硫酸亚铁铵,商品名称为摩尔盐,其化学式为,色晶体。
是一种盐。
溶于水,溶于酒精。
(NH4)2SO4和硫酸亚铁溶液混合,加热浓缩即可制得硫酸亚铁铵,其主要原因是。
写出反应式步骤:(1)Na2CO3溶液可以除油污的原因是,加热更有利于提高去污能力的原因是,将剩余的碱液倒掉的方法是。
(2)将称量好的Fe屑放入锥形瓶中,加入25 mL 3 mol·L-1 H2SO4 ,放在水浴中加热至不再有气体生成为止,再加入1 mL 3 mol·L-1 H2SO4,趁热过滤,将滤液转移至中。
趁热过滤的目的是。
反应结束时再加入1 mL 3 mol·L-1 H2SO4的作用是。
在制备FeSO4过程中常会出现黄色现象,避免这种现象的有效方法是。
(3)(NH4)2SO4与FeSO4混合后,缓缓加热,浓缩至。
浓缩时能否蒸发至干,为什么?不能。
①蒸干时溶液中的杂质离子会被带入晶体中,②。
制得的晶体过滤后用洗涤而不用蒸馏水的原因是①减少晶体在洗涤时的溶解,②。
(4)加热浓缩硫酸亚铁铵溶液的过程中,可能形成Fe3+,为什么?二、无机物质制备例题1、(2014. 28)利用废旧锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO。
制备流程图如下:已知:Zn及化合物的性质与Al及化合物的性质相似。
请回答下列问题:(1)用NaOH溶液处理废旧锌铁皮的作用有。
A.去除油污B.溶解镀锌层C.去除铁锈D.钝化(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,原因是。
(4)Fe3O4胶体粒子能否用减压过滤发实现固液分离?(填“能”或“不能”),理由是。
(5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。
若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取g K2Cr2O7(保留.....4.位有效数字..,已知M(K2Cr2O7)=294.0 g·mol-1)。
《实验化学》专题7 硫酸亚铁铵制备练习
班级姓名学号
一、硫酸亚铁铵的制备知识要点
硫酸亚铁铵,商品名称为摩尔盐,其化学式为,色晶体。
是一种盐。
溶于水,溶于酒精。
(NH4)2SO4和硫酸亚铁溶液混合,加热浓缩即可制得硫酸亚铁铵,其主要原因是。
写出反应式
步骤:
(1)Na2CO3溶液可以除油污的原因是,加热更有利于提高去污能力的原因是,将剩余的碱液倒掉的方法是。
(2)将称量好的Fe屑放入锥形瓶中,加入25 mL 3 mol·L-1 H2SO4 ,放在水浴中加热至不再有气体生成为止,再加入1 mL 3 mol·L-1 H2SO4,趁热过滤,将滤液转移至中。
趁热过滤的目的是。
反应结束时再加入1 mL 3 mol·L-1 H2SO4的作用是。
在制备FeSO4过程中常会出现黄色现象,避免这种现象的有效方法是。
(3)(NH4)2SO4与FeSO4混合后,缓缓加热,浓缩至。
浓缩时能否蒸发至干,为什么?不能。
①蒸干时溶液中的杂质离子会被带入晶体中,②。
制得的晶体过滤后用洗涤而不用蒸馏水的原因是①减少晶体在洗涤时的溶解,②。
(4)加热浓缩硫酸亚铁铵溶液的过程中,可能形成Fe3+,为什么?
二、无机物质制备例题
1、(2014. 28)利用废旧锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO。
制备流程图如下:
已知:Zn及化合物的性质与Al及化合物的性质相似。
请回答下列问题:
(1)用NaOH溶液处理废旧锌铁皮的作用有。
A.去除油污B.溶解镀锌层C.去除铁锈D.钝化
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,原因是。
(4)Fe3O4胶体粒子能否用减压过滤发实现固液分离?(填“能”或“不能”),理由是。
(5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。
若需配制浓度为0.01000 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取g K2Cr2O7(保.
1)。
留.4.位有效数字
.....,已知M(K2Cr2O7)=294.0 g·mol-
配制该标准溶液时,下列仪器中不必要
...用到的有。
(用编号表示)。
①电子天平②烧杯③量筒④玻璃棒⑤容量瓶⑥胶头滴管⑦移液管(6)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将(填“偏大”、“偏小”或“不变”)。
反面还有
2. 硫酸亚铁铵(N H 4)2S O 4•FeSO 4•6H 2O 是一种重要化学试剂,实验室用除去锌镀层的铁片来制取硫酸亚铁铵,流程如下:
请回答下列问题:
(1)确定锌镀层被除去的标志是 ;
计算上述铁片锌镀层的厚度,不需要的数据是 (填编号)。
a .锌的密度ρ(g/cm 3)
b .镀锌铁片质量m 1(g )
c .纯铁片质量m 2(g )
d .镀锌铁片面积S (cm 2)
e .镀锌铁片厚度h (cm )
锌镀层的厚度为 cm (用含ρ、m 1、m 2…等的代数式表示)。
(2)上述流程中:操作Ⅰ是取出铁片、 、 、称量;操作Ⅱ是 。
(3)A 物质可以为 (填编号)。
a .CuCl 2
b .CuO
c .C u (N O 3)2
d .CuSO 4
加入少量A 物质的目的是 ,B 物质的成分为 。
(4)加少量硫酸调节pH 为 1~2的目的是 。
(5)用无水乙醇洗涤潮湿的硫酸亚铁铵晶体是为了除去晶体表面残留的水分,不用加热烘干的原因是 。
(6)鉴定所得晶体中含有Fe 2+、NH 4+、SO 42―离子的实验方法正确的是 (填编
号)。
a .取少量样品于试管,加水溶解,通入适量Cl 2,再加KSCN 溶液,观察现象
b .取少量样品于试管,加水溶解,加入NaOH 溶液,露置于空气中,观察现象
c .取少量样品于试管,加水溶解,加入稀NaOH 溶液,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化
FeSO 4溶液 固体B
操作Ⅱ
加少量硫酸
调pH 为 1~2
加入
(N H 4)2S O 4
冷却 沸水浴 加热蒸发 潮湿的硫酸亚铁铵晶体 母液 过滤 无水乙醇 洗涤 干燥晶体 晾干 加入 少量A 物质 纯铁片8.000g 50mL 2mol/L 硫酸 加热反应
过量的
6mol/L 盐酸
除锌镀层
操作Ⅰ 镀锌铁片
d.取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液,观察现象
3.磁材氧化铁的化学名称是氧化铁(Fe2O3),它是电子、电信工业的磁性材料,工业上采用生产钛白粉的下脚料(含大量FeSO4的废液)为原料来制备磁材氧化铁。
已知煅烧中的化学反应方程式为:FeCO3 → FeO + CO2↑,4FeO + O2 → 2Fe2O3
(1)用98%的浓H2SO4配制500mL20%的H2SO4,所需玻璃仪器除胶头滴管、一定规格量筒外,还需要的仪器是
A、玻璃棒
B、烧杯
C、漏斗
D、250mL容量瓶
E、500mL容量瓶
(2)浓缩结晶后得到的浅绿色晶体是(填化学式),A中溶质是;
此溶液中各离子的浓度比较大小为:。
(3)20%H2SO4和铁皮的作用分别是。
(4)检验滤液中含有NH4+的方法是。
(5)写出步骤“合成”中发生的化学变化(用化学方程式表示):。
答案:硫酸亚铁铵的制备
硫酸亚铁铵,商品名称为摩尔盐,其化学式为(NH4)2SO4·FeSO4·6HO,浅绿色晶体
是一种复盐。
易溶于水,难溶于酒精。
(NH4)2SO4和硫酸亚铁溶液混合,加热浓缩即可制得硫酸亚铁铵,其主要原理是在相同温度下,硫酸亚铁铵在水中的溶解度比FeSO4或(NH4)2SO4都小。
写出反应式FeSO4+(NH4)2SO4+6H2O=(NH4)2SO4·FeSO4·6H2O↓
(1)Na2CO3溶液可以除油污的原因是Na2CO3水解呈碱性,加热更有利于提高去污能力的原因是加热促进Na2CO3水解,使碱性增强,提高去污能力,将剩余的碱液倒掉的方法是倾析法。
(2)将称量好的Fe屑放入锥形瓶中,加入25 mL 3 mol·L-1 H2SO4 ,放在水浴中加热至不再有气体生成为止,再加入1 mL 3 mol·L-1 H2SO4,趁热过滤,将滤液转移至蒸发皿中。
趁热过滤的目的是为防止因冷却使FeSO4晶体析出而造成损失。
反应结束时再加入1 mL 3 mol·L-1 H2SO4的作用是抑制硫酸亚铁水解。
在制备FeSO4过程中常会出现黄色现象,避免这种现象的有效方法是Fe屑过量。
(3)(NH4)2SO4与FeSO4混合后,缓缓加热,浓缩至表面出现结晶薄膜为止。
浓缩时能否蒸发至干,为什么?不能。
①蒸干时溶液中的杂质离子会被带入晶体中,②蒸干时晶体会受热分解或被氧化。
制得的晶体过滤后用无水乙醇洗涤而不用蒸馏水的原因是①减少晶体在洗涤时的溶解,②除去其表面的水分。
(4)加热浓缩硫酸亚铁铵溶液的过程中,可能形成Fe3+,为什么?在高温并与空气接触的条件下,部分Fe2+被氧化成Fe3+。
2、【上海市浦东新区2009年高考预测卷】【答案】
(1)反应速率突然减小(或铁片表面生成的气泡突然减少) e
S
22
1ρm
m-
(2)洗涤、烘干(或干燥)过滤
(3)b、d(各1分,共2分),加快铁片与硫酸的反应速率,Fe和Cu(1分,有缺不得分)(4)抑制Fe2+、NH4+水解(5)避免加热过程中晶体受热分解(或被氧化)(6)b、d(各1分,共2分)
3、【上海市奉贤区2009年高考模拟考试(二)】
(1)ABE(2分,对2个给1分,有错不给分)
(2)FeSO4·7H2O(1分),( NH4)2 SO4(1分);c(NH4+)>c(SO42-)> c(H+)>c(OH-) (2分)(3)硫酸作用抑制Fe2+的水解,铁皮的作用防止Fe3+的氧化。
(2分,各1分)
(4)在试管中取滤液少许,加入足量的NaOH溶液,加热,用湿润的红色石蕊试纸检验,若试纸变兰色,则证明滤液中含有NH4+。
(2分)
(5)FeSO4+2NH4HCO3→FeCO3↓+( NH4)2 SO4+ CO2↑+H2O(2分)。