化工原理第十章-液-液萃取和液-固浸取
- 格式:doc
- 大小:3.17 MB
- 文档页数:13


实验15 液—液萃取实验一.实验目的1.了解液-液萃取原理和实验方法。
2.熟悉转盘萃取塔的结构、操作条件和控制参数。
3.掌握评价传质性能(传质单元数、传质单元高度)的测定和计算方法。
二.实验原理液-液萃取是分离液体混合物和提纯物质的重要单元操作之一。
在欲分离的液态混合物(本实验暂定为:煤油和苯甲酸的混合溶液)中加入一种与其互不相溶的溶剂(本实验暂定为:水),利用混合液中各组分在两相中分配性质的差异,易溶组分较多地进入溶剂相从而实现混合液的分离。
萃取过程中所用的溶剂称为萃取剂(水),混合液中欲分离的组分称为溶质(苯甲酸),萃取剂提取混合液中的溶质称为萃取相,剩余的混合液称为萃余相。
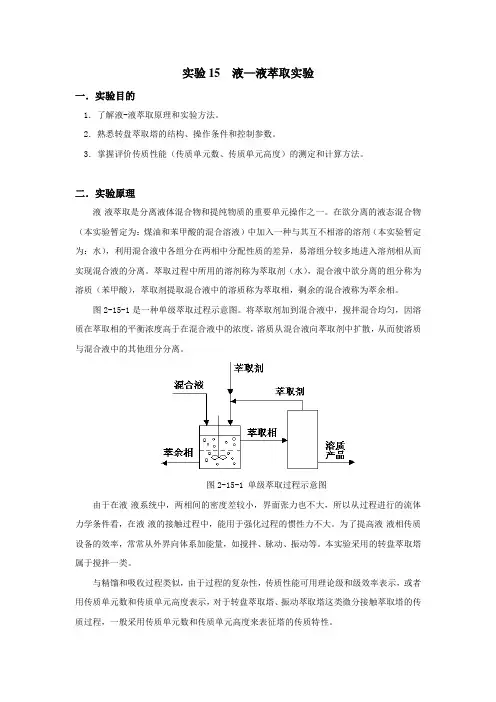
图2-15-1是一种单级萃取过程示意图。
将萃取剂加到混合液中,搅拌混合均匀,因溶质在萃取相的平衡浓度高于在混合液中的浓度,溶质从混合液向萃取剂中扩散,从而使溶质与混合液中的其他组分分离。
图2-15-1单级萃取过程示意图由于在液-液系统中,两相间的密度差较小,界面张力也不大,所以从过程进行的流体力学条件看,在液-液的接触过程中,能用于强化过程的惯性力不大。
为了提高液-液相传质设备的效率,常常从外界向体系加能量,如搅拌、脉动、振动等。
本实验采用的转盘萃取塔属于搅拌一类。
与精馏和吸收过程类似,由于过程的复杂性,传质性能可用理论级和级效率表示,或者用传质单元数和传质单元高度表示,对于转盘萃取塔、振动萃取塔这类微分接触萃取塔的传质过程,一般采用传质单元数和传质单元高度来表征塔的传质特性。
萃取相传质单元数N OE 表示分离过程的难易程度。
对于稀溶液,近似用下式表示:**ln *2112x x x x x x dxN x x OE --=-=⎰(2-15-1) 式中:N OE ——萃取相传质单元数x ——萃取相的溶质浓度(摩尔分率,下同) x * ——溶质平衡浓度x l 、x 2 ——分别表示萃取相进塔和出塔的溶质浓度。
萃取相的传质单元高度用H OE 表示:OE OE H/N H = (2-15-2)式中:H 为塔的有效高度(m )。

萃取是利用系统中组分在溶剂中有不同的溶解度来分离混合物的单元操作,利用相似相溶原理,萃取有两种方式:液-液萃取,用选定的溶剂分离液体混合物中某种组分,溶剂必须与被萃取的混合物液体不相溶,具有选择性的溶解能力,而且必须有好的热稳定性和化学稳定性,并有小的毒性和腐蚀性。
如用苯分离煤焦油中的酚;用有机溶剂分离石油馏分中的烯烃;用CCl4萃取水中的Br2.固-液萃取,也叫浸取,用溶剂分离固体混合物中的组分,如用水浸取甜菜中的糖类;用酒精浸取黄豆中的豆油以提高油产量;用水从中药中浸取有效成分以制取流浸膏叫“渗沥”或“浸沥”。
虽然萃取经常被用在化学试验中,但它的操作过程并不造成被萃取物质化学成分的改变(或说化学反应),所以萃取操作是一个物理过程。
萃取是有机化学实验室中用来提纯和纯化化合物的手段之一。
通过萃取,能从固体或液体混合物中提取出所需要的化合物。
用溶剂从液体混合物中提取其中某种组分的操作称为液/液萃取。
萃取是利用溶液中各组分在所选用的溶剂中溶解度的差异,使溶质进行液液传质,以达到分离均相液体混合物的操作。
萃取操作全过程可包括:1.原料液与萃取剂充分混合接触,完成溶质传质过程;2.萃取相和萃余相的分离过程;3.从萃取相和萃余相中回收萃取剂的过程。
通常用蒸馏方法回收。
现以提取含有A、B两组分的混合液中的A组分为例说明萃取操作过程。
选用一种适宜的溶剂S,这种溶剂对欲提取的组分A应有显著的溶解能力,而对其它组分B应是完全不溶或部分互溶(互溶度越小越好)。
所选用的溶剂S称为萃取剂。
待分离的混合液(含A+B)称为原料液,其中被提取的组分A称为溶质,另一组分B(原溶剂)称为稀释剂。
萃取过程的三个步骤:(1)首先将原料液(A+B)与适量的萃取剂S在混合器中充分混合。
由于B与S不互溶,混合器中存在S与(A+B)两个液相。
进行搅拌,造成很大的相界面,使两相充分接触,溶质A由原料液(稀释剂B)中经过相界面向萃取剂S中扩散。



萃取分离技术Extraction 5.1 概述利用物质在互不相容的两相之间溶解度的不同而使物质得到分离纯化或浓缩的方法称为萃取。
目标物液体:液液萃取固体:液固萃取(浸取)有机溶剂萃取双水相萃取液膜萃取反胶束萃取超临界萃取5.2 液固萃取(浸取)¾液固萃取,又称浸取或提取,是一种分离和富集某些天然产物、生化试剂和添加剂的有效手段。
由于溶剂渗入固体试样内部是比较缓慢的过程,因此液固萃取需要较长的时间,一般需要连续萃取。
浸提分为冷浸和热浸两种:¾冷浸法:适用于提取遇热易被破坏的物质及含淀粉、树胶、果胶、黏液质的样品。
¾热浸法:由于提高温度有利于有效成分的溶解度故提取效果较冷浸好。
该方法操作时间长,浸出溶剂用量大,往往浸出效率差,不易完全浸出,不适合有效成分含量低的原料。
为了有效成分的浸出,固体样品尽量粉碎传统的液固萃取装置是利用索氏(Soxhlet)提取器浸取在食品工业中的应用食用油¾除了采用传统的压榨法外,常采用溶剂浸提其中所含的油脂。
黄豆经溶剂浸提后,豆渣中残油量往往低于l%,远较压榨法的豆渣的残油率2%~2.5%为低。
除了油料种籽可以采用浸提法抽取其所含的油脂外,有时还采用浸提法抽取鱼肝或鱼皮的油脂。
常用溶剂:己烷、庚烷、环己烷速溶咖啡¾从咖啡豆中浸提出可溶性成分,经喷雾干燥或冷冻干燥可制得速溶咖啡。
食品功能成分的提取5.3 溶剂萃取法(Solvent Extraction)杂质目的产物料液萃取剂Light phaseHeavy phase溶剂萃取过程示意图实验室溶剂萃取过程分液漏斗有机相水相溶剂萃取法的原理萃取是根据不同物质在两相中分配平衡的差异是实现分离的。
物理萃取:利用溶剂对需分离的组分有较高的溶解能力,分离过程纯属物理过程,理论基础是分配定律;化学萃取:溶剂首先有选择性地与溶质化合或络合,从而在两相中重新分配而达到分离目的,服从相律及一般化学反应的平衡定律。



第九章 蒸馏1.在密闭容器中将A 、B 两组分的理想溶液升温至82 ℃,在该温度下,两组分的饱和蒸气压分别为*A p =107.6 kPa 及*B p =41.85 kPa ,取样测得液面上方气相中组分A 的摩尔分数为0.95。
试求平衡的液相组成及容器中液面上方总压。
解:本题可用露点及泡点方程求解。
()()()()95.085.416.10785.416.107总总*B*A 总*B 总*A A 总*AA =-=--==p p p p p p p p x p p y - 解得 76.99=总p kPa8808.085.416.10785.4176.99*B*A *B =--=--=p p p p x 总本题也可通过相对挥发度求解571.285.416.107*B *A ===p p α由气液平衡方程得()()8808.095.01571.295.095.01=-+=-+=y y y x α()()[]kPa 76.99kPa 8808.0185.418808.06.1071A *BA *A =-+⨯=-+x p x p p =总 2.试分别计算含苯0.4(摩尔分数)的苯—甲苯混合液在总压100 kPa 和10 kPa 的相对挥发度和平衡的气相组成。
苯(A )和甲苯(B )的饱和蒸气压和温度的关系为 24.22035.1206032.6lg *A +-=t p 58.21994.1343078.6lg *B +-=t p式中p ﹡的单位为kPa ,t 的单位为℃。
苯—甲苯混合液可视为理想溶液。
(作为试差起点,100 kPa 和10 kPa 对应的泡点分别取94.6 ℃和31.5 ℃)解:本题需试差计算 (1)总压p 总=100 kPa初设泡点为94.6℃,则191.224.2206.9435.1206032.6lg *A =+-=p 得 37.155*A =p kPa同理 80.158.2196.9494.1343078.6lg *B =+-=p 15.63*B =p kPa4.03996.015.6337.15515.63100A ≈=--=x或 ()kPa04.100kPa 15.636.037.1554.0=⨯+⨯=总p则 46.215.6337.155*B *A ===p p α6212.04.046.114.046.2)1(1=⨯+⨯=-+=x x y αα(2)总压为p 总=10 kPa通过试差,泡点为31.5℃,*A p =17.02kPa ,*B p =5.313kPa203.3313.502.17==α 681.04.0203.214.0203.3=⨯+⨯=y随压力降低,α增大,气相组成提高。
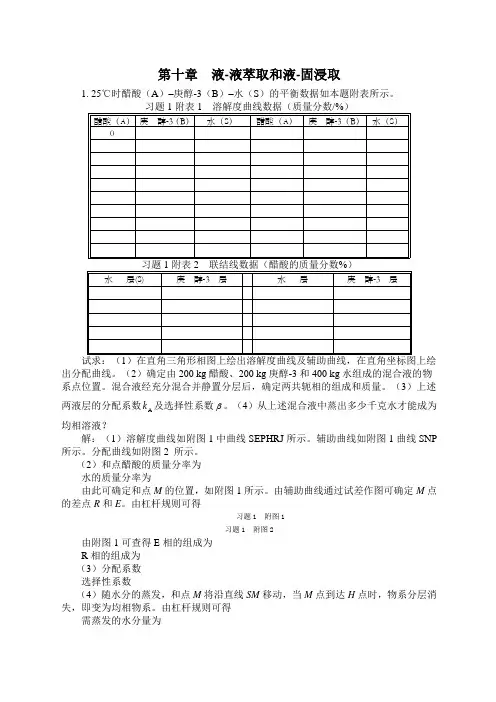
第十章液-液萃取和液-固浸取1. 25℃时醋酸(A)–庚醇-3(B)–水(S)的平衡数据如本题附表所示。
出分配曲线。
(2)确定由200 kg醋酸、200 kg庚醇-3和400 kg水组成的混合液的物系点位置。
混合液经充分混合并静置分层后,确定两共轭相的组成和质量。
(3)上述k及选择性系数 。
(4)从上述混合液中蒸出多少千克水才能成为两液层的分配系数A均相溶液?解:(1)溶解度曲线如附图1中曲线SEPHRJ所示。
辅助曲线如附图1曲线SNP 所示。
分配曲线如附图2 所示。
(2)和点醋酸的质量分率为水的质量分率为由此可确定和点M的位置,如附图1所示。
由辅助曲线通过试差作图可确定M点的差点R和E。
由杠杆规则可得习题1 附图1习题1 附图2由附图1可查得E相的组成为R相的组成为(3)分配系数选择性系数(4)随水分的蒸发,和点M将沿直线SM移动,当M点到达H点时,物系分层消失,即变为均相物系。
由杠杆规则可得需蒸发的水分量为2. 在单级萃取装置中,以纯水为溶剂从含醋酸质量分数为30%的醋酸–庚醇-3混合液中提取醋酸。
已知原料液的处理量为1 000 kg/h,要求萃余相中醋酸的质量分数不大于10%。
试(1)水的用量;(2)萃余相的量及醋酸的萃取率。
操作条件下的平衡数据见习题1。
解:(1)物系的溶解度曲线及辅助曲线如附图所示。
由原料组成x F=可确定原料的相点F,由萃余相的组成x A=可确定萃余相的相点R。
借助辅助曲线,由R可确定萃取相的相点E。
联结RE、FS,则其交点M即为萃取操作的物系点。
由杠杆规则可得(2)由杠杆规则可确定萃余相的量。
由附图可读得萃取相的组成为萃取率=()0.14242379176.2%10000.3⨯-=⨯3. 在三级错流萃取装置中,以纯异丙醚为溶剂从含醋酸质量分数为30%的醋酸水溶液中提取醋酸。
已知原料液的处理量为2000 kg,每级的异丙醚用量为800 kg,操作温度为20 ℃,试求(1)各级排出的萃取相和萃余相的量和组成;(2)若用一级萃取达到同样的残液组成,则需若干千克萃取剂。
化工原理下萃取过程的流程与计算化工原理中的萃取过程是指利用溶剂将目标物质从混合物中分离出来的操作过程。
该过程适用于从可溶液中获得目标物质,或者将两相液体或气体中的目标物质转移至另一相中。
萃取过程的流程一般包括以下几个步骤:1.选择合适的溶剂:根据目标物质的物化性质,选择适合的溶剂。
该溶剂应与混合物中其他成分相互不溶或溶度低。
同时,溶剂的选择还要考虑到需求的目标物质浓度、产率和分离度等因素。
2.混合物预处理:将待萃取的混合物进行预处理,以提高目标物质的相对浓度。
预处理手段可以包括调整溶剂酸碱性、溶剂萃取剂的加入以及混合物的预处理等。
3.萃取过程:在一定温度条件下,将混合物与溶剂充分接触并反应。
在这个过程中,目标物质会从混合物中转移到溶剂中,得到所需的提取液。
4.分离过程:对提取液进行分离,获得目标物质。
分离过程可以采用各类分离工艺,如蒸馏、结晶、过滤等。
萃取过程的计算主要涉及到平衡和热力学方面的内容。
其中,平衡计算主要包括挥发分离计算、浸出平衡计算和溶剂选择计算等。
而热力学计算主要包括传热和传质方面的内容,例如浸出塔传质速率的估算、提取液的热力学性质计算等。
以浸出平衡计算为例,其步骤如下:1.确定混合物的成分:通过实验或其他手段,获得混合物的成分组分,包括所需的目标物质。
2.根据热力学平衡关系,建立分离物质在混合物与溶剂中的分配系数。
该系数表示分离物质在两相中的相对分配情况。
3.在给定温度和溶剂比例下,根据分配系数计算提取液中目标物质浓度。
4.根据计算结果,可以调整溶剂比例、反应温度或溶剂浓度等参数,以提高目标物质的回收率和分离度。
需要注意的是,萃取过程的最终计算结果可能受到外部因素的影响,如反应速率、传质速率、传质过程中的温度变化和浓差极化等。
因此,在进行计算时,需要综合考虑多个因素,进行系统的分析和优化。
综上所述,化工原理中的萃取过程是一种分离技术,其流程包括溶剂选择、混合物预处理、萃取过程和分离过程。
萃取名词解释
萃取是利用系统中组分在溶剂中有不同的溶解度来分离混合物的单元操作。
即,是利用物质在两种互不相溶(或微溶)的溶剂中溶解度或分配系数的不同,使溶质物质从一种溶剂内转移到另外一种溶剂中的方法。
广泛应用于化学、冶金、食品等工业,通用于石油炼制工业。
另外将萃取后两种互不相溶的液体分开的操作,叫做分液。
萃取有两种方式:
1.液-液萃取,用选定的溶剂分离液体混合物中某种组分,溶剂必须与被萃取的混合物液体不相溶,具有选择性的溶解能力,而且必须有好的热稳定性和化学稳定性,并有小的毒性和腐蚀性。
如用苯分离煤焦油中的酚;用有机溶剂分离石油馏分中的烯烃等。
2.固-液萃取,也叫浸取,用溶剂分离固体混合物中的组分,如用水浸取甜菜中的糖类;用酒精浸取黄豆中的豆油以提高油产量;用水从中药中浸取有效成分以制取流浸膏叫“渗沥”或“浸沥”。
虽然萃取经常被用在化学试验中,但它的操作过程并不造成被萃取物质化学成分的改变(或说化学反应),所以萃取操作是一个物理过程。
萃取是有机化学实验室中用来提纯和纯化化合物的手段之一。
通过萃取,能从固体或液体混合物中提取出所需要的物质。
第十章 液-液萃取和液-固浸取1. 25℃时醋酸(A )–庚醇-3(B )–水(S )的平衡数据如本题附表所示。
习题1附表1 溶解度曲线数据(质量分数/%)试求:(1)在直角三角形相图上绘出溶解度曲线及辅助曲线,在直角坐标图上绘出分配曲线。
(2)确定由200 kg 醋酸、200 kg 庚醇-3和400 kg 水组成的混合液的物系点位置。
混合液经充分混合并静置分层后,确定两共轭相的组成和质量。
(3)上述两液层的分配系数A k 及选择性系数β。
(4)从上述混合液中蒸出多少千克水才能成为均相溶液?解:(1)溶解度曲线如附图1中曲线SEPHRJ 所示。
辅助曲线如附图1曲线SNP 所示。
分配曲线如附图2 所示。
(2)和点醋酸的质量分率为25.0400200200200A =++=x水的质量分率为50.0400200200400S =++=x由此可确定和点M 的位置,如附图1所示。
由辅助曲线通过试差作图可确定M 点的差点R 和E 。
由杠杆规则可得kg 260kg 80040134013=⨯==M R()kg 540kg 260800=-=-=R M E由附图1可查得E 相的组成为A SB 0.28,0.71,0.01y y y ===R 相的组成为 A S B 0.20,0.06,0.74x x x ===(3)分配系数A A A 0.281.40.20ykx ===B B B 0.010.01350.74y k x === 选择性系数 7.1030135.04.1B A ===k k β (4)随水分的蒸发,和点M 将沿直线SM 移动,当M 点到达H 点时,物系分层消失,即变为均相物系。
由杠杆规则可得kg 5.494kg 80055345534=⨯==M H 需蒸发的水分量为()kg 5.305kg 5.494800=-=-H M2. 在单级萃取装置中,以纯水为溶剂从含醋酸质量分数为30%的醋酸–庚醇-3混合液中提取醋酸。
已知原料液的处理量为1 000 kg/h ,要求萃余相中醋酸的质量分数不大于10%。
试(1)水的用量;(2)萃余相的量及醋酸的萃取率。
操作条件下的平衡数据见习题1。
解:(1)物系的溶解度曲线及辅助曲线如附图所示。
由原料组成x F =0.3可确定原料的相点F ,由萃余相的组成x A =0.1可确定萃余相的相点R 。
借助辅助曲线,由R 可确定萃取相的相点E 。
联结RE 、FS ,则其交点M 即为萃取操作的物系点。
由杠杆规则可得习题1 附图1 习题1 附图23726F S ⨯=⨯kg 1423kg 100026372637=⨯=⨯=F S (2)由杠杆规则可确定萃余相的量。
4916R M ⨯=⨯ ()kg 791kg 1423100049164916=+==M R 由附图可读得萃取相的组成为 A 0.14y =萃取率=()0.14242379176.2%10000.3⨯-=⨯3. 在三级错流萃取装置中,以纯异丙醚为溶剂从含醋酸质量分数为30%的醋酸水溶液中提取醋酸。
已知原料液的处理量为2000 kg ,每级的异丙醚用量为800 kg ,操作温度为20 ℃,试求(1) 各级排出的萃取相和萃余相的量和组成;(2)若用一级萃取达到同样的残液组成,则需若干千克萃取剂。
20 ℃时醋酸(A )–水(B )–异丙醚(S )的平衡数据如下:习题3附表 20 ℃时醋酸(A )–水(B )–异丙醚()的平衡数据(质量分数)水 相 有 机 相醋酸(A ) 水(B ) 异丙醚(S ) 醋酸(A ) 水(B ) 异丙醚(S ) 0.69 98.1 1.2 0.18 0.5 99.3 1.41 97.1 1.5 0.37 0.7 98.9 2.89 95.5 1.6 0.79 0.8 98.4 6.42 91.7 1.9 1.9 1.0 97.1 13.34 84.4 2.3 4.8 1.9 93.3 25.50 71.7 3.4 11.4 3.9 84.7 36.7 58.9 4.4 21.6 6.9 71.5 44.3 45.1 10.6 31.1 10.8 58.1 46.40 37.1 16.5 36.2 15.1 48.7习题2 附图解:由平衡数据在直角三角形坐标图上绘出溶解度曲线及辅助曲线,如附图所示。
由原料组成x F=0.3,在图中确定原料相点F。
由物料衡算确定一级萃取物系的组成A 20000.30.2142000800x⨯==+S8000.2862000800x==+由此可确定一级萃取物系点M1的位置。
借助辅助曲线,通过试差作图可由M1确定一级萃取的萃取相点E1和萃余相点R1。
由杠杆规则可得115034.5R M⨯=⨯kg19322800kg505.34505.341=⨯==MR()kg868kg19322800111=-=-=RME由附图可读得一级萃取相和萃余相的组成为110.1100.255yx==由R1的量及组成,以及所加萃取剂的量,通过物料衡算可求得二级萃取的物系点M2。
与一级萃取计算方法相同可得2930E=kg21800R=kg220.100.23yx==与二级萃取计算相同,可得三级萃取计算结果3920E=kg习题3 附图31890R =kg330.080.21y x ==(2)若采用一级萃取达到同样的萃取效果,则萃取物系点为附图中的N 点。
由杠杆规则可得37.526.5F S ⨯=⨯ kg 2830kg 20005.265.375.265.37=⨯==F S 4. 在多级错流萃取装置中,以水为溶剂从含乙醛质量分数为6%的乙醛—甲苯混合液中提取乙醛。
已知原料液的处理量为1 200kg/h ,要求最终萃余相中乙醛的质量分数不大于0.5%。
每级中水的用量均为250 kg/h 。
操作条件下,水和甲苯可视为完全不互溶,以乙醛质量比表示的平衡关系为Y =2.2X 。
试求所需的理论级数。
解:(a )直角坐标图解法 在X –Y 直角坐标图上绘出平衡曲线Y =2.2X ,如附图所示。
F F F 0.060.064110.06x X x ===-- 原料中稀释剂的量为()()h kg 1128h kg 06.0112001F =-⨯=-=x F B 操作线的斜率为习题4 附图1128 4.512250B S -=-=- 过X F 作斜率为–4.512的直线,与平衡线交于Y 1,则X F Y 1为一级萃取的操作线。
过Y 1作Y 轴的平行线,与X 轴交于X 1。
过X 1作X F Y 1的平行线,与平衡曲线交于Y 2,X 1Y 2即为二级萃取的操作线。
同理可作以后各级萃取的操作线,其中X i 为第i 级萃余相的组成,直至X n 小于或等于所规定的组成0.005为止。
操作线的条数即为理论级数,即 n =7(b )解析法 由于B 与S 不互溶,故可采用式(10–35)计算理论级数。
F n S 2.20.0640.0050K X X Y ==≈=m 2.22500.48761128KS A B ⨯=== ()()F S n S m 0.064ln ln 0.005 6.4ln 1ln 10.4876X Y K X Y K n A ⎡⎤-⎢⎥-⎣⎦===++ 取n =7也可采用迭代计算求理论级数。
平衡关系为 i i 2.2Y X = 操作关系为()i i i-14.512Y X X =-- 由此可得迭代关系为 i i-10.6722X X =迭代计算结果为0F 12345670.0640.04300.02890.01940.01310.008790.005910.003970.005X X X X X X X X X =========<即所需理论级数为7级。
5. 在多级逆流萃取装置中,以水为溶剂从含丙酮质量分数为40%的丙酮–醋酸乙酯混合液中提取丙酮。
已知原料液的处理量为2 000kg/h ,操作溶剂比(F S )为0.9,要求最终萃余相中丙酮质量分数不大于6%,试求(1)所需的理论级数;(2)萃取液的组成和流量。
操作条件下的平衡数据列于本题附表。
萃取相萃余相丙酮(A)醋酸乙酯(B)水(S)丙酮(A)醋酸乙酯(B)水(S)07.492.6096.3 3.53.28.388.54.891.0 4.26.08.086.09.485.6 5.09.58.382.213.580.5 6.012.89.278.016.677.2 6.214.89.875.420.073.07.017.510.272.322.470.07.621.211.867.027.862.010.226.415.058.632.651.013.2解:(1)由平衡数据在直角三角形坐标图上绘出溶解度曲线及辅助曲线,如附图所示。
由原料组成x F=0.40,在图中确定原料相点F。
F=1000kg/h、S/F=0.9,再根据杠杆规则可确定F、S的和点M。
由最终萃取要求x n=0.06确定R n。
联结R n、M,其延长线与溶解度曲线交于E1,FE1、R n S两线的交点Δ即为操作点。
借助辅助曲线作图可得E1的共轭相点R1(第一级萃取萃余相点),联结R1Δ与溶解度曲线交于E2。
同理可找到R2、R3……,直至萃余相的组成小于0.06为止,操作线的条数即为理论级数。
由作图可得n=6(2)联结S、E1,并延长交AB与E′,E′即为萃取液的相点,读图可得A0.65y'=hkg1800hkg20009.0=⨯=⎪⎭⎫⎝⎛=FFSS()hkg3800hkg18002000=+=+=SFM习题5 附图由杠杆规则可得 135.527E M ⨯=⨯ h kg 2890h kg 38005.35275.35271=⨯==M E 172.529E E '⨯=⨯h kg 1156h kg 5.722928905.72291=⨯=⨯='E E 6. 在多级逆流萃取装置中,以纯氯苯为溶剂从含吡啶质量分数为35%的吡啶水溶液中提取吡啶。
操作溶剂比(F S )为0.8,要求最终萃余相中吡啶质量分数不大于5%。
操作条件下,水和氯苯可视为完全不互溶。
试在X –Y 直角坐标图上求解所需的理论级数,并求操作溶剂用量为最小用量的倍数。
操作条件下的平衡数据列于本题附表。
解:将以质量分数表示的平衡数据转化为质量比表示,其结果列于附表2中。
习题6 附表2由表中数据在–直角坐标系中绘出平衡曲线,如附图中曲线12所示。
由S /F =0.8及x F =0.35可得操作线的斜率0.80.812535165S S SBF A BSB ===⇒=+⎛⎫+ ⎪⎝⎭由最终萃取要求可确定点X n ,n n n 0.050.053110.05x X x ===--过点X n 作斜率为0.8125的直线与直线F F F 0.350.538110.35x X X x ====--交于J ,则X n J 即为操作线。