2021妇科肿瘤学会 SGO子宫内膜癌:基于证据回顾的建议(全文)
- 格式:doc
- 大小:81.50 KB
- 文档页数:19

子宫内膜癌概念又称为子宫体癌,是妇科常见的恶性肿瘤,发病率仅次于子宫颈癌。
镜下可分为腺癌、腺角化癌、鳞腺癌、透明细胞癌。
病因子宫内膜癌的真正发病原因迄今不明,但其发病的危险因素却长期被人们注意。
其危险因素有:一、肥胖脂肪过多将增加雌激素的储存,以及增加血浆中雄烯二酮转化为雌酮。
这种游离的具有活性雌酮增加,可能是子宫内膜癌的致癌因子,或促癌因子。
二、糖尿病糖尿病病人或耐糖量不正常者,其患子宫内膜癌的危险比正常人增加2.8倍。
三、高血压内膜癌伴高血压者较多。
肥胖、糖尿病与高血压三者并存于子宫内膜癌患者,称为“宫内膜的三联征”或“宫内膜癌综合征”。
三者可能与高脂饮食有关,而高脂饮食与子宫内膜癌有直接关系。
四、月经失调宫内膜癌患者,月经紊乱、量多者,比正常妇女高3倍。
五、初潮早与绝经迟12岁以前比12岁以后初潮者,宫内膜癌的发生率多60%。
宫内膜癌的绝轻年龄较正常妇女迟6年。
六、孕产次宫内膜癌发生于多产、未产、不孕症者较多。
七、多囊卵巢综合征表现为不排卵,而使子宫内膜处于高水平的、持续的雌激素作用之下,缺乏孕激素的调节和周期性的子宫内膜剥脱,而发生增生改变。
八、卵巢肿瘤分泌较高水平雌激素的颗粒细胞癌、卵泡膜细胞瘤等,可致月经不调,绝经后出血及子宫内膜增生和内膜癌。
九、子宫内膜不典型增生可为内膜癌发展的一个阶段或无此阶段。
而重度不典型增生,可视为子宫内膜原位癌。
十、外源性雌激素服用雌激素的妇女具有高度发生子宫内膜癌的危险,其危险与剂量大小、服用时间长短,及是否合用孕激素、中间是否停药,以及病人特点等有关。
停药后危险性在灰降低,但危险性仍继续古几年。
目前,雌激素与内膜癌之间的因果关系已有充分的证据。
雌激素中雌三醇(E3)不促使子宫内膜增生,而E2、E1、乙炔雌二醇或结合雌激素则易促使内膜增生,有增加子宫内膜癌变的危险。
病理(一)弥漫型:病变可累及全部或大部内膜。
其早期与增生的子宫内膜不易区别。
然而仔细检查癌肿部位,仍有一些特征,与正常的子宫内膜之间有界限可辨认,即癌肿的粘膜增厚、粗糙并有大小不规则的息肉样突起,而良性的子宫内膜增生则较软,表面光滑。




2022复发性子宫内膜癌的治疗(全文)子宫内膜癌(endometrial cancer)是妇科常见的恶性肿瘤,早期诊断率达70% ,如果治疗规范则总体预后较好。
尽管如此,仍有7% ~ 15%的早期(I ~ U期)子宫内膜癌患者出现肿瘤复发。
另外,晚期(IΠ ~ IVA期)子宫内膜癌患者,即使接受了系统规范治疗,5年内无疾病复发率也仅58%~59%°而一旦肿瘤复发,治疗便较为棘手。
复发性子宫内膜癌指接受初始治疗后出现的局部或者广泛复发转移。
大多数复发发生在初始治疗的3年内,其中局限于盆腔的子宫内膜癌复发患者5年生存率为55% , 远处转移者仅为17%o复发性子宫内膜癌的治疗选择需基于复发的部位及数量、初始治疗情况、患者一般情况以及肿瘤病理类型,以及相关分子指标等情况制定,复发性子宫内膜癌强烈建议启动多学科诊疗模式(multidisciplinary treatment, MDT )讨论。
治疗的方式包括化疗、放疗、手术治疗、免疫检查点抑制剂治疗、内分泌治疗和分子靶向治疗等。
随着近年来对于子宫内膜癌分子分型的优化和深入理解,更多的治疗选择进入视野,个体化的精准医疗正广泛开展。
本文将阐述复发性子宫内膜癌的治疗及基于子宫内膜癌分子检测及分型的治疗选择。
1子宫内膜癌分子分型最新进展经典Bokhman分型根据病理分型和预后,分为:I型雌激素依赖型;∏ 型非雌激素依赖型。
该分型较简单,对患者复发风险分层不够精准,对后续治疗作用有限。
2013年美国癌症基因组图谱提出新的癌症基因组图谱(the cancer genome atlas z TCGA )分子分型:依据多组学特征和预后的关联性分为4个亚型:POLE超突变型:约占7% ;微卫星不稳定型(microsatellite instability , MSI) /高突变型:约占28% ;低拷贝数型(copy number low ) /微卫星稳定型(microsatellite stable , MSS ):约占39% ;类浆液样型(serous-like )/高拷贝数型copy number high : 约占26%o分子分型对预测患者的预后和复发风险具有重要意义,其中POLE超突变型预后最好,而高拷贝数型预后最差。




2021妇科肿瘤学会SGO子宫内膜癌:基于证据回顾的建议(全文)摘要2014年妇科肿瘤学会(SGO)临床实践委员会更新了子宫内膜癌有关诊断、检查、手术和治疗方案指南。
尽管如此,子宫内膜癌的发病率及相关死亡率仍持续增加,自1987年至2014年子宫内膜癌年发病例数增加了75%,死亡病例翻了3倍,幸运的是在子宫内膜癌治疗方面有了一定进展,分子病理学研究不断深入,对遗传易感性认识更进一步,淋巴结评估更加精准,对放疗和化疗的理解更加全面,生存评估和随访方法更加完善。
制订过程回顾了现有的证据,对相关指南内容进行了批判性审查,最后确定了推荐意见,提交SGO临床实践委员会、SGO出版物委员会和SGO董事会成员审核后出版。
这些建议由SGO实践和教育委员会妇科肿瘤专家小组制订,使用的术语借鉴ASCCP管理指南,对建议的强度和证据质量进行评级。
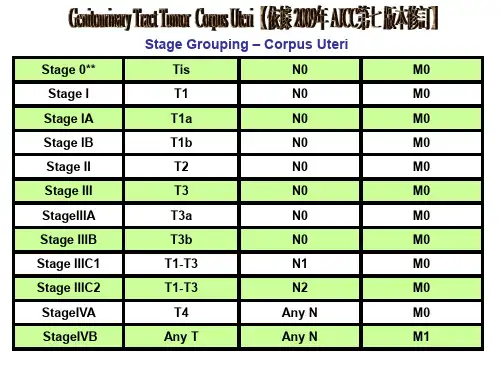
组织病理学和分子病理学临床问题1 对新诊断的子宫内膜癌如何进行分类?建议1.1目前指导子宫内膜癌治疗及预后的临床病理参数有:组织学类型、分级、分期、年龄和LVSI。
(AI)建议1.2 III/IV期子宫内膜癌患者应考虑雌激素受体。
(BII)建议1.3 III/IV期子宫浆液性癌患者建议HER2Neu检测,以确定辅助化疗是否加入曲妥珠单抗。
(AI)建议1.4应对所有子宫内膜癌进行错配修复状态和/或微卫星不稳定性检测,以筛选Lynch 综合征,有利于确定免疫检查点抑制剂Pembrolizumab单药或联合Lenvatanib治疗[2]。
(AII)建议1.5对于子宫内膜癌患者应进行分子分型检测,尤其是晚期患者,以确定是否存在TP53突变,指导治疗决策。
(BIII)建议1.6尽量进行生物标志物检测[3],参照美国病理学家学院(CAP)临床指导。
(B III)【证据文献复习】三十多年来子宫内膜癌分为两型[4]:I 型主要包括FIGO1/2级子宫内膜样癌,发病与雌激素有关,由子宫内膜增生、上皮内瘤变(EIN)发展而来,83%的肿瘤PTEN缺失,多数能够早期诊断,总体预后良好。
II型包括癌肉瘤、浆液性癌、透明细胞癌、混合性癌、未分化癌、高级别子宫内膜腺癌,通常雌激素不敏感,与EIN无关,浆液性癌可能与子宫内膜上皮内癌(EIC)有关[5],90% II型子宫内膜癌存在TP53突变。
尽管II型子宫内膜癌占比不足1/3,死亡占比达75%[6,7]。
尽管二分类系统有重要临床价值,但相关研究异质性大,特别是高级别肿瘤[8,9]。
分子分型和基因组分类研究可提高分类和预后信息的一致性,从而成为临床决策的基础。
癌症基因组图谱(TCGA)将子宫内膜癌分为四类:(1)POLE超突变型;(2)微卫星不稳定型(MSI-H),与MLH1启动子甲基化有关;(3)低拷贝型,是存在CTNNB1高频突变及其他重复性基因缺陷;(4)高拷贝型,是指TP53突变和FBXW7和PPP2R1A高频突变,与高级别子宫内膜腺癌肿瘤特异性生存率有关,POLE超突变型预后最好,其次是MSI-H、低拷贝型,高拷贝型预后最差[10,11]。
研究人员随后开发并验证了一种简化、实用的分子分型工具ProMis E,识别出四种分子亚型(错配修复缺陷、POLE突变、p53突变和p53野生型),与TCGA分子分型[12]类似,但不尽相同。
来自NRG肿瘤研究人员同样开发了一种用于子宫内膜癌风险预测的分子分型,指定四个分子基团与TCGA分类一致[13]。
PORTEC研究人员证实了分子分型的指导意义,PORTEC-3试验将TCGA分型应用于高危子宫内膜癌患者,随机分为联合放化疗组与单独放疗组,无论组织学类型,TP53突变型联合治疗组PFS显著改善;无论何种治疗方式,POLE超突变型均预后良好,这些研究彰显了分子分型的应用前景[14]。
或许将基因检测和传统的临床病理参数[15]结合起来进行分层,指导预后更为科学,但迄今为止,尚无大型前瞻性研究来验证这一假设。
风险因素临床问题1 子宫内膜癌还应该增加哪些风险因素?建议1.1应包括导致外源性或内源性雌激素升高的任何因素(AI)。
如胚系相关突变,包括PTEN(Cowden综合征)、MLH1、MSH2、MSH6、PMS2和EPCAM(Lynch 综合征)。
(AI)临床问题2 对于这些风险因素应如何进行管理?建议2.1对于绝经后性激素替代或服用他莫昔芬的女性,不建议常规行子宫内膜活检和/或盆腔超声检查,但绝经后出血或绝经前不规则出血的女性应行子宫内膜活检或分段诊刮术,酌情予宫腔镜检查。
(AII)建议2.2对于患有Cowden综合征或Lynch 综合征的女性,每1-2年应进行子宫内膜活检,完成生育后需应行全子宫切除术。
(BII)【证据文献复习】大多数子宫内膜癌的风险因素与单一雌激素(包括内源性和外源性)暴露有关,内源性雌激素来源包括慢性无排卵、超重或肥胖女性,以及相关肿瘤产生,生殖方面因素包括不孕、未产、初潮早或绝经迟等;外源性雌激素来源包括绝经期雌激素替代和他莫昔芬应用,而口服避孕药或联合孕激素治疗可降低发病风险[16,17],他莫昔芬与子宫内膜癌和子宫肉瘤的发生有关[18]。
尽管仅有2%-5%的子宫内膜癌属家族遗传性,Cowden综合征或Lynch 综合征女性子宫内膜癌发病风险增加,以Lynch 综合征居多,这是一种常染色体显性遗传病,由错配修复基因MLH1、MSH2、MSH6、PMS2和EPCAM 胚系突变导致,Lynch 综合征女性患子宫内膜癌的终生风险为40%-60%,等同或超过罹患结肠癌的终生风险。
Cowden综合征是一种罕见的常染色体显性遗传病,由PTEN胚系突变导致,与乳腺癌、甲状腺和子宫内膜癌风险增加有关[19-21]。
研究数据表明,BRCA1突变可能增加子宫浆液性癌发生风险,但增加程度尚不清楚。
临床表现和诊断临床问题1 绝经后出血患者应进行哪些检查及评估?建议1.1绝经后出血可通过子宫内膜取样和/或经阴道超声评估(AI)。
如子宫内膜厚度超过4mm,超声检查或取样后阴道出血持续或反复发作,应行宫腔镜检查及诊刮术。
( AI)【证据文献复习】绝经后出血的女性需要进一步评估。
2018年5月美国妇产科学院(ACOG)发布了绝经后出血评估指南,认为经阴道超声和子宫内膜取样(活检或诊刮)均是首选的方法。
如果经阴道超声提示子宫内膜厚度≤4mm,子宫内膜癌阴性预测值为99%,如果厚度>4mm应行宫腔镜检查或子宫内膜取样;如果超声和/或子宫内膜活检术后阴道出血持续或反复发作,应行宫腔镜检查及诊刮术[22]。
强调了症状持续存在的重要性,研究发现25% II型子宫内膜癌超声检查子宫内膜呈线状回声[23]。
临床问题2 绝经前女性异常子宫出血应如何评估?建议2.1绝经前女性异常子宫出血的评估应基于症状和临床表现,子宫内膜厚度的价值不大[22]。
如果患者有高危因素,不论是否有出血症状,均应行子宫内膜活检术(需要排除息肉或子宫肌瘤)。
(AII)【证据文献复习】 90% 以上子宫内膜癌患者存在异常子宫出血或绝经后出血,这是疾病的早期信号,值得警惕,因此,加强宣教尤为重要,数据显示早期就诊与及时评估仍有差距,这在黑人女性尤为突出,常导致诊断延迟和不良预后[24]。
晚期患者往往出现下腹或盆腔疼痛、腹胀不适、纳差或排便排尿习惯改变[16,17]。
临床问题3 对于子宫内膜癌,应由谁来管理?建议3应推荐给妇科肿瘤专家。
(BIII)临床问题4 肿瘤标志物和/或影像学检查是否必要?建议4.1对于子宫内膜样癌G1或G2不需行影像学检查(AIII),对于高级别子宫内膜样癌或特殊类型或考虑转移时,推荐血清CA125和/或CT检查。
(CIII)【证据文献复习】一旦确诊子宫内膜癌,应转诊妇科肿瘤医生,优化手术治疗,当患者希望保留生育力或者手术风险太大时需考虑其他替代方法。
多数患者不需要影像学检查评估是否存在转移,对于高级别子宫内膜样癌或特殊类型或考虑转移时,可行CT扫描或CA 125检测[16]。
手术治疗方面临床问题1 早期子宫内膜癌首选手术方式是怎样?建议1.1微创分期手术应是大多数子宫内膜癌患者首选的治疗方式。
(AI)【证据文献复习】子宫内膜癌分期手术需要切除全子宫及双附件,并评估淋巴结,高危组织学类型需要行腹膜多点活检,切除大网膜。
微创手术是子宫内膜癌初治患者的标准术式,多项随机对照试验论证了微创手术的益处[25-27]。
GOG LAP2试验是第一项随机试验比较了腹腔镜和开腹手术的结局,共纳入2600名患者,尽管中转开腹率为25.8%,但术后不良事件少,住院时间短[25]。
在澳大利亚、新西兰和香港进行的LACE试验也有相同的结论,腹腔镜手术降低了术后并发症和严重不良事件的发生率,近期生活质量明显改善[26]。
尽管如此,OS是妇科肿瘤手术的终极目标,2012年GOGLAP2随访数据报告了两组患者复发率的微小差异(腹腔镜组11.4% vs 开腹组10.2%),腹腔镜组HR为1.14 (95%CI 0.92-1.46),该研究设计为非劣效试验,HR 95% CI未达到预定非劣效标准,无统计学意义,5年OS两组均为89.8%,支持腹腔镜手术的安全性,推荐所有I期患者应接受微创手术[28]。
LAP2试验事后分析评估了高级别子宫内膜癌(包括子宫内膜腺癌G3、浆液性癌、透明细胞癌和子宫癌肉瘤)腹腔镜手术的安全性及有效性,发现手术入路不影响复发和生存[29]。
与开放手术相比,机器人手术结局与腹腔镜手术相似,出血少,住院时间短[30-32],其优势主要体现在肥胖患者,机器人手术是腹腔镜手术替代治疗方法[33]。
最近一项前瞻性研究比较了开腹手术和微创手术患者的生活质量和临床结局,468名患者接受短期(1周和3周)和长期(12周和24周)随访,机器人手术组和腹腔镜组结果没有差异,生活质量评分显著高于开腹手术组,疼痛轻,对日常生活影响较小,长期随访的结论与此相同,手术入路对性生活没有影响,结果支持微创手术的优势[34]。
而对于手术风险远大于获益的患者来讲,经阴道子宫切除是可接受的选择[35]。
临床问题2 淋巴结切除的适应证?如何评估淋巴结?建议2.1不论组织学分级或组织学类型,前哨淋巴结(SLN)绘图或基于转移风险分层的淋巴结切除方案均是可接受的替代方案。
(AII)建议2.2当采用前哨淋巴结绘图时,如SLN未显影,需行同侧淋巴结切除术,或送检冷冻切片病理检查,以评估是否需要进一步行淋巴结切除,所有可疑淋巴结均应予以切除[36]。
(AII)【证据文献复习】关于SLN已经争论了20余年,在此不予赘述。
子宫内膜癌的全面分期手术包括:全面探查、取盆腔冲洗液、子宫切除、双侧输卵管卵巢切除、可疑区域选择性活检,有转移风险的患者行淋巴结取样。