烃的燃烧规律总结
- 格式:doc
- 大小:79.50 KB
- 文档页数:6
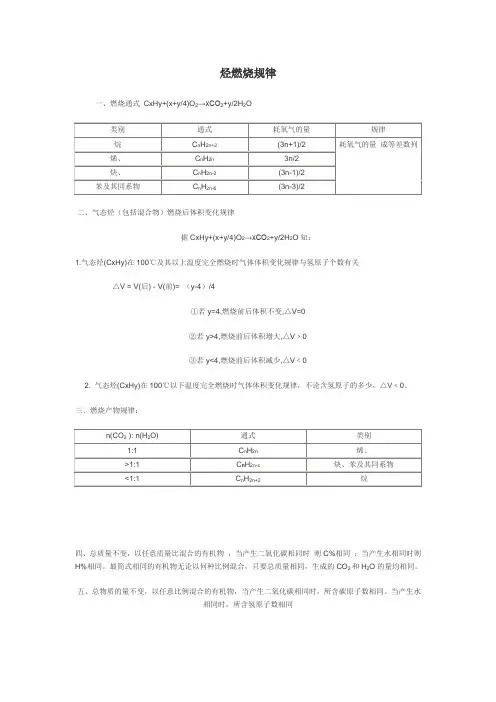
烃燃烧规律一、燃烧通式CxHy+(x+y/4)O2→xCO2+y/2H2O二、气态烃(包括混合物)燃烧后体积变化规律据CxHy+(x+y/4)O2→xCO2+y/2H2O知:1.气态烃(CxHy)在100℃及其以上温度完全燃烧时气体体积变化规律与氢原子个数有关△V = V(后) - V(前)= (y-4)/4①若y=4,燃烧前后体积不变,△V=0②若y>4,燃烧前后体积增大,△V﹥0③若y<4,燃烧前后体积减少,△V﹤02. 气态烃(CxHy)在100℃以下温度完全燃烧时气体体积变化规律,不论含氢原子的多少,△V﹤0。
三、燃烧产物规律:四、总质量不变,以任意质量比混合的有机物,当产生二氧化碳相同时则C%相同;当产生水相同时则H%相同。
最简式相同的有机物无论以何种比例混合,只要总质量相同,生成的CO2和H2O的量均相同。
五、总物质的量不变,以任意比例混合的有机物,当产生二氧化碳相同时,所含碳原子数相同。
当产生水相同时,所含氢原子数相同六、消耗氧气的量的规律1.等物质的量的烃完全燃烧时,其耗氧量的大小取决于(x+y/4)。
2.等质量的烃完全燃烧,其耗氧量的大小取决该烃分子中氢的质量分数,其值越大,耗氧量越大。
设烃的质量为m ,含氢的质量分数为ω,有关系式C~O2~CO2及4H~O2~2H2O可知该厅的耗氧量为:n(O2) = m(1-ω)/12 + mω/4= m/12 +mω/6当m 为定值时,ω值越大,耗氧量就越大。
①对于等质量的烷烃,碳原子数越多,氢的质量分数越小,耗氧量越小,由此可知CH4的耗氧量最多。
②对于等质量的单烯烃,因炭、氧的个数比为定值,股氢的质量分数也为定值,即耗氧量相等。
③对于等质量的炔烃,碳原子数越多,氢的质量分数越大,耗氧量越多,由此可知C2H2的耗氧量最少。
④等质量烷烃、单烯烃、炔烃,因为氢的质量分数关系导致耗氧量的关系如下:“烷烃﹥烯烃﹥炔烃”。

有关烃燃烧的规律一、烷烯炔各类烃含碳(或氢)质量分数的变化规律:1.烷烃:C n H2n+2(n≥1)W(C)=12n/(14n+2)×100% 随n的增大,烷烃W(C)逐渐增大,但永远小于85.7%。
甲烷是烷烃中W(H)最高的。
2.烯烃(或环烷烃):C n H2n(n≥2)W(C)=12n/14n×100%=85.7%即烯烃的W(C)是固定不变的。
3.炔烃(或二烯烃):C n H2n-2(n≥2)W(C)=12n/(14n-2)×100% 随n的增大,炔烃W(C)逐渐减小,但总比烯烃的W(C)高,即总大于85.7%。
乙炔是炔烃中含碳量最高的。
二、烃的燃烧规律:烃的可燃性是烃的一个基本性质,有关烃的燃烧计算和比较是中学化学中常见的习题,掌握烃的燃烧规律,对解决这类习题会起到事半功倍的效果。
烃类燃烧可用通式表示:CxHy + (x+y/4)O2 →xCO2 + y/2H2O1..等物质的量的不同烃燃烧时的耗氧规律:(1)耗O2量取决于(x+y/4),(x+y/4)越大,消耗氧气越多。
(2)产生CO2的量取决于x,x越大,产生CO2的量越多。
(3)产生H2O的量取决于y,y越大,产生H2O的量越多。
例1:等物质的量的CH4、C2H4、C2H2,分别在足量氧气中完全燃烧,以下说法正确的是()A.C2H2含碳量最高,燃烧生成的CO2最多B.C2H2燃烧时火焰最明亮C.CH4含氢量最高,燃烧生成的水最多D.CH4、C2H4燃烧生成的水质量不同,消耗的氧气不同。
例2:1molCxHy(烃)完全燃烧需要5molO2,则X与Y之和可能是( )A.X+Y=5 B.X+Y=7 C.X+Y=11 D.X+Y=92.等质量的不同烃完全燃烧时的耗氧规律:1molC(12g)消耗1mol O2,而4molH(4g)也消耗1molO2,故质量相等的不同烃完全燃烧时,氢元素的质量分数H%越大,消耗O2越多,产生的H2O越多;反之碳元素的质量分数C%越大,消耗O2越少,产生的CO2则越多。









烃燃烧的几条规律烃的燃烧通式是:CxHy +(X+y/4 )O2 →xCO2 + y/2 H2O(1)当温度高于100℃,生成物全部是气体,气体体积变化量为:△V=V前-V后=1- 分三种情况:①当y=4时,△V=0,体积不变。
②当y<4时,△V>0,体积减小。
③当y>4时,△V<0,体积增大。
通常把△V=0的情况称为氢4规律,即分子中含有4个氢原子的烃分子在温度高于100℃时完全燃烧,反应前后气体体积不变,如CH4、C2H4、C3H4等,与碳原子数无关。
反过来也可以根据燃烧前后体积不变来判断烃的分子组成。
(2)当室温(或者低于100℃)时烃完全燃烧,由于水是液体,体积计算时水的体积被忽略,则△V=1+,此时,△V均大于0,即体积不会不变,也不会增加,只能减小。
一、烃完全燃烧耗氧量的比较1、等物质的量的烃燃烧耗氧量的计算对于1molCxHy ,消耗氧气物质的量为(x+y/4 )mol,显然(x+ y/4)值越大,耗氧量越多。
[练习]取下列四种气态烃各1mol,分别在足量的氧气中燃烧,消耗氧气最多的是(D )A CH4B C2H6C C3H8D C4H102、等质量的烃燃烧耗氧量的计算由于等质量的C和H相比,H的耗氧量比C多。
例如12克C要消耗32克O2,而12克H要消耗96克O2。
因此等质量的不同烃完全燃烧,烃中H的质量分数越大,耗氧量越多。
等质量的烃完全燃烧时,耗氧量的多少决定于氢的质量分数,即y/x的值,y/x越大,耗氧量越多[练习]等质量的下列烃完全燃烧时,消耗氧气最多的是(A )A CH4B C2H6C C3H8D C6H6二、烃燃烧时生成的CO2和H2O的量的比较1、等物质的量的烃燃烧生成CO2和H2O的量的比较对烃CxHy来说,x越大,生成CO2越多,y越大,生成H2O越多。
2、等质量的烃燃烧生成CO2和H2O的量的比较等质量的两种烃,如果C的质量分数越大,则生成CO2的质量越多,生成H20的质量越少。
烃的燃烧规律总结烃的燃烧是很简单的,但它的计算现象丰富多彩,从而成为考查学生综合应用能力的一个不可多得的知识点。
一、烃的燃烧化学方程式不论是烷烃、烯烃、炔烃还是苯及苯的同系物,它们组成均可用C x H y来表示,这样当它在氧气或空气中完全燃烧时,其方程式可表示如下:二、烃燃烧时物质的量的变化烃完全燃烧前后,各物质的总物质的量变化值与上述燃烧方程式中的化学计量数变化值一致,即。
也就是说,燃烧前后物质的量变化值仅与烃分子中的氢原子数有关,而与碳原子数无关。
且:当y〉4时,,即物质的量增加;当y=4时,,即物质的量不变;当y〈4时,,即物质的量减少。
三、气态烃燃烧的体积变化要考虑燃烧时的体积变化,必须确定烃以及所生成的水的聚集状态。
因此,当气态烃在通常压强下燃烧时,就有了两种不同温度状况下的体积变化:1. 在时,.说明,任何烃在以下燃烧时,其体积都是减小的;2. 在时,。
当y>4时,,即体积增大;当y=4时,,即体积不变;当y〈4时,,即体积减小.四、烃燃烧时耗氧量(nO2)、生成二氧化碳量(nCO2)、生成水量(nH2O)的比较在比较各类烃燃烧时消耗或生成的量时,常采用两种量的单位来分别进行比较:1. 物质的量相同的烃C x H y,燃烧时也就是说:(1)相同条件下等物质的量的烃完全燃烧时,(x+y/4)值越大,消耗O2越多;x值越大,生成的CO2越多;y值越大,生成的水越多。
(2)1mol有机物每增加一个CH2,消耗O2量增加为:(1+2/4)=1。
5mol2。
质量相同的烃C x H y转换成yCHx,燃烧时也就是说:(1)质量相同的含氢质量分数(y/x)大的烃,燃烧时耗氧量大,生成水量大,生成二氧化碳量小.(2)最简式相同的烃,不论以何种比例混合,只要混合物的总质量一定,完全燃烧后的耗氧量、生成二氧化碳量、生成水的量也一定。
五、混合烃燃烧时的加和性尽管烃的混合物燃烧时,具有单一烃各自的燃烧特征,但它们具有加和性。
烃的燃烧规律
烃是一类碳氢化合物,常见的有甲烷、乙烷、丙烷等。
燃烧是烃常见的化学反应之一,也是我们日常生活中经常遇到的现象。
烃的燃烧规律是非常重要的,对我们了解燃烧过程有着重要的指导意义。
首先,烃的燃烧需要氧气的参与,也就是说,烃在空气中才能进行燃烧。
一般情况下,烃与氧气在一定温度下发生反应,产生二氧化碳和水。
例如,甲烷(CH4)与氧气(O2)反应生成二氧化碳(CO2)和水(H2O)。
其次,烃的燃烧是一个放热反应,也就是说,在燃烧过程中会释放出大量的热能。
这是因为烃分子中碳和氢的键能被氧气的氧原子断裂,形成新的碳氧键和氢氧键,释放出能量。
这也是为什么火焰能够发出明亮的光和强烈的热量。
此外,烃的燃烧还可以根据所需的条件进行控制。
例如,燃烧需要一定的温度和点火源。
在点火源引燃下,烃分子开始裂解,碳和氢逐渐与氧结合,产生大量的热量。
而烃的燃烧速度也与温度、压力、燃料浓度和氧气浓度等因素有关。
总结起来,烃的燃烧规律是需要氧气参与的放热反应。
燃烧过程中,氧气与烃分子中的碳和氢发生反应,形成二氧化碳和水,同时释放出大量的热能。
燃烧的速度受到多种因素的影响,需要适当的温度和点火源。
对于我们来说,了解烃的燃烧规律可以帮助我们安全使用和储存燃料,同时也有助于环境保护,减少有害气体的排放。
因此,在日常生活中要注意合理使用烃类燃料,确保燃烧的环境和条件安全合理。
同时,研究燃烧规律也有助于改善燃烧过程,提高燃烧效率,减少能源浪费和污染物的排放。
对于环境保护和节能减排而言,烃的燃烧规律掌握得越全面,我们就能更好地应对能源挑战。
烃的燃烧规律及应用烃是一类由碳和氢元素组成的有机化合物,常见的烃包括烷烃、烯烃和炔烃。
烃具有较高的能量含量和燃烧性能,因此广泛应用于能源、化工和燃料等领域。
下面将从燃烧规律和应用两个方面来详细介绍烃的特点和用途。
燃烧规律:烃的燃烧是指烃与氧气发生氧化反应,产生二氧化碳和水。
燃烧的化学方程式如下:CnHm + (n+m/4)O2 →nCO2 + m/2H2O根据这个方程式,可以得出烃的燃烧规律:1. 反应物:烃燃烧的反应物主要是烃和氧气。
烃是能够提供燃料的有机物,而氧气是燃烧所需的氧化剂。
当烃和氧气充分接触时,燃烧反应会自发进行。
2. 产物:烃的燃烧主要产生二氧化碳和水。
二氧化碳是一种常见的废气,在空气中存在会造成温室效应。
水是燃烧过程中产生的水蒸气。
产物的生成主要取决于烃和氧气的化学反应。
3. 反应条件:烃的燃烧需要一定的温度和氧气浓度来提供充分的反应条件。
当温度较高、氧气浓度足够时,燃烧反应速率较快,燃烧产热较多。
应用:烃的燃烧具有高能量含量和方便燃烧等特点,因此被广泛用于以下领域:1. 能源:烃是重要的化石燃料,如石油和天然气主要由烃组成。
燃烧烃类化合物可以产生大量的热能,用于发电、供暖和工业生产等,是主要的能源来源之一。
2. 燃料:烃可用作汽车、飞机和船舶等交通工具的燃料。
烷烃类化合物如汽油、柴油和天然气都可以作为燃料使用,为交通工具提供动力。
3. 化工:烃可作为化学工业的原料和中间体。
通过烃类化合物可以合成各种有机化学品,如塑料、纤维、润滑油和溶剂等。
烃也可以用于制备合成氨、甲醇和乙醇等重要化学品。
4. 生活用品:烃也被用于生活用品的制备。
例如,烷烃类化合物可以提炼成石蜡,用于制作蜡烛、抛光剂和防水剂等。
而烷烃类烃燃烧产生的火焰可以用于灶具、热水器等家庭用具。
总结起来,烃的燃烧规律和应用主要体现在烃与氧气发生氧化反应,产生二氧化碳和水。
烃的高能量含量和方便燃烧性质使其在能源、化工和燃料等领域有着广泛的应用。
烃的燃烧规律总结烃的燃烧就是很简单的,但它的计算现象丰富多彩,从而成为考查学生综合应用能力的一个不可多得的知识点。
一、烃的燃烧化学方程式不论就是烷烃、烯烃、炔烃还就是苯及苯的同系物,它们组成均可用C x H y 来表示,这样当它在氧气或空气中完全燃烧时,其方程式可表示如下:二、烃燃烧时物质的量的变化烃完全燃烧前后,各物质的总物质的量变化值与上述燃烧方程式中的化学计量数变化值一致,即。
也就就是说,燃烧前后物质的量变化值仅与烃分子中的氢原子数有关,而与碳原子数无关。
且:当y>4时,,即物质的量增加;当y= 4时,,即物质的量不变;当y<4时,,即物质的量减少。
三、气态烃燃烧的体积变化要考虑燃烧时的体积变化,必须确定烃以及所生成的水的聚集状态。
因此,当气态烃在通常压强下燃烧时,就有了两种不同温度状况下的体积变化:1、在时,。
说明,任何烃在以下燃烧时,其体积都就是减小的;2、在时,。
当y>4时,,即体积增大;当y=4时,,即体积不变;当y<4时,,即体积减小。
四、烃燃烧时耗氧量(nO2)、生成二氧化碳量(nCO2)、生成水量(nH2O)的比较在比较各类烃燃烧时消耗或生成的量时,常采用两种量的单位来分别进行比较:1、物质的量相同的烃C x H y,燃烧时也就就是说:(1)相同条件下等物质的量的烃完全燃烧时,(x+y/4)值越大,消耗O2越多;x值越大,生成的CO2越多;y值越大,生成的水越多。
(2)1mol有机物每增加一个CH2,消耗O2量增加为:(1+2/4)=1、5mol2、质量相同的烃C x H y转换成yCHx,燃烧时也就就是说:(1)质量相同的含氢质量分数(y/x)大的烃,燃烧时耗氧量大,生成水量大,生成二氧化碳量小。
(2)最简式相同的烃,不论以何种比例混合,只要混合物的总质量一定,完全燃烧后的耗氧量、生成二氧化碳量、生成水的量也一定。
五、混合烃燃烧时的加与性尽管烃的混合物燃烧时,具有单一烃各自的燃烧特征,但它们具有加与性。
因此,可以将瞧作为混合烃的“平均分子式”。
这样就找到了将“混合烃”转换成“单一烃”的支点,从而根据“一大一小法”或“十字交叉法”就很容易求解出混合物中具有哪些组份以及这些组份的物质的量分数。
六、典型例题解析1、时,2 L常见烃A的蒸气能在b L氧气中完全燃烧,反应后体积增至(b+4) L(体积在同前的条件下测定)。
(1)烃A在组成上应满足的条件就是______________;(2)当b=15时,该烃可能的化学式______________;(3)当A在常压常温下为气态,b的取值范围就是______________。
解析:这就是一道单一气态烃在大于以上燃烧的体积变化计算题,由于体积增加值,故得y=8因此,烃A在组成上应满足的条件就是:该烃分子中氢原子数为8,且在总耗氧量不超过15L的情况下,其可能的化学式为。
但在常温常压下只有、答案:(1)该烃分子中氢原子数为8;(2);(3)2、现有A、B两份混合气体,A就是烯烃R与足量O的混合气体,B就是烯烃2的混合气体。
在下,取A、B各2、24 L,分别R、炔烃Q与足量O2燃烧,A充分燃烧后气体总体积仍为2、24L,B充分燃烧后气体总体积为2、34 L(燃烧后的产物均为气态,其体积已换算成为标准状况)。
通过计算,写出:(1)R、Q的化学式;(2)求2、24LB中烯烃R所允许的最大体积就是多少L?解析:由于A充分燃烧后气体的体积不变,故A中的烯烃R一定为含有4个氢原子的;又由于B充分燃烧,气体的体积增加,故B中的烷烃分子中的氢原子数一定大于4,而在标准状况下惟有符合,又x L 3 xL且得x=0、235L答案:(1)。
3.由两种气态烷烃组成的混合物,标准状况下的密度为1、16 g/L,则关于混合物的组成判断正确的就是( )A.一定有甲烷B.一定有乙烷C.可能就是丙烷与丁烷的混合物D.可能就是乙烷与丙烷的混合物解析:该混合物的平均摩尔质量为1、16 g/L×22、4 L/mol≈26 g/mol,在烷烃中相对分子质量小于26的只有甲烷,常温下为气态的烷烃还有乙烷、丙烷、丁烷,相对分子质量大于26的气态烷烃与甲烷按一定比例混合后均可以符合题意。
答案:A4.等质量的下列有机物完全燃烧,消耗O2最多的就是( )A.CH4B.CH3CH3C.C3H8D.C5H12解析:甲烷中含氢量最高,等质量时完全燃烧消耗的氧气最多。
答案:A5.两种气态烃以一定比例混合,在105℃时,1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体的体积为11 L,下列各组混合烃中不符合此条件的就是( )A.C3H6、C4H10B.CH4、C3H8C.C2H4、C4H10D.C3H8、C4H8解析:因反应体系的温度为105℃,故生成的H2O为气态,设该混合烃的平均分子式为C x H y,则C x H y+(x+y4)O2――→点燃x CO2+y2H2O ΔV1 x+y4xy2y4-11 L 11 L-(9+1)L则y4-1=1,y=8即该混合烃的平均分子式为C x H8,则组成该混合烃的两种烃中,一种分子中含氢原子数大于8,另一种小于8或都等于8,B选项中CH4、C3H8的混合物平均分子式中氢原子数小于8,不符合题中条件。
答案:B6.将在120℃、1、01×105Pa的条件下由烃A与最简单的烯烃B组成的2 L 混合气体与足量的氧气混合并点燃使A、B完全燃烧。
恢复到原来的温度与压强时测得生成4 L二氧化碳与4、8 L水。
A的结构简式就是______,B的结构简式就是______,B在A、B混合气体中所占的体积分数就是______。
解析:最简单的烯烃为乙烯,故B为CH2==CH2。
在同温、同压下,混合烃与生成的二氧化碳、气态水的体积比就是2∶4∶4、8,则混合物的平均化学式就是C2H 4、8,则A分子中含H原子数>4、8,必定就是CH3CH3。
设CH2==CH2与CH3CH3的体积比就是a∶b,则(4a+6b)/(2a+2b)=4、8∶2,a∶b=3∶2,所以CH2==CH2在混合气体中所占的体积分数就是33+2×100%=60%。
答案:CH3CH3CH2==CH260%7.a mL 三种气态烃的混合物与足量的氧气混合点燃爆炸后,恢复到原来的状态(常温、常压),体积共缩小2a mL。
则三种烃可能就是( )A.CH4、C2H4、C3H6B.C2H6、C3H6、C4H6C.CH4、C2H6、C3H8D.C2H6、C2H2、CH4解析:设混合烃的平均组成为C x H y,根据烃的燃烧通式C x H y+(x+y4)O2――→点燃x CO2+y2H2O ΔV1 x+y4x 1+y4a 2a则:1+y4=2,y=4,符合H原子数平均为4的烃即可。
D项,当C2H6与C2H2的物质的量之比为1∶1时,混合物分子平均氢原子数为4个,此时符合题意。
答案:D8.1 mol C x H y(烃)完全燃烧需要5 mol O2,则x与y之与可能就是( )A.x+y=5B.x+y=7C.x+y=11D.x+y=9解析:烃的燃烧通式为C x H y+(x+y4)O2――→点燃x CO2+y2H2O,x+y4=5,分别代入各项中,因x、y为正整数,所以C项合理,得x=3,y=8。
答案:C9.在一密闭容器中充入一种气态烃与足量的氧气,用电火花点燃,完全燃烧后,容器内气体体积保持不变,若气体体积均在120℃与相同的压强下测定,这种气态烃就是( )A.CH4B.C2H6C.C2H2D.C3H6解析:120℃时水就是气体,故由烃的燃烧通式:C x H y+(x+y4)O2――→点燃x CO2+y2H2O1 x+y4xy2由题意知1+x+y4=x+y2,可知y=4,故正确选项为A。
10、120 ℃时,将1体积某气态烃与7体积氧气混合完全燃烧后恢复到原来的温度与压强时气体体积变为原来的98,则该烃分子式不可能为( )A.C3H8B.C4H8C.C5H8D.C7H8解析:由烃的燃烧通式C x H y+(x+y4)O2――→点燃x CO2+y2H2O1 x+y4xy2则x+y2≤8×98=9,D项不符合题意。