专题1原子结构与晶体
- 格式:docx
- 大小:22.57 KB
- 文档页数:4


郴州市二中高一化奥班辅导资料——晶体结构(2008-05-28)【涉及概念和内容】根据《化学课程标准》和中学化学教材以及《物质结构与性质》选修教材,晶体结构涉及的内容包括:(1)基本概念:周期性有序排列、晶胞及晶胞类型、晶胞中粒子数的计算、配位数、空隙、堆积方式、晶格能、并置碓砌;(2)堆积方式:面心立方、六方、体心立方和简单立方堆积;(3)晶体种类和性质:金属晶体、离子晶体、分子晶体、原子晶体,自范性、各向异性、金属晶体的导电导热和延展性、X-射线衍射。
这些内容看似零碎,实际上它们有着密切的内在联系,了解和建立它们的关系,对于晶体结构的教与学,深刻理解晶体结构和性质,掌握核心、突出重点都是很重要的。
它们的联系可以用下面的结构表示,其中堆积类型是联系晶体基本概念、基本结构与不同晶体类型的结构和性质的桥梁。
面心立方最密堆积(A1)最密堆积六方最密堆积(A3)体心立方密堆积(A2)简单立方堆积金刚石型堆积(四面体堆积)(A4)一、晶体的结构1、晶体的概念晶体是质点(原子、分子、离子)在空间有规律周期性地重复排列,是具有规则的多面体固体物质。
2自范性:在一定条件下晶体能自动地呈现具有一定对称性的多面体的外形(晶体的形貌)。
非晶体不能呈现多面体的外形。
晶态石英的谱图非晶态石英的谱图3、晶体的点阵结构概念:在晶体内部原子或分子周期性地排列的每个重复单位的相同位置上定一个点,这些点按一定周期性规律排列在空间,这些点构成一个点阵。
点阵是一组无限的点,连结其中任意两点可得一矢量,将各个点阵按此矢量平移能使它复原。
点阵中每个点都具有完全相同的周围环境。
晶体结构= 点阵+ 结构基元结构基元:在晶体的点阵结构中每个点阵所代表的具体内容,包括原子或分子的种类和数量及其在空间按一定方式排列的结构。
(1)直线点阵(2)平面点阵(3)晶胞(晶胞是人为划定的,为平行六面体)空间点阵必可选择3个不相平行的连结相邻两个点阵点的单位矢量a,b,c,它们将点阵划分成并置的平行六面体单位,称为点阵单位。


第一章 原子结构与性质知识点归纳2.位、构、性关系的图解、表解与例析3.元素的结构和性质的递变规律同位素(两个特性)4.核外电子构成原理(1)核外电子是分能层排布的,每个能层又分为不同的能级。
(2)核外电子排布遵循的三个原理:a .能量最低原理b .泡利原理c .洪特规则及洪特规则特例(3)原子核外电子排布表示式:a .原子结构简图 b .电子排布式 c .轨道表示式 5.原子核外电子运动状态的描述:电子云 6.确定元素性质的方法1.先推断元素在周期表中的位置。
2.一般说,族序数—2=本族非金属元素的种数(1 A 族 除外)。
3.若主族元素族序数为m ,周期数为n ,则: (1)m/n<1时为金属,m/n 值越小,金属性越强:(2)m/n>1时是非金属,m/n 越大,非金属性越强;(3)m/n=1时是两性元素。
随着原子序数递增① 原子结构呈周期性变化② 原子半径呈周期性变化③ 元素主要化合价呈周期性变化④ 元素的金属性与非金属形呈周期性变化⑤ 元素原子的第一电离能呈周期性变化⑥ 元素的电负性呈周期性变化元素周期律 排列原则① 按原子序数递增的顺序从左到右排列 ② 将电子层数相同的元素排成一个横行 ③ 把最外层电子数相同的元素(个别除外),排成一个纵行周期 (7个 横行) ① 短周期(第一、二、三周期)② 长周期(第四、五、六周期)③ 不完全周期(第七周期)性质递变 原子半径主要化合价元 素 周期表族(18 个纵行) ① 主族(第ⅠA 族—第ⅦA 族共七个) ② 副族(第ⅠB 族—第ⅦB 族共七个) ③ 第Ⅷ族(第8—10纵行) ④结构第二章 分子结构与性质复习1.微粒间的相互作用(2)共价键的知识结构2.分子构型与物质性质(1)微粒间的相互作用σ键π键 按成键电子云 的重叠方式极性键 非极性键一般共价键 配位键离子键 共价键 金属键 按成键原子的电子转移方式 化学键 范德华力氢键 分子间作用力本质:原子之间形成共用电子对(或电子云重叠) 特征:具有方向性和饱和性σ键特征 电子云呈轴对称(如s —s σ键、 s —p σ键、p —p σ键)π键 特征电子云分布的界面对通过键轴的一个平面对称(如p —p π键)成键方式共价单键—σ键共价双键—1个σ键、1个π键共价叁键—1个σ键、2个π键 规律 键能:键能越大,共价键越稳定键长:键长越短,共价键越稳定键角:描述分子空间结构的重要参数用于衡量共价键的稳定性 键参数 共 价 键定义:原子形成分子时,能量相近的轨道混合重新组合成一组新轨道sp 杂化 sp 2杂化sp 3杂化 分类 构型解释: 杂化理论sp 杂化:直线型sp 2杂化:平面三角形sp 3杂化:四面体型杂化轨道理论 价电子理论 实验测定 理论推测 构型判断 分 子 构 型共价键的极性 分子空间构型决定因素由非极性键结合而成的分子时非极性分子(O 3除外),由极性键组成的非对称型分子一般是极性分子,由极性键组成的完全对称型分子为非极性分子。

高中化学晶体的结构与性质专项训练专题复习含答案一、晶体的结构与性质1.萤石(CaF2)属于立方晶体(如图),晶体中每个Ca2+被8个F-包围,则晶体中F-的配位数为A.2B.4C.6D.82.如图是从NaCl和CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是()A.只有c B.b和c C.a和c D.a和d3.下列说法不正确的是A.2p和3p轨道形状均为哑铃形,能量也相等B.金属离子的电荷越多、半径越小,金属晶体的熔点越高C.石墨转化为金刚石既有共价键的断裂和生成,也有分子间作用力的破坏D.DNA分子的两条长链中的碱基以氢键互补配对形成双螺旋结构,使遗传信息得以精准复制4.下列关于氯化钠晶胞(如图)的说法正确的是()A.每个晶胞含有6个Na+和6个Cl-B.晶体中每个Na+周围有8个Cl-,每个Cl-周围有8个Na+C.晶体中与每个Na+最近的Na+有8个D.将晶胞沿体对角线AB作投影,CD两原子的投影将相互重合5.纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因。
假设某纳米颗粒的大小和形状恰好与某晶体晶胞的大小和形状(如图)相同,则这种纳米颗粒的表面粒子数占总粒子数的百分数为()A.87.5% B.88.9% C.96.3% D.100%6.下列关于等离子体的叙述正确的是()A.物质一般有固态、液态和气态三态,等离子体却被认为是物质存在的第四态B.为了使气体变成等离子体,必须使其通电C.等离子体通过电场时,所有粒子的运动方向都发生改变D.等离子体性质稳定,不易发生化学反应7.美国某国家实验室成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2的原子晶体的说法正确的是()A.CO2的原子晶体和分子晶体互为同分异构体B.在一定条件下,CO2的原子晶体转化为分子晶体是物理变化C.CO2的原子晶体和分子晶体具有相同的物理性质D.在CO2的原子晶体中,每个C原子周围结合4个O原子,每个O原子与2个碳原子结合8.下列叙述正确的是A.离子晶体中,只存在离子健,不可能存在其它化学键B.可燃冰中甲烷分子与水分子之间存在氢键C.Na2O2、NaHSO4晶体中的阴、阳离子个数比均为12D.晶体熔点:金刚石>食盐>冰>干冰9.石墨可作电极材料、耐高温耐酸材料、铅笔芯等,以下有关石墨的叙述正确的是①属原子晶体②属分子晶体③是C60的同素异形体④每个碳原子都形成了4个共用电子对A.①③④B.②③④C.②③D.③10.C60、金刚石和石墨的结构模型如图所示(石墨仅表示出其中的一层结构)。
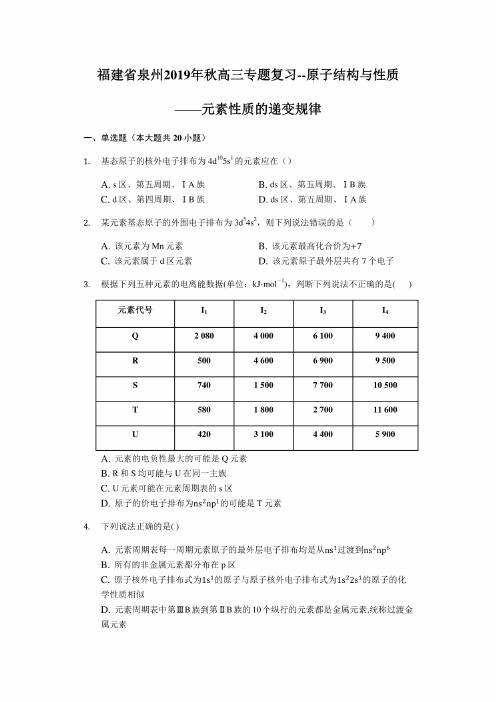
福建省泉州2019年秋高三专题复习--原子结构与性质—元素性质的递变规律—一、单选题(本大题共20小题)1.基态原子的核外电子排布为4d105s1的元素应在()A.s区、第五周期、IA族B.ds区、第五周期、IB族C.d区、第四周期、IB族D.ds区、第五周期、IA族2,某元素基态原子的外围电子排布为3d54s2,则下列说法错误的是()A.该元素为Mn元素B.该元素最高化合价为+7C.该元素属于d区元素D.该元素原子最外层共有7个电子3.根据下列五种元素的电离能数据(单位:kJ.molT),判断下列说法不正确的是()元素代号11h13:4 Q2080400061009400R500460069009500S7401500770010500T5801800270011600U420310044005900A.元素的电负性最大的可能是Q元素B.R和S均可能与U在同一主族C.U元素可能在元素周期表的S区D.原子的价电子排布为ns2npi的可能是T元素4,下列说法正确的是()A.元素周期表每一周期元素原子的最外层电子排布均是从ns】过渡到ns2np6B.所有的非金属元素都分布在p区C.原子核外电子排布式为Is】的原子与原子核外电子排布式为1s22s】的原子的化学性质相似D.元素周期表中第HIB族到第U B族的10个纵行的元素都是金属元素,统称过渡金属兀素5, 在元素周期表中,伯元素与铁元素同族,则祐元素位于。
A. s 区B. p 区C. d 区D. ds 区6, 第一电离能最小的金属、电负性最大的的非金属、常温下呈液态的金属(价电子排布为5d 106s 2)分别位于下面元素周期表中的()—. 11 1Illi Illi ___iill till . _ J . ■ 1. ■ .-i _ . ; . ■血i i i i i i 1 1 1 | 1 11 1■ ill • • i i 1 11::::::ds ;1::: J f 1 1 1 1 1 1------1 J 1 1 i 1 11i i i 1 i i DC i i i i i i ■ a • 1 e >11A. s 区、p 区、ds 区B. s 区、p 区、d 区C. f 区、p 区、ds 区D. s 区、f 区、ds 区7, 现有①、②、③三种元素的基态原子的电子排布式如下:①ls 22s 22p 63s 23p 4;②ls 22s 22p 63s 23p 3; (3)ls 22s 22p 5.则下列有关比较中正确的是( )A.第一电离能:③〉②>①B.原子半径:①'②〉③C.电负性:③ > ② > ①D.最高正化合价:③ > ① > ②8, 己知X 、Y 是主族元素,I 为电离能,单位是kJ-mol 1.根据如表所列数据判断,错误的是( )A. 元素X 的常见化合价是+1价B. 元素Y 是IIIA 族元素C. 若元素Y 处于第3周期,它的单质可与冷水剧烈反应D. 元素X 与氯元素形成化合物时,化学式可能是XC1元素II I 2【3I4X500460069009500Y 58018002700116009,某元素的第一电离能至第七电离能(kJ/mol )如下:II I2I 3I4I 5I 6I75781817274511575148301837623293该元素最有可能位于元素周期表的族是()第2页,共33页A.I A b.ha c. nA D.IVA10.下列说法中正确的是()①s p3杂化轨道是由同一个原子中能量最近的S轨道和P轨道混合起来形成的一组能量相同的新轨道②同一周期从左到右,元素的第一电离能、电负性都是越来越大③分子中键能越大,表示分子拥有的能量越高④所有的配合物都存在配位键⑤所有含极性键的分子都是极性分子⑥熔融状态下能导电的化合物一定是离子化合物⑦所有的原子晶体都不导电A.①②③B.①⑦C.④⑥⑦D.①④⑥11.下列叙述正确的个数是O①配位键在形成时,是由成键双方各提供一个电子形成共用电子对②s-s6键与s-p6键的电子云形状相同③Ge的核外电子排布式为:[Ar]4s24p2,属于P区元素④下列分子键角大小由大到小为:COS>BC13>CC14>H2O>P4⑤冰中存在极性共价键和氢键两种化学键的作用⑥C u(OH)2是一种蓝色的沉淀,既溶于硝酸、浓硫酸,也能溶于氨水中⑦中心原子采取sp3杂化的分子,其立体构型不一定是正四面体形⑧键长:C-H⑨第一电离能:SiA.1B.2C.3D.412.气态中性原子失去一个电子转化为气态正离子所需要的最低能量叫做第一电离能(11),气态正离子继续失去电子所需要的最低能量依次称为第二电离能(【2),第三电离能03)……右表是第3周期部分元素的电离能[单位:eV(电子伏特)擞据。



第一章 原子排列与晶体结构1. fcc 结构的密排方向是 ,密排面是 ,密排面的堆垛顺序是 ,致密度为 ,配位数是 ,晶胞中原子数为 ,把原子视为刚性球时,原子的半径r 与点阵常数a 的关系是 ;bcc 结构的密排方向是 ,密排面是 ,致密度为 ,配位数是 ,晶胞中原子数为 ,原子的半径r 与点阵常数a 的关系是 ;hcp 结构的密排方向是 ,密排面是 ,密排面的堆垛顺序是 ,致密度为 ,配位数是 ,,晶胞中原子数为 ,原子的半径r 与点阵常数a 的关系是 。
2. Al 的点阵常数为0.4049nm ,其结构原子体积是 ,每个晶胞中八面体间隙数为 ,四面体间隙数为 。
3. 纯铁冷却时在912ε 发生同素异晶转变是从 结构转变为 结构,配位数 ,致密度降低 ,晶体体积 ,原子半径发生 。
4. 在面心立方晶胞中画出)(211晶面和]211[晶向,指出﹤110﹥中位于(111)平面上的方向。
在hcp 晶胞的(0001)面上标出)(0121晶面和]0121[晶向。
5. 求]111[和]120[两晶向所决定的晶面。
6 在铅的(100)平面上,1mm 2有多少原子?已知铅为fcc 面心立方结构,其原子半径R=0.175×10-6mm 。
第二章 合金相结构一、 填空1) 随着溶质浓度的增大,单相固溶体合金的强度 ,塑性 ,导电性 ,形成间隙固溶体时,固溶体的点阵常数 。
2) 影响置换固溶体溶解度大小的主要因素是(1) ;(2) ;(3) ;(4) 和环境因素。
3) 置换式固溶体的不均匀性主要表现为 和 。
4) 按照溶质原子进入溶剂点阵的位置区分,固溶体可分为 和 。
5) 无序固溶体转变为有序固溶体时,合金性能变化的一般规律是强度和硬度 ,塑性 ,导电性 。
6)间隙固溶体是 ,间隙化合物是 。
二、 问答1、 分析氢,氮,碳,硼在α-Fe 和γ-Fe 中形成固溶体的类型,进入点阵中的位置和固溶度大小。

物质结构专题(电子式化学键晶体结构)班级姓名一、电子式1. 下列物质的电子式书写正确的是(广东90.2) ( )A. B. C.D.2.下列电子式中错误的是()A. Na+B.C.D.(03上海化学)3.下列分子的电子式书写正确的是()A. 氨B. 四氯化碳(01上海)C. 氮D. 二氧化碳4.下列电子式中,正确的是(00春京)()A.B.C.D.5.下列电子式书写错误的是()(98上海)6.下列电子式书写正确的是()(97上海)7.下列电子式书写错误的是()H ∶N∶HH....HH+[∶O∶]2-H+....∶N∶∶N∶∶(96上海)8. 下列分子的结构中,原子的最外层电子不能都满足8电子稳定结构的是( )A. CO2B. PCl3C. CCl4D. NO2 (MCE93.10)9. 下列电子式中,正确的是()(94上海)10.下列各分子中所有原子都满足最外层为8电子结构的是( )A. BeCl2B. PCl3C. PCl5D. N2(99广东)11.下列分子中所有原子都满足最外层8电子结构的是( )A. 光气(COCl2)B. 六氟化硫C. 二氟化氙D. 三氟化硼(98MCE)12. 下列各分子中所有原子都满足最外层8电子结构的是(05)A.光气(ClCOCl)B.五氯化磷 C.三氟化硼 D.水二、化学键13.(1)下列结构中,∙代表原子序数从1到10的元素的原子实(原子实是原子除去最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表价键,(00广东)根据各图表示的结构特点,写出该分子的化学式:A:B:C:D:(2)在分子的结构式中,由一个原子提供成键电子对而形成的共价键用→表示,例如:写出三硝酸甘油酯的的结构式:。
14.(1)由2个C原子、1个O原子、1个N原子和若干个H原子组成的共价化合物,H的原子数目最多..为个,试写出其中一例的结构简式。
(2)若某共价化合物分子只含有C、N、H三种元素,且以n(C)和n(N)分别表示C和N的原子数目,则H原子数目最多..等于。


《量⼦⼒学基础和原⼦、分⼦及晶体结构》习题和思考题《结构化学》课程作业题第⼀部分:《量⼦⼒学基础和原⼦结构》思考题与习题1. 经典物理学在研究微观物体的运动时遇到过哪些困难?举例说明之。
如何正确对待归量⼦论?2. 电⼦兼具有波动性的实验基础是什么?宏观物体有没有波动性?“任何微观粒⼦的运动都是量⼦化的,都不能在⼀定程度上满⾜经典⼒学的要求”,这样说确切吗?3. 怎样描述微观质点的运动状态?为什么?波函数具有哪些重要性质?为什么?4. 简述薛定谔⽅程得来的线索。
求解该⽅程时应注意什么?5. 通过⼀维和三维势箱的解,可以得出哪些重要結論和物理概念?6. 写出薛定谔⽅程的算符表达式。
你是怎样理解这个表达式的? *7. 量⼦⼒学中的算符和⼒學量的关系怎样?8. 求解氢原⼦和类氢离⼦基态和激发态波函数的思想⽅法是怎样的? 9. 通过氢原⼦薛定谔⽅程⼀般解的讨论明确四个量⼦数的物理意义。
10. 怎样根据波函数的形式讨论“轨道”和电⼦云图象?为什么不能说p +1和p -1就是分别代表p x 和p y ? 11. 样来研究多电⼦原⼦的结构?作过哪些近似?⽤过哪些模型?试简单说明之。
12. 电⼦的⾃旋是怎样提出的?有何实验依据?在研究原⼦内电⼦运动时,我们是怎样考虑电⼦⾃旋的?*13. 哈特⾥-福克SCF 模型考虑了⼀些什么问题?交换能有何意义?14. 怎样表⽰原⼦的整体状态?光谱项、光谱⽀项各代表什么含义?洪特规则、选择定则⼜是讲的什么内容?15. 原⼦核外电⼦排布的规律是什么?现在哪些问题你⽐过去理解得更加深⼊了?通过本部分的学习,你对微观体系的运动规律和特点掌握了多少?在思想⽅法上有何收获?16. 巴尔末起初分析氢原⼦光谱是⽤波长)(422-=n n c λ,其中c 为常数,n 为⼤于2的正整数,试⽤⾥德伯常数H R ~求出c 值。
17. 试计算氢原⼦中电⼦处于波尔轨道n = 1和n = 4时的动能(单位:J )和速度(单位:m·s -1)。

专题一名词解释第一章1.金属键:处于聚集状态的金属原子,全部或大部分将他们的价电子贡献出来,为其整个原子集体所公有,称之为电子气或电子云。
这些价电子或自由电子已不在只围绕自己的原子核转动,而是与所有的价电子一起在所有的原子核周围按量子力学的规律运动着,贡献出价电子的原子则变为正离子,沉浸在电子云中,他们依靠运动与其间的公有化的自由电子的静电作用而结合起来,这种结合方式叫金属键。
没有饱和性和方向性。
2.熔点:晶体向非结晶状态的液体转变的临界温度。
3。
晶体结构:晶体中原子在三维空间有规律的周期性的具体排列方式。
4.阵点:将构成晶体的原子抽象为纯粹的几何点,称之为阵点。
5.空间点阵:阵点有规律的周期性重复排列所形成的三维空间阵列称之为6.晶格:认为的将阵点用直线连接起来形成空间格子,称之为晶格。
他的实质是空间点阵。
7.晶胞:能够完全反应晶格特性的最小几何单元称之为晶胞。
8晶格常数、轴间夹角:晶胞的棱边长度一般称为晶格常数,晶胞的棱间夹角称为轴间夹角。
9.配位数:是指晶体结构中与任一原子最近邻、等距离的原子数目。
10.晶面、晶向:在晶体中,由一系列原子所组成的平面称之为晶面。
任意两原子之间连线所指的方向叫晶向。
11.晶粒:组成固态金属的结晶颗粒叫晶粒12.多晶体:有二颗以上晶粒所组成的晶体称为多晶体。
13.伪等向性:由于多晶体中的晶粒位向是任意的,晶粒的各向异性被互相抵消,因此在一般情况下整个晶粒不显示各向异性,称之为伪等向性。
14:多晶型:具有两种或几种晶体结构。
15:多晶型转变或同素异构转变:金属内部有一种晶体结构向另一种晶体结构的转变称之为多晶型转变或同素异构转变。
16晶体缺陷:一些原子偏离规则排列的不完整性区域。
17:空位:在某一温度下的某一瞬间,总有一些原子具有足够高的能量,以克服周围原子对他的约束,脱离开原来的平衡位置迁移到别处,于是在原来的位置上出现了空结点,这就是空位。
18.晶格畸变:19:间隙原子:处于晶格间隙中的原子叫20:置换原子:占据在原来基体原子上的异类原子21:位错:在晶体中某处有一列或若干列原子发生了有规律的错排现象,使长度达几百至几万个原子间距,宽约几个原子间距范围内的原子离开其平衡位置,发生了有规律的错动。



晶体专题复习班级姓名座号一、判断晶体类型的依据与方法(1)依据组成晶体的微粒和微粒间的相互作用判断离子晶体的微粒是阴、阳离子,微粒间的相互作用是离子键;原子晶体的微粒是原子,微粒间的相互作用是共价键;分子晶体的微粒是分子,微粒间的相互作用为分子间作用力;金属晶体的微粒是金属阳离子和自由电子,微粒间的相互作用是金属键。
(2)依据物质的分类判断活泼金属氧化物、强碱和绝大多数的盐类是离子晶体;大多数非金属单质、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外)是分子晶体;常见的原子晶体有单质,如金刚石(C)、晶体硼(B)、晶体硅(Si)、锗(Ge)、灰锡(Sn);某些非金属化合物。
)、碳化硅(SiC;金刚砂)、氮化硼(BN)、如二氧化硅(SiO2氮化铝(AlN)、氮化硅()、刚玉()等;金属单质(除汞外)与合金是金属晶体。
(3)依据晶体的熔点判断离子晶体的熔点较高,常在数百至l 000℃;原子晶体的熔点高,常在l 000℃至几千摄氏度;分子晶体的熔点低.常在数百摄氏度以下至很低温度;金属晶体多数的熔点高,但也有相当低的。
(4)依据导电性判断离子晶体水溶液及熔化时能导电;原子晶体不导电;分子晶体为不导电,分子晶体中的电解质溶于水,也能导电;金属晶体是电的良导体。
(5)依据硬度和机械性能判断离子晶体硬度较大或较硬、脆;原子晶体硬度大;分子晶体硬度小且较脆;金属晶体多数硬度大,但也有较低的,且具有延展性。
二、物质熔、沸点高低的判断方法(1)不同类型晶体熔沸点高低的一般规律为:原子晶体>离子晶体>分子晶体(2)同种晶体类型的物质:晶体内微粒间的作用力越大,熔、沸点越高。
①分子晶体:a.分子间有氢键的,熔沸点较高。
b.组成和结构相似的物质,相对分子质量越大,范德华力越大,熔沸点越高。
c.相对分子质量相等或相近时,分子的极性越大,范德华力越大,熔沸点越高。
d.在烷烃的同分异构体中,一般来说,支链数越多,熔沸点越低。

08~09学年各模拟考汇编(上海)专题原子结构与晶体原子结构5.(闵行二)以下是人们对原子结构的认识所经历的几个重要历史阶段:①道尔顿提出的原子论;②汤姆孙提出的葡萄干面包原子摸型;③德谟克里特的古典原子论;④卢瑟福的原子结构行星模型。
其先后顺序正确的是()A.①②③④B.②③①④C.③④②①D.③①②④4.(十四校二)下列各组物质的分类,正确的是()A.同位素:红磷、白磷B.非电解质:Cl2、C2H5OHC.非极性分子:CO2、CCl4 D.同系物:OH、OCH33.(闵行二)下列各组物质的分类正确的是()A.同分异构体:乙酸、乙二酸B.同位素:C.同素异形体:金刚石、C60 D.同系物:甲醇、苯甲醇4.(闵行一)下列各组物质的类别归属正确的是()A.同位素:1H2、2H2、3H2B.分子晶体:I2、SO3、固态氩C.非电解质:Cl2、BaSO4、C2H5OHD.化合物:重水、双氧水、矿泉水6、(八校)下列有关物质的分类或归类正确的是()①混合物:石炭酸、福尔马林、水玻璃、水银②化合物:CaCl2、烧碱、聚苯乙烯、HD ③电解质:明矾、胆矾、冰醋酸、硫酸钡④同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2 ⑤同位素:612C、613C、614CA、①③④B、③⑤C、②③④D、②④3.(南汇二)据报道,科学家已成功合成了少量O4 ,有关O4的说法正确的是()A.O4与O3、O2是同素异形体B.O4比O2稳定C.相同质量的O4与O3所含原子个数比为4:3 D.O4的摩尔质量是64g13.(十四校一)目前人类认为钚(94Pu)是最毒的元素,其一种原子的中子数是质子数的1.596倍。
该原子的质量数为()A.94 B.150 C.244.024 D.2442.(南汇一)无放射性的同位素称之为“稳定同位素”,在陆地态系统研究中2H、13 C、15 N、18O、34S等常用作环境分析指示物。
下列有关一些“稳定同位素”的说法正确的是()A.34S原子核内中子数为16 B.2H+的酸性比1H+的酸性更强C.16O与18O的化学性质相同D.13C和15N原子核内的质子数相差24. (宝山二)“神舟七号”的燃料是氢化锂三兄弟——LiH、LiD、LiT。
其中Li的质量数为7,对这三种物质的下列说法正确的是()A.质子数之比为1:2:3B.中子数之比为1:1:1C.摩尔质量之比为8:9:10D.化学性质不相同2、(闸北一)随着科学技术的不断进步,研究物质的手段和途径越来越多,N5+、H3、O4、C60等已被发现。
下列有关说法中,正确的是()A.N5+离子中含有36个电子B.C60的摩尔质量为720gC.H2和H3属于同素异形体D.O2和O4属于同位素4. (普陀一)同种元素的不同微粒,它们的()A. 质量数一定相同B. 核外电子数一定相同C. 中子数一定不同D. 电子层数可能不同5.(虹口一)物质发生化学反应时,下列选项在反应前后肯定不发生变化的是①原子总数②分子总数③电子总数④物质的种类⑤物质的总质量⑥物质所具有的总能量()A.①④⑤B.①③⑤C.②⑤⑥D.④⑤⑥10.(静安一)关于硫原子核外电子的叙述错误的是()A.排布在K、L、M三个电子层上B.3p亚层上有2个空轨道C.共有16种不同的运动状态D.共有5种不同的能量4.(十四校一)我国发射载人航天飞船用火箭的起动炸药为氢化锂、氘化锂和氚化锂。
它们()A.都是共价化合物B.由同位素原子构成的同分异构体C.具有较强还原性D.所有结构微粒的半径全部都相同7.(浦东二)下列说法中正确的是()A.分子中键能越大,键越长,则分子越稳定B.电子层结构相同的不同离子,其半径随核电荷数增多而减小C.在化学反应中,某元素由化合态变为游离态,该元素被还原D.是我国在1992年发现的一种元素的新的同位素,它的中子数是288晶体结构4.(卢湾一)下列化学式既能表示物质的组成,又能表示物质的一个分子的是()。
A.CuB.C2H4C.NaClD.SiO22.(浦东二)下列物质加热熔化时破坏极性共价键的是()A.干冰B.二氧化硅C.晶体硅D.氢氧化钠2. (宝山二)下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是()A.SiO2和SO2B.Na2O2和H2O2C.CO2和H2OD.NaCl和HCl 4.下列各组物质中,都属于含极性键的非极性分子的是A.BCl3、CH4 B.F2、C2H2 C.NH3、HCl D.CO2、H2O3.(嘉定一)下列化学式既能表示物质的组成,又能表示物质分子式的是()A.NH4NO3B.SiO2C.C6H5OHD.Fe14.(卢湾一)下列说法正确的是()。
A.原子晶体中只存在非极性共价键B.离子晶体熔化时破坏了离子键C.干冰升华时,分子内共价键会发生断裂D.金属元素和非金属元素形成的化合物一定是离子化合物5. (普陀一)下列有关化学键的叙述正确的是A. 由两种元素组成的共价化合物分子中,只存在极性键B. 不同种非金属元素原子之间形成的化学键都是极性键C. 离子化合物一定不含共价键D. 共价化合物可能不含离子键4.(南汇一)下列说法中正确的是A.完全由非金属元素组成的化合物一定是共价化合物B.由金属元素和非金属元素组成的化合物一定是离子化合物C.离子化合物中不可能含有非极性共价键 D. 离子键只存在离子化合物中8.(十四校一)有关物质结构的叙述正确的是()A.有较强共价键存在的物质熔沸点一定很高B.由电子定向移动而导电的物质是金属晶体C.只含有共价刍的物质不一定是共价化合物D.在离子化合物中不可能存在非极性共价键7.(浦东一下列有关晶体的叙述中正确的是()A.冰熔化时水分子中共价键发生断裂B.原子晶体中只存在共价键,一定不含有离子键C.金属晶体的熔沸点均很高D.分子晶体中一定含有共价键6.(南汇二)下列有关化学键与晶体结构说法正确的是A.两种元素组成的分子中一定只有极性键B.离子化合物的熔点一定比共价化合物的高C.非金属元素组成的化合物一定是共价化合物D.含有阴离子的化合物一定含有阳离子6. (宝山二)下列有关化学键与晶体结构说法正确的是()A.两种元素组成的分子中一定只有极性键B.离子化合物的熔点一定比共价化合物的高C.非金属元素组成的化合物一定是共价化合物D.含有阴离子的化合物一定有阳离子10. (静安二)有关晶体的下列说法中正确的是A. 分子晶体中都含有共价键B. 金属键键能越大金属单质的还原性越强C.原子晶体中共价键越强,熔点越高 D. 离子晶体溶于水时,离子键未被破坏3.(卢湾二)有关晶体的下列说法中正确的是A.分子晶体的稳定性决定于分子间作用力的大小B.原子晶体的熔点一定高于其它晶体C.氯化钠溶于水时离子键被破坏D.金属晶体中金属键越强,金属的活泼性越差7.(普陀二)下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是A.干冰和氯化铵分别受热变为气体B.二氧化硅和钠分别受热熔化C.苯和液溴分别受热变为气体D.食盐和葡萄糖分别溶解在水中15.(青浦一)有关晶体的下列说法中正确的是A.晶体中分子间作用力越大,分子越稳定B.原子晶体中共价键越强,熔点越高C.干冰融化时分子中共价键发生断裂D.氯化钠溶于水时离子键未被破坏9.(普陀二)关于化合物的下列说法中正确的是A.熔化状态下不导电的化合物一定是共价化合物B.只含有共价键的物质一定是共价化合物C.由两种不同的原子组成的纯净物一定是化合物D.不含非极性键的分子晶体一定是共价化合物10.(闵行二)下列说法正确的是A.在离子晶体的结构中一定不存在共价健B.在共价化合物的分子中可能存在离子键C.在氧化还原反应中,应至少有两种元素的化合价发生变化D.一种离子和一种分子的质子数和电子数不可能分别都相等7.(十四校二)下列指定微粒的个数比是1:2的是()A.Be2+中的质子和电子B.原子中的中子和质子C.Na2O2固体中的阴离子和阳离子D.K2CO3晶体中的阳离子和阴离子16. (市调研)下列叙述中,结论和对应的解释均错误的是()A. 金刚石的熔沸点高于晶体硅,因为C-C键能大于Si-Si键能B. 二氧化硅晶体中不存在SiO2分子,因为它含有类似金刚石的空间网状结构C. 稀有气体的晶体属于原子晶体,因为其组成微粒是原子,不存在分子间作用力D. 四面体构型的分子不一定是非极性分子,因为四个键角不一定相等9.(闵行二)下列说法错误的是A.Na2O2晶体中阴、阳离子数之比为1∶2bvB.0.1 mol/L醋酸与0.2 mol/L醋酸中c(H+)之比大于1∶2C.常温下pH=1的硝酸和pH=2的硝酸中c(H+)之比为1∶2D.NO2溶于水时,被还原的NO2与被氧化的NO2物质的量之比为1∶25. (奉贤二)由解放军总装备部军事医学院研究所研制的小分子团水,解决了医务人员工作时的如厕难题。
新型小分子团水,具有饮用量少、渗透力强、生物利用率高、在人体内储存时间长、排放量少的特点。
一次饮用125mL小分子团水,可维持人体6小时正常需水量。
下列关于小分子团水的说法正确的是A.水分子的化学性质改变B.水分子中氢氧键缩短C.水分子间的作用力减小D.水分子间结构、物理性质改变13、(闸北二)下列叙述中正确的是A.某非金属元素从游离态变成化合态时,该元素一定被还原B.气态氢化物的稳定性:HF>HCl,是因为H-F的键能大于H-ClC.NF3分子结构是三角锥形,分子中三个N-F键的性质完全相同,故NF3分子是非极性分子D.分子晶体在状态变化或溶于水的过程中,均不会破坏化学键3、(八校)下列叙述中正确的是()A、CO2分子内含有极性键,所以CO2分子是极性分子B、分子晶体、原子晶体中一定含有共价键,离子晶体一定含有离子键C、气态氢化物的稳定性:NH3>PH3>AsH3D、某非金属元素从游离态变成化合态时,该元素一定被还原3.(虹口一)1993年世界十大科技新闻称:中国学者徐志博和美国科学家穆尔共同合成了世界最大的碳氢化合物分子,其中1个分子由ll34个碳原子和1146个氢原子构成。
关于此物质的下列说法中,错误的是A.属于烃类化合物B.常温下一定是固体C.易被氧化D.具有类似金刚石的硬度12.(静安一)右图是已经合成的一种硫氮化合物的分子结构,下列说法中正确的是A.该物质属原子晶体B.该物质具有很高的熔、沸点C.该物质的分子中既有极性键又有非极性键D.该物质与化合物S2N2互为同素异形体7.(黄浦二)20世纪80年代后,人们发现和证实了碳的另一类单质,它们是由一系列偶数个碳原子组成的分子,其中C60(足球烯,分子中含有30个双键)最具代表性。
下图所示为n个C60连接而成的物质X下列有关X的说法中不正确的是()A.X难溶于水B.一定条件下X可与H2发生加成反应C.X是碳的一种同素异形体D.X的摩尔质量为720n。