专题原子结构化学键doc
- 格式:doc
- 大小:839.00 KB
- 文档页数:22


物质结构元素周期律第1讲原子结构化学键复习目标知识建构1.了解元素、核素和同位素的含义。
2.了解原子的构成,了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
3.了解原子核外电子排布规律,掌握原子结构示意图、电子式、结构式的表示方法。
4.了解化学键的定义,了解离子键、共价键的形成。
5.了解相对原子质量、相对分子质量的定义,并能进行有关计算。
一、原子结构、核素和同位素1.原子的构成微粒及作用2.原子构成微粒间的关系(1)质量关系:质量数(A)=质子数(Z)+中子数(N);(2)电性关系:①原子中:质子数(Z)=核电荷数=核外电子数;②阳离子的核外电子数=质子数-阳离子所带的电荷数;③阴离子的核外电子数=质子数+阴离子所带的电荷数。
(3)微粒符号周围数字的含义3.元素、核素、同位素(1)元素、核素、同位素的概念及相互关系(2)氢元素的三种核素1H:名称为氕,不含中子;12H:用字母D表示,名称为氘或重氢;13H:用字母T表示,名称为氚或超重氢。
1(3)几种重要核素的用途核素235 92U 14 6C 21H 31H 18 8O用途核燃料用于考制氢弹示踪古断代原子4.相对原子质量(1)原子(即核素)的相对原子质量:一个原子(即核素)的质量与一个12C质量的1 12的比值。
一种元素有几种同位素,就有几种不同核素的相对原子质量。
(2)元素的相对原子质量:是按该元素各种天然同位素原子所占的原子百分比算出的平均值。
如:A r(Cl)=A r(35Cl)×a%+A r(37Cl)×b%。
(3)核素的近似相对原子质量=该核素的质量数。
【判一判】判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)任何原子的原子核均有质子和中子,任何离子均有电子()(2)一种元素可以有多种核素,也可能只有一种核素,有多少种核素就有多少种原子()(3)中子数不同而质子数相同的微粒一定互为同位素()(4)3517Cl与3717Cl得电子能力几乎相同()(5)H2、D2、HD均为氢元素的不同单质,三者属于同素异形体()(6)2H+的核外电子数为2()答案(1)×(2)√(3)×(4)√(5)×(6)×二、原子核外电子排布1.核外电子排布规律2.原子结构示意图3.元素的性质与原子的核外电子排布的关系元素结构与性质稀有气体元素金属元素非金属元素最外层电子数8(He为2) 一般小于4 一般大于或等于4 稳定性稳定不稳定不稳定得失电子能力既不易得电子,也不易失电子易失电子易得电子化合价0 只显正价既显正价,又显负价(F、O无正价) 【判一判】判断下列说法是否正确,正确的打“√”,错误的打“×”。

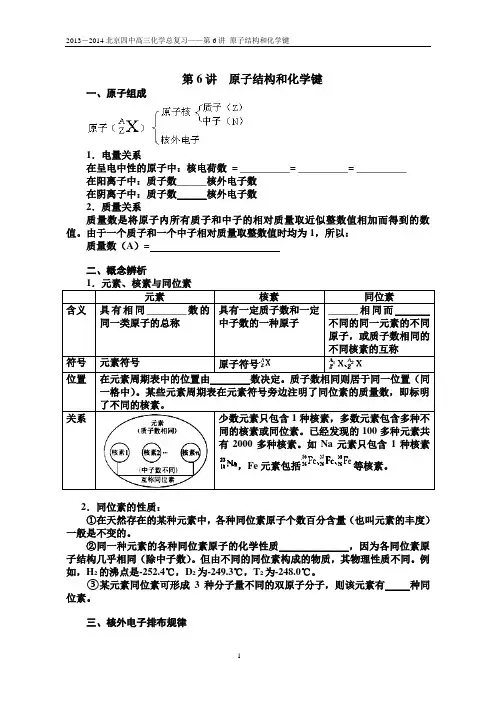
第6讲原子结构和化学键一、原子组成1.电量关系在呈电中性的原子中:核电荷数= __________= __________= __________在阳离子中:质子数______核外电子数在阴离子中:质子数______核外电子数2.质量关系质量数是将原子内所有质子和中子的相对质量取近似整数值相加而得到的数值。
由于一个质子和一个中子相对质量取整数值时均为1,所以:质量数(A)=二、概念辨析元素包括2.同位素的性质:①在天然存在的某种元素中,各种同位素原子个数百分含量(也叫元素的丰度)一般是不变的。
②同一种元素的各种同位素原子的化学性质______________,因为各同位素原子结构几乎相同(除中子数)。
但由不同的同位素构成的物质,其物理性质不同。
例如,H2的沸点是-252.4℃,D2为-249.3℃,T2为-248.0℃。
③某元素同位素可形成3种分子量不同的双原子分子,则该元素有_____种同位素。
三、核外电子排布规律要求掌握前18号元素的原子和简单离子的核外电子排布。
N Si Na+ Al3+四、微粒半径大小的比较1.同周期,从左向右,随核电荷数的递增,原子半径________,到稀有气体原子半径突然增大。
2.同主族,从上向下,随电子层数递增,原子半径、离子半径__________。
3.同种元素的不同微粒,核外电子数越多,半径_______,即:阳离子半径<原子半径、阴离子半径>原子半径。
4.核外电子层结构相同的不同微粒,核电荷数(即质子数)越多,对电子的吸引力越强,微粒半径________。
例1.已知短周期元素的离子a A2+、b B+、c C3-、d D-都具有相同的电子层结构,则下列叙述正确的是A.原子半径A>B>D>C B.原子序数d>c>b>aC.离子半径C>D>B>A D.单质的还原性A>B>D>C五、电子层结构相同的微粒电子层结构相同指_______________________________________________相同。

高三化学专题训练(13)(原子结构与化学键 必修)班别___________ 姓名____________ 座号 ____________ 评分 __________一、选择题(本题包括10小题,每小题3分,共30分,每小题只有1个答案符合题意)1.2002年由德、法、美及波兰等多国科学家组成的科研小组合成了非常罕见的4526Fe 原子,有关4526Fe 的说法正确的是A .它是一种新元素B .4526Fe 与5626Fe 互为同素异形体C .它是一种新原子D .这种铁原子发生衰变放出两个质子后变成4326Fe2.核磁共振(NMR )技术已广泛应用于复杂分子结构的测定和医学论断等高科技领域。
已知只有质子数或中子数为奇数的原子核才有NMR 现象。
试判断下列哪组原子均可产生NMR 现象 A .18O 、31P 、119Sn B .27Al 、19F 、12CC .元素周期表中V A 族所有元素的原子D .元素周期表中第一周期所有元素的原子 3.下列各项中表达正确的是 A .S 2-的结构示意图为: B .CO 2的分子模型示意图: C .Na 2S 的电子式:D .N 2的结构式: :N≡N:4.下列分子中,每个原子最外层均满足8电子稳定结构的是A .NO 2B .SF 6C .BeCl 2D .NCl 3 5.A 、B 、C 三种短周期元素,原子序数按A 、B 、C 依次增大,A 元素原子最外层电子数是次外层电子数的2倍,B 元素原子的次外层电子数是最外电子数的2倍,C 元素原子的最外层电子数是内层电子总数的一半。
则下列说法中正确的是 A .A 元素的气态氢化物都是含极性键的非极性分子 B .由B 元素的单质分子形成的晶体熔沸点较高。
C .C 元素可以组成不同的单质,它们互为同素异形体。
D .A 、B 、C 的氧化物都能溶于水形成酸 6.在水溶液中,,YO 3n-和S 2-发生如下反应:YO 3n – +3S 2– +6H + = Y – +3S ↓+ 3H 2O ,则YO 3n-中Y 元素的化合价和原子最外层电子数分别为 A .+4、6 B .+7、7 C .+5、5 D .+5、7 7.铜有两种天然同位素6329Cu 和6529Cu ,已知铜的近似相对原子质量为63.5,估算6329Cu 的 原子百分含量为: A .20% B .25% C .50% D .75% 8.对于化学键的理解中,正确的是A .化学键是分子(或晶体)内相邻的两个或多个原子(或离子)之间强烈的作用力B .化学键存在于任何分子内C .化学键只存在于离子化合物和共价化合物中D .氢键和范德华力也是一种化学键9.既含有极性键又含有非极性键的非极性分子是 A .H 2O 2 B .Na 2O 2 C .C 2H 2 D .C 2H 5OH10.最近有人用一种称为“超酸”的化合物H(CB 11H 6Cl 6) 和C 60反应,使C 60获得一个质子,得到一种新型离子化合物[HC 60]+[CB 11H 6Cl 6]-。

考点专练14原子结构化学键两年高考真题演练1.(2015·江苏化学,2)下列有关氯元素及其化合物的表示正确的是()A.质子数为17、中子数为20的氯原子:2017ClB.氯离子(Cl-)的结构示意图:C.氯分子的电子式:∶Cl , ∶Cl , ∶D.氯乙烯分子的结构简式:H3C—CH2Cl2.(2015·课标全国Ⅱ,9)原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。
a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。
下列叙述错误的是()A.元素的非金属性次序为c>b>aB. a和其他3种元素均能形成共价化合物C. d和其他3种元素均能形成离子化合物D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、63.(2015·海南化学,10)下列指定微粒的数目相等的是(双选)()A.等物质的量的水与重水含有的中子数B.等质量的乙烯和丙烯中含有的共用电子对数C.同温、同压、同体积的CO和NO含有的质子数D.等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数4.(2015·海南化学,12)a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。
下列叙述错误..的是()A.d元素的非金属性最强B.它们均存在两种或两种以上的氧化物C.只有a与其他元素生成的化合物都是离子化合物D.b、c、d分别与氢形成的化合物中化学键均为极性共价键5.(2014·山东理综,8)根据原子结构及元素周期律的知识,下列推断正确的是() A.同主族元素含氧酸的酸性随核电荷数的增加而减弱B.核外电子排布相同的微粒化学性质也相同C.Cl-、S2-、Ca2+、K+半径逐渐减小D. 3517Cl与3717Cl得电子能力相同6.(2014·江苏化学,2)下列有关化学用语的表示正确的是()A.过氧化钠的电子式:Na∶O , ∶O , ∶NaB.质子数为35、中子数为45的溴原子:8035BrC.硫离子的结构示意图:D.间二甲苯的结构简式:H3CCH37.(2014·上海化学,1)“玉兔”号月球车用23894Pu作为热源材料,下列关于23894Pu的说法正确的是()A.23894Pu与23892U互为同位素B.23894Pu与23994Pu互为同素异形体C.23894Pu与23892U具有完全相同的化学性质D.23894Pu与23994Pu具有相同的最外层电子数8.(2014·上海化学,4)在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是()A.范德华力、范德华力、范德华力B.范德华力、范德华力、共价键C.范德华力、共价键、共价键D.共价键、共价键、共价键9.(2014·上海化学,7)下列各组中两种微粒所含电子数不相等的是()A.H3O+和OH-B.CO和N2C.HNO2和NO-2D.CH+3和NH+410.(2015·重庆理综,8)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。

专题22原子结构与化学键1.【2022年山东卷】138O 、158O 的半衰期很短,自然界中不能稳定存在。
人工合成反应如下:16313a 828b O+He O+X →;16315m 828n O+He O+Y →。
下列说法正确的是A .X 的中子数为2B .X 、Y 互为同位素C .138O 、158O 可用作示踪原子研究化学反应历程D .自然界不存在1382O 、1582O 分子是因其化学键不稳定【答案】B【解析】根据质量守恒可知,X 微粒为62He ,Y 微粒为42He ,据此分析解题。
A .由分析可知,X 微粒为62He ,根据质量数等于质子数加中子数可知,该微粒的中子数为4,A 错误;B .由分析可知,X 微粒为62He ,Y 微粒为42He ,二者具有相同的质子数而不同的中子数的原子,故互为同位素,B 正确;C .由题干信息可知,138O 与158O 的半衰期很短,故不适宜用作示踪原子研究化学反应历程,C 错误;D .自然界中不存在1382O 与1582O 并不是其化学键不稳定,而是由于138O 与158O 的半衰期很短,很容易发生核变化,转化为气体其他原子,O=O 的键能与形成该键的核素无关,D 错误;故答案为:B 。
2.(2021·广东真题)“天问一号”着陆火星,“嫦娥五号”采回月壤。
腾飞中国离不开化学,长征系列运载火箭使用的燃料有液氢和煤油等化学品。
下列有关说法正确的是A .煤油是可再生能源B .2H 燃烧过程中热能转化为化学能C .火星陨石中的20Ne 质量数为20D .月壤中的3He 与地球上的3H 互为同位素【答案】C【解析】A .煤油来源于石油,属于不可再生能源,故A 错误;B .氢气的燃烧过程放出热量,将化学能变为热能,故B 错误;C .元素符号左上角数字为质量数,所以火星陨石中的20Ne质量数为20,故C正确;D.同位素须为同种元素,3He和3H的质子数不同,不可能为同位素关系,故D错误;故选C。

课时24原子结构化学键知识点一原子结构【考必备·清单】1.原子的构成(1)构成原子的微粒及作用(2)微粒符号周围数字的含义[名师点拨]①原子中不一定都含有中子,如11H中没有中子。
②电子排布完全相同的原子不一定是同一种原子,如互为同位素的各原子。
(3)微粒之间的数量关系①原子中:质子数(Z)=核电荷数=核外电子数;②质量数(A)=质子数(Z)+中子数(N);③阳离子的核外电子数=质子数-阳离子所带电荷数;④阴离子的核外电子数=质子数+阴离子所带电荷数。
(4)两种相对原子质量①原子(即核素)的相对原子质量:一个原子(即核素)的质量与12C质量的112的比值。
一种元素有几种同位素,就有几种不同核素的相对原子质量。
②元素的相对原子质量:该元素各种天然同位素原子所占的原子百分比算出的平均值。
如A r(Cl)=A r(35Cl)×a%+A r(37Cl)×b%。
2.元素、核素、同位素(1)元素、核素、同位素的关系(2)同位素的特征①相同存在形态的同位素,化学性质几乎完全相同,物理性质不同。
②天然存在的同一元素的各核素所占的原子百分数一般不变。
[名师点拨]①由于同位素的存在,核素的种数远大于元素的种类。
②不同核素可能具有相同的质子数,如21H和31H;也可能具有相同的中子数,如146C和168O;也可能具有相同的质量数,如146C和147N。
(3)常见的重要核素及其应用核素235 92U14 6C21H(D)31H(T)18 8O用途核燃料用于考古断代制氢弹示踪原子【夯基础·小题】1.在当前空气污染日益严重,人们的健康受到来自空气威胁的情况下,“空气罐头”应运而生。
16O和18O是氧元素的两种核素,下列说法正确的是()A.16O2与18O2互为同素异形体B.16O与18O核外电子排布方式不同C.通过化学变化可以实现16O与18O间的相互转化D.16O与18O互为同位素解析:选D同素异形体是指同一元素形成的结构不同的单质,A错误;16O和18O质子数相同,核外电子数相同,所以两者的核外电子排布方式相同,但两种核素的中子数不同,则16O和18O互为同位素,B错误;D正确;16O 和18O都是氧原子,而化学变化中的最小微粒是原子,所以化学变化不能实现16O与18O间的转化,C错误。

课时作业1.金属钛对人体体液无毒且能与肌肉和骨骼生长在一起,有“生物金属”之称。
下列有关48Ti和50Ti的说法正确的是()A.48Ti和50Ti的质子数相同,互称同位素B.48Ti和50Ti的质量数不同,属于两种元素C.48Ti和50Ti的质子数相同,是同一种核素D.48Ti和50Ti的质子数相同,中子数不同,互称同素异形体解析:48Ti和50Ti的质子数相同,中子数不同,是Ti元素的不同核素,互称同位素,故A 正确。
答案:A2.11H、21H、31H、H+、H2是()A.氢的五种同位素B.五种氢元素C.氢的五种核素D.氢元素的五种不同微粒解析:11H、21H、31H三种粒子质子数相同,都为1;但中子数分别为0、1、2,它们是同一种元素的三种不同核素,互为同位素。
H+是质子数为1,电子数为0,带一个单位正电荷的粒子。
H2是由两个H原子构成的分子。
总之,它们属于氢元素的五种不同微粒。
答案:D3.化学中有“四同”,根据“四同”的概念,下列物质间关系正确的是()A.1H2、2H2——同位素B.HCOOCH3、CH3OCHO——同分异构体C.S2-、S2-2——同素异形体D.甲醇、乙醇——同系物答案:D4.已知氢元素有1H、2H、3H三种同位素,氯元素有35Cl、37Cl两种同位素。
由这五种微粒构成的HCl分子中,其相对分子质量数值可能有()A.1种B.5种C.6种D.7种解析:H的核素有3种,Cl的核素有2种,所以HCl的种类=3×2=6种,但1H37Cl和3H35Cl的相对分子质量相同,所以HCl分子的相对分子质量数值有5种,答案选B。
答案:B5.化学科学需要借助化学专用语言来描述,下列化学用语正确的是()A.溴化铵的电子式:B.羟基的电子式:C.HClO的结构式:H—Cl—OD.氮分子的结构式:解析:A项应为C项应为H—O—Cl;D项应为N≡N。
答案:B6.下列各分子的所有原子都满足最外层8电子稳定结构的是()A.PCl5B.NH3C.CH4D.NCl3解析:A选项中的P原子,最外层有10个电子,B、C选项中的H原子都不满足最外层8电子结构。

