第3章 电极反应动力学基础
- 格式:ppt
- 大小:1.11 MB
- 文档页数:63

电化学第3章电化学极化讲解第3章电化学极化(电荷转移步骤动⼒学)绪论中曾提到:⼀个电极反应是由若⼲个基本步骤形成的,⼀个反应⾄少有三个基本步骤:00R R ze O O s s →→+→-1) 反应粒⼦⾃溶液深处向电极表⾯的扩散——液相传质步骤。
2) 反应粒⼦在界⾯得失电⼦的过程——电化学步骤。
3) 产物⽣成新相,或向溶液深处扩散。
当有外电流通过电极时,?将偏离平衡值,我们就说此时发⽣了极化。
如果传质过程是最慢步骤,则?的偏离是由浓度极化引起的(此时0i s i C C ≠,e ?的计算严格说是⽤s i C 。
⽆浓度极化时0i s i C C =,?的改变是由s i C 的变化引起)。
这时电化学步骤是快步骤,平衡状态基本没有破坏。
因此反映这⼀步骤平衡特征的Nernst ⽅程仍能使⽤,但须⽤?代e ?,s i C 代0i C ,这属于下⼀章的研究内容。
如果传质等步骤是快步骤,⽽电化学步骤成为控制步骤,则这时?偏离e ?是由电化学极化引起的,也就是本章研究的内容。
实际上该过程常常是⽐较慢的,反应中电荷在界⾯有积累(数量渐增),?随之变化。
由此引起的?偏离就是电化学极化,这时Nernst ⽅程显然不适⽤了,这时?的改变将直接以所谓“动⼒学⽅式”来影响反应速度。
3.1 电极电位与电化学反应速度的关系电化学反应是⼀种特殊的氧化—还原反应(⼀个电极上既有氧化过程,⼜有还原过程)。
若⼀个电极上有净的氧化反应发⽣,⽽另⼀个电极上有净的还原反应发⽣,则在这两个电极所构成的电化学装置中将有电流通过,⽽这个电流刚好表征了反应速度的⼤⼩,)(nFv i v i =∝[故电化学中总是⽤i 表⽰v ,⼜i 为电信号,易测量,稳态下串联各步速度同,故浓差控制也⽤i 表⽰v 。
i 的单位为A/cm 2,zF 的单位为C/mol ,V 的单位为mol/(cm 2.s )]。
既然电极上有净的反应发⽣(反应不可逆了),说明电极发⽣了极化,?偏离了平衡值,偏离的程度⽤η表⽰,极化的⼤⼩与反应速度的⼤⼩有关,这⾥就来研究i ~?⼆者间的关系。






电极过程动力学电极过程动力学是电化学中的一个重要分支,它着重研究电极电荷转移过程和相关的动力学机制。
电极过程动力学的研究对象包括电化学反应速率、电极化学反应的机理以及电化学反应的动态过程等。
本文将从电极反应速率、电位调控机理以及实际应用方面对电极过程动力学进行详细的介绍和分析。
一、电极反应速率1. 项里反应速率常数项里反应速率常数是衡量电极反应速率的重要参数。
它表示单位时间内反应物和产物之间的数量变化率。
在计算过程中,可以根据电荷转移过程中的动力学机制来确定项里反应速率常数。
通常情况下,项里反应速率常数与反应物和产物之间的活化能和电荷转移系数有关。
一般来说,项里反应速率常数越大,反应速率越快。
2. 泊松分布模型泊松分布模型是一种根据电子传输动力学研究电极反应速率的经典方法。
泊松分布模型假设电子从电极表面进入液相中的分布满足泊松分布。
据此,可以利用该模型计算出电极反应速率以及与之相关的电极化学反应机理。
然而,实际情况中,由于电极表面可能存在着非均匀性和多孔性等特征,泊松分布模型过于理想化,难以准确预测电极反应速率。
3. 热力学因素对电极反应速率的影响热力学因素对电极反应速率有着重要的影响。
根据热力学定律,电位差和电极之间的电势差会影响电子传输和离子转移速率。
当电极电位愈高,电位差就愈大,因此,电子和离子的传输速率就变得更快。
此外,反应物和产物之间的物理和化学吸附现象也会影响电极反应速率。
这些因素的影响程度需要结合具体的条件和反应机理来进行考虑。
二、电位调控机理1. 电位和电场电位是电子在电场作用下所具有的势能差。
由于电场力是由电荷带来的,因此,电位和电场强度是密切相关的。
在电极过程动力学中,电位的变化会影响电子传输过程,进而影响电极化学反应的速率和机理。
2. 离子选择电位离子选择电位可以影响电极的电化学反应机理和速率。
当电极表面存在多种离子时,离子选择电位会决定电极表面上离子种类的比例。
因此,在研究电极过程动力学时,需要对离子选择电位进行分析和控制。


化学反应动力学的基础化学反应动力学是一门研究化学反应速率及其机制的科学,它不仅为我们理解反应过程提供了理论基础,同时在工业、环境科学及生物医学等多个领域都具有广泛的应用。
这篇文章将介绍化学反应动力学的基础概念、基本定律、影响因素、反应机理以及相关的实验方法,以帮助读者深入了解这一重要的科学领域。
一、化学反应速率化学反应速率是指单位时间内反应物转化为产物的量,通常用摩尔数/升/秒(mol/L·s)来表示。
为了量化化学反应速率,科学家们引入了以下几个重要概念:平均反应速率:在一个特定时间段内,反应物浓度减少或产物浓度增加的变化率。
例如,对于反应A→B,平均反应速率可以表达为:[ = - = ]瞬时反应速率:在某一时刻,反应物浓度或产物浓度变化的速率。
在数学上,它是反应速率的导数,可以用以下形式表示:[ = - = ]反应级数:反应级数是描述反应速率与各个反应物浓度之间关系的整数,比如对于双分子反应 ( A + B C ),其速率方程通常表示为:[ v = k[A]m[B]n ]其中,(k) 是速率常数,(m) 和 (n) 是分别对应于A和B的反应级数。
二、影响因素多种因素可以影响化学反应的速率,包括温度、压力、催化剂以及反应物浓度等:温度温度对化学反应速率有着显著的影响。
根据阿伦尼乌斯方程,随着温度的升高,分子运动加剧,使得反击能量提升,从而加快了反应速率。
阿伦尼乌斯方程如下所示:[ k = Ae^{-} ]其中,A 为频率因子,(E_a) 是活化能,(R) 是气体常数,(T) 是绝对温度。
反应物浓度增加反应物浓度通常会使得分子碰撞频率增加,从而提高了化学反应速率。
在许多简单的单分子和双分子反应中,这一点尤其明显。
催化剂催化剂是加快化学反应而且自身不被消费的物质。
催化剂通过降低活化能来加快反应速率。
例如,在酶促反应中,酶作为催化剂能够选择性地加快某些生物分子的转变。
压力对于气体相互作用的反应而言,增加压力会导致气体分子之间更频繁地碰撞,从而提升反应速率。

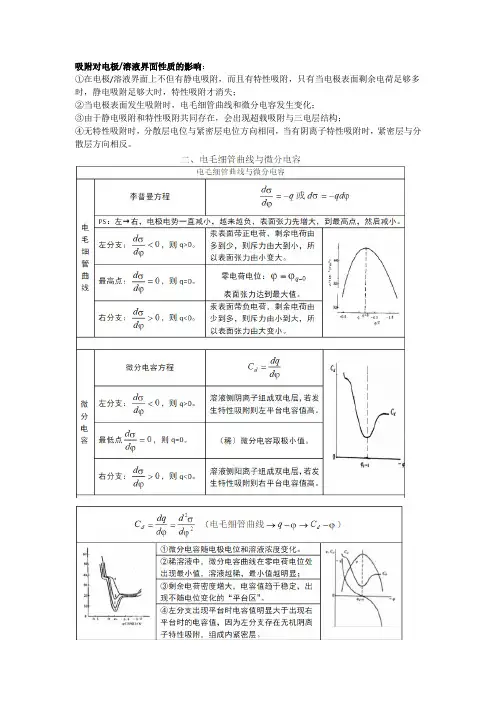
吸附对电极/溶液界面性质的影响:①在电极/溶液界面上不但有静电吸附,而且有特性吸附,只有当电极表面剩余电荷足够多时,静电吸附足够大时,特性吸附才消失;②当电极表面发生吸附时,电毛细管曲线和微分电容发生变化;③由于静电吸附和特性吸附共同存在,会出现超载吸附与三电层结构;④无特性吸附时,分散层电位与紧密层电位方向相同,当有阴离子特性吸附时,紧密层与分散层方向相反。
电极过程——电极表面附近薄液层中进行的过程与电极表面上发生的过程的总称。
电极过程单元步骤:①液相传质——反应粒子向电极表面传递;②表面转化(前置)——反应粒子在电极表面或附近液层发生某些转化;③电化学——反应粒子在电极/溶液界面得到电子或失去电子;④表面转化(后置)——反应产物在电极表面或附近液层发生某些转化;⑤a、新相生成——反应产物不溶时,反应产物生成新相;b、液相传质——反应产物可溶时,产物粒子从电极表面向溶液中或溶液电极内部迁移。
电极极化——电流通过电极时,电极电势偏离平衡电极电势的现象。
过电势——表示某一电流密度下极化电势与平衡电势之差。
①阳极过电势:②阴极过电势:控制步骤——电极过程中最慢的单元步骤。
极化曲线——电极上电势随电流密度变化的关系曲线。
传质过程(溶液):①对流——物质粒子随液体流动而移动。
A、自然对流——液体各部分之间由于存在浓度差或温度差产生的密度差或密度梯度而产生的对流;B、强制对流——通过搅拌而引起的对流。
②扩散——溶液中某一组分由于存在浓度梯度(或化学势梯度)而发生该组分向减少这种梯度的方向转移的过程。
③电迁移——带电粒子在电场梯度或电势梯度的作用下而引起的迁移过程。
扩散层——通过电流时,由于物质迁移缓慢而引起浓度发生扩散的液层。
稳态扩散——溶液中任意一点的浓度不再随时间变化的扩散过程。
(扩散速度与时间无关,反应粒子浓度分布只与空间有关,扩散层厚度一定)非稳态扩散——溶液中任意一点的浓度随时间变化的扩散过程。
第三章电极/溶液界面附近液相中的传质过程电极反应的分部步骤:界面附近传质过程,化学转化过程,界面上转化过程,电子转移过程.对于发生在电极/溶液异相界面的电极过程,除了电子转移过程之外,还涉及传质过程及各种表面效应,后者甚至可以成为速控步骤。
一般认为总的电极反应由一系列分步骤所组成。
电极反应的速率由这一系列分步骤的一个控制或若干个混合控制。
这些步骤包括以下几种。
物质传递:反应物从溶液本体相传递到电极表面和产物从电极表面相传递到分布到本体溶液.。
电荷转移:电极/溶液界面的电子传递耦联化学反应:电子传递反应前置或后续的化学转化,这些过程可能是均相也可能是异相过程。
表面转化反应:反应物或产物的吸脱附过程及新相生成(表面沉积、沉淀形成、气体放出)等其他的表面反应。
一般电极反应的基本步骤电极反应的速率大小取决于上述系列反应中受阻最大而进行最慢的步骤,最慢的步骤称速度控制步骤,其动力学特征就反应了整个电极过程的动力学特征。
基础电化学研究的核心内容之一就是识别电极过程包括的各分步骤,确定速度控制步骤,阐明反应机理和速率方程,从而掌握该电极过程的反应规律。
§3.1 研究液相中传质动力学的意义和方法(1)液相传质步骤是整个电极过程中的一个重要环节整个电极反应的基本历程(2)液相传质步骤可能成为许多电极过程的控制步骤,由它来决定整个电极过程的动力学特征。
a 电子传递过程(法拉第过程,电化学过程)进行的很快。
(热力学上)b可以增加过电位使反应的活化能降低,从而使电子传递过程大大加快,导致液相传质过程成为决速步骤。
(动力学)(3) 了解液相中的传质动力学规律有助于寻求提高这一步骤进行速度的方法,并消除由于这一步骤进行缓慢而带来的各种限制作用。
a由于液相中传质速度的限制,致使我们无法观测一些快速分布步骤(特例是电子传递过程)的动力学特征和参数。
b电极反应处于混合区时,可以利用这些规律来校正液相传质步骤的影响。
如何研究液相传质动力学?电极过程各个分部步骤是串联进行的,要想单独研究某一分部步骤,必须首先假定其它步骤进行的速度非常快,处于准平衡态,这样才能使问题得以简化。
熔融金属氧化物甲烷燃料电池电极反应【1. 引言】熔融金属氧化物甲烷燃料电池(melted metal oxide methane fuel cell,MOMFC)是一种新型的高效清洁能源电池,近年来备受关注。
它利用熔融的金属氧化物作为固体电解质,以甲烷为燃料,在高温下进行电化学反应,产生电能的同时还能够直接转化为化学燃料。
电池的关键部分是电极,它直接影响着电池的性能和能量转化效率。
对熔融金属氧化物甲烷燃料电池电极反应进行深度和广度兼具的研究与探讨,对于提高电池的稳定性、催化活性和能效具有重要意义。
【2. 电极反应的基本原理】熔融金属氧化物甲烷燃料电池的电极反应包括氧还原反应(ORR)和甲烷氧化反应(MOR)。
在氧化电极上,ORR将氧气还原为氧化物,是电池正极的反应;在还原电极上,MOR将甲烷氧化为二氧化碳和水,是电池负极的反应。
这两个电极反应的催化活性和转化效率直接决定了整个电池的性能。
提高氧还原反应和甲烷氧化反应的活性成为了目前研究的热点和难点。
【3. 电极材料的选择】在研究熔融金属氧化物甲烷燃料电池电极反应时,选择合适的电极材料至关重要。
金属氧化物、贵金属和含铁氧化物等材料被广泛应用于氧化电极和还原电极。
这些材料具有优异的导电性和催化性能,能够有效地降低电极反应的活化能和提高反应速率。
还有一些新型纳米材料,如碳纳米管、氧化石墨烯等,被引入到电极材料中,以增强其导电性和表面活性。
【4. 电极反应的动力学研究】电极反应的动力学研究是理解和优化电极反应活性的重要手段。
它可以通过实验和理论模拟的方法,揭示电极反应在不同温度、压力和流速下的动态变化规律。
动力学研究不仅可以定量评价电极材料的催化性能,还可以为优化电极结构和改进电池工艺提供科学依据。
【5. 电极反应的机理探讨】对电极反应的机理进行深入探讨,有助于揭示催化作用的本质和反应过程的细节。
通过表面分析、原位光谱和计算模型等手段,可以研究电极表面的活性位点分布、吸附解吸动力学和反应中间体生成机制。