无菌原料药GMP设计及要求-李忠德..
- 格式:ppt
- 大小:1.25 MB
- 文档页数:41

附录1 :无菌药品第一章范围第一条无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,包括无菌制剂和无菌原料药。
第二条本附录适用于无菌制剂生产全过程以及无菌原料药的灭菌和无菌生产过程。
第二章原则第三条无菌药品的生产须满足其质量和预定用途的要求,应当最大限度降低微生物、各种微粒和热原的污染。
生产人员的技能、所接受的培训及其工作态度是达到上述目标的关键因素,无菌药品的生产必须严格按照精心设计并经验证的方法及规程进行,产品的无菌或其它质量特性绝不能只依赖于任何形式的最终处理或成品检验(包括无菌检查)。
第四条无菌药品按生产工艺可分为两类:采用最终灭菌工艺的为最终灭菌产品;部分或全部工序采用无菌生产工艺的为非最终灭菌产品。
第五条无菌药品生产的人员、设备和物料应通过气锁间进入洁净区,采用机械连续传输物料的,应当用正压气流保护并监测压差。
第六条物料准备、产品配制和灌装或分装等操作必须在洁净区内分区域(室)进行。
第七条应当根据产品特性、工艺和设备等因素,确定无菌药品生产用洁净区的级别。
每一步生产操作的环境都应当达到适当的动态洁净度标准,尽可能降低产品或所处理的物料被微粒或微生物污染的风险。
第三章洁净度级别及监测第八条洁净区的设计必须符合相应的洁净度要求,包括达到“静态”和“动态”的标准。
第九条无菌药品生产所需的洁净区可分为以下4个级别:A级:高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域,应当用单向流操作台(罩)维持该区的环境状态。
单向流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s (指导值)。
应当有数据证明单向流的状态并经过验证。
在密闭的隔离操作器或手套箱内,可使用较低的风速。
B级:指无菌配制和灌装等高风险操作A级洁净区所处的背景区域。
C级和D级:指无菌药品生产过程中重要程度较低操作步骤的洁净区。
以上各级别空气悬浮粒子的标准规定如下表:注:(1)为确认A级洁净区的级别,每个采样点的采样量不得少于1立方米。

2010版GMP附录—无菌药品附录1:无菌药品第一章范围第一条无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药~包括无菌制剂和无菌原料药。
第二条本附录适用于无菌制剂生产全过程以及无菌原料药的灭菌和无菌生产过程。
第二章原则第三条无菌药品的生产须满足其质量和预定用途的要求~应当最大限度降低微生物、各种微粒和热原的污染。
生产人员的技能、所接受的培训及其工作态度是达到上述目标的关键因素~无菌药品的生产必须严格按照精心设计并经验证的方法及规程进行~产品的无菌或其它质量特性绝不能只依赖于任何形式的最终处理或成品检验,包括无菌检查,。
第四条无菌药品按生产工艺可分为两类:采用最终灭菌工艺的为最终灭菌产品,部分或全部工序采用无菌生产工艺的为非最终灭菌产品。
第五条无菌药品生产的人员、设备和物料应通过气锁间进入洁净区~采用机械连续传输物料的~应当用正压气流保护并监测压差。
第六条物料准备、产品配制和灌装或分装等操作必须在洁净区内分区域,室,进行。
第七条应当根据产品特性、工艺和设备等因素~确定无菌药品生产用洁净区的级别。
每一步生产操作的环境都应当达到适当的动态洁净度标准~尽可能降低产品或所处理的物料被微粒或微生物污染的风险。
1第三章洁净度级别及监测第八条洁净区的设计必须符合相应的洁净度要求~包括达到“静态”和“动态”的标准。
第九条无菌药品生产所需的洁净区可分为以下4个级别:A级:高风险操作区~如灌装区、放臵胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域~应当用单向流操作台,罩,维持该区的环境状态。
单向流系统在其工作区域必须均匀送风~风速为0.36-0.54m/s,指导值,。
应当有数据证明单向流的状态并经过验证。
在密闭的隔离操作器或手套箱内~可使用较低的风速。
B级:指无菌配制和灌装等高风险操作A级洁净区所处的背景区域。
C级和D级:指无菌药品生产过程中重要程度较低操作步骤的洁净区。
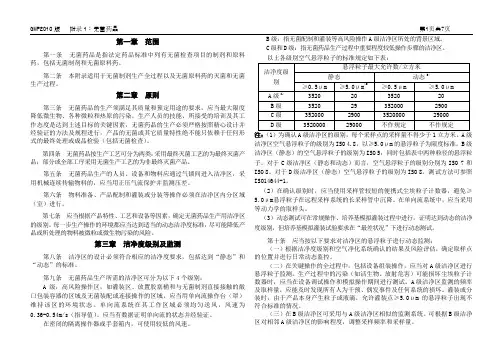
以上各级别空气悬浮粒子的标准规定如下表:悬浮粒子最大允许数/立方米(3)洁净度级别静态动态(2)?0.5μm ?5.0μm ?0.5μm ?5.0μm(1) A级 3520 20 3520 20B级 3520 29 352000 2900C级 352000 2900 3520000 29000D级 3520000 29000 不作规定不作规定注:,1,为确认A级洁净区的级别~每个采样点的采样量不得少于1立方米。




第一章范围第一条无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,包括无菌制剂和无菌原料药。
第二条本附录适用于无菌制剂生产全过程以及无菌原料药的灭菌和无菌生产过程。
第二章原则第三条无菌药品的生产须满足其质量和预定用途的要求,应当最大限度降低微生物、各种微粒和热原的污染。
生产人员的技能、所接受的培训及其工作态度是达到上述目标的关键因素,无菌药品的生产必须严格按照精心设计并经验证的方法及规程进行,产品的无菌或其它质量特性绝不能只依赖于任何形式的最终处理或成品检验(包括无菌检查)。
第四条无菌药品按生产工艺可分为两类:采用最终灭菌工艺的为最终灭菌产品;部分或全部工序采用无菌生产工艺的为非最终灭菌产品。
第五条无菌药品生产的人员、设备和物料应通过气锁间进入洁净区,采用机械连续传输物料的,应当用正压气流保护并监测压差。
第六条物料准备、产品配制和灌装或分装等操作必须在洁净区内分区域(室)进行。
第七条应当根据产品特性、工艺和设备等因素,确定无菌药品生产用洁净区的级别。
每一步生产操作的环境都应当达到适当的动态洁净度标准,尽可能降低产品或所处理的物料被微粒或微生物污染的风险。
第三章洁净度级别及监测第八条洁净区的设计必须符合相应的洁净度要求,包括达到“静态”和“动态”的标准。
第九条无菌药品生产所需的洁净区可分为以下4个级别:A级:高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域,应当用单向流操作台(罩)维持该区的环境状态。
单向流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s(指导值)。
应当有数据证明单向流的状态并经验证。
在密闭的隔离操作器或手套箱内,可使用较低的风速。
B级:指无菌配制和灌装等高风险操作A级洁净区所处的背景区域。
C级和D级:指无菌药品生产过程中重要程度较低操作步骤的洁净区。
以上各级别空气悬浮粒子的标准规定如下表:注:(1)为确认A级洁净区的级别,每个采样点的采样量不得少于1立方米。

附录1:无菌药品第一章范围第一条无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,包括无菌制剂和无菌原料药。
第二条本附录适用于无菌制剂生产全过程以及无菌原料药的灭菌和无菌生产过程。
第二章原则第三条无菌药品的生产须满足其质量和预定用途的要求,应当最大限度降低微生物、各种微粒和热原的污染。
生产人员的技能、所接受的培训及其工作态度是达到上述目标的关键因素,无菌药品的生产必须严格按照精心设计并经验证的方法及规程进行,产品的无菌或其它质量特性绝不能只依赖于任何形式的最终处理或成品检验(包括无菌检查)。
第四条无菌药品按生产工艺可分为两类:采用最终灭菌工艺的为最终灭菌产品;部分或全部工序采用无菌生产工艺的为非最终灭菌产品。
第五条无菌药品生产的人员、设备和物料应通过气锁间进入洁净区,采用机械连续传输物料的,应当用正压气流保护并监测压差。
第六条物料准备、产品配制和灌装或分装等操作必须在洁净区内分区域(室)进行。
第七条应当根据产品特性、工艺和设备等因素,确定无菌药品生产用洁净区的级别。
每一步生产操作的环境都应当达到适当的动态洁净度标准,尽可能降低产品或所处理的物料被微粒或微生物污染的风险。
第三章洁净度级别及监测第八条洁净区的设计必须符合相应的洁净度要求,包括达到“静态”和“动态”的标准。
第九条无菌药品生产所需的洁净区可分为以下4个级别:A级:高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域,应当用单向流操作台(罩)维持该区的环境状态。
单向流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s(指导值》应当有数据证明单向流的状态并经过验证。
在密闭的隔离操作器或手套箱内,可使用较低的风速。
B级:指无菌配制和灌装等高风险操作A级洁净区所处的背景区域。
C级和D级:指无菌药品生产过程中重要程度较低操作步骤的洁净区。
以上各级别空气悬浮粒子的标准规定如下表:(1)为确认A级洁净区的级别,每个采样点的采样量不得少于1立方米。

工业技术118 2015年27期浅析原料药车间设计的几个问题孙玉龙新发药业有限公司,山东东营 257500摘要:介绍了原料药车间设计中生产特点及设计要求,并简单介绍了原料药车间布局原则、环境保护、劳动安全。
《药品生产质量管理规范》(2010修订版)对原料药精干包工序做了细致要求,对原料药合成、物料分离相关工艺步骤没有具体要求,这是原料药车间设计时不应该忽视的问题。
关键词:原料药车间;设计中图分类号:TQ460 文献标识码:A 文章编号:1671-5810(2015)27-0118-011 原料药车间的生产特征原料药车间存在危险系数高、污染问题严重、毒害作用显著等问题,对原料药生产环境还有洁净性要求。
1.1 高危险性原料药生产中经常使用有机溶剂作为反应物或反应介质,在物料相互反应过程中,伴随着高温和高压。
有机溶剂具有燃点低、爆炸极限宽的特性,通过放空或容器口扩散到车间生产环境中,操作稍有不当,可能会有产生爆炸或引发车间火灾的高危险性。
生成过程工艺流程比较长,反应控制条件较复杂,不易实现完全自动化操作,增加人员误操作的风险。
1.2 高污染性、高毒害性化工原料(如强酸、强碱等)在原料药的生产过程中,不仅对设备、设施有很强的腐蚀性,对人体也有极大的危害;合成反应中产生的废水随意排放时,可能对土壤、水体产生严重污染。
有机溶媒具有挥发性、燃点低、毒害性的特点,挥发会污染空气环境,并对无关人员造成伤害;有机溶液随意排放会污染水体和土壤,给社会造成危害。
1.3 洁净的生产环境原料药生产不同于其它化工产品生产的重要一点就是,其精精干包工序要求具有洁净的生产环境,根据产品标准的不同要求,按照国家规定原料药车间分为D级、C级、B级、A级等不同的洁净等级,根据不同洁净等级要求再进行相关方案的设计。
2 原料药车间的设计要求针对原料药车间生产的主要特征,设计时主要从以下几个方面考虑:2.1 平面布局原料药车间的平面布局应结合当地的气候、地形、植被和厂房外设施及交通等具体条件,按照原材料、辅助材料进厂、成品出厂到生产的全过程,实现对厂区内的建筑物、构筑物的合理安排。


无菌药品第一章范围第一条无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,包括无菌制剂和无菌原料药。
第二条本附录适用于无菌制剂生产全过程以及无菌原料药的灭菌和无菌生产过程。
第二章原则第三条无菌药品的生产须满足其质量和预定用途的要求,应当最大限度降低微生物、各种微粒无菌第四条第五条第七条A级作区域必须均匀送风,风速为0.36-0.54m/s(指导值)。
应当有数据证明单向流的状态并经过验证。
在密闭的隔离操作器或手套箱内,可使用较低的风速。
B级:指无菌配制和灌装等高风险操作A级洁净区所处的背景区域。
C级和D级:指无菌药品生产过程中重要程度较低操作步骤的洁净区。
以上各级别空气悬浮粒子的标准规定如下表:注:(1别为(2(3)(一)生产(三)在B级洁净区可采用与A级洁净区相似的监测系统。
可根据B级洁净区对相邻A级洁净区的影响程度,调整采样频率和采样量。
(四)悬浮粒子的监测系统应当考虑采样管的长度和弯管的半径对测试结果的影响。
(五)日常监测的采样量可与洁净度级别和空气净化系统确认时的空气采样量不同。
(六)在A级洁净区和B级洁净区,连续或有规律地出现少量≥5.0 μm的悬浮粒子时,应当进行调查。
(七)生产操作全部结束、操作人员撤出生产现场并经15~20分钟(指导值)自净后,洁净区的悬浮粒子应当达到表中的“静态”标准。
(八)应当按照质量风险管理的原则对C 级洁净区和D 级洁净区(必要时)进行动态监测。
监控要求以及警戒限度和纠偏限度可根据操作的性质确定,但自净时间应当达到规定要求。
(九)应当根据产品及操作的性质制定温度、相对湿度等参数,这些参数不应对规定的洁净度造成不良影响。
第十一条 应当对微生物进行动态监测,评估无菌生产的微生物状况。
监测方法有沉降菌法、定(2明结果超标时需采取的纠偏措施。
第十三条 无菌药品的生产操作环境可参照表格中的示例进行选择。
(1)轧盖前产品视为处于未完全密封状态。
(2)根据已压塞产品的密封性、轧盖设备的设计、铝盖的特性等因素,轧盖操作可选择在C级或D级背景下的A级送风环境中进行。
GMP附录2无菌原料药附录2:原料药第一章范围第一条本附录适用于非无菌原料药生产及无菌原料药生产中非无菌生产工序的操作。
第二条原料药生产的起点及工序应当与注册批准的要求一致。
第二章厂房与设施第三条非无菌原料药精制、干燥、粉碎、包装等生产操作的暴露环境应当按照D级洁净区的要求设臵。
第四条质量标准中有热原或细菌内毒素等检验项目的~厂房的设计应当特别注意防止微生物污染~根据产品的预定用途、工艺要求采取相应的控制措施。
第五条质量控制实验室通常应当与生产区分开。
当生产操作不影响检验结果的准确性~且检验操作对生产也无不利影响时~中间控制实验室可设在生产区内。
第三章设备第六条设备所需的润滑剂、加热或冷却介质等~应当避免与中间产品或原料药直接接触~以免影响中间产品或原料药的质量。
当任何偏离上述要求的情况发生时~应当进行评估和恰当处理~保证对产品的质量和用途无不良影响。
1第七条生产宜使用密闭设备,密闭设备、管道可以安臵于室外。
使用敞口设备或打开设备操作时~应当有避免污染的措施。
第八条使用同一设备生产多种中间体或原料药品种的~应当说明设备可以共用的合理性~并有防止交叉污染的措施。
第九条难以清洁的设备或部件应当专用。
第十条设备的清洁应当符合以下要求:,一,同一设备连续生产同一原料药或阶段性生产连续数个批次时~宜间隔适当的时间对设备进行清洁~防止污染物,如降解产物、微生物,的累积。
如有影响原料药质量的残留物~更换批次时~必须对设备进行彻底的清洁。
,二,非专用设备更换品种生产前~必须对设备,特别是从粗品精制开始的非专用设备,进行彻底的清洁~防止交叉污染。
,三,对残留物的可接受标准、清洁操作规程和清洁剂的选择~应当有明确规定并说明理由。
第十一条非无菌原料药精制工艺用水至少应当符合纯化水的质量标准。
第四章物料第十二条进厂物料应当有正确标识~经取样,或检验合格,后~可与现有的库存,如储槽中的溶剂或物料,混合~经放行后混合物料方可使用。
无菌药品第一章范围第一条无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,包括无菌制剂和无菌原料药。
第二条本附录适用于无菌制剂生产全过程以及无菌原料药的灭菌和无菌生产过程。
第二章原则第三条无菌药品的生产须满足其质量和预定用途的要求,应当最大限度降低微生物、各种微粒和热原的污染。
生产人员的技能、所接受的培训及其工作态度是达到上述目标的关键因素,无菌药品的生产必须严格按照精心设计并经验证的方法及规程进行,产品的无菌或其它质量特性绝不能只依赖于任何形式的最终处理或成品检验(包括无菌检查)。
第四条无菌药品按生产工艺可分为两类:采用最终灭菌工艺的为最终灭菌产品;部分或全部工序采用无菌生产工艺的为非最终灭菌产品。
第五条无菌药品生产的人员、设备和物料应通过气锁间进入洁净区,采用机械连续传输物料的,应当用正压气流保护并监测压差。
第六条物料准备、产品配制和灌装或分装等操作必须在洁净区内分区域(室)进行。
第七条应当根据产品特性、工艺和设备等因素,确定无菌药品生产用洁净区的级别。
每一步生产操作的环境都应当达到适当的动态洁净度标准,尽可能降低产品或所处理的物料被微粒或微生物污染的风险。
第三章洁净度级别及监测第八条洁净区的设计必须符合相应的洁净度要求,包括达到“静态”和“动态”的标准。
第九条无菌药品生产所需的洁净区可分为以下4个级别:A级:高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域,应当用单向流操作台(罩)维持该区的环境状态。
单向流系统在其工作区域必须均匀送风,风速为0.36-0.54m/s(指导值)。
应当有数据证明单向流的状态并经过验证。
在密闭的隔离操作器或手套箱内,可使用较低的风速。
B级:指无菌配制和灌装等高风险操作A级洁净区所处的背景区域。
C级和D级:指无菌药品生产过程中重要程度较低操作步骤的洁净区。
以上各级别空气悬浮粒子的标准规定如下表:注:(1)为确认A级洁净区的级别,每个采样点的采样量不得少于1立方米。
目录附件 1 (1)无菌兽药生产质量管理的特殊要求 (1)第一章范围 (1)第二章原则 (1)第三章洁净度级别与监测 (2)第四章隔离操作技术 (6)第五章吹灌封技术 (7)第六章人员 (7)第七章厂房 (9)第八章设备 (11)第九章消毒 (12)第十章生产管理 (12)第十一章灭菌工艺 (16)第十二章灭菌方法 (17)第十三章无菌兽药的最终处理 (21)第十四章质量控制 (22)第十五章术语 (22)附件 1无菌兽药生产质量管理的特殊要求第一章范围第一条无菌兽药是指法定兽药标准中列有无菌检查项目的制剂和原料药,包括无菌制剂和无菌原料药。
第二条本要求适用于无菌制剂生产全过程以及无菌原料药的灭菌和无菌生产过程。
第二章原则第三条无菌兽药的生产须满足其质量要求,应当最大限度降低微生物、各种微粒和热原的污染。
生产人员的技能、所接受的培训及其工作态度是达到上述目标的关键因素,无菌兽药的生产应当严格按照设计并经验证的方法及规程进行,产品的无菌或其他质量特性绝不能只依赖于任何形式的最终处理或成品检验(包括无菌检查) 。
第四条无菌兽药按生产工艺可分为两类:采用最终灭菌工艺的为最终灭菌产品;部分或全部工序采用无菌生产工艺的为非最终灭菌产。
第五条无菌兽药生产的人员、设备和物料应通过气锁间进入洁净区,采用机械连续传输物料的,应当用正压气流保护并监测压差。
第六条物料准备、产品配制和灌装(灌封) 或分装等操作应当在洁净区内分区域(室)进行。
第七条应当根据产品特性、工艺和设备等因素,确定无菌兽药生产用洁净区的级别。
每一步生产操作的环境都应当达到适当的动态洁净度标准,尽可能降低产品或所处理的物料被微粒或微生物污染的风险。
第三章洁净度级别与监测第八条洁净区的设计应当符合相应的洁净度要求,包括达到“静态”和“动态”的标准。
第九条无菌兽药生产所需的洁净区可分为以下 4 个级别:A 级:高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域,应当用单向流操作台( 罩) 维持该区的环境状态。
目录附件 1 (1)无菌兽药生产质量管理的特殊要求 (1)第一章范围 (1)第二章原则 (1)第三章洁净度级别与监测 (2)第四章隔离操作技术 (6)第五章吹灌封技术 (7)第六章人员 (7)第七章厂房 (9)第八章设备 (11)第九章消毒 (12)第十章生产管理 (12)第十一章灭菌工艺 (16)第十二章灭菌方法 (17)第十三章无菌兽药的最终处理 (21)第十四章质量控制 (22)第十五章术语 (22)附件 1无菌兽药生产质量管理的特殊要求第一章范围第一条无菌兽药是指法定兽药标准中列有无菌检查项目的制剂和原料药,包括无菌制剂和无菌原料药。
第二条本要求适用于无菌制剂生产全过程以及无菌原料药的灭菌和无菌生产过程。
第二章原则第三条无菌兽药的生产须满足其质量要求,应当最大限度降低微生物、各种微粒和热原的污染。
生产人员的技能、所接受的培训及其工作态度是达到上述目标的关键因素,无菌兽药的生产应当严格按照设计并经验证的方法及规程进行,产品的无菌或其他质量特性绝不能只依赖于任何形式的最终处理或成品检验(包括无菌检查) 。
第四条无菌兽药按生产工艺可分为两类:采用最终灭菌工艺的为最终灭菌产品;部分或全部工序采用无菌生产工艺的为非最终灭菌产。
第五条无菌兽药生产的人员、设备和物料应通过气锁间进入洁净区,采用机械连续传输物料的,应当用正压气流保护并监测压差。
第六条物料准备、产品配制和灌装(灌封) 或分装等操作应当在洁净区内分区域(室)进行。
第七条应当根据产品特性、工艺和设备等因素,确定无菌兽药生产用洁净区的级别。
每一步生产操作的环境都应当达到适当的动态洁净度标准,尽可能降低产品或所处理的物料被微粒或微生物污染的风险。
第三章洁净度级别与监测第八条洁净区的设计应当符合相应的洁净度要求,包括达到“静态”和“动态”的标准。
第九条无菌兽药生产所需的洁净区可分为以下 4 个级别:A 级:高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域,应当用单向流操作台( 罩) 维持该区的环境状态。
目录附件 1 (1)无菌兽药生产质量管理的特殊要求 (1)第一章范围 (1)第二章原则 (1)第三章洁净度级别与监测 (2)第四章隔离操作技术 (6)第五章吹灌封技术 (7)第六章人员 (7)第七章厂房 (9)第八章设备 (11)第九章消毒 (12)第十章生产管理 (12)第十一章灭菌工艺 (16)第十二章灭菌方法 (17)第十三章无菌兽药的最终处理 (21)第十四章质量控制 (22)第十五章术语 (22)附件 1无菌兽药生产质量管理的特殊要求第一章范围第一条无菌兽药是指法定兽药标准中列有无菌检查项目的制剂和原料药,包括无菌制剂和无菌原料药。
第二条本要求适用于无菌制剂生产全过程以及无菌原料药的灭菌和无菌生产过程。
第二章原则第三条无菌兽药的生产须满足其质量要求,应当最大限度降低微生物、各种微粒和热原的污染。
生产人员的技能、所接受的培训及其工作态度是达到上述目标的关键因素,无菌兽药的生产应当严格按照设计并经验证的方法及规程进行,产品的无菌或其他质量特性绝不能只依赖于任何形式的最终处理或成品检验(包括无菌检查) 。
第四条无菌兽药按生产工艺可分为两类:采用最终灭菌工艺的为最终灭菌产品;部分或全部工序采用无菌生产工艺的为非最终灭菌产。
第五条无菌兽药生产的人员、设备和物料应通过气锁间进入洁净区,采用机械连续传输物料的,应当用正压气流保护并监测压差。
第六条物料准备、产品配制和灌装(灌封) 或分装等操作应当在洁净区内分区域(室)进行。
第七条应当根据产品特性、工艺和设备等因素,确定无菌兽药生产用洁净区的级别。
每一步生产操作的环境都应当达到适当的动态洁净度标准,尽可能降低产品或所处理的物料被微粒或微生物污染的风险。
第三章洁净度级别与监测第八条洁净区的设计应当符合相应的洁净度要求,包括达到“静态”和“动态”的标准。
第九条无菌兽药生产所需的洁净区可分为以下 4 个级别:A 级:高风险操作区,如灌装区、放置胶塞桶和与无菌制剂直接接触的敞口包装容器的区域及无菌装配或连接操作的区域,应当用单向流操作台( 罩) 维持该区的环境状态。