第四单元物质构成的奥秘复习
- 格式:ppt
- 大小:2.83 MB
- 文档页数:42

第四单元物质构成的奥秘一、基本概念1、相对原子质量:以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子质量。
2、元素:具有相同核电荷数(即核内质子数)的一类原子的总称。
3、离子:带电的原子或原子团。
二、符号与原理1、元素符号氢H 氦He 碳C 氮N 氧O 氟F 氖Ne 钠Na 镁Mg铝Al 硅Si 磷P 硫S 氯Cl 氩Ar 钾K 钙Ca 锰Mn铁Fe 铜Cu 锌Zn 银Ag 钡Ba 铂Pt 金Au 汞Hg 碘I2、化合价钾+1 钠+1 银+1 钙+2 镁+2 铜+1、+2 钡+2铁+2、+3 铝+3 锰+2、+4、+6、+7 锌+2 氢+1氟-1 氯-1、+1、+5、+7溴-1 氧-2 硫-2、+4、+6 碳+2、+4硅+4氮-3、+2、+3、+4、+5 磷-3、+3、+53、化学式氮气N2氢气H2 红磷P木炭C硫磺S 铁丝Fe 氧气O2氯气Cl2二氧化碳CO2五氧化二磷P2O5二氧化锰MnO2一氧化氮NO二氧化氮NO2氧化铝Al2O3四氧化三铁Fe3O4氧化铁Fe2O3水H2O 盐酸HCl 硫酸H2SO4硝酸HNO3氢氧化钙Ca(OH)2氨气NH3过氧化氢H2O2氯酸钾KClO3碳酸钠NaCO3氯化钾KCl 尿素CO(NH2)2锰酸钾K2MnO4氯化钠(食盐)NaCl碱式碳酸铜Cu2(OH)2CO3高锰酸钾KMnO4硝酸铵NH4NO3乙醇(酒精)C2H5OH三、基本知识点1、原子的构成质子:带一个单位正电荷,相对质量为 1原子核原子的构成中子:不带电,相对质量为 1核外电子:带一个单位负电荷,微粒数与电荷数关系:相对原子质量≈质子数+中子数;质子数=核外电子数=核电荷数=原子序数2、几种原子的构成原子种类质子数中子数核外电子数相对原子质量氢 1 0 1 1碳 6 6 6 12氧8 8 8 16钠11 12 11 23硫16 16 16 32 可总结出的规律有:(1)不是所有的原子都有中子;(2)质子数=电子数(3)原子种类不同,原子质子数不同;(4)相对原子质量≈质子数+中子数3、元素含量(1)地壳中元素含量前四位:O 、Si 、Al 、Fe(2)生物细胞元素含量前四位:O 、 C 、H 、N(3)空气中元素含量前两位:N 、O4、元素符号的意义元素符号表示:表示一种元素;表示给该元素一个原子。



第四单元物质构成的奥秘[考点梳理]考点1 原子的构成⒈构成原子的粒子质子:一个质子带一个单位的正电荷原子核原子中子:不带电电子:一个电子带一个单位的负电荷⒉在原子里,核电荷数=质子数=核外电子数,原子不显电性。
考点2 相对原子质量⒈相对原子质量的标准:碳-12原子质量的1/12。
⒉表达式:Ar=其他原子的质量/(碳-12的质量×1/12)相对原子质量是一个比值,不是原子的实际质量。
⒊原子的质量重要集中在原子核上,相对原子质量≈质子数+中子数考点3 元素⒈元素的定义:具有相同核电荷数(即核内质子数)的一类原子的总称。
⒉元素的种类决定于核电荷数(即核内质子数)。
⒊地壳中含量列前四位的元素(质量分数):氧、硅、铝、铁,其中含量最多的元素(非金属元素)是氧,含量最多的金属元素是铝。
⒋生物细胞中含量列前四位的元素:氧、碳、氢、氮。
考点4 元素符号⒈元素符号:用元素的拉丁文名称的第一个大写字母来元素。
⒉书写:⑴由一个字母表达的元素符号要大写,如:H 、O 、S 、C 、P 等。
⑵由两个字母表达的元素符号,第一个字母要大写,第二个字母要小写(即“一大二小”),如:Ca 、Na 、Mg 、Zn 等。
⒊元素符号表达的意义:⑴表达一种元素;⑵表达这种元素的一个原子。
例如: ①表达氢元素H 2H :表达二个氢原子②表达一个氢原子 注意:元素不讲个数,2H 不能说成二个氢元素。
考点5 物质组成、构成的描述⒈物质由元素组成:如:水是由氢元素和氧元素组成的。
⒉物质由粒子(分子、原子、离子)构成。
例如:⑴ 是由水分子构成的 ⑵金是由金原子构成的 ⑶氯化钠是由钠离子和氯离子构成的。
⒊分子是由原子构成的:如:水分子是由 氢原子和氧原子构成的;每个水分子是由二个氢原子和一个氧原子构成的。
考点6 元素周期表简介 ⒈元素周期表的结构————元素符号 ———— 元素名称 ————相对原子质量 ⑴周期表每一横行叫做一个周期,共有7个周期。



物质构成的奥秘知识点1、原子的构成(1)原子结构示意图的认知识识=质子数=核外电子数(3)原子的质量主要集中在 原子核 上 (4)相对原子质量≈质子数+中子数 原子核※说明 最外层电子数相同的原子化学性质相似,如F ,Cl 化学性质类似,但(He 和H)除外。
2.元素的概念:质子数(即核电荷数)相同的一类原子的总称为元素。
注意 1只有两层含义,其他的元素符号都还可以还表示单质的意思。
2元素符号前的数字表示原子个数,如:3H 表示三个氢原子。
3由同种元素组成的物质是可能是单质,可能是混合物(如由O 2和O 3),一定不可能是化合物。
4地壳中元素按质量分数前三位是:O 氧 Si 硅 Al 铝 F 细胞:O 、5元素、物质都是宏观概念,只表示种类,不表示个数。
6具有相同核电荷数的粒子不一定是同种元素。
(如,H 2O ,Ne 核电核荷数都是10)7化学中的“语法“:“某物质”由“某元素组成” 水是由氢元素和氧元素组成的“某物质”由“某某分子或原子或离子构成” 水是由水分子构成的“某分子”由“某原子构成” 水分子是由氢原子和氧原子构成“一个某分子”由“几个某原子构成” 一个水分子是由两个氢原子和一个氧原子构成的 3 a b 4、离子:带电的原子或原子团(1)如2Fe 3+ “ 2”表示2个铁离子, “3”表示每个铁离子带3个单位正电荷质子数=电子数 为原子结构,一般不稳定(稀有气体元素除外)*质子数≠电子数为离子结构,稳定 (3)同种元素的原子与离子比较:一定改变的是:核外电子总数,最外层电子数,元素的化学性质,粒子的电性,阳离子的电子层数。
一定不改变的是:原子核(核内质子数、中子数、相对原子质量、原子的质量),阴离子电子层数。
5、 掌握化合价与化学式的关系和化合价的应用。
(1)常见元素化合价规律: 单质元素全为零,化合物中记分明。
①单质元素的化合价为零 一价K Na Ag H , 二价Mg Ca Zn Ba,②在化合物中氢元素为+1价,氧元素为-2 三Al 四Si 五价P , 二三Fe,二四C , ③在化合物中,元素化合价代数和为零 二四六S 都齐全, Cu 、Hg 二价最常见 ④原原子团的化合价是组成元素的化合价代数和。
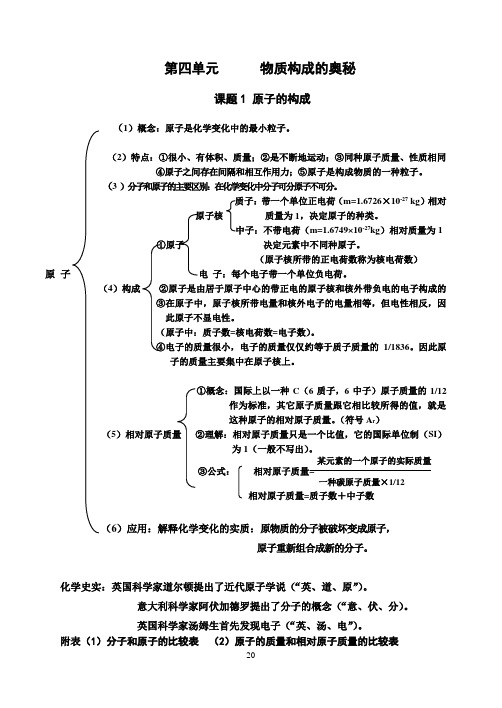
第四单元物质构成的奥秘课题1 原子的构成(1)概念:原子是化学变化中的最小粒子。
Array(2)特点:①很小、有体积、质量;②是不断地运动;③同种原子质量、性质相同④原子之间存在间隔和相互作用力;⑤原子是构成物质的一种粒子。
(3 )分子和原子的主要区别:在化学变化中分子可分原子不可分。
质子:带一个单位正电荷(m=1.6726×10-27 kg)相对原子核质量为1,决定原子的种类。
中子:不带电荷(m=1.6749×10-27kg)相对质量为1①原子决定元素中不同种原子。
(原子核所带的正电荷数称为核电荷数)电子:每个电子带一个单位负电荷。
4)构成②原子是由居于原子中心的带正电的原子核和核外带负电的电子构成的③在原子中,原子核所带电量和核外电子的电量相等,但电性相反,因此原子不显电性。
(原子中:质子数=核电荷数=电子数)。
④电子的质量很小,电子的质量仅仅约等于质子质量的1/1836。
因此原子的质量主要集中在原子核上。
①概念:国际上以一种C(6质子,6中子)原子质量的1/12作为标准,其它原子质量跟它相比较所得的值,就是这种原子的相对原子质量。
(符号A r)(5)相对原子质量②理解:相对原子质量只是一个比值,它的国际单位制(SI)为1(一般不写出)。
某元素的一个原子的实际质量③公式:相对原子质量=一种碳原子质量×1/12相对原子质量=质子数+中子数(6)应用:解释化学变化的实质:原物质的分子被破坏变成原子,原子重新组合成新的分子。
化学史实:英国科学家道尔顿提出了近代原子学说(“英、道、原”)。
意大利科学家阿伏加德罗提出了分子的概念(“意、伏、分)。
英国科学家汤姆生首先发现电子(“英、汤、电”)。
附表(1)分子和原子的比较表(2)原子的质量和相对原子质量的比较表分子和原子的比较表注:氢原子里无中子原子的质量和相对原子质量的比较表课题二 元素1.概念:元素是具有相同核电荷数(即核内质子数)的一类原子的总称。

第四单元 物质构成的奥秘复习学案1、原子的构成(1)原子结构示意图的认识(2)在原子中核电荷数=质子数=核外电子数决定元素种类 质子数(核电荷数)(3)原子的质量主要集中在 原子核 上(4)三决定 决定元素化学性质 最外层电子数(4)相对原子质量≈质子数+中子数决定原子的质量 原子核说明:最外层电子数相同其化学性质不一定都相同(Mg ,He 最外层电子数为2)最外层电子数不同其化学性质有可能相似(He ,Ne 均为稳定结构)2、元素(1)定义:具有相同核电荷数(质子数)的一类原子的总称*一种元素与另一种元素的本质区别:质子数不同注意:*由同种元素组成的物质不一定是单质,(如由O 2、O 3组成的混合物或金刚石与石墨的混合物)不可能是化合物。
(2)表示方法——元素符号——拉丁文名称的第一个字母大写a 、书写方法:b 、意义注意:*有些元素符号还可表示一种单质 如Fe 、He 、C 、Si*在元素符号前加上数字后只能有微观意义,没有宏观意义,如3O :只表示3个氧原子c 、有关元素周期表*发 *排列依据注:原子序数=质子数d 、分类e 、元素之最:3、离子:带电的原子或原子团(1)表示方法及意义:如Fe 3+ :铁离子带3个单位正电荷(2)离子结构示意图的认识 *原子数≠电子数为离子结构示意图 (3)与原子的区别与联系二、物质的组成的表示:1、化合价a 、写法及意义: Mg :镁元素化合价为+2价 MgCl 2:氯化镁中镁元素化合价为+2价b 、几种数字的含义Fe 2+ 每个亚铁离子带两个单位正电荷 3 Fe 2+:3个亚铁离子2H 2O 两个水分子, 每个水分子含有2个氢原子c 、化合物中各元素正、负化合价的代数和为零d 、化合价是元素的原子在形成化合物时表现出来的性质,所以单质分子中元素化合价为02、化学式(1)写法:a 单质:金属、稀有气体及大多数固态非金属通常用元素符号表示它们的化学式;而氧气、氢气、氮气、氯气等非金属气体的分子由两个原子构成,其化学式表示为O 2、H 2、N 2、Cl2。
