卡培他滨杂质结构式等基本情况列表
- 格式:pdf
- 大小:116.85 KB
- 文档页数:3

卡培他滨片【说明书修订日期】核准日期:2006年10月27日修改日期:【药品名称】卡培他滨片【商品名】希罗达【英文商品名】Xeloda【英文名】Capecitabine Tablets【汉语拼音】Kapeitabin Pian【成份】本品主要成份为卡培他滨化学名称:5’-脱氧-5-氟-N-[(戊氧基)羰基[-胞(嘧啶核)苷。
化学结构式:分子式:C15H22FN3O6分子量:359.35【性状】0.15g:双凸、长方形、浅桃色包衣片,除去包衣后显白色。
一面有XELODA字样,另一面有150字样;0.5g:双凸、长方形、桃色包衣片,除去包衣后显白色。
一面有XELODA字样,另一面有500字样。
【适应症】结肠直肠癌:当建议转移性结肠直肠癌患者单用氟嘧啶治疗时,卡培他滨可用作一线治疗。
与单用5-FU/LV相比,联合化疗对延长生存期有利。
卡培他滨单药治疗没有证明比5-FU/LV延长生存期有利。
用卡培他滨取代联合化疗中的5-FU/LV尚未得到足够研究以确保安全性或维持生存期。
乳腺癌联合治疗:卡培他滨与多西他赛联合用于治疗包括蒽环类抗生素化疗失败的转移性乳腺癌。
乳腺癌单药治疗:卡培他滨亦可单独用于治疗对紫杉醇和一种包括蒽环类抗生素化疗方案均耐药或对紫杉醇耐药同时不能再使用蒽环类抗生素治疗(例如已经接受了累积剂量400mg/m2阿霉素或阿霉素同类物)的转移性乳腺癌患者。
耐药定义为治疗期间疾病继续进展,完成含有蒽环类抗生素的辅助治疗方案后有或无初始缓解,或6个月内复发。
【规格】(1)0.15g;(2)0.5g【用法用量】卡培他滨的建议剂量是口服1250mg/m2一天2次(早晚各1次;等于每日总剂量2500mg/m2)治疗2周后停药1周,3周为一个疗程。
卡培他滨片剂应在餐后30分钟内用水吞服。
表1列出了按体表面积计算的每日总剂量和每个剂量需要服用的药片数量。
表1.根据体表面积计算的卡培他滨剂量1250mg/m2一天2次的剂量水平每个剂量需要服用的药片数量(早晨和晚上)体表面积(m2)每日总剂量*(mg)150mg500mg≤1.253000031.26-1.373300131.38-1.513600231.52-1.654000041.66-1.774300141.78-1.914600241.92-2.055000052.06-2.17530015≥2.18560025*每日总剂量分为2次以平衡早晨和晚上的剂量剂量调整指南:应密切监测患者的毒性反应。
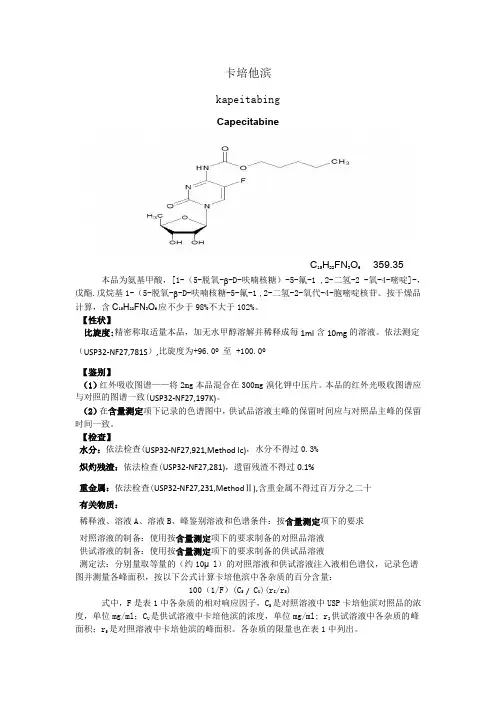
卡培他滨kapeitabingCapecitabineC15H22FN3O6 359.35本品为氨基甲酸,[1-(5-脱氧-β-D-呋喃核糖)-5-氟-1 ,2-二氢-2 -氧-4-嘧啶]-,戊酯.戊烷基1-(5-脱氧-β-D-呋喃核糖-5-氟-1 ,2-二氢-2-氧代-4-胞嘧啶核苷。
按干燥品计算,含C15H22FN3O6应不少于98%不大于102%。
【性状】比旋度:精密称取适量本品,加无水甲醇溶解并稀释成每1ml含10mg的溶液。
依法测定(USP32-NF27,781S),比旋度为+96.0⁰至 +100.0⁰【鉴别】(1)红外吸收图谱——将2mg本品混合在300mg溴化钾中压片。
本品的红外光吸收图谱应与对照的图谱一致(USP32-NF27,197K)。
(2)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品主峰的保留时间一致。
【检查】水分:依法检查(USP32-NF27,921,Method Ic),水分不得过0.3%炽灼残渣:依法检查(USP32-NF27,281),遗留残渣不得过0.1%重金属:依法检查(USP32-NF27,231,MethodⅡ),含重金属不得过百万分之二十有关物质:稀释液、溶液A、溶液B、峰鉴别溶液和色谱条件:按含量测定项下的要求对照溶液的制备:使用按含量测定项下的要求制备的对照品溶液供试溶液的制备:使用按含量测定项下的要求制备的供试品溶液测定法:分别量取等量的(约10μl)的对照溶液和供试溶液注入液相色谱仪,记录色谱图并测量各峰面积,按以下公式计算卡培他滨中各杂质的百分含量:100(1/F)(C S / C U)(r I/r S)式中,F是表1中各杂质的相对响应因子,C S是对照溶液中USP卡培他滨对照品的浓度,单位mg/ml;C U是供试溶液中卡培他滨的浓度,单位mg/ml; r I供试溶液中各杂质的峰面积;r S是对照溶液中卡培他滨的峰面积。
各杂质的限量也在表1中列出。


卡培他滨说明书,你真的会看吗?建议收藏的详细解析版首先,卡培他滨属于哪种化疗药物:细胞毒性药物,就是我们常说的化疗药物。
不同于靶向药物针对性杀死表达某种基因突变的肿瘤细胞,化疗药物主要攻击处于快速分裂期的细胞,因此除了蛮横的肿瘤细胞以外,极其容易受到攻击的就是血液细胞。
卡培他滨的主流用药方案卡培他滨有大致两种用药:01单用卡培他滨通常是口服,针对一些分期较早(复发概率较低),或是年龄较长的老年患者,考虑联合用药打击过猛,反而损害免疫系统,无法从化疗中收益。
单药应用推荐剂量为1250mg/m2,每日两次,口服(每日总剂量为2500mg/m2);吃2周,停1周,3周为一疗程,餐后30分钟内用水吞服。
那么具体怎么计算用量呢,首先要先算体表面积,体表面积计算公式:体表面积(m) =0.0061x身高(cm)+0.0128×体重(kg)-0.1529。
举个例子,患者A,75岁老年男性,身高:175cm,体重:65kg,体表面积:1.7466 m2约等于2.00m2;那么根据说明书:推荐剂量1250mg/m2,按照卡培他滨每片0.5g(=500mg)计算,患者A的卡培他滨具体用药量为:1250x2.00=2500mg 每顿;注:5片/次 2次/日餐后30分钟内用水吞服,连服14天,休息1周,3周(21天)为一个疗程。
02与奥沙利铂联用奥沙利铂130mg/m2,静脉输注,当天开始口服卡培他滨,剂量为1000mg/m2,每日两次,用药2周,停1周;再举个例子:患者B,55岁老年男性,身高:175cm,体重:65kg,体表面积:1.7466 m2约等于2.00m2;那么根据说明书:奥沙利铂推荐剂量:130mg/m2;卡培他滨推荐剂量1000mg/m2,按照卡培他滨每片0.5g(=500mg)计算:患者B的化疗药物具体用药量为:奥沙利铂:130x2.00=260mg+卡培他滨:1000x2.00=2000mg ;注:第一天静脉滴注奥沙利铂260mg;同日起,口服卡培他滨:4片/次2次/日餐后30分钟内用水吞服,连服14天,休息1周,3周(21天)为一个疗程。

核准日期:修改日期:卡培他滨片说明书请仔细阅读说明书并在医师指导下使用警告对于同时服用卡培他滨和香豆素类衍生物抗凝药如华法令和苯丙香豆素的患者,应该频繁监测抗凝反应指标,如INR或凝血酶原时间,以调整抗凝剂的用量。
在合并用药期间,曾有凝血参数改变和/或出血,包括死亡的报告。
发生时间:在开始卡培他滨治疗后几天到几个月时间内,也可能在停止使用卡培他滨后1个月内观察到。
易感因素:年龄>60,诊断为癌症。
【药品名称】通用名称:卡培他滨片英文名称:Capecitabine Tablets汉语拼音:Kapeitabin Pian【成份】本品主要成份为卡培他滨,化学名称:5’-脱氧-5-氟-N-[(戊氧基)羰基]-胞(嘧啶核)苷化学结构式:分子式:C15H22FN3O6分子量:359.35【性状】本品为薄膜衣片,除去包衣后显白色或类白色。
【适应症】结肠癌辅助化疗:卡培他滨适用于Dukes’ C期、原发肿瘤根治术后、适于接受氟嘧啶类药物单独治疗的结肠癌患者的单药辅助治疗。
其治疗的无病生存期(DFS)不亚于5-氟尿嘧啶和甲酰四氢叶酸联合方案(5-FU/LV) 。
卡培他滨单药或与其他药物联合化疗均不能延长总生存期(OS),但已有试验数据表明在联合化疗方案中卡培他滨可较5-FU/LV改善无病生存期。
医师在开具处方使用卡培他滨单药对Dukes’ C期结肠癌进行辅助治疗时,可参考以上研究结果。
结直肠癌:卡培他滨单药或与奥沙利铂联合(XELOX)适用于转移性结直肠癌的一线治疗。
乳腺癌联合化疗:卡培他滨可与多西紫杉醇联合用于治疗含蒽环类药物方案化疗失败的转移性乳腺癌。
乳腺癌单药化疗:卡培他滨亦可单独用于治疗对紫杉醇及含蒽环类药物化疗方案均耐药或对紫 杉醇耐药和不能再使用蒽环类药物治疗(例如已经接受了累积剂量400 mg/m 阿霉素或阿霉素同2类物)的转移性乳腺癌患者。
耐药的定义为治疗期间疾病继续进展(有或无初始缓解),或完成 含有蒽环类药物的辅助化疗后6个月内复发。




抗肿瘤药卡培他滨有关物质分析方法验证作者:胡丽娟来源:《新教育时代·教师版》2018年第21期摘要:分析卡培他滨中有关物质,并验证测定有关物质的分析方法。
方法:使用高效液相色谱法测定有关物质并进行方法验证。
结论:确定了卡培他滨制备过程中的主要杂质;建立的分析方法简单灵敏,准确可靠,专属性好,结果稳定,适用于卡培他滨的有关物质控制,也可为其它氟化嘧啶类药物的有关物质研究提供参考。
关键词:卡培他滨有关物质分析方法验证卡培他滨(Capecitabine)是一种可以在体内转变成5-FU的抗代谢氟嘧啶脱氧核苷氨基甲酸酯类抗肿瘤原料药物,通过体内三步酶链反应转换为5-FU而作用于肿瘤细胞,能够抑制细胞分裂和干扰RNA和蛋白质(protein)合成。
具有临床高效低毒价格低廉的优势,作为一方便、安全、疗效确切的抗癌药,有可能取代5-FU成为胃癌联合化疗方案的基本用药。
从2001年美国FDA和2002年欧洲药品管理局(EMEA)批准用于转移性乳腺癌开始,先后获得英国国家健康与临床优化研究所(NICE)和美国国立综合癌症网络(NCCN)权威指南的推荐,在全世界范围已有多项大样本研究证明其在胃癌、肠癌以及乳腺癌中具有生存获益。
而在我国,卡培他滨自2001年上市8年来,先后被批准单药和联合治疗转移性乳腺癌、肠癌的辅助治疗和转移性肠癌的一线治疗,直至去年被批准用于晚期胃癌的一线治疗。
[1]本文在国家标准H31022940的基础上结合卡培他滨美国药典USP32版的有关物质控制要求建立了HPLC-UV法测定卡培他滨中有关物质,并对该方法进行方法验证。
一、仪器设备1.仪器:A gilent1260高效液相色谱仪(紫外检测器)、电子天平2.色谱条件:[2](1)色谱柱:用十八烷基硅烷键合硅胶为填充剂的色谱柱(4.6mm*250mm,5μm)(2)流动相:以甲醇为流动相A,乙腈为流动相B,0.1%醋酸溶液为流动相C,进行梯度洗脱,检测波长:250nm,流速:1.0ml/min ,柱温:40℃进样量:10μl,稀释剂:甲醇-乙腈-水(25:3:72)二、有关物质卡培他滨成品中可能含有的已知杂质,杂质A(5′-脱氧-5-氟胞苷)、杂质B(5’-脱氧-5-氟脲苷)、杂质C(2′,3′-氧-羰基-5′-脱氧-5′-氟-N-(戊氧基羰基胞嘧啶核苷))、杂质D (2′,3′-二-氧-乙酰基-5′-脱氧-5-氟-N-(戊氧基羰基)-胞嘧啶核苷)、杂质E(2′,3′-二- 氧-乙酰基-5′-脱氧-5-氟胞嘧啶核苷)、杂质F(5-氟胞嘧啶)、杂质J(5-氟-N-[(戊氧基)羰基]-胞嘧啶)、杂质L1(5′-脱氧-5-氟-N-[(2-甲基丁氧基)碳基]-胞嘧啶核苷)、杂质L2(5′-脱氧-5-氟-N-[(3-甲基丁氧基)碳基]-胞嘧啶核苷)、杂质Q(5’-脱氧-5-氟-N-[(甲氧基)羰基]- 胞嘧啶核苷)。

卡培他滨(USP31)C15H22FN3O6[].氨基甲酸,[1-(5-脱氧--D-呋喃核糖)-5-氟代-1,2-二氢-2-氧-4-嘧啶基]-, 戊基酯. 戊基 1-(5-脱氧--D-呋喃核糖)-5-氟代-1,2-二氢-2-氧-4-嘧啶氨基甲酸酯以无水和无溶剂物计,卡培他滨含C15H22FN3O6为%~%。
【包装和贮存】密闭,受控室温保存。
【性状】白色至类白色结晶性粉末。
易溶于甲醇,溶解于乙腈和乙醇,难溶于水。
【鉴别】A: 红外鉴别试样:2mg供试品与300mg溴化钾混合。
B:含量项下,样品溶液色谱图中主峰保留时间应与标准溶液色谱图中主峰保留时间一致。
【水分】:不得过%。
(库仑滴定)【比旋度】+ ~+。
供试品溶液:10 mg/ mL,溶于甲醇,20,以无水和无溶剂物计。
【炽灼残渣】不得过%。
【重金属】不得过20 ppm。
(重金属第二法)【有关物质】稀释液,溶液A,溶液B,峰鉴别溶液,色谱系统——同含量项下。
标准溶液——直接采用含量项下标准溶液。
供试品溶液——直接采用含量项下供试品溶液。
程序——分别进样等体积(约10 µL)标准溶液和供试品溶液,注入色谱仪,记录谱图,测定所有峰面积。
用下列公式计算卡培他滨中每个杂质的百分比:100(1/F)(C S / C U)(r I / r S)F——各个杂质的相对响应因子,见表1CS——标准溶液中卡培他滨标准品的浓度,mg/mlCU——供试品溶液中卡培他滨的浓度,mg/mlrI——供试品溶液中各个杂质的峰响应rS——标准溶液中卡培他滨的峰响应限度见表1。
表 12,3-Di-O-acetyl-5-deoxy-5-fluorocytidine5-Deoxy-5-fluoro-N4-(2-methyl-1-butyloxycarbonyl)cytidine +5-Deoxy-5-fluoro-N4-(3-methyl-1-butyloxycarbonyl)cytidine2,3-Di-O-acetyl-5-deoxy-5-fluoro-N4-(pentyloxycarbonyl)cytidine【含量】稀释液——水:甲醇:乙腈=60:35:5稀醋酸——%醋酸水溶液(v/v)溶液A——稀醋酸:甲醇:乙腈=60:35:5溶液B——甲醇:稀醋酸:乙腈=80:15:5标准溶液——精密称取一定量USP卡培他滨对照品,溶于稀释液,超声,并用稀释液稀释以获得浓度约为mL的溶液。

卡培他滨项目介绍一、概述通用名:卡培他滨英文名:capecitabine;Ro-9-1978商品名:希罗达;Xeloda化学名:5-脱氧-5-氟-N-[(戊氧基)羰基]-胞嘧啶核苷;Cytidine, 5-deoxy-5-fluoro-N-[(pentyloxy)carbonyl]- [CAS]分子式:C15H22O6N3F分子量:359.35CAS登录号:154361-50-9结构式:原研发企业:Hoffmann-La Roche (瑞士)上市时间:1998年8月15日在瑞士首次上市适应症:联合多西紫杉醇治疗包括蒽环类抗生素化疗失败的转移性乳腺癌;单药一线治疗转移性直肠癌。
剂型:片剂,0.5g*30片/盒给药途径:口服专利情况:物质专利2013年12月到期。
二、研发背景乳腺癌是女性最常见的恶性肿瘤之一,据资料统计,发病率占全身各种恶性肿瘤的7~10%。
它的发病常与遗传有关,以及40~60岁之间、绝经期前后的妇女发病率较高。
仅约1~2%的乳腺癌患者是男性。
通常发生在乳房腺上皮组织的恶性肿瘤。
是一种严重影响妇女身心健康甚至危及生命的最常见的恶性肿瘤之一,男性乳腺癌罕见。
结肠直肠癌是胃肠道中常见的恶性肿瘤,早期症状不明显,随着癌肿的增大而表现排便习惯改变、便血、腹泻、腹泻与便秘交替、局部腹痛等症状,晚期则表现贫血、体重减轻等全身症状。
其发病率和病死率在消化系统恶性肿瘤中仅次于胃癌、食管癌和原发性肝癌。
结肠直肠癌在中国相比于其他国家属于低发地区,但其发生率在不少地区有程度不等的增加趋势。
本病多发生在中年以上的男性,以40~70岁最为多见,但20世纪末发现30岁以下者亦不少见。
男女两性发病比例约为2:1。
本病和其他恶性肿瘤一样,发病原因仍不清楚,可以发生在结肠或直肠的任何部位,但以直肠、乙状结肠最为多见,其余依次见于盲肠、升结肠、降结肠及横结肠。
癌瘤大多数为腺癌,少数为鳞状上皮癌及粘液癌。
本病可以通过淋巴、血液循环及直接蔓延等途径,播散到其他组织和脏器。
年产20吨卡培他滨项目环境影响介绍高纯卡培他滨是口服氟代嘧啶氨基甲酸酯类抗肿瘤药物,如治疗乳腺癌、结肠直肠癌的新型靶向药物,在抗代谢类市场排行中居第2位。
国家医保目录乙类。
卡培他滨以D-核糖为原料,经缩酮化、酯化、还原、水解和酰化反应制得三乙酰核糠,5-氟胞嘧啶进行si1yl反应,再与氯甲酸正戊酯进行酰胺化,最后水解去除乙酰基得到卡培他滨,该技术在文献工艺基础上把多步分离转为一锅法,降低了三废总量,提高了收率。
1、化学反应方程式2、主要物料消耗表2-1 年产20吨卡培他滨项目主要物料消耗从上表可以看出,该项目的物料消耗为159.78t/a,单耗为7.989㎏/㎏。
3、主要生产设备清单表3-1 年产20吨卡培他滨项目生产清单4、工艺流程图及主污点图单位:㎏/批回收正已烷188 废气12废气:少量氢气废气:水汽回收丙酮223 甲醇162废气:丙酮25 甲醇18少量丙酮,甲醇废气D-核糖200常压蒸馏缩酮化反应丙酮248(新50)甲醇180(新36)减压蒸馏还原反应烘干脂化反应水1000对甲苯磺酰氯140废水D1500碱性PH10含苯磺酸盐脂化物离心(含湿率15%)379.5 三乙胺67正已烷200(新20)硼氢化钠60还原物粘稠状液体120减压蒸馏水解反应水1350废气:水汽废气:水汽甲苯345减压蒸馏洗涤分层酰化反应醋酐340(新68)废气甲苯1废水E300含醋酸水100*3母液:异丙醇常压回收189 废气21回收甲苯331 废气9减压离心结晶异丙醇210三乙酰核糖(含湿5%)140废气二氯甲烷25 母液常压回收145 少量废气二氯甲烷1六甲基硅氮烷120(新24)缩合反应5-氟胞嘧啶45二氯甲烷170离心缩合物(含湿率10%)118氯甲酸正戊酯46酰胺化反应三乙胺35二氯甲烷120(新30)少量废气二氯甲烷1极少量废气二氯甲烷常压蒸馏洗涤分层水解反应氢氧化钠0.5水75*3废水F225有氯化钠盐0.8 回收二氯甲烷102废气18 乙醇270(新27)结晶乙醚45废气:乙醇9乙醚5母液回收乙脂260乙醚38 废气乙脂1乙醚2成品(含湿率5%) 105离心真空烘干成品1005、工艺流程说明A、在缩酮化反应中加入D-核糖,丙酮、甲醇及少量催化剂进行反应,反应结束后常压蒸馏,回收丙酮甲醇套用,同时产生甲醇丙酮废气,浓缩液加水氢氧化钠,对甲苯磺酰氯反应,反应完全结晶,离心甩滤、烘干得得脂化物。
卡培他滨片的质量控制1、实验材料1.1、材料甲醇、乙睛、冰醋酸购买于山东禹王实业有限公司化工分公司;高效液相用甲醇、乙睛为色谱纯,其它试剂为分析纯。
表1 材料信息一览表1.2仪器表2 仪器一览表2、方法与结果2.1、质量标准参考卡培他滨片美国药典标准(USP39)的内容,制定了本品的质量标准。
表3 质量标准、方法和限度2. 2分析方法【性状】本品为薄膜衣片,除去包衣后显白色。
【鉴别](1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应照品溶液主峰的保留时间一致。
(2)本品的红外光吸收图谱应与对照品的图谱一致。
【含量】稀释液:甲醇一乙睛一水(7:1:12)溶液A: O.I%冰醋酸水溶液溶液B:甲醇一乙睛一溶液A (7:1:12)溶液C:甲醇一乙腊一溶液A (16:1:3 )时间程序系统适用性溶液:用稀释液制成含0.6}g/ml的USP卡培他滨标准品,USP相关杂质A,USP 相关杂质B和USP相关杂质C溶液。
标准溶液:用稀释液制成含0.6mg/ml的USP卡培他滨标准品溶液。
样品溶液:取20片样品,碾细,称取适量粉末,用稀释液制成含卡培他滨0.6mg/ml的样品溶液,过滤,取续滤液作为样品溶液。
色谱系统:高效液相色谱色谱法检测波长:250nm2. 3分析方法的验证2. 3. 1、性状本品为薄膜衣片,除去包衣后应显白色。
取卡培他滨片三批样品,依法检查,结果见下表。
表4 卡培他滨片外观性状检查试验结果试验结果表明:3批样品检查结果均为薄膜包衣片,除去包衣后显白色,订入质量标准。
2. 3. 2鉴别2. 3. 2. 1红外吸收光谱法将一片卡培他滨片研细,加约1-2mg药粉到300mg的溴化钾中,依法检查,供试样品的吸收带应和对照品一致。
表5 卡培他滨片IR法鉴别检查结果结论:3批样品的红外色谱吸收带均与对照品一致,将本鉴别方法列入质量标准2. 3. 2. 2高效液相色谱法在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。
卡培他滨片说明书卡培他滨片(首辅)联合多西紫杉醇治疗包括蒽环类抗生素化疗失败的转移性乳腺癌;单药一线治疗转移性直肠癌。
下面是店铺整理的卡培他滨片说明书,欢迎阅读。
卡培他滨片商品介绍通用名:卡培他滨片生产厂家: 正大天晴药业集团股份有限公司批准文号:国药准字H20143044药品规格:0.5g*12片药品价格:¥280元卡培他滨片说明书【通用名称】卡培他滨片【商品名称】卡培他滨片(首辅)【英文名称】CapecitabineTablets【拼音全码】KaPeiT aBinPian(ShouFu)【主要成份】卡培他滨。
【性状】双凸,长方形桃色包衣片,除去包衣后显白色。
【适应症/功能主治】联合多西紫杉醇治疗包括蒽环类抗生素化疗失败的转移性乳腺癌;单药一线治疗转移性直肠癌。
【规格型号】0.5g*12s【用法用量】推荐剂量:每日2,500mg/m2,连用两周,休息一周。
每日总剂量分早晚两次于饭后半小时用水吞服。
如病情继续恶化或产生不能耐受的毒性时应停止治疗。
【不良反应】1.消化系统:常见的副反应为可逆性胃肠道反应,如腹泻、恶心、呕吐、腹痛、口炎等。
严重的(3-4级)副反应相对少见。
2.皮肤:在几乎一半使用卡培他滨片(首辅)的病人中发生手足综合征:表现为麻木、感觉迟钝、感觉异常、麻刺感、无痛感或疼痛感,皮肤肿胀或红斑,脱屑、水泡或严重的疼痛。
皮炎和脱发较常见,但严重者很少见。
3.全身不良反应:常有疲乏但严重者极少见。
其他常见的副反应为粘膜炎、发热、虚弱、嗜睡等,但均不严重。
4.神经系统:头痛、感觉异常、味觉障碍、眩晕、失眠等较常见,但严重者少见。
5.心血管系统:下肢水肿较轻且不常见。
尚未见其他心血管系统副作用。
6.血液系统:少见中性粒细胞减少,极少见贫血,但都不严重。
7.其他:常见厌食及脱水,但重者极少见。
【禁忌】曾经出现卡培他滨片(首辅)严重副反应或对氟嘧啶(卡培他滨的代谢产物)有过敏史者禁用。
【注意事项】需限制剂量的毒性包括:腹泻、腹痛、恶心、胃炎及手足综合征。