高一化学人教版同步培优专题讲义18---核素
- 格式:pdf
- 大小:813.83 KB
- 文档页数:12

高一化学核素知识点核素是指具有确定质子数和中子数的同位素,可以通过核反应进行转化,存在于核反应中的核素称为反应物,参与反应但未被转化的核素称为中间体,通过核反应转化成其他核素的核素称为产物。
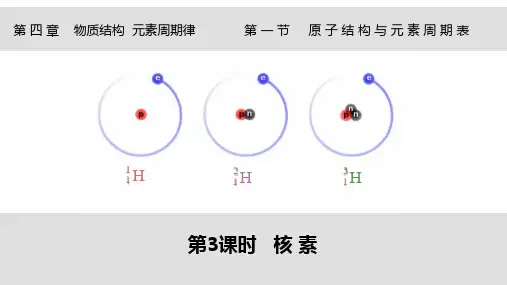
一、核素符号核素符号由元素化学符号和质量数构成,元素化学符号一般用拉丁字母表的第一个字母大写来表示,质量数在元素符号的左上角标注,质子数在元素符号的右下角标注,如氢的核素符号为^1H,碳-12的核素符号为^12C。
二、同位素和同位素符号同位素是指具有相同质子数但质量数不同的核素,同位素符号的元素化学符号后面用连字符的方式接上质量数,如氢的同位素有氘和氚,分别表示为^2H和^3H。
三、放射性核素和稳定核素根据核素的稳定性,可以将核素分为放射性核素和稳定核素。
放射性核素具有不稳定核结构,会自发地发生核衰变释放粒子或电磁辐射,最终转化成其他核素。
稳定核素则具有相对稳定的核结构,不会自发发生核衰变。
例如,铀-238是一种放射性核素,而碳-12是一种稳定核素。
四、核反应和核方程式核反应是指由于核的结构变化导致的反应过程。
核方程式用于表示核反应的化学方程式,由反应物核素符号和产物核素符号组成,反应物写在箭头的左侧,产物写在箭头的右侧。
核方程式中需保证质量数和电荷数在反应前后相等。
例如,氢的核融合反应方程式可以表示为:^1H + ^1H → ^2H + e+ + ν其中,ν表示中微子,e+表示正电子。
五、核衰变和半衰期核衰变是指放射性核素发生自发性核转换的过程,常见的核衰变方式包括α衰变、β衰变和γ衰变。
α衰变是指放射性核素放出一个α粒子,质量数减少4、质子数减少2。
β衰变是指放射性核素放出一个β粒子,质量数不变、质子数增加1。
γ衰变是指放射性核素发射γ射线,不改变质量数和质子数。
半衰期是指放射性核素衰变为其半衰期的一半所需的时间。
不同放射性核素具有不同的半衰期,半衰期的长短决定了放射性核素的放射强度和放射性活度。
常见的放射性核素如铀-238的半衰期为45.7亿年,碳-14的半衰期为5730年。





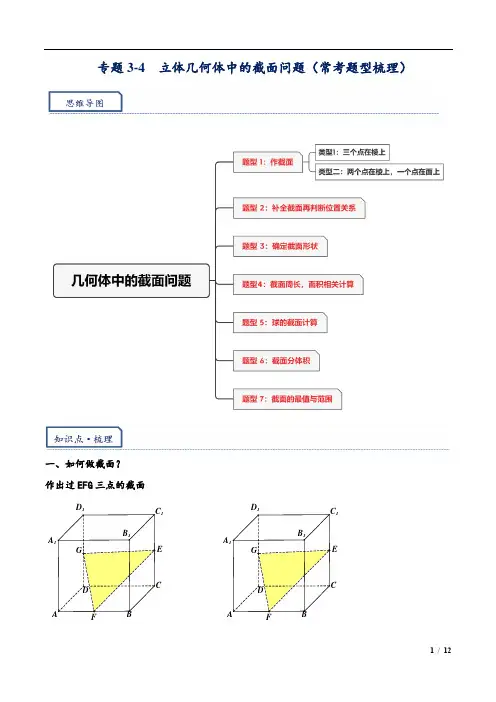
专题3-4 立体几何体中的截面问题(常考题型梳理)一、如何做截面?作出过EFG 三点的截面C 1DABB 1A GC 1DABB 1A G二、如何确定截面是否已经“搞定”?题型一 作截面类型1:三个点在棱上 1.作出过EFG 三点的截面2.作出过EFG 三点的截面,EFG 为所在棱上中点(三条边都在正方体内部)ED 1C 1CGD FABA 1B 1EF D 1C 1CG D ABA 1B 1GF ED 1C 1CDABA 1B 1ED 1C 1CDFABA 1B 1G 重点题型·归类精讲3.如图①,正方体1111ABCD A B C D −的棱长为2,P 为线段BC 的中点,Q 为线段1CC 上的动点,过点A 、P 、Q 的平面截该正方体所得的截面记为S ,若12CQ <<,请在图中作出截面S (保留尺规作图痕迹);4.如图,已知正方体1111ABCD A B C D −,点E 为棱1CC 的中点,在图中作出平面1BED 截正方体所得的截面图形(如需用到其它点,需用字母标记并说明位置),并说明理由.类型二:两个点在棱上,一个点在面上5.已知G 是底面ABCD 上一点,E,F 为棱上的点,作出过EFG 三点的截面1C DBA B 1GE F题型二 补全截面再判断位置关系武汉调研&浙江杭州二模6.(多选)如图,点A ,B ,C ,M ,N 为正方体的顶点或所在棱的中点,则下列各图中,满足直线MN //平面ABC 的是( )2023·温州模拟7.下列正方体中,A ,B 为正方体的两个顶点,M ,N ,P 分别为其所在棱的中点,则能满足//AB 平面MNP的是( )A .B .C .D .题型三 确定截面形状8.在正方体1111ABCD A B C D −中,1BB 和11C D 的中点分别为M ,N .如图,若以A ,M ,N 所确定的平面将正方体截为两个部分,则所得截面的形状为( )A .六边形B .五边形C .四边形D .三角形AAMCBBCAB MC BNCMDCAB M9.如图,在正方体1111ABCD A B C D −中,2AB =,E 为棱BC 的中点,F 为棱11A D 上的一动点,过点A ,E ,F 作该正方体的截面,则该截面不可能是( )A .平行四边形B .等腰梯形C .五边形D .六边形2023·重庆巴蜀中学高三校考10.(多选)已知截面定义:用一个平面去截一个几何体,得到的平面图形(包含图形内部)称为这个几何体的一个截面.则下列关于正方体截面的说法,正确的是( ) A .截面图形可以是七边形B .若正方体的截面为三角形,则只能为锐角三角形C .当截面是五边形时,截面可以是正五边形D .当截面是梯形时,截面不可能为直角梯形2024届雅礼中学月考(二)11.如图所示,在棱长为2的正方体1111ABCD A B C D −中,点M ,N 分别为棱11B C ,CD 上的动点(包含端点),当M ,N 分别为棱11B C ,CD 的中点时,则过1A ,M ,N 三点作正方体的截面,所得截面为______边形12.如图正方体1111ABCD A B C D −,棱长为1,P 为BC 中点,Q 为线段1CC 上的动点,过A 、P 、Q 的平面截该正方体所得的截面记为Ω.若1CQ CC λ→→=,则下列结论错误的是( )A .当102λ∈⎛⎫⎪⎝⎭,时,Ω为四边形B .当12λ=时,Ω为等腰梯形 C .当3,14λ⎛⎫∈ ⎪⎝⎭时,Ω为六边形D .当1λ=时,Ω6题型四 截面周长,面积相关计算13.如图,在棱长为1的正方体1111ABCD A B C D −中,点EF 分别是棱111,B B B C 的中点,点G 是棱1C C 中点,则过线段AG 且平行于平面1A EF 的截面的面积为________.14.如图,在棱长为2的正方体ABCD -A 1B 1C 1D 1中,E 是棱CC 1的中点,则过三点A,D 1,E 的截面面积等于( )FED 11CDBA B 1A .3 2B .3 102C .92D .315.如图,在棱长为4的正方体1111ABCD A B C D −中,M ,N 分别为棱AB ,11B C 的中点,过C ,M ,N 三点作正方体的截面,则以B 点为顶点,以该截面为底面的棱锥的体积为( )A .83B .8C 83D 163162ABCD A B C D −''''中,点E 、F 、G 分别是棱A B ''、B C ''、CD 的中点,则由点E 、F 、G 确定的平面截正方体所得的截面多边形的面积等于 .17.如图,在正方1111ABCD A B C D −中,2,,,,,AB E F P M N =分别是11,,,,AB CC DD AD CD 的中点,存在过点,E F 的平面α与平面P MN 平行,平面α截该正方体得到的截面面积为______D1C CDBB 1A题型五 球的截面计算计算球截面基本规律 1.确定球心和半径2.寻找做出并计算截面与球心的距离3.要充分利用“球心做弦的垂直垂足是弦的中点”这个性质4.强调弦的中点,不一定是几何体线段的中点。

第三课时核素——————————————————————————————————————[课标要求]1.了解质量数和A Z X的含义。
2.了解核素、同位素的概念。
3.了解原子的构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数,以及质量数与质子数、中子数之间的相互关系。
1.原子结构记忆口诀:原子构成三子(质子、中子、电子)奇(奇妙),质子正电擎大旗。
电子抗衡带负电,中子无电为中立。
2.质量数(A)=质子数(Z)+中子数(N)。
3.元素种类由质子数决定,同位素种类由质子数和中子数共同决定。
4.具有一定数目质子和一定数目中子的一种原子叫做核素。
质子数相同而中子数不同的同一元素的不同原子,互称同位素,同位素间的化学性质基本相同,物理性质不同。
原子的构成质量数1.原子的构成原子⎩⎨⎧原子核⎩⎪⎨⎪⎧质子:带1个单位正电荷中子:不带电核外电子:带1个单位负电荷2.质量数(1)概念:将核内所有质子和中子的相对质量取近似整数值后相加,所得的数值。
(2)构成原子的微粒间的两个关系①质量关系:质量数(A )=质子数(Z )+中子数(N )②电性关系:质子数=核外电子数=核电荷数=原子序数。
3.原子的表示方法如作为相对原子质量标准的12 6C 表示质子数为6,质量数为12的碳原子。
[特别提醒]并不是所有原子都是由质子、中子和电子构成的,如11H 原子核内不含中子。
1.质量数相同的原子一定属于同种元素吗?提示:不一定属于同种元素;质子数相同的原子属于同一种元素,而质量数相同的原子不一定属于同种元素。
如14 6C 和147N 。
2.X 元素原子的质量数为m ,核内中子数为n ,则a g X 含有的电子的物质的量是多少?提示:am (m -n )mol 。
1.粒子符号(A Z X ±b n ±m )中各数字的含义2.数量关系(1)原子中:质子数=核电荷数=原子序数=核外电子数 (2)阳离子中:质子数=阳离子的核外电子数+阳离子所带电荷数 (3)阴离子中:质子数=阴离子的核外电子数-阴离子所带电荷数1.235 92U是核电站的主要燃料,下列关于235 92U的说法正确的是()A.质子数为235B.中子数为92C.电子数为143 D.质量数为235U的质量数是235,质子数等于电子数等于92,中子数=质量数-质解析:选D23592子数=235-92=143。
高一化学人教版同步培优专题讲义核素[明确学习目标] 1.了解核素、同位素的概念。
2.知道A Z X的含义。
学生自主学习核素1.概念01质子和一定数目□02中子的一种原子。
具有一定数目□2.核素的表示方法即:A Z X表示□05质量数是A,□06质子数是Z的X原子。
3.实例——氢的三种核素同位素 1.概念质子数相同而□01中子数不同的同一元素的不同原子互称为□02同位素,即同一元素的不同核素互称为同位素。
2.特点——两同两不同(1)两同:□03质子数相同,元素相同。
(2)两不同:□04中子数不同,□05质量数不同。
3.性质(1)同位素在周期表里占据□06同一位置。
(2)同位素的化学性质几乎完全相同。
(3)天然存在的同位素,相互间保持一定的比率。
4.用途□0714 6C 在考古工作中用于测定文物的年代;235 92U 用于制造原子弹、核发电;□0821H 、31H 用于制造氢弹等。
原子的相对原子质量与元素的相对原子质量1.原子的相对原子质量=一个该原子的质量一个12C 原子质量×112。
2.元素的相对原子质量,是按照该元素各种核素所占的一定百分比计算出的平均值。
1.质量数相同的原子一定属于同种元素吗?提示:不一定属于同种元素。
质子数相同的原子属于同一种元素,而质量数相同的原子不一定属于同种元素,如14 6C 和147N 。
2.X 元素原子的质量数为m ,核内中子数为n ,则a g X 含有的电子的物质的量是多少?提示:am (m -n ) mol 。
3.18O 2和16O 2互为同位素吗?提示:不是,同位素指的是质子数相同而中子数不同的同一元素的不同原子,这两种微粒属于分子,是同一种物质。
4.互为同位素的不同核素的物理性质不同,而它们的化学性质为什么几乎完全相同?提示:互为同位素的不同核素其原子的电子层结构相同,故它们的化学性质几乎完全相同。
课堂互动探究知识点一 构成原子的粒子1已知氮原子的质量数为14,在NH3D+中,电子数、质子数、中子数之比为()A.10∶7∶11 B.11∶11∶8C.11∶10∶8 D.10∶11∶8[批注点拨][解析]氮原子的质子数为7,已知其质量数为14,则其中子数为7,NH3D+的质子数为7+4=11,电子数为11-1=10,H中不含中子,D中含1个中子,故NH3D+的中子数为7+1=8,则电子数、质子数、中子数之比为10∶11∶8,故D正确。
[答案] D[练1]A Z X与A+1Z X+两种微粒,下列叙述正确的是()A.一定都是由质子、中子、电子构成的B.化学性质几乎完全相同C.质子数一定相同,质量数和中子数一定不相同D.核电荷数和核外电子数一定相同答案 C解析 若A Z X为11H,原子核内则没有中子,故A错误;A Z X与A+1Z X+核外电子数不同、化学性质不同,故B错误;A Z X的质子数为Z,质量数为A,中子数为A-Z,而A+1Z X+的质子数为Z,质量数为A+1,中子数为A+1-Z,故C正确;A Z X的核外电子数为Z,A+1Z X+的核外电子数为Z-1,故D错误。
[练2]已知R2-的核内有n个中子,R原子的质量数为M,则m g R2-里含有电子的物质的量为()A.m(M-n)Mmol B.M-n-2MmmolC.m(M-n-2)Mmol D.m(M-n+2)Mmol答案 D解析 R2-含有电子数为(M-n+2)个,m g R2-的物质的量为mMmol,则m g R2-含有电子的物质的量为m(M-n+2)Mmol。
方法规律 质量数的应用(1)在计算时可以用质量数代替原子的相对原子质量,如11H2的相对分子质量为2,21 H2的相对分子质量为4。
(2)根据中子数+质子数=质量数,利用质量数计算原子的中子数或质子数。
知识点二 元素、核素、同位素、同素异形体的区别和联系1.区别2.联系2重水(D2O)是重要的核工业原料,下列说法错误的是()A.氘(D)原子核外有1个电子B.1H与D互为同位素C.H2O与D2O互为同素异形体D.1H182O与D162O的相对分子质量相同[批注点拨][解析]同素异形体是指同种元素形成的性质不同的单质,H2O和D2O为化合物,故C错误。
[答案] C[练3]下列说法错误的是()A.11H、21H、H+和H2是氢元素的四种不同粒子B.4020Ca和4220Ca、石墨和金刚石均为同素异形体C.11H和21H是不同的核素D.12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同答案 B解析 元素的存在形式有游离态和化合态两种,A项中的四种微粒是氢元素的四种不同粒子;12C和14C由于其质子数均为6,而中子数分别为6和8,故它们互为同位素,同理,4020Ca和4220Ca互为同位素其物理性质不同但化学性质几乎完全相同;金刚石与石墨是由碳元素组成的不同的单质,它们互为同素异形体。
[练4]下列各组微粒互为同位素的是()①16O2和18O2②H2和D2③16 8O和18 8O④1H182O和2H162O⑤3517Cl和3717ClA.①②B.③⑤C.④D.②③答案 B解析 同位素是原子和原子之间的互称,①②④均不是原子,只有③⑤是原子,而且质子数相同,中子数不同,符合同位素的定义。
方法规律 (1)同位素中“同位”指几种核素的质子数相同,在元素周期表中占据同一个位置。
同位素属于同一种元素,但不是同种原子。
例如:11H、21H、31H是三种不同的原子,但都是氢元素。
(2)同种元素可以有多种不同的核素,所以元素的种类数远小于原子的种类数。
本课归纳总结1.元素种类由质子数决定,核素种类由质子数和中子数共同决定。
2.具有一定数目质子和一定数目中子的一种原子叫做核素。
质子数相同而中子数不同的同一元素的不同原子,互称同位素,同位素间的化学性质基本相同,物理性质不同。
3.元素周期表中的相对原子质量是指元素的平均相对原子质量,而不是该元素的某种核素的相对原子质量。
学习效果检测1.下表符号中“2”的含义正确的一组是()答案 B解析 21H中2表示质量数,2He中2表示质子数,Cl2中2表示含有2个氯原子,Ca2+中的2表示带2个正电荷。
2.诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。
下列关于错误错误!!Pt的说法正确的是()错误!!Pt和错误A.202 78Pt和198 78Pt的质子数相同,互称为同位素B.202 78Pt和198 78Pt的中子数相同,互称为同位素C.202 78Pt和198 78Pt的核外电子数相同,是同一种核素D.202 78Pt和198 78Pt的质量数不同,不能互称为同位素答案 A解析 根据同位素定义“质子数相同,中子数不同的核素互为同位素”判断,A项Pt和198 78Pt是Pt的两种核素,C项错误。
正确,B、D两项错误;202783.下列描述中,不正确的是()A.14N与15N具有相同的质子数B.18O和17O具有相同的电子数C.18O和19F具有相同的中子数D.12C与13C具有相同的质量数答案 D解析 14N与15N的质子数都是7;18O和17O的电子数都是8;18O和19F的中子数都是10;12C与13C的质量数分别为12和13。
4.有六种微粒,它们分别是4019M、4020N、4018X、4019Q+、4020Y2+、4017Z-,它们所属元素的种类为()A.3种B.4种C.5种D.6种答案 B解析 质子数决定元素的种类,4019M、4019Q+是K元素形成的微粒,4020N、4020Y2+表示Ca元素形成的微粒;4018X表示Ar原子,4017Z-表示Cl-。
5.简单原子的原子结构可用下图形象地表示:其中“”表示质子或电子,“”表示中子,则下列有关①②③的叙述正确的是()A.①②③互为同素异形体B.①②③互为同位素C.①②③是三种化学性质不同的粒子D.①②③具有相同的质量数答案 B解析 由题图可知三个原子的质子数、核外电子数相同,而中子数不同,所以三者互为同位素,同位素的化学性质相同。
6.我国著名化学家张青莲教授测定的锑元素的相对原子质量为121.760,被国际原子量委员会采用为国际新标准。
已知锑有两种以上天然同位素,则121.760是()A.按照锑的各种天然同位素的质量数与这些同位素所占的原子百分比计算出来的平均值B.按照锑的各种天然同位素的相对原子质量与这些同位素所占的原子百分比计算出来的平均值C.一个锑原子的质量与12C原子质量的112的比值D.锑元素的质量与12C原子质量的112的比值答案 B解析 元素的相对原子质量是根据各种天然同位素的相对原子质量和这些同位素所占的原子百分比计算出来的平均值。
7.用A.质子数 B.中子数 C.核外电子数 D.最外层电子数 E.电子层数,填写下列空格(用字母代号填写):(1)同位素种类由________决定。
(2)元素种类由________决定。
(3)某元素有无同位素由________决定。
(4)核素相对原子质量由________决定。
(5)主族元素的化学性质主要由________决定。
(6)核电荷数由________决定。
(7)碱金属原子失电子能力相对强弱由________决定。
(8)原子得失电子能力相对强弱由________决定。
答案(1)A、B(2)A(3)B(4)A、B(5)D(6)A(7)E(8)D、E解析 (1)同位素种类的确定,既要确定元素(质子数),又要确定核素(中子数)。
(2)确定元素只需确定质子数。
(3)某元素有无同位素,已经确定了元素,只要由中子数确定同位素即可。
注意跟(1)的区别。
(4)核素的相对原子质量的近似整数等于该核素的质量数,则由质子数和中子数决定。
(5)主族元素最外层电子数决定元素原子得失电子的能力,即化学性质。
(6)核电荷数=质子数。
(7)碱金属元素原子电子层数越多,失电子能力越强,故决定碱金属原子失电子能力相对强弱的因素是电子层数。
(8)电子层数和最外层电子数决定原子得失电子的能力。