《酶工程实验》教案
- 格式:doc
- 大小:797.00 KB
- 文档页数:15
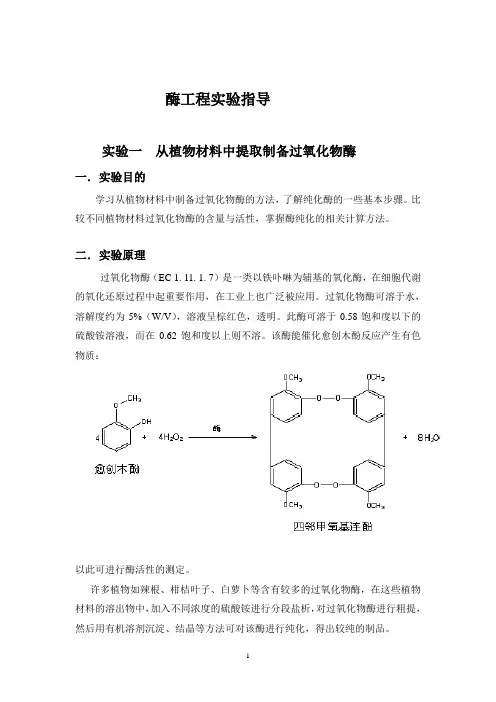
酶工程实验指导实验一从植物材料中提取制备过氧化物酶一.实验目的学习从植物材料中制备过氧化物酶的方法,了解纯化酶的一些基本步骤。
比较不同植物材料过氧化物酶的含量与活性,掌握酶纯化的相关计算方法。
二.实验原理过氧化物酶(EC 1. 11. 1. 7)是一类以铁卟啉为辅基的氧化酶,在细胞代谢的氧化还原过程中起重要作用,在工业上也广泛被应用。
过氧化物酶可溶于水,溶解度约为5%(W/V),溶液呈棕红色,透明。
此酶可溶于0.58饱和度以下的硫酸铵溶液,而在0.62饱和度以上则不溶。
该酶能催化愈创木酚反应产生有色物质:以此可进行酶活性的测定。
许多植物如辣根、柑桔叶子、白萝卜等含有较多的过氧化物酶,在这些植物材料的溶出物中,加入不同浓度的硫酸铵进行分段盐析,对过氧化物酶进行粗提,然后用有机溶剂沉淀、结晶等方法可对该酶进行纯化,得出较纯的制品。
三.主要仪器与试剂仪器:组织捣碎机,冰箱,真空冷冻干燥机,离心机,紫外-可见分光光度计等。
试剂:愈创木酚,丙酮,过氧化氢,硫酸铵等。
四.实验步骤(尽量在冰浴中进行)鲜植物样品约70克,剪碎或捣烂,加少许水研磨成浆(可用捣碎机),转移到500ml的烧杯中,加水至约200ml,于冰箱中浸提约2小时(中间多次搅动)。
多层纱布挤压过滤后离心(4000rpm),10ml上清液用来测酶活力,其余上清液按226克/升加硫酸铵盐析,冰箱中静置1小时以上,离心(4000rpm)去沉淀。
上清液再按258克/升加硫酸铵盐析,冰箱中静置4小时以上。
离心收集沉淀,用水溶解至约10ml,用水透析去盐,离心去沉淀,取部分酶液稀释后测酶活。
其余酶液用作精制样品。
在搅动下沿着杯壁加入一倍体积预冷(-15℃)的丙酮于酶液中,混匀,静置10分钟,低温离心(8000rpm, 4℃) 去沉淀。
按上清液与丙酮之比为1比0.8再次加入预冷丙酮,静置10分钟后离心(8000rpm, 4℃) 收集沉淀,溶于少量水中,透析去丙酮。

实验二大肠杆菌菌体总蛋白的超声破碎抽提与蛋白质的凝胶过滤纯化[实验原理]利用溶菌酶、反复冻融或超声波破碎的方法将培养的细菌的细胞壁破碎后,可使那些可溶性的蛋白释放出来,再利用硫酸铵沉淀、蛋白质层析技术和制备电泳等方法能够将蛋白分离纯化出来,供进一步的研究使用。
超声破碎时要产生大量的热,会引起蛋白的变性。
为了避免产生高温,超声时一般使用间隔的脉冲处理,而且应在冰浴中进行。
凝胶是一种多孔性的不带表面电荷的物质,当带有多种成分的样品溶液在凝胶内运动时,由于它们的分子量不同而表现出速度的快慢,在缓冲液洗脱时,分子量大的物质不能进入凝胶孔内,而在凝胶间几乎是垂直的向下运动,而分子量小的物质则进入凝胶孔内进行“绕道”运行,这样就可以按分子量的大小,先后流出凝胶柱,达到分离的目的[仪器、试剂和材料]1、大肠杆菌2、细菌蛋白抽提液(100mmol/L NaCl,10mmol/L EDTA,pH 8.0)3、恒温摇床4、小型高速离心机5、超声波组织细胞破碎仪6、玻璃试管,三角瓶7、1.5mL 和5mL 塑料离心管8、“枪”,枪头[实验操作]1、大肠杆菌的培养:从过夜培养的大肠杆菌LB琼脂平板上挑取2-3个菌落,接种5mL LB的玻璃试管中,放恒温摇床中,37℃培养过夜。
2、超声破碎抽提:将培养的大肠杆菌培养物转移到数只5mL离心管中,8000转/分离心5分钟,倾去上清液后,在沉淀上面再加培养物,继续离心,将所有的培养物都收集在一起。
每管中加入1.5mL的细菌蛋白抽提液(100mmol/L NaCl,10mmol/L EDTA,pH 8.0),用枪吹打,使沉淀悬浮。
将离心管放在小试管架上,将超声波破碎仪的金属头插到离心管中,调整好试管的位置后关上超声破碎仪的门,打开仪器的电源,对每只离心管中的菌体进行超声破碎。
条件:功率80瓦,工作2秒,间隔2秒,每一次处理5个循环。
4次处理后,8000转/分离心5分钟。
取出离心管,在显微镜下观察菌体的破碎情况。

吉林农业大学酶工程实习设计方案题目名称:纤维素酶和果胶酶的固定化及性质研究学生姓名:院系:生命科学学院专业班级:指导教师:职称:讲师2014年6月12日1前言 (1)1.1纤维素 (1)1.2纤维素酶 (1)1.3酶的固定化技术 (1)1.4固定化的方法 (2)1.4.1吸附法 (2)1.4.2 包埋法 (2)1.4.3 共价结合法 (3)1.4.4 交联法 (3)1.5 实验目的及意义 (3)2 仪器与试剂 (4)2.1 试剂配制 (4)2.1.1 缓冲溶液的配制 (4)2.1.2 DNS显色剂 (4)2.1.3 标准葡萄糖溶液的配制(1mg/ml) (4)2.1.4 海藻酸钠溶液的配制 (4)2.1.5 1.5%壳聚糖 (4)2.1.6酶液制备 (4)2.2 仪器 (4)3 方法与步骤 (5)3.1葡萄糖标准曲线的绘制 (5)3.2游离纤维素酶活力测定 (5)3.3 固定化影响因素 (5)3.3.1固定化时间对酶固定化的影响 (5)3.3.2 pH对酶固定化的影响 (6)3.3.3固定化时间对酶固定化影响 (6)3.4 不同条件对酶反应的影响 (7)3.4.1 温度对游离酶反应的影响 (7)3.4.2 pH对游离酶反应的影响 (7)3.4.3 底物浓度对游离酶反应的影响 (8)3.4.4 温度对固定化酶反应的影响 (8)3.4.5 pH对固定化酶活力的影响 (9)3.4.7 底物浓度对固定化酶活力的影响 (10)3.5 交联固定纤维素酶 (10)3.5.1戊二醛浓度对酶固定化的影响 (10)3.5.2交联时间对固定化的影响 (11)3.6壳聚糖吸附交联法固定化酶 (11)参考文献 (12)1前言1.1纤维素纤维素(C6H10O5)n。
一种天然有机高分子化合物。
由许多个D(+)-葡萄糖通过β-1, 4糖甙键结合成的多糖,是构成植物细胞壁的主要成分。
纤维素和淀粉一样无还原性,不溶于水和一般有机溶剂,但溶于氢氧化铜的氨溶液、浓的氯化锌溶液、硫氰酸钙和某些盐类的饱和溶液。

酶工程实验指导西南农业大学农学与生物科技学院2009年3月实验一产蛋白酶菌株的分离一、实验目的学习胞外生产微生物菌种的分离选择,熟悉分离菌种的基本操作。
二、实验原理工业上常用的生产酶的微生物有许多,重要的有枯草杆菌和真菌中的曲霉等等,它们都能产生耐热的芽孢或分生孢子,分离这类菌种时可采取先进行一定的热处理杀灭其它营养细胞,提高该菌株的相对数目。
根据胞外酶能分泌到培养基的特点,采用一定的方法在培养基上形成单菌落分泌的酶形成的“水解透明圈”,可对产酶的微生物的产酶能力(活力)进行初步估计、分离高产酶的微生物。
三、试剂、仪器高压灭菌锅,天平,无菌超净工作台,培养皿(8套/组)、试管(2支/组)、三角瓶、烧杯、酵母膏,蛋白胨,NaCl、琼脂粉,奶粉三、操作步骤1、带菌土壤的热处理称取1g带菌土壤湿润后放入80℃烘箱处理30min。
2、分离选择培养基的配制,各组按下列比例配制120ml培养基:奶粉2g ,自来水50ml,装入50ml三角瓶琼脂1.8g ,NaCl 0.5g,自来水70ml,装入100ml三角瓶自来水50ml,装入50ml三角瓶取50ml烧杯一个,放入5支带帽5ml离心管,灭菌备用。
分别封口,常规灭菌(121℃、20min),灭菌后待冷却至不太烫手时混合上述液体,按无菌操作要领迅速倒平板8个,其中4个加有0.2ml不同稀释倍数(操作5)的样品液(菌悬液),迅速混合冷却形成平板,余4个平板冷却后用于涂布筛选。
3、稀释制备菌液,取5支灭菌带帽5ml离心管,各加入无菌水3.6ml备用;将热处理过的土壤放入无菌50ml烧杯中,加入无菌水10ml,搅拌后静置片刻,上层液体为微生物悬液,按下法稀释微生物悬液:在第一支试管中加入0.4ml微生物悬液,混合均匀后再取0.4ml到第二支试管中混合,从第二支试管中再取0.4ml到第三支试管中,以此类推。
4、斜面培养基配制:配制100ml LB培养基,加入1.5g琼脂粉、蛋白胨1.0g、酵母膏1.0g、NaCl、1.0g加水到100ml,调节pH=7,加热融化后,各组倒斜面培养基2 支,灭菌备用。
长沙医学院教案课程名称酶工程授课题目(章节或主题)第一章绪论授课教师罗琼所属系(部)基础医学系所属教研室生物技术职称助教授课时间年月日第周星期第节第次课授课时数3学时授课班级生物技术专业(本科√专科□)级教学课型理论课√实验课□见习课□习题课□讨论课□其它□教材名称、作者、出版社及出版时间酶工程、郭勇主编、科学出版社、2009.8教学目的要求:1.酶工程的内容、任务、特点。
2. 酶工程的发展概况。
3.本课程的要求。
重点与难点:重点:酶工程的内容难点:酶工程的发展概况教学方法(请打√选择):讲授法√讨论法□启发式□自学辅导法√练习法(习题或操作) 读书指导法√PBL(以问题为中心的教学法)□其他□教学手段(请打√选择):板书√实物□标本□挂图□模型□投影√幻灯□录像√CAI(计算机辅助教学)□教学过程设计和教学内容:第一节酶的定义此列为提示栏(包括重点、难点、教学方法、时间分配一:酶的定义(一)定义:酶是具有生物催化功能的生物大分子,按照分子中起催化作用的主要组分的不同,自然界中天然存在的酶可以分为蛋白类酶和核酸类酶两大类别。
二:酶工程的相关概念(一)酶工程:酶的生产、改性与应用的技术过程称为酶工程。
(二)酶的生产(三)酶的改性(四)酶的应用第二节酶的发展历史一:酶的发展历史(一)人们对酶的认识起源于生产与生活实践。
1.夏禹时代,人们掌握了酿酒技术。
2.公元前12世纪周朝,人们酿酒,制作饴糖和酱。
3.春秋战国时期已知用麴(曲)治疗消化不良的疾病。
(二)西方国家19世纪对酿酒发酵过程进行了大量研究。
教学手段、更新教学内容、教书育人等)通过复习生化的酶学内容引进新课程(三)1896年,日本的高峰让吉首先从米曲霉中制得高峰淀粉酶,用作消化剂,开创了有目的的进行酶生产和应用的先例。
(四)现已鉴定出4000多种酶,数百种酶已得到结晶,而且每年都有新酶被发现。
第三节酶的分类与命名一:酶的分类与命名(一)蛋白类酶的分类与命名1.1961年国际酶学委员会(Enzyme Committee, EC)根据酶所催化的反应类型和机理,把酶分成6大类:氧化还原酶、转移酶、水解酶、裂合酶、异构酶、合成酶。

实验一酶促反应中初速度时间范围测定一、实验目的1.了解酶促反应中初速度时间范围测定的基本原理;2.掌握酶促反应中初速度时间范围的测定方法。
二、实验原理酸性磷酸酯酶(acid phosphatase, EC 3.1.3.2)广泛分布于动植物体中,尤其是植物的种子、动物肝脏和人体的前列腺中。
它对生物体内核苷酸、磷蛋白和磷脂的代谢起着重要作用。
酸性磷酸酯酶能专一性水解磷酸单酯键。
以人工合成的对硝基苯磷酸酯(4-nitrophenyl phosphate,NPP)作底物,水解产生对硝基苯酚和磷酸。
在碱性溶液中,对硝基酚的盐离子于405nm处光吸收强烈,而底物没有这种特性。
利用产物的这种特性,可以定量的测定产物的生成量,从而求得酶的活力单位。
即通过测定单位时间内405nm处光吸收值的变化来确定酸性磷酸酯酶的活性。
酸性磷酸酯酶的一个活力单位是指在酶反应的最适条件下,每分钟生成1μmol产物所需的酶量。
要进行酶活力测定,首先要确定酶反应时间。
而酶的反应时间应该在初速度时间范围内选择。
可以通过进程曲线的制作来求出酶的初速度时间范围。
进程曲线的制作是指在酶反应的最适条件下,采用每隔一定时间测定产物生成量,以酶反应时间为横坐标,产物生成量为纵坐标绘制而成。
从进程曲线可知,在曲线起始的一段时间内为直线,其斜率代表初速度。
随着反应时间的延长,曲线趋于平坦,斜率变小,反应速度下降。
要真实反映出酶活力大小,就应在初速度时间内测定。
三、实验试剂与器材1.试剂(1)酸性磷酸酯酶原液(从绿豆芽中提取)(2)酸性磷酸酯酶液(通过原酶液稀释得到)取原酶液,用0.05mol/L、pH5.0柠檬酸盐缓冲液稀释,使进程曲线中第11号管吸光度A在0.6~0.7之间。
405(3)1.2mmol/L对硝基苯磷酸酯精确称取NPP0.4454g,加缓冲液定容至100mL。
(4)0.3mol/LNaOH溶液2.器材恒温水浴槽,可见分光光度计,试管,刻度吸管,离心机。

实验一过氧化氢酶米氏常数的测定一、目的了解米氏常数的意义,测定过氧化氢酶的米氏常数。
二、实验原理H2O2被过氧化氢酶分解出H2O和O2,未分解的H2O2用KMNO4在酸性环境中滴定,根据反应前后H2O2的浓度差可求出反应速度。
本实验以马铃薯提供过氧化氢酶,以1/ν~1/[S]作图求Km三、实验器材1.锥形瓶100~150ml(×6)。
2.吸管1.0ml(×2)、0.5ml(×2)、2.0ml(×2)、5ml(×2)、10.0ml(×1)。
3.温度计(0~100℃)。
4.微量滴定管5ml(×1)。
5.容量瓶1000ml(×1)。
四、实验试剂1、0.02mol/L磷酸缓冲液(Ph7.0)取磷酸二氢钾 0.68g,加0.1mol/L氢氧化钠溶液 29.1ml,用水稀释至100ml,即得。
2、酶液:称取马铃薯5g,加上述缓冲液10ml,匀浆,过滤。
3、0.02mol/L KMnO4:称取KMnO4(AR)3.2g,加蒸馏水1000ml,煮沸15min,2d后过滤,棕色瓶保存。
4、0.004mol/L KMnO4:准确称取恒重草酸钠0.2g,加250ml冷沸水及10ml浓硫酸,搅拌溶解,用0.02ml/L的KMnO4滴定至微红色,水浴,加热至65℃,继续滴定至溶液微红色并30s不褪,算出KMnO4的准确浓度稀释成0.004mol/L即可。
5、0.05 mol/L H2O2:取30% H2O223ml加入1000ml容量瓶中,加蒸馏水至刻度(约0.2mol/L),用标准KMnO4(0.004mol/L)标定其准确浓度,稀释成0.05mol/L(标定前稀释4倍,取2.0ml,加25% H2SO42.0ml,用0.004mol/LKMnO4滴定至微红色)。
6、25% H2SO4五、操作取锥形瓶6只,按下表顺序加入试剂:表一过氧化氢酶米氏常数的测定管号试剂0123450.05mol/L H2O2/ml蒸馏水/ml酶液/ml9.50.51.008.500.51.258.250.51.677.830.52.57.00.55.004.500.5先加好0.05mol/L H2O2及蒸馏水,加酶液后立即混合,依次记录各瓶的起始反应时间。

酶工程实验方案一、实验目的通过本实验,学生将学会利用酶工程实验技术,熟悉酶的生产、纯化和应用过程,培养学生实验操作技能和科学研究能力,为学生今后的科研工作打下良好的基础。
二、实验原理酶工程是利用生物工程学原理和技术手段,对酶进行筛选、改造和工程应用。
酶在生产中扮演着极其重要的角色,它广泛应用于食品、医药、环保、能源、材料等领域。
酶工程实验的关键是酶的生产和纯化技术。
典型的酶工程包括:酶源的筛选、酶基因的克隆与表达、酶的纯化和酶的应用等。
三、实验内容本实验将包括以下内容:1. 酶源的筛选:选择一种具有较高酶活性的微生物菌株,进行培养、鉴定,筛选出所需酶。
2. 酶基因的克隆与表达:通过PCR技术扩增酶基因,将其克隆至适当的表达载体中,然后将其转化至表达宿主中,表达目的蛋白。
3. 酶的纯化:采用离心、柱层析、过滤等方法对表达蛋白进行酶的分离和纯化。
4. 酶的应用:将纯化的酶用于特定的生产或研究中,评价酶的性能。
四、实验步骤1. 酶源的筛选(1)选择合适的微生物菌株,进行培养并获得菌液样品。
(2)采集菌液样品,进行酶活性测试,筛选出具有较高酶活性的菌株。
2. 酶基因的克隆与表达(1)利用PCR技术扩增酶基因。
(2)将扩增出的酶基因克隆至表达载体中。
(3)转化表达载体至适当的表达宿主中,进行表达。
3. 酶的纯化(1)收集表达蛋白,进行细胞破碎,得到目的蛋白混合物。
(2)通过离心、柱层析、过滤等方法对蛋白混合物进行纯化。
4. 酶的应用(1)评价纯化酶的性能。
(2)将纯化的酶用于特定的生产或研究中。
五、实验材料和仪器1. 微生物菌株:待定2. 实验宿主:大肠杆菌等3. 载体:pET等4. 酶活性测试试剂盒5. PCR试剂盒6. 离心机、柱层析仪、过滤器等实验仪器七、实验结果1. 酶源的筛选结果:取得具有较高酶活性的微生物菌株。
2. 酶基因的克隆与表达结果:成功将酶基因克隆至表达载体中,并通过转化实现表达。
3. 酶的纯化结果:得到较纯的酶样品。
![[工学]《酶工程》教案](https://uimg.taocdn.com/9fe9e605a31614791711cc7931b765ce05087abe.webp)
《酶工程》教案安排:本课总学时为48,其中理论课40,实验课8,周学时为3学时。
要求:要求同学们课前预习教材,带着问题听课,这样学习效果好;学生上课作笔记,动动脑;学生课后复习和整理笔记,教师作课后小结和布置作业,达到教学相长的目的。
绪论1教学目标:使学生掌握酶、酶工程的概念,酶的化学性质与催化特性,了解酶的分类与命、酶活力测定、酶的生产方法。
2教学内容:主要讲酶和酶工程的基本概念与发展史、影响酶催化作用的因素、酶的分类与命名、酶的化学性质与催化特性、酶活力测定、酶的生产方法。
3重点和难点:酶、酶工程、酶活力有关的概念;酶的化学性质与催化特性、酶活力测定。
4教学方法:采用讲授式、启发式、图示法、问答式相结合的教学方法。
5板书设计:从上至下,从左至右;大标题始终留在黑板的左边;书写规范。
6学时分配:理论3学时,实验2学时。
7教学进程:第一节酶和酶工程的基本概念与发展史1酶的基本概念酶是生物体内进行新陈代谢不可缺少的受多种因素调节控制的具有催化能力的生物催化剂。
按化学组成分:蛋白类酶(Enzyme proteins)和核酸类酶(Ribozyme RNAs)。
a蛋白类酶(Enzyme proteins)酶是由生物体产生的具有催化活性的蛋白质。
b核酸类酶(Ribozyme RNAs)本身就是一段RNA,不需要额外的蛋白酶就可以对自身进行剪切。
提问:酶一定是蛋白质吗?2酶的发展史1.2.1酶在中国的发展史人们对酶的认识起源于生产与生活实践。
夏禹时代,人们掌握了酿酒技术。
公元前12世纪周朝,人们酿酒,制作饴糖和酱。
春秋战国时期已知用麴(曲)治疗消化不良的疾病。
酶者,酒母也。
1.2.2酶在西方的发展史1878年, 给酶一个统一的名词,叫Enzyme,这个字来自希腊文,其意思“在酵母中”。
1896年,日本的高峰让吉首先从米曲霉中制得高峰淀粉酶,用作消化剂,开创了有目的的进行酶生产和应用的先例。
西方国家19世纪对酿酒发酵过程进行了大量研究。
《酶工程》课程实验教学大纲一、实验课程基本情况二、实验课程简介《酶工程》是制药工程的主要内容之一,是现代酶学和生物工程学相互结合而发展起来的一门新的技术学科。
它将酶学、微生物学的基本原理与化工、发酵等工程技术有机结合起来,并随着酶学研究的迅速发展,特别是酶的广泛应用而在国民生产生活中日益发挥着越来越重要的作用。
酶工程实验课是制药工程等本科实验教学的一个重要组成部分,通过实验教学可以加强学生对酶工程基本知识和基本理论的理解,掌握现代酶学与相关技术的有关的基本的实验原理与技能。
在实验过程中要求学生自己动手,分析思考并完成实验报告。
酶工程实验性质有基础性、综合性、设计(创新)性三层次。
三、实验教学目的和基本要求本实验课程主要根据酶工程的三大块内容即酶的生产、酶的改性与酶的应用来设计安排实验,通过这些实验内容,使学生深入理解酶工程课程的基本知识;巩固和加深所学的基本理论;掌握酶工程中基本的操作技能。
同时,通过实验培养学生独立观察、思考和分析问题、解决问题和提出问题的能力,养成实事求是、严肃认真的科学态度,以及敢于创新的开拓精神;并在实验中进一步提高学生的科学素养。
四、实验内容与学时分配课堂教学与实验教学结合。
课堂教学合班上课,实验课分小班进行,每4人一组。
实验设计尽量从实际生产中提出问题,增加学生对实际动手操作的兴趣,安排每个人动手。
通过实际操作巩固掌握教材相关理论知识。
六、考核方法实验成绩占课程总成绩的20%。
主要考察学生每次实验的表现:动手操作能力,观察能力,解决问题的能力等。
其次检查实验报告的书写情况是否认真准确。
七、实验内容安排【实验一】淀粉酶动力学分析(4学时)一、实验目的:了解并掌握米氏常数的意义和测定方法。
二、实验要求:掌握米氏常数的意义和测定方法,掌握酶反应的动力学分析方法。
三、实验步骤:1、酶反应:取13支干燥的18×180 mm试管,按下表编号,实验组做两份平行实验,加入pH5.0的淀粉溶液和α-淀粉酶溶液,50℃反应10分钟2、酶反应速度测定:酶反应液稀释一定倍数(约5倍,取1 mL反应液,加4 mL蒸馏水,混匀),取1 mL稀释液加DNS试剂,于沸水浴中加热2 min进行显色,取出后在盛有冷水的500 mL烧杯中冷却(注意换冷水),各加入蒸馏水9.0 mL,摇匀,以空白管为调零点,在540 nm波长测定吸光度值,从标准曲线查出葡萄糖的含量,算出酶反应速度(mol/(L·min))。

酶工程教学大纲
一、引言
A. 背景介绍
B. 目的和目标
C. 教学方法和评估方式
二、酶工程概述
A. 酶的定义与特点
B. 酶工程的定义和作用
C. 酶工程的发展历程
三、酶的结构与功能
A. 酶的化学结构
1. 蛋白质组成
2. 酶的活性中心
3. 酶的辅助分子
B. 酶的功能与作用机制
1. 酶的催化作用原理
2. 酶的底物特异性和催化效率
3. 酶的调控机制
四、酶的分离与纯化
A. 酶的源和提取方法
1. 酶的细胞来源
2. 细胞破碎与酶的提取
B. 酶的分离与纯化方法
1. 萃取分离方法
2. 柱层析方法
3. 电泳分离方法
五、酶的性质和测定
A. 酶的催化速度和底物浓度关系。
一、前言【教学目标】1. 了解酶工程的定义、发展历程及应用领域。
2. 掌握酶的特性,包括高效性、专一性和易受环境影响的特性。
【教学内容】1. 酶工程的定义和发展历程。
2. 酶的应用领域,如食品工业、医药工业、环境保护等。
3. 酶的特性及其在催化反应中的优势。
【教学方法】采用讲解、案例分析、小组讨论等方式进行教学。
【教学时长】45分钟二、酶的性质与酶活性【教学目标】1. 掌握酶的化学本质和结构特点。
2. 了解酶活性的影响因素,如温度、pH、酶浓度等。
【教学内容】1. 酶的化学本质和结构特点。
2. 酶活性的定义及其单位。
3. 温度对酶活性的影响及最适温度的确定。
4. pH对酶活性的影响及最适pH的确定。
5. 酶浓度对酶活性的影响。
【教学方法】采用讲解、实验演示、小组讨论等方式进行教学。
【教学时长】90分钟三、酶的分离与纯化【教学目标】1. 掌握酶的分离与纯化的方法和技术。
2. 了解酶的纯化程度及其在催化反应中的重要性。
【教学内容】1. 酶的分离与纯化的方法,如凝胶过滤、离子交换、亲和层析等。
2. 酶的纯化程度及其判断方法。
3. 酶的纯化在催化反应中的重要性。
【教学方法】采用讲解、实验演示、小组讨论等方式进行教学。
【教学时长】90分钟四、酶的固定化技术【教学目标】1. 掌握酶的固定化技术及其分类。
2. 了解固定化酶的优势和局限性。
【教学内容】1. 酶的固定化技术,如物理吸附、共价结合、包埋等。
2. 固定化酶的优势,如易于回收、可重复使用等。
3. 固定化酶的局限性,如酶活性降低、传质效率降低等。
【教学方法】采用讲解、实验演示、小组讨论等方式进行教学。
【教学时长】90分钟五、酶工程的应用【教学目标】1. 掌握酶工程在各个领域的应用。
2. 了解酶工程的发展趋势和前景。
【教学内容】1. 酶工程在食品工业中的应用,如面包制作、乳品制作等。
2. 酶工程在医药工业中的应用,如药物合成、基因工程等。
3. 酶工程在环境保护中的应用,如废水处理、生物降解等。
酶工程课程设计前言酶工程是生物工程领域的一个重要分支,在工业上广泛应用。
本次课程设计旨在让学生们深入了解酶工程的基本概念、原理和应用,通过实践设计一个能够实现特定反应的酶催化反应器。
本文将介绍课程设计的具体内容和步骤。
设计目标本次课程设计的主要目标是:1.了解酶催化反应的基本原理和反应机理。
2.熟悉常见的酶工程应用场景,如食品加工、药物合成等。
3.设计并搭建一个可以实现某一种特定酶催化反应的反应器,并调试反应条件。
设计步骤步骤一:确定酶催化反应类型首先,需要选定一种酶催化反应类型作为课程设计的基础。
可以从常见的应用场景中选取,例如乳糖酶的水解反应、蛋白酶的降解反应等。
在确定反应类型后,需要学生对该反应类型进行深入了解,包括反应机理、反应条件等。
步骤二:筛选酶种和反应底物根据选定的反应类型,需要筛选适合的酶种和反应底物。
在筛选酶种时,需要考虑酶的活性和稳定性,并优先选择商业化生产的酶制剂。
在筛选反应底物时,需要考虑其溶解度、反应条件等因素。
步骤三:确定反应器类型和设计参数根据选定的酶种和反应底物,需要设计一个能够实现该反应的反应器。
在设计反应器时,需要考虑反应器类型、反应器规模、反应温度、反应时间等因素。
不同反应器类型的优缺点和适用场景也需要学生进行深入了解。
步骤四:搭建反应器并调试反应条件在确定反应器类型和设计参数后,需要学生们搭建反应器并进行调试。
在调试过程中,需要优化反应条件,使反应达到最佳效果。
另外,也需要考虑反应器的安全性和稳定性,以避免意外情况发生。
步骤五:实验报告撰写课程设计结束后,需要学生们根据实验过程和结果撰写实验报告。
实验报告应当包括反应机理的分析、反应器设计的思路和过程、反应条件的优化以及反应结果的分析等内容。
总结酶工程课程设计是一项能够让学生们深入了解酶催化反应原理和实际应用的重要实践活动。
通过该设计,学生们可以熟悉酶工程的基本概念和常见应用场景,并提高实验和设计能力。
希望通过课程设计的实践,学生们可以更好地理解酶工程的价值和应用前景。