29:锰及其化合物
- 格式:pdf
- 大小:333.92 KB
- 文档页数:13

锰及其化合物
锰是一种常见的金属元素,原子号为25,符号为Mn,在自然界中具有重要的作用,可以
作为重要的组成部分组成各种催化剂和催化剂材料。
锰是第25号元素,属于第7族元素,形成了一种双价,同时存在多种不同的己价状态,其中介于2+,3+,4+,6+之间。
锰具有良好的电子导电性能,具有良好的化学稳定性和抗腐蚀性,可用作电极材料。
同时,磁性材料也需要锰,因为当磁场在铁磁体中设定时,可以使锰从三价水平向四价水平变化,从而产生连续的磁效应。
此外,由于锰的电化学活性特性和物理性质,可以用作合成氧化物以及电化学催化剂,广
泛应用于材料科学,分析化学,催化等领域,对转化、过氧化、氧化等反应都非常有效。
锰酸盐和锰化合物通常具有解离性、芳香性,热稳定性,反应活性和溶解度等优点,是重
要的工业原料和有机材料,在有机合成中有着很高的应用价值。
锰酸钾是一种混合物,性质受其组分的影响,它具有解离性、热稳定性和溶解度优点,广
泛应用于化工行业,比如染料、润滑油、钻井液、绝缘剂和农药中。
总之,锰和锰化合物是经济重要的物质,在工业领域被广泛应用,它们的特性取决于其组分,可用于催化剂和材料等,在材料科学和分析化学等领域发挥重要作用。

系列三副族金属专题1 锰及其化合物一、锰单质块状锰是呈灰色,是一种较活泼的金属,在空气中金属锰的表面被一层褐色的氧化膜所覆盖,甚至与冷的浓硝酸也形成强的氧化膜,所以呈化学惰性。
二、锰的化合物的价态规律稳定:Mn2+、MnO2(不溶于酸的固体)、MnO4-、Mn2O3(MnOOH(氢氧化氧锰))不稳定:Mn3+、MnO42-(酸性条件下会歧化:3MnO42-+4H+=====2MnO4-+MnO2+2H2O)三、Mn(Ⅱ)(1)溶解性:Mn(Ⅱ)强酸盐易溶,弱酸盐(MnCO3、硫化物),氧化物,氢氧化物为难溶(但可溶于稀酸)。
(2)Mn(H2O)62+离子为苹果绿色(3)还原性Ⅱ酸性介质中稳定,碱性介质中不稳定,易被氧化。
在Mn2+盐溶液中加OH-,生成Mn(OH)2白色沉淀,而后在空气中迅速被氧化生成MnO(OH)2的棕褐色沉淀。
Mn2+ + 2OH-=====Mn(OH)2↓白色,2Mn(OH)2 + O2=====2MnO(OH)2↓棕褐色Ⅱ酸性介质中,能被一些强氧化剂所氧化:2Mn2+ + 5S2O82-+ 8H2O=====2MnO4-+ 10SO42-+ 16H+2Mn2+ + 5NaBiO3 + 14H+ =====2MnO4-+ 5Na+ + 5Bi3+ + 7H2O2Mn2+ + 5PbO2 + 4H+=====2MnO4- + 5Pb2+ + 2H2O其中Mn2+的鉴定常用NaBiO3为氧化剂在H2SO4或HNO3介质下反应。
Ⅱ在浓硫酸中,MnSO4与KMnO4反应可生成深红色的Mn3+(实际是硫酸根的配合物):MnO4-+4Mn2++8H+=====5Mn3++4H2OⅡ在中性或近中性的溶液中,MnO4-与Mn2+反应生成MnO2:2MnO4-+3Mn2++2H2O =====5MnO2(s)+4H+⑤Mn(OH)2易被氧化:Mn2++2OH-=====Mn(OH)2(s)(白色),2Mn(OH)2+O2=====2MnO(OH)2(s)(棕色)(4)硫酸锰:白色或微红色细小结晶体。


高考化学工艺流程中的新考点锰及其化合物一、知识拓展1、金属锰锰是第25号元素,在周期表中位于第四周期,第ⅦB族,在地壳中主要以氧化物形式存在,如软锰矿MnO2⋅x H2O、黑锰矿Mn3O4和水锰矿Mn2O3⋅H2O等。
锰的氧化态有+2、+3、+4、+5、+6和+7,其中+2、+4、+6、+7为常见氧化态。
锰是活泼金属,它在空气中燃烧生成Mn3O4(类似Fe3O4,是MnO和Mn2O3的混合氧化物):3Mn+2O2Mn3O4锰能分解水,易溶于稀的非氧化性酸生成Mn(Ⅱ)盐和放出氢气:Mn + 2H2O == Mn(OH)2+ H2↑Mn+2H+== Mn2++H2↑锰与冷浓H2SO4作用缓慢。
有氧化剂存在时,锰与熔融碱作用生成锰酸盐:2Mn + 4KOH + 3O22K2MnO4+ 2H2O高温时,Mn 和X2、O2、S、B、C、Si、P 等非金属直接化合,更高温度时可与N2化合。
2、锰(Ⅱ)化合物Mn2+的价电子构型为较稳定的半充满d5结构,因此Mn2+是Mn的最稳定状态。
在酸性溶液中Mn2+的还原性很弱,只有在高酸度的热溶液中,与过二硫酸铵、铋酸钠等强氧化剂作用,才能将Mn2+氧化成MnO4-。
2Mn2++5S2O82-+8H2O2MnO4-+10SO42-+16H+2Mn2++5NaBiO3+14H+2MnO4-+5Na++5Bi3++7H2O2Mn2++5PbO2+4H+2MnO4-+5Pb2++2 H2O由于MnO4-是紫色的,故这些反应常用于定性检验Mn2+ 离子。
在碱性溶液中,Mn(Ⅱ)很容易被氧化成Mn(Ⅳ) 化合物。
2Mn(OH)2+O2== 2MnO(OH)2↓(棕褐)多数锰(Ⅱ)盐如MnX2、Mn(NO3)2、MnSO4等皆溶于水。
MnO2与浓H2SO4和C作用可制得硫酸锰:2MnO2+C+2H2SO4== 2MnSO4+CO2↑+2H2O锰(Ⅱ)的弱酸盐和氢氧化物难溶于水,如MnS、MnCO3、MnC2O4、Mn(OH)2等。

系列三副族金属专题1 锰及其化合物一、锰单质块状锰是呈灰色,是一种较活泼的金属,在空气中金属锰的表面被一层褐色的氧化膜所覆盖,甚至与冷的浓硝酸也形成强的氧化膜,所以呈化学惰性。
二、锰的化合物的价态规律稳定:Mn2+、MnO2(不溶于酸的固体)、MnO4-、Mn2O3(MnOOH(氢氧化氧锰))不稳定:Mn3+、MnO42-(酸性条件下会歧化:3MnO42-+4H+=====2MnO4-+MnO2+2H2O)三、Mn(Ⅱ)(1)溶解性:Mn(Ⅱ)强酸盐易溶,弱酸盐(MnCO3、硫化物),氧化物,氢氧化物为难溶(但可溶于稀酸)。
(2)Mn(H2O)62+离子为苹果绿色(3)还原性Ⅱ酸性介质中稳定,碱性介质中不稳定,易被氧化。
在Mn2+盐溶液中加OH-,生成Mn(OH)2白色沉淀,而后在空气中迅速被氧化生成MnO(OH)2的棕褐色沉淀。
Mn2+ + 2OH-=====Mn(OH)2↓白色,2Mn(OH)2 + O2=====2MnO(OH)2↓棕褐色Ⅱ酸性介质中,能被一些强氧化剂所氧化:2Mn2+ + 5S2O82-+ 8H2O=====2MnO4-+ 10SO42-+ 16H+2Mn2+ + 5NaBiO3 + 14H+ =====2MnO4-+ 5Na+ + 5Bi3+ + 7H2O2Mn2+ + 5PbO2 + 4H+=====2MnO4- + 5Pb2+ + 2H2O其中Mn2+的鉴定常用NaBiO3为氧化剂在H2SO4或HNO3介质下反应。
Ⅱ在浓硫酸中,MnSO4与KMnO4反应可生成深红色的Mn3+(实际是硫酸根的配合物):MnO4-+4Mn2++8H+=====5Mn3++4H2OⅡ在中性或近中性的溶液中,MnO4-与Mn2+反应生成MnO2:2MnO4-+3Mn2++2H2O =====5MnO2(s)+4H+⑤Mn(OH)2易被氧化:Mn2++2OH-=====Mn(OH)2(s)(白色),2Mn(OH)2+O2=====2MnO(OH)2(s)(棕色)(4)硫酸锰:白色或微红色细小结晶体。

锰属黑色金属,钢灰色,有金属光泽,硬而脆;熔点1244o C,沸点1962o C;密度7.2g/cm3。
锰的导电性出奇的差,锰是导电性和导热性最差的金属!原因不明。
锰是活泼金属,易溶于稀盐酸;易被空气氧化;加热时与氮、硫、氟、氯、溴···反应。
MnO2+C=(1500o C)Mn+CO2高锰酸钾的还原产物由哪些因素决定?•溶液的pH•高锰酸钾浓度•还原剂品种•还原剂浓度•高锰酸钾和还原剂的相对量•温度•溶液中的其他组分,如作为杂质的非氧化还原组分(作为金属的配体等,如磷酸根对于铁)大多数情况下KMnO4的还原产物•酸性溶液KMnO4→Mn2+KMnO4→MnO2•中性溶液• KMnO4→MnO2•碱性溶液• KMnO4→MnO 2• KMnO4→MnO 42-• 2 MnO2+ 4 KOH + O2 = 2 K2MnO4 + 2 H2O• 3 K2MnO4 + 2 CO2 = 2 KMnO4 + MnO2 + 2 K2CO3•锰原子的理论利用率仅2/3 !• 3K2MnO4+4HAc=2KMnO4 + MnO2 +4KAc+2H2O 仅2/3 !•阳极氧化MnO42- - e- = MnO4-这才是工业制法• 2K2MnO4 + 2H2O = 2KMnO4 + 2KOH + H2↑Mn2+ + 2H2O -2e- = MnO2 + 4H+一、锰的存在与制备软锰矿:MnO2·xH2O铝热法还原Mn3O4,电解MnCl2二、锰的化合物Mn2+:粉红色,稳定MnO2:+HCl(Cl2↑);H2SO4(O2↑);去极化剂:MnO(OH)2MnO2+4KOH+O2→2K2MnO4+2H2O;3K2MnO4+2H2O→2KMnO4+MnO2+4KOH电解(最好)或Cl2氧化三、几个名词解释1.锰(manganese):化学元素。
化合价+2、+3、+4、+6、+7。
自然界只有一种稳定同位素55Mn,另有十一种放射性同位素。

锰属黑色金属,钢灰色,有金属光泽,硬而脆;熔点1244o C,沸点1962o C;密度7.2g/cm3。
锰的导电性出奇的差,锰是导电性和导热性最差的金属!原因不明。
锰是活泼金属,易溶于稀盐酸;易被空气氧化;加热时与氮、硫、氟、氯、溴···反应。
MnO2+C=(1500o C)Mn+CO2高锰酸钾的还原产物由哪些因素决定?•溶液的pH•高锰酸钾浓度•还原剂品种•还原剂浓度•高锰酸钾和还原剂的相对量•温度•溶液中的其他组分,如作为杂质的非氧化还原组分(作为金属的配体等,如磷酸根对于铁)大多数情况下KMnO4的还原产物•酸性溶液KMnO4→Mn2+KMnO4→MnO2•中性溶液• KMnO4→MnO2•碱性溶液• KMnO4→MnO 2• KMnO4→MnO 42-• 2 MnO2+ 4 KOH + O2 = 2 K2MnO4 + 2 H2O• 3 K2MnO4 + 2 CO2 = 2 KMnO4 + MnO2 + 2 K2CO3•锰原子的理论利用率仅2/3 !• 3K2MnO4+4HAc=2KMnO4 + MnO2 +4KAc+2H2O 仅2/3 !•阳极氧化MnO42- - e- = MnO4-这才是工业制法• 2K2MnO4 + 2H2O = 2KMnO4 + 2KOH + H2↑Mn2+ + 2H2O -2e- = MnO2 + 4H+一、锰的存在与制备软锰矿:MnO2·xH2O铝热法还原Mn3O4,电解MnCl2二、锰的化合物Mn2+:粉红色,稳定MnO2:+HCl(Cl2↑);H2SO4(O2↑);去极化剂:MnO(OH)2MnO2+4KOH+O2→2K2MnO4+2H2O;3K2MnO4+2H2O→2KMnO4+MnO2+4KOH电解(最好)或Cl2氧化三、几个名词解释1.锰(manganese):化学元素。
化合价+2、+3、+4、+6、+7。
自然界只有一种稳定同位素55Mn,另有十一种放射性同位素。

化学教材关于锰的知识点锰(Manganese)是一种重要的金属元素,在化学、材料科学和工业中都有广泛的应用。
本节将详细介绍锰的基本性质、存在形式、用途以及与其相关的化学反应。
一、锰的基本性质锰是一种坚硬、有光泽的过渡金属,其原子序数为25。
在常温下,锰可以抵抗空气和水,但在高温下,它会与氧、硫、氯等元素反应。
锰的化学性质较活泼,能与许多元素发生反应,形成化合物。
二、知识点锰及其化合物1、锰的单质金属锰: 银白色金属,粉末状的锰: 灰色。
锰是钢的一种重要添加剂,因为它能脱除氧和硫.2、锰的化合物(1)Mn(VII)化合物1)高锰酸钾的制备以软锰矿为原料 (MnO2) 制备高锰酸钾,先制K2MnO4:3 MnO2 + 6 KOH + KClO3 = 3 K2MnO4 + KCl + 3 H2O (碱熔法)从 K2MnO4 制 KMnO4 有三种方法。
A) 歧化法, 酸性介质中, 有利于歧化:3 MnO42- +4 H+ = MnO2 + 2 MnO4- + 2 H2O2 MnO42- + 2 CO2 = MnO2 + 2 MnO4- + 2 CO32-在中性或弱碱性溶液中也发生歧化反应,但趋势及速率小:3 MnO42- + 2 H2O = 2 MnO4- + MnO2 +4 OH-B) 氧化法:2 MnO42- + 2 Cl2 = 2 MnO4- + 2 Cl-C) 电解法: 电解 K2MnO4 溶液:阳极:MnO42-à MnO4- + e-阴极:2 H2O + 2 e-à H2 + 2 OH-电解总反应:2 K2MnO4 + 2 H2O = 2 KMnO4 + 2 KOH + H22) 高锰酸钾的强氧化性MnO4- + 5 Fe2+ + 8 H+ = Mn2+ + 5 Fe3+ + 4 H2O2 MnO4- + 5 H2C2O4 + 6 H+ = 2 Mn2+ + 10 CO2 + 8 H2OMnO4- + 4 Mn2+ + 15 H2P2O72- + 8 H+ =5 [Mn(H2P2O7)3]3- + 4 H2O 2 MnO4- + 5 SO32- + 6 H+ = 2 Mn2+ + 5 SO42- + 3 H2O2 MnO4- +3 SO32- + H2O = 2 MnO2 + 3 SO42- + 2 OH-2 MnO4- + SO32- + 2 OH-(浓) = 2 MnO42- + SO42- + H2O(2)Mn(IV)化合物二氧化锰在强酸中有氧化性(2) 还原性: 在碱中易被氧化成高价,生成MnO(OH)2. MnO(OH)2 (棕黄色)Mn2+ + 2 OH- = Mn(OH)2¯ (白) 无氧条件Mn(OH)2 + ½O2 = MnO(OH)2 (棕黄色)MnO(OH)2 + (x - 1) H2O = MnO2∙x H2O (黑褐色)Mn(OH)2 + 2 H+ = Mn2+ + 2 H2OMn(II) 在碱性条件下不稳定(还原性强)Mn(II)在酸性条件下稳定 (还原性差)在酸性溶液中,只有用强氧化剂,如NaBiO3、PbO2、(NH4)2S2O8 等,才能将 Mn2+ 氧化为呈现紫红色的高锰酸根(MnO4-)。


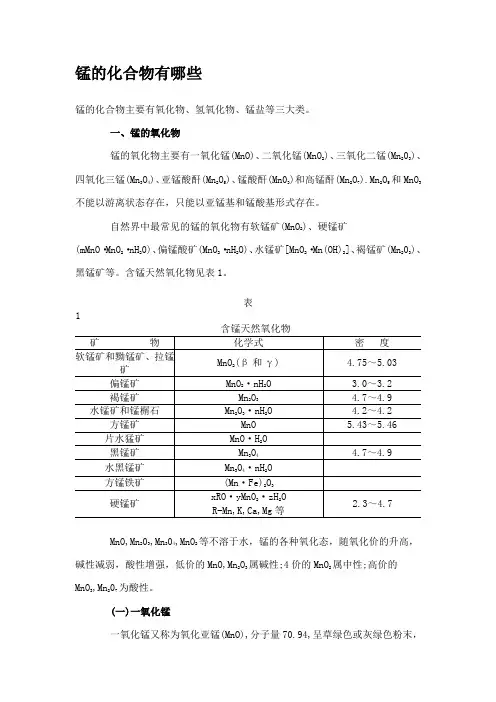
锰的化合物有哪些锰的化合物主要有氧化物、氢氧化物、锰盐等三大类。
一、锰的氧化物锰的氧化物主要有一氧化锰(MnO)、二氧化锰(MnO2)、三氧化二锰(Mn203)、四氧化三锰(Mn3O4)、亚锰酸酐(Mn2O5)、锰酸酐(Mn03)和高锰酐(Mn2O7).Mn2O5和MnO3不能以游离状态存在,只能以亚锰基和锰酸基形式存在。
自然界中最常见的锰的氧化物有软锰矿(MnO2)、硬锰矿(mMnO·MnO2·nH20)、偏锰酸矿(MnO2·nH2O)、水锰矿[MnO2·Mn(OH)2]、褐锰矿(Mn203)、黑锰矿等。
含锰天然氧化物见表1。
表1 含锰天然氧化物MnO,Mn203,Mn304,MnO2等不溶于水,锰的各种氧化态,随氧化价的升高,碱性减弱,酸性增强,低价的MnO,Mn2O3属碱性;4价的MnO2属中性;高价的MnO3,Mn207为酸性。
(一)一氧化锰一氧化锰又称为氧化亚锰(MnO),分子量70.94,呈草绿色或灰绿色粉末,为碱性氧化物,在空气中易氧化,在大气中加热至不同温度时可以生成Mn304,Mn203,MnO2.常温下不溶于水,易溶于酸而生成玫瑰色的二价锰盐。
结晶水合物和Mn2+盐溶液的玫瑰色是因为存在[Mn(H20)6]2+离子的缘故。
MnO密度为5.43~5.46g/cm3,硬度为5~6,熔点1784℃.Mn0主要用于生产硫酸锰,因为生产硫酸锰的主要原料是软锰矿(Mn02),MnO2不溶于稀酸,必须预先还原成MnO。
纯度较高和重金属离子含量低的MnO可直接用于作肥料和饲料添加剂。
工业上生产MnO的方法主要是在回转窑或反射炉加碳还原软锰矿粉制得,也有报导可在多层移动炉、沸腾炉生产。
除采用软锰矿外还可用Mn(OH)2和MnCO3在隔绝空气条件下加热制得。
(二)四氧化三锰(Mn304)Mn304矿物学中又称之为黑锰矿,分子量228.82,理论含锰量72.03%,离子结构为Mn2+[Mn23+]O4,复合分子式为MnO·Mn203,属四方(斜方)晶系,是普通尖晶石结构。
锰的化合物有哪些锰的化合物主要有氧化物、氢氧化物、锰盐等三大类。
一、锰的氧化物锰的氧化物主要有一氧化锰(MnO)、二氧化锰(MnO2)、三氧化二锰(Mn23)、四氧化三锰(Mn3O4)、亚锰酸酐(Mn2O5)、锰酸酐(Mn03)和高锰酐(Mn2O7).Mn2O5和MnO3不能以游离状态存在,只能以亚锰基和锰酸基形式存在。
自然界中最常见的锰的氧化物有软锰矿(MnO2)、硬锰矿(mMnO·MnO2·nH20)、偏锰酸矿(MnO2·nH2O)、水锰矿[MnO2·Mn(OH)2]、褐锰矿(Mn23)、黑锰矿等。
含锰天然氧化物见表1。
表1MnO,Mn203,Mn34,MnO2等不溶于水,锰的各种氧化态,随氧化价的升高,碱性减弱,酸性增强,低价的MnO,Mn2O3属碱性;4价的MnO2属中性;高价的MnO3,Mn27为酸性。
(一)一氧化锰一氧化锰又称为氧化亚锰(MnO),分子量70.94,呈草绿色或灰绿色粉末,为碱性氧化物,在空气中易氧化,在大气中加热至不同温度时可以生成Mn304,Mn23,MnO2.常温下不溶于水,易溶于酸而生成玫瑰色的二价锰盐。
结晶水合物和Mn2+盐溶液的玫瑰色是因为存在[Mn(H20)6]2+离子的缘故。
MnO密度为5.43~5.46g/cm3,硬度为5~6,熔点1784℃.Mn0主要用于生产硫酸锰,因为生产硫酸锰的主要原料是软锰矿(Mn02),MnO2不溶于稀酸,必须预先还原成MnO。
纯度较高和重金属离子含量低的MnO可直接用于作肥料和饲料添加剂。
工业上生产MnO的方法主要是在回转窑内或反射炉内加碳还原软锰矿粉制得,也有报导可在多层移动炉、沸腾炉内生产。
除采用软锰矿外还可用Mn(OH)2和MnCO3在隔绝空气条件下加热制得。
(二)四氧化三锰(Mn30 4 )Mn304矿物学中又称之为黑锰矿,分子量228.82,理论含锰量72.03%,离子结构为Mn2+[Mn23+]O4,复合分子式为MnO·Mn23,属四方(斜方)晶系,是普通尖晶石结构。
锰及其化合物用途广泛锰是一种广泛应用的化学元素,其化合物具有许多应用领域。
以下是锰及其化合物的一些主要用途:1. 钢铁制造:锰是一种重要的合金元素,可用于制造钢和铁合金。
锰合金可以增加钢的硬度、强度和耐腐蚀性,使其适用于制造高速工具钢、弹簧钢和不锈钢等。
此外,锰可以减少钢铁中的硫和氧含量,改善钢铁的质量。
2. 电池制造:锰可以用于制造电池,如干电池和锰酸锂电池。
在干电池中,锰被用作正极活性物质,它与二氧化锰反应产生电流。
在锰酸锂电池中,锰酸锂是正极材料,具有高能量密度和长寿命特点。
3. 化工工业:锰及其化合物被广泛应用于化学工业。
例如,二氧化锰可用作催化剂,促进氧化还原反应,并用于制备有机化合物、染料和医药中间体。
锰盐还可用于水处理,作为氧化剂和除臭剂。
4. 农业:锰是植物生长所需的微量元素之一。
它在植物中起着重要的生物催化剂作用,参与光合作用和酶的活化。
锰缺乏会导致植物生长不良、叶片发黄和果实质量下降。
因此,锰肥料在农业生产中被广泛应用,以提高农作物的产量和品质。
5. 食品和饮料工业:锰是人体所需的微量元素,对人体的新陈代谢和骨骼发育起着重要作用。
锰盐可以用作食品添加剂,增加食品和饮料的营养价值。
例如,锰可以用于制作谷物食品、啤酒和果汁等。
6. 环境保护:锰及其化合物在环境领域也有重要的应用。
例如,锰矿石和锰盐可以用于处理废水中的重金属,将其转化为不溶性沉淀物。
锰盐也可用于土壤修复,改善土壤肥力和植物生长环境。
7. 医药工业:锰盐也被广泛应用于医药工业。
锰是许多酶的辅助因子,参与机体的代谢过程,具有抗氧化和抗炎作用。
锰盐可用于制备某些药物,如锰剂和锰葡萄糖酸钠。
总之,锰及其化合物具有广泛的应用领域,包括钢铁制造、电池制造、化工工业、农业、食品和饮料工业、环境保护和医药工业等。
锰的应用对许多领域的生产和生活都起到重要的推动作用。
工作场所空气中锰及其化合物限值工作场所空气中锰及其化合物的限值是指工作环境中锰及其化合物浓度的合理范围,以保护工人的健康和安全。
锰是一种常见的金属元素,广泛用于许多工业过程中。
然而,在高浓度下,锰及其化合物可能对人体健康造成危害。
因此,各国针对工作场所中锰及其化合物的浓度制定了相关的限值标准。
1. 国际劳工组织(ILO) 的限值标准:国际劳工组织设定了工作场所空气中锰及其化合物的限值标准。
根据ILO的建议,锰及其化合物暴露限值如下:- 可溶性锰化合物(MnSO4):每立方米空气中不得超过0.2毫克。
- 雾状锰化合物及氧化锰粉尘:每立方米空气中不得超过0.05毫克。
这些限值标准是根据对锰及其化合物的研究结果和对人体健康的影响进行确定的。
2. 美国职业安全与健康管理局(OSHA) 的限值标准:美国职业安全与健康管理局设定了工作场所空气中锰及其化合物的限值标准。
根据OSHA的建议,锰及其化合物浓度的限值如下:- 可溶性锰化合物(MnSO4):每立方米空气中不得超过5毫克。
- 其他锰化合物:每立方米空气中不得超过1毫克。
这些限值标准是根据对锰及其化合物的研究结果和对人体健康的影响进行确定的。
3. 欧洲工作场所大气污染物限值(OELs) 的限值标准:欧洲工作场所大气污染物限值是欧洲针对工作场所中各种污染物制定的标准。
根据欧盟对锰及其化合物的限值标准,锰及其化合物浓度的限值如下:- 可溶性锰化合物(MnSO4):每立方米空气中不得超过0.2毫克。
- 其他锰化合物:每立方米空气中不得超过0.05毫克。
这些限值标准是根据对锰及其化合物的研究结果和对人体健康的影响进行确定的。
4. 中国的限值标准:中国对工作场所空气中锰及其化合物的限值标准也有相关规定。
根据中国的《职业卫生标准》(GBZ/T 189.1-2007),锰及其化合物的限值如下:- 总锰:每立方米空气中不得超过1毫克。
- 可溶性锰化合物:每立方米空气中不得超过0.2毫克。
金属锰及化合物广泛应用于金属锰及其化合物在许多领域都有广泛的应用。
下面将详细介绍金属锰及其化合物在不同领域的应用。
1. 钢铁生产:金属锰是钢铁生产中的重要合金元素,主要用于制造各种类型的钢材。
在钢铁中添加适量的锰可以提高钢的硬度、韧性和耐磨性。
此外,锰还可以消除钢中的夹杂物,提高钢的质量和强度。
因此,金属锰在钢铁行业中是不可或缺的。
2. 电池:金属锰主要用于制造干电池和一些充电电池。
在干电池中,锰是一个重要的正极材料,能够提供稳定的电流输出。
同时,锰还可以作为一种电解质添加到一些充电电池中,提高电池的充放电效率和循环寿命。
3. 化肥生产:化合物锰酸二锰(MnO2)是一种常用的化肥原料,用于制造高锰素、锰镁肥等肥料。
这些肥料富含锰元素,可以提供作物所需的营养,促进作物的生长和发育。
4. 钢铁耐火材料:金属锰和锰矿石可以用于制造耐火材料,如耐火砖、耐火水泥等。
锰的添加可以提高耐火材料的抗高温性能和耐腐蚀性能,使其在高温环境下更加稳定和耐用。
5. 陶瓷和玻璃工业:锰化合物可以用作陶瓷和玻璃工业的颜料和添加剂。
锰的氧化物可以制造紫色玻璃和陶瓷制品,使其颜色更加鲜艳。
此外,锰也可以提高陶瓷和玻璃制品的硬度和耐热性能。
6. 钢铁脱硫剂:金属锰和锰矿石可以用作钢铁脱硫剂。
在钢铁冶炼过程中,锰可以与硫化物反应生成易挥发的锰硫化物,从而有效去除钢铁中的硫。
这可以改善钢的质量,降低环境污染。
7. 医药行业:锰化合物可以用于制造多种药物和医疗设备。
锰盐被广泛用于制造抗贫血药物和补钙剂,可以有效预防和治疗贫血症状。
此外,锰也可以用于制造一些医疗设备,如MRI(磁共振成像)设备中的磁芯。
8. 环境领域:锰化合物可以用于净化水体和空气中的污染物。
锰酸盐可以作为水处理剂,去除水中的重金属离子和有机物。
此外,锰矿石也可以用于制造汽车尾气处理催化剂,减少尾气中的有害气体排放。
综上所述,金属锰及其化合物在钢铁生产、电池制造、化肥生产、钢铁耐火材料、陶瓷和玻璃工业、钢铁脱硫、医药行业和环境领域等各个领域都有广泛应用。
锰的化合物有哪些锰的化合物主要有氧化物、氢氧化物、锰盐等三大类。
一、锰的氧化物锰的氧化物主要有一氧化锰(MnO)、二氧化锰(MnO2)、三氧化二锰(Mn203)、四氧化三锰(Mn3O4)、亚锰酸酐(Mn2O5)、锰酸酐(Mn03)和高锰酐(Mn2O7).Mn2O5和MnO3不能以游离状态存在,只能以亚锰基和锰酸基形式存在。
自然界中最常见的锰的氧化物有软锰矿(MnO2)、硬锰矿(mMnO·MnO2·nH20)、偏锰酸矿(MnO2·nH2O)、水锰矿[MnO2·Mn(OH)2]、褐锰矿(Mn203)、黑锰矿等。
含锰天然氧化物见表1。
表1 含锰天然氧化物MnO,Mn203,Mn304,MnO2等不溶于水,锰的各种氧化态,随氧化价的升高,碱性减弱,酸性增强,低价的MnO,Mn2O3属碱性;4价的MnO2属中性;高价的MnO3,Mn207为酸性。
(一)一氧化锰一氧化锰又称为氧化亚锰(MnO),分子量70.94,呈草绿色或灰绿色粉末,为碱性氧化物,在空气中易氧化,在大气中加热至不同温度时可以生成Mn304,Mn203,MnO2.常温下不溶于水,易溶于酸而生成玫瑰色的二价锰盐。
结晶水合物和Mn2+盐溶液的玫瑰色是因为存在[Mn(H20)6]2+离子的缘故。
MnO密度为5.43~5.46g/cm3,硬度为5~6,熔点1784℃.Mn0主要用于生产硫酸锰,因为生产硫酸锰的主要原料是软锰矿(Mn02),MnO2不溶于稀酸,必须预先还原成MnO。
纯度较高和重金属离子含量低的MnO可直接用于作肥料和饲料添加剂。
工业上生产MnO的方法主要是在回转窑或反射炉加碳还原软锰矿粉制得,也有报导可在多层移动炉、沸腾炉生产。
除采用软锰矿外还可用Mn(OH)2和MnCO3在隔绝空气条件下加热制得。
(二)四氧化三锰(Mn304)Mn304矿物学中又称之为黑锰矿,分子量228.82,理论含锰量72.03%,离子结构为Mn2+[Mn23+]O4,复合分子式为MnO·Mn203,属四方(斜方)晶系,是普通尖晶石结构。
电焊作业时锰及其无机化合物电焊作业时,锰及其无机化合物起着重要的作用。
锰是一种重要的合金元素,其在电焊中的应用主要体现在焊丝、焊条和焊剂中。
同时,锰的无机化合物也广泛应用于电焊作业中的辅助材料和工艺中。
锰在电焊中的应用主要体现在焊丝、焊条和焊剂中。
焊丝和焊条是电焊中常用的填充材料,锰在其中起着重要的合金化作用。
锰合金可以增加焊接材料的硬度和抗磨性,提高焊缝的耐磨性和抗腐蚀性。
此外,锰合金还可以改善焊接材料的流动性和湿润性,提高焊缝的质量和工艺性能。
除了在焊丝和焊条中的应用,锰的无机化合物也广泛应用于电焊作业中的辅助材料和工艺中。
例如,锰酸锂是一种常用的电解质材料,可以用于制备锂离子电池,其在电焊中的应用主要体现在焊接机的电源系统中。
锰酸锂电池具有高能量密度、长循环寿命和低自放电率等优点,可以提供稳定可靠的电能供应,保证焊接过程的顺利进行。
锰的无机化合物还可以用作电焊作业中的焊接剂。
焊接剂是焊接过程中不可或缺的辅助材料,它可以提高焊接材料的可焊性和焊接接头的强度。
锰的无机化合物作为焊接剂的成分之一,可以提高焊接接头的稳定性和可靠性,减少焊接过程中的气孔和裂纹等缺陷。
同时,锰的无机化合物还可以改善焊接接头的机械性能和耐热性能,提高焊接接头的使用寿命和安全性。
在电焊作业中使用锰及其无机化合物需要注意一些安全问题。
首先,锰及其无机化合物具有一定的毒性,操作时应佩戴好防护设备,避免直接接触。
其次,锰及其无机化合物在高温下易发生氧化反应,产生有毒气体,操作时应保持通风良好,避免中毒和火灾事故的发生。
此外,锰及其无机化合物的储存和运输也需要注意防潮、防晒和防爆等安全措施,确保其稳定性和安全性。
锰及其无机化合物在电焊作业中起着重要的作用。
锰在焊丝、焊条和焊剂中的应用可以提高焊接材料的硬度、抗磨性和耐腐蚀性,改善焊缝的质量和工艺性能;锰的无机化合物作为电解质材料和焊接剂可以提供稳定可靠的电能供应,提高焊接接头的稳定性和可靠性。