物质结构与物质状态
- 格式:doc
- 大小:27.61 KB
- 文档页数:9


高中化学选修3物质结构与性质知识点总结主要知识要点:1、原子结构2、元素周期表和元素周期律3、共价键4、分子的空间构型5、分子的性质6、晶体的结构和性质(一)原子结构1、能层和能级(1)能层和能级的划分①在同一个原子中,离核越近能层能量越低。
②同一个能层的电子,能量也可能不同,还可以把它们分成能级s、p、d、f,能量由低到高依次为s、p、d、f。
③任一能层,能级数等于能层序数。
④s、p、d、f……可容纳的电子数依次是1、3、5、7……的两倍。
⑤能层不同能级相同,所容纳的最多电子数相同。
(2)能层、能级、原子轨道之间的关系每能层所容纳的最多电子数是:2n2(n:能层的序数)。
2、构造原理(1)构造原理是电子排入轨道的顺序,构造原理揭示了原子核外电子的能级分布。
(2)构造原理是书写基态原子电子排布式的依据,也是绘制基态原子轨道表示式的主要依据之一。
(3)不同能层的能级有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E (5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。
原子轨道的能量关系是:ns<(n-2)f <(n-1)d <np(4)能级组序数对应着元素周期表的周期序数,能级组原子轨道所容纳电子数目对应着每个周期的元素数目。
根据构造原理,在多电子原子的电子排布中:各能层最多容纳的电子数为2n2 ;最外层不超过8个电子;次外层不超过18个电子;倒数第三层不超过32个电子。
(5)基态和激发态①基态:最低能量状态。
处于最低能量状态的原子称为基态原子。
②激发态:较高能量状态(相对基态而言)。
基态原子的电子吸收能量后,电子跃迁至较高能级时的状态。
处于激发态的原子称为激发态原子。
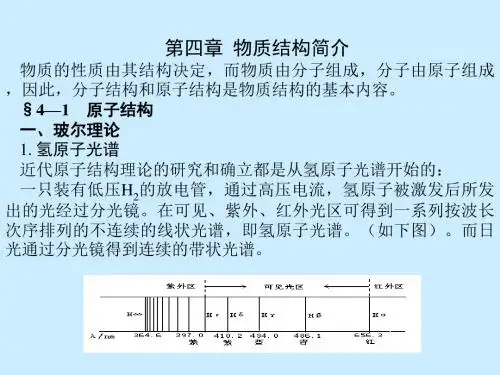
③原子光谱:不同元素的原子发生电子跃迁时会吸收(基态→激发态)和放出(激发态→较低激发态或基态)不同的能量(主要是光能),产生不同的光谱——原子光谱(吸收光谱和发射光谱)。
利用光谱分析可以发现新元素或利用特征谱线鉴定元素。


化学状态概念的理解化学状态是描述物质存在的形式以及物质之间的相互作用和运动状态的概念。
物质在化学反应中常常会发生状态的变化,包括固态、液态和气态三种基本状态,同时还包括等离子体、分散相、溶液等其他特殊状态。
固态是物质最常见的状态之一,它表现为物质具有固定的形状和体积,并且分子间具有较为紧密的排列和规则的结构。
在固体中,分子在空间上具有较小的自由度,只能作微小的振动。
而固体的强度和硬度主要取决于分子之间的相互作用,如金属的离子键和共价键,这些作用力使得固体具有较高的熔点和沸点。
液态是物质的另一种常见状态,液态物质的分子之间有接近但无序排列、不规则的结构。
液体具有较小的体积和形状上的自由度,但具有较大的分子间距离。
液体的特点是可以流动、填充容器并形成平面,同时具有表面张力等特殊性质。
液态和固态之间的相变通常发生在物质的熔点和冷凝点。
气态是物质的第三种常见状态,气态物质的分子之间间距较大、无序排列。
气体具有较大的体积和形状上的自由度,分子具有较高的热运动能量,可以不受限地移动和扩展,充满整个容器。
气体的特点是可压缩性较强,并且气体的热膨胀和低密度使其具有较低的凝结点和沸点。
等离子体是物质的另一种特殊状态,是由电离后的正负离子和自由电子组成的高度电离气体。
等离子体在高温和高电压条件下形成,可见于太阳和其它恒星的外层、发光等离子体、等离子体切割与焊接等。
等离子体对于高温物理研究、核聚变和等离子体技术等具有重要意义。
分散相是指在其中一个物质中悬浮的小颗粒或液滴等微观粒子,被称为分散相。
分散相可以存在于固体、液体或气体中,与连续相(周围环境)相互作用。
分散相的形成可以是由化学反应、机械作用或热力学因素引起的,常见的例子有胶体、气溶胶等。
溶液是由溶质和溶剂组成的均相混合物,其中溶质是被溶解的物质,溶剂是充分溶解溶质的物质。
溶液中的溶质和溶剂分子之间相互作用,成键和解键反应是溶液形成的物理基础。
溶液是化学反应和物质交换的重要参与者,如溶解、配位反应、氧化还原反应等。

物质的组成和结构一、物质的组成1、从宏观上看:物质是由 组成的;如醋酸钾(CH 3COOK )由 、 、 、 四种元素组成,其中原子个数比为 : : : 。
2、从微观上看,物质是由 、 和 三种粒子构成,如水是由 构成,氯化钠是由 构成,铁是由 构成。
二、原子(带正电)1、原子结构 (不带电)2、在原子中存在的等量关系: = = =原子序数。
3、核外电子围绕原子核进行分层运动,共分 层,越在外层的电子能量越 。
4、最外层电子数为 或为 (只有一层)的为相对稳定结构。
5、金属原子最外层电子数 ,易 电子,形成 离子。
6、非金属原最外层电子数 ,易 电子,形成 离子。
7、所以原子的化学性质取决于 。
8、原子的质量主要集中在 上。
相对原子质量= ,近似计算= + 。
相对原子质量是一个比值,没有 。
三、分子、原子和离子区别、联系1、共同性质: 、 、 。
2、区别:分子是 最小粒子原子是 最小粒子分子在 变化中可再分,而原子在化学变化中不能再分。
化学变化的实质是构成分子的原子重新组合。
3、联系:离子 原子 分子4、练习:用符号表示下列元素、原子、分子、离子3个铁原子 ,5个二氧化硫分子 ,2个钙离子 ,2个水分子 。
氮元素 , 2个氢氧根离子 , 镁元素 , 2个氧原子5、根据下列结构图作答:其中属于金属原子的有 ,属于稀有气体原子的有 ,属于阴离子的有 ,离子符号分别是达到稳定结构的有 。
6.右图是某粒子的结构示意图:(1)当该粒子为原子时,X= ;(2)当该粒子的化学符号为X 3+ 时,X= ,符号为 ;(3)当微粒带两个单位负电荷时,微粒符号为四、物质分类混合物:宏观上是由多种物质混合而成的物质,微观上由多种分子构成的物质:只有一种元素组成的纯净物1、物质氧化物:由种元素组成,且其中一种元素是元素。
纯净物化合物酸:如:HCl H2CO3H2SO4 HNO3碱; 如:NaOH Mg(OH)2KOH Ca(OH)2盐2、将下列物质分类空气,干冰、氧气、纯净的井水、石灰水、氮气、蒸馏水、铁粉,氧化镁其中属于混合物的有属于纯净物的有(写化学式)属于单质的有(写化学式)属于氧化物的有(写化学式)实验部分1、药品取用规则:三不原则(不、不不);节约原则(不规定用量时,固体药品一般取;液体药品一般取);环保原则。

简明讲解物质的三态转变物质的三态转变是指物质在不同的温度和压力条件下,由固体态转变为液体态,再由液体态转变为气体态的过程。
这三种态分别称为固态、液态和气态。
接下来,我将对物质的三态转变做一简明的讲解。
固态是物质最常见的态之一。
在固态下,物质的分子或原子紧密排列,并保持相对稳定的结构。
分子间的距离较小,分子之间有一定的相互作用力,因此固体具有一定的形状和体积。
不同的物质在固态下呈现出不同的形态和性质。
例如,铁的固态就是金属晶体,呈现出坚硬、电导性等特点。
当温度升高或外部施加压力时,固态物质可能会发生相变,转变为液态。
液态是物质的另一种常见态。
在液态下,物质的分子或原子排列比较松散,具有一定的流动性。
液体没有固定的形状,但有确定的体积。
液体分子间的相互作用力较弱,能够自由移动,使得液体具有流动性和扩散性。
当外界的温度和压力条件发生变化,液态物质也可能发生相变,转变为固态或气态。
气态是物质的第三种常见态。
在气态下,物质的分子或原子之间距离较远,分子之间的相互作用力很小。
气体没有确定的形状和体积,能够填充整个容器。
气体分子具有高度的自由度,能够快速地扩散和混合。
当温度和压力变化时,气态物质也可能会发生相变,转变为液态或固态。
物质的三态转变受到温度和压力的影响。
一般来说,当温度升高或压力降低时,物质更容易从固态转变为液态,从液态转变为气态。
相反,当温度降低或压力增加时,物质更容易从气态转变为液态,从液态转变为固态。
这与物质分子动能的大小和相互作用力的变化有关。
除了常见的固态、液态和气态,物质还存在一些特殊的态,如等离子态、凝聚态等,它们的形成和性质与物质分子之间的相互作用力、外界条件有关。
这些特殊态的形成需要更加极端的条件,例如高温、高压等。
总结起来,物质的三态转变是固态、液态和气态之间的相互转变过程。
这些转变受到温度和压力的影响,当外界条件发生变化时,物质可能从一种态转变为另一种态。
通过对物质三态转变的理解,我们能够更好地认识物质的性质和行为,也为研究和应用物质提供基础。


第一节、分子热运动一、物质结构1、物质是由极其微小的分子、原子构成的。
2、分子之间有间隔。
二、分子热运动1、扩散现象:不同物质在相互接触时,彼此进入对方的现象。
扩散可以发生在固液气三种状态之间,但看不到颗粒存在。
扩散的实质:(1)、分子永不停息的做无规则运动。
(2)、分子间有间隔。
2、分子热运动:分子无规则运动与温度有关,所以称为分子热运动。
三、分子间的作用力:分子间有相互作用的引力和斥力。
当分子间距离处于平衡位置r=r0时,分子所受引力和斥力相等;当分子间的距离r﹤r0时,引力小于斥力,作用力表现为斥力;当分子间的距离r﹥r0时,引力大于斥力,作用力表现为引力;如果分子相距很远r﹥10r0,作用力就变得十分微弱,可以忽略第二节、内能一、内能1、内能:物体内部所有分子热运动的动能和分子势能的总和,叫做物体的内能。
注意:内能与机械能是两种形式的能,物体的机械能可以为零,但内能永不为零,也即是说任何物体都具有内能。
2、内能的影响因素:质量、材料、温度、状态。
在物体的质量,材料、状态相同时,温度越高物体内能越大。
3、在所有的表述中,只有说物体温度升高内能一定增加和物体温度降低内能一定减少是对的,其他的只能是不一定。
二、改变内能的方式1、热传递(1)、热传递:使温度不同的物体互相接触时,高温物体将能量传给低温物体的现象。
(能量的转移)(2)、在热传递过程中,传递内能的多少称为热量,用Q表示,单位为J注意:热量是热传递过程中内能的特殊称呼,不能说具有、含有多少热量。
2、做功(1)、做功:通过压缩、摩擦、敲打等方式将机械能转化为内能使物体内能增加。
(能量的转化)(2)、对物体做功,物体内能增加;物体对外界做功,物体内能减小。
第三节、比热容一、比较不同物质的吸热能力1、选用相同的电加热器(使物体单位时间吸收的热量相同),为质量和初温相同的两种物质进行加热,记录加热时间和温度。
2、加热相同的时间,比较温度的变化量,温度变化量越小说明吸热能力越强;变化相同的温度比较加热时间,用时越长,说明吸热能力越强。

物质结构与物质状态变化引言:物质是构成我们周围世界的基本单位,而物质的结构和状态变化是我们理解物质性质和现象的关键。
本教案将围绕物质结构和物质状态变化展开,通过多种教学方法和案例分析,帮助学生深入理解物质的本质和变化过程。
一、物质的微观结构1.1 原子和分子的概念- 通过示意图和实验观察,引导学生认识原子和分子的概念。
- 通过案例分析,让学生了解不同元素和化合物的原子组成。
1.2 原子结构与元素周期表- 介绍原子的基本结构,包括质子、中子和电子。
- 引导学生探索元素周期表,了解元素周期表中的规律和特点。
1.3 分子结构与化学键- 介绍分子的组成和结构,包括共价键、离子键和金属键。
- 通过实验和案例分析,让学生了解不同类型化合物的分子结构。
二、物质的状态变化2.1 固态与液态的转变- 通过实验和观察,让学生了解固态和液态之间的转变过程。
- 引导学生思考分子间的相互作用力对状态变化的影响。
2.2 液态与气态的转变- 介绍液态和气态之间的转变过程,包括蒸发和沸腾。
- 通过实验和案例分析,让学生了解温度和压力对状态变化的影响。
2.3 固态与气态的转变- 引导学生了解固态和气态之间的转变过程,包括升华和凝华。
- 通过实验和观察,让学生了解不同物质的升华和凝华特点。
三、物质状态变化的能量变化3.1 相变热的概念- 介绍相变热的概念,引导学生理解物质状态变化中的能量转化。
- 通过实验和案例分析,让学生了解不同物质的相变热。
3.2 熔化和凝固过程中的能量变化- 引导学生了解熔化和凝固过程中的能量变化,包括熔化热和凝固热。
- 通过实验和观察,让学生了解不同物质的熔化和凝固特点。
3.3 汽化和凝华过程中的能量变化- 介绍汽化和凝华过程中的能量变化,包括汽化热和凝华热。
- 引导学生思考不同物质的汽化和凝华条件和特点。
结语:通过本教案的学习,学生将深入了解物质的微观结构和状态变化的基本原理,以及能量在物质状态变化中的作用。

配浙大普通化学第五版复习,根据注册结构师考试摘选课本内容编辑。
.1物质的结构和物质状态原子结构的近代概念;原子轨道和电子云;原子核外电子分布;原子和离子的电子结构;原子结构和元素周期律;元素周期表;周期;族;元素性质及氧化物及其酸碱性。
离子键的特征;共价键的特征和类型;杂化轨道与分子空间构型;分子结构式;键的极性和分子的极性;分子间力与氢键;晶体与非晶体;晶体类型与物质性质。
3.2溶液溶液的浓度;非电解质稀溶液通性;渗透压;弱电解质溶液的解离平衡;分压定律;解离常数;同离子效应;缓冲溶液;水的离子积及溶液的pH值;盐类的水解及溶液的酸碱性;溶度积常数;溶度积规则。
3.3化学反应速率及化学平衡反应热与热化学方程式;化学反应速率;温度和反应物浓度对反应速率的影响;活化能的物理意义;催化剂;化学反应方向的判断;化学平衡的特征;化学平衡移动原理。
3.4氧化还原反应与电化学氧化还原的概念;氧化剂与还原剂;氧化还原电对;氧化还原反应方程式的配平;原电池的组成和符号;电极反应与电池反应;标准电极电势;电极电势的影响因素及应用;金属腐蚀与防护。
3.5;有机化学有机物特点、分类及命名;官能团及分子构造式;同分异构;有机物的重要反应:加成、取代、消除、氧化、催化加氢、聚合反应、加聚与缩聚;基本有机物的结构、基本性质及用途:烷烃、烯烃、炔烃、;芳烃、卤代烃、醇、苯酚、醛和酮、羧酸、酯;合成材料:高分子化合物、塑料、合成橡胶、合成纤维、工程塑料。
;第1章热化学与能源系统环境按照系统与环境之间有无物质和能量交换,可将系统分成三类:(1)敞开系统与环境之间既有物质交换又有能量交换的系统,又称开放系统。
(2)封闭系统与环境之间没有物质交换,但可以有能量交换的系统。
通常在密闭容器中的系统即为封闭系统。
热力学中主要讨论封闭系统。
(3}隔离系统与环境之间既无物质交换又无能量交换的系统,又称孤立系统。
绝热、密闭的恒容系统即为隔离系统。
物质的七态在自然界中,物质以各种形态出现。
千差万别,极不统一。
但是,就他们的基本结构特点来说,却可以区分为不多的几类,每一类叫物质的一种状态。
例如,大家熟知的有固态、液态、气态三种态。
现代科学家还发现物质有其他的状态,如等离子态、中子态(超固态)、场、反物质等等各种态的特点:我们常碰到的物质是由许多分子组成的。
每个分子是由若干个原子组成的。
每个原子又是由一个带正电的原子核和它周围的若干个带负电的电子组成的。
原子核又是由若干个质子和中子组成的。
质子带正电,和电子带的负电的电量一样多。
中子不带电。
质子华人中子的质量相差不多,都约是电子质量的1840倍。
电子、质子和中子,都是目前人们认识的构成物质的基本单元,因此又叫做“基本粒子”。
已发现的基本粒子不止这三种,还有u子、介子、超子等等。
目前已发现的基本粒子已有三百余种,有的质量很小,有的质量相对地很大,有的带正电,有的带负电,有的不带电。
从分子到基本粒子,由于他们非常微小,都不能用肉眼直接看到,所以统称微观粒子。
我们常看到的以某种状态出现的物质,都是这些粒子以很大数目聚集而成的宏观物体。
不同的状态,实际上不过是这些微观粒子的不同的聚集形式而已。
像固态、液态、气态就是以分子或原子为基本单元的三种不同的聚集状态。
固态各种金属看来好象没有一定的天然形状。
但他们也是晶体。
因为实际上,一大块金属是又许多小晶粒组成的。
有些固体是非晶体,起内部的分子或原子的排列没有按一定的严格的规律。
把石英晶体熔化后在冷却成的固体,叫石英玻璃,就是一种非晶体。
一般的玻璃也是非晶体。
在这些非晶体内部,原子的排列也并非完全没有规则。
只是在大范围内没有规律性。
但对每一个原子来说,其近邻的原子排列还是有规则的。
如装在石英玻璃中,一个硅原子的近邻总是四个氧原子,而一个氧原子的近邻总是两个硅原子。
在大范围内分子或原子的有规则排列,叫做远程有序。
单晶就是远程有序的固体。
只是在每个原子的近邻才有的有规则排列,叫做近程有序。
(2)原子的结构:其中:核电荷数=质子数=核外电子数7.物质的微观构成和宏观组成走进中考例2:(05年福州中考)下图中的事例能说明分子间的间隙变小的是()解析:辨别图中分子间的间隙变小的关键是该物质的分子所占体积在变小,所以,只解析:葡萄糖分子中碳、氢、氧元素的质量比为:(12×6):(1×12):(16×6)=6:1:8 故C错。
答案:C例4:(05年厦门中考)在元素周期表中,应用于计算机的硅元素如右图所示,下列有关硅的说法正确的是( )。
A. 原子序数是14B. 原子个数是14 C.相对原子质量是14 D.质子数是28.1解析:本题考察的知识很综合,包括元素周期表的原子序数是与质子数相对应的,包括周期表中各个位置是死固定的:上左的位置是原子序数的,上右的位置是元素符号,中间的位置是元素名称,下边的位置是相对原子质量。
所以B、C、D是错的。
答案:A例5:(05年福州中考)大蒜是人们生活中常见的食品,同时又有药用的价值。
大蒜中大蒜新素的化学式为C6H10S2,它是由种元素组成,分子中碳、硫的原子个数比为。
解析:从大蒜新素的化学式可以看出,大蒜新素中含有三种元素。
答案:三;3:1专题训练一、我会选1.右图是某粒子的结构示意图,下列说法中不正确的是()A.该元素原子的原子核外有2个电子层B.该元素是一种金属元素C.该粒子是阳离子D.该粒子具有稳定结构2.某些花岗岩石材中含有放射性元素氡,一种氡原子的质子数为86,中子数为136,这种氡原子核外电子数为 ( )A.50 B.86 C.136 D.2223.下列关于原子核的叙述中,正确的是 ( )①通常由中子和电子构成②通常由质子和中子构成③带负电荷④不显电性⑤不能再分⑥体积大约相当于原子⑦质量大约相当于原子A.①⑤B.②⑦C.③④D.②⑥⑦4.“墙脚数枝梅,凌寒独自开,遥知不是雪,为有暗香来”(王安石《梅花》)。
诗人在远处就能闻到梅花香味的原因是()A.分子很小B.分子是可分的C.分子之间有间隔D.分子在不停地运动5.下列物质中,含有氧分子的是()A.水B.液氧C.氧化汞D.二氧化碳6.聚乳酸[(C3H4O2)n]是一种对人体无毒无害且可生物降解的理想的高分子环保材料,合成聚乳酸的原料是乳酸(C3H6O3)。
物质结构与物质状态(总分:34.00,做题时间:90分钟) 一、(总题数:34,分数:34.00)1.下列媒体中出现的说法科学的是( )。
A.本饮料纯属天然,绝对不含化学物质B.新粉刷过石灰浆的房间释放出CO2,严禁入内C.水是取之不尽用之不竭的D.易燃易爆的车间严禁穿化纤类衣服(分数:1.00)A.B.C.D. √解析:2.Mn2+的外层电子排布是( )。
A.3s23p63d34s2 B.3d5 C.3s23p63d5 D.3p63d5(分数:1.00)A.B.C. √D.解析:3.( )是基态原子核外电子的排布原则。
A.能量最低原 B.暴力不相容原理C.洪特规则 D.以上三者都应遵循(分数:1.00)A.B.C.D. √解析:4.( )是描述原子轨道形状,并在多电子原子中决定电子能级的次要因素。
A.磁量子数 B.自旋量子数 C.主量子数 D.角量子数(分数:1.00)A.B.C.D. √解析:5.保持二氧化碳的化学性质的最小微粒是( )。
A.碳原子和氧原子 B.二氧化碳分子C.氧原子 D.碳原子(分数:1.00)A.B. √C.D.解析:6.下列各组的两个变化都属于化学变化的是( )。
A.酒精的挥发;酒精的燃烧 B.电解水;氢气燃烧C.硝酸钾加热熔化;水结冰 D.工业制氧气,实验室制氧气(分数:1.00)A.B. √C.D.解析:7.某物质具有较低的熔点和沸点,难溶于水,易溶于有机溶剂又不导电,这种物质可能是( )。
A.离子晶体 B.过渡型晶体C.金属晶体 D.非极性分子晶体(分数:1.00)A.B.C.D. √解析:8.下列卤化氢分子极性大小顺序正确的是( )。
A.HF>HCl>HBr>HI B.HI>HBr>HCl>HFC.HF>HI>HBr>HCl D.HCl>HBr>HI>HF(分数:1.00)A. √B.C.D.解析:9.下列关于物质内部范德华力的说法错误的是( )。
A.极性分子间没有色散力 B.极性愈强的分子之间取向力愈大C.非极性分子间没有取向力 D.范德华力中诱导力通常最小(分数:1.00)A. √B.C.D.解析:10.下列说法正确的是( )。
A.化学键的类型有离子键、共价键、金属键,其中离子键是由正、负离子的电性引力而结合,其他化学键中的结合力则不是电性的B.金属和非金属元素原子之间形成的化学键必定是离子键C.离子键没有饱和性、方向性,因此任何离子周围可以吸引数目不定的异性离子D.共价分子的中心原子有几个轨道发生杂化,就形成几个能量相等的杂化轨道(分数:1.00)A.B.C.D. √解析:11.若把某原子核外电子排布式写成ns2np7时,它违背了( )。
A.保利不相容原 B.能量最低原理C.洪特规则 D.洪特规则特例(分数:1.00)A. √B.C.D.解析:12.原子最外层电子是4s1的元素有( )。
A.1个 B.2个 C.3个 D.4个(分数:1.00)A.B.C. √D.解析:13.对于多电子原子来说,下列说法正确的是( )。
A.主量子数n决定原子轨道的能量B.主量子数n和角量子数l决定原子轨道的能量C.一般来说,n值越大,电子云离核的平均距离越近D.角量子数l决定主量子数n的取值(分数:1.00)A.B. √C.D.解析:14.下列电子构型中属于原子基态的是( )。
A.1s22s22p54f1 B.1s22p2 C.1s22s12p1 D.1s22s2(分数:1.00)A.B.C.D. √解析:15.下列说法正确的为( )。
A.s电子绕核旋转,其轨道为一圆圈,而p电子的轨道为“8”字形B.主量子数为1时,有自旋相反的两个轨道C.主量子数为4时,有4s、4p、4d、4f四个轨道D.主量子数为4时,其轨道总数为16,电子层最大容量为32(分数:1.00)A.B.C.D. √解析:16.将水煮沸时,( )作用力不能克服。
A.分子间力 B.氢键 C.共价键 D.都能克服(分数:1.00)A.B.C. √D.解析:17.下列原子中哪个的半径最大( )。
A.Na B.Al C.Cl D.K(分数:1.00)A.B.C.D. √解析:18.下列说法正确的是( )。
A.原子核外电子的能量,随其离核的远近,可以连续变化B.原子核外电子的能量,完全由主量子数决定C.所有电子的原子轨道都有特定的空间取向D.主量子数n为4时,可能的轨道总数为16,可容纳的电子总数为32(分数:1.00)A.B.C.D. √解析:19.下列说法中正确的是( )。
A.碱性氧化物一定是金属氧化物 B.金属氧化物一定是碱性氧化物C.酸性氧化物一定是非金属氧化物 D.非金属氧化物一定是酸性氧化物(分数:1.00)A. √B.C.D.解析:20.某物质经分析可知其中仅含一种元素,此物质( )。
A.一定是一种单质 B.一定是一种纯净物C.一定是混合物 D.可能是纯净物也可能是混合物(分数:1.00)A.B.C.D. √解析:21.下列说法错误的是( )。
A.所有非金属元素(H除外)都在p区,但p区的元素并非都是非金属元素B.一个元素的核外电子层数与该元素在周期表中所处的周期数相等,最外层电子数与该元素在周期表中所处的族数相等C.周期系中的过渡元素都是金属元素D.在一个原子中不可能存在四个量子数都相同的电子(分数:1.00)A.B. √C.D.解析:22.由下列原子构成的单质中,能与酸反应的是( )。
A.K(第1) 电子层上有1个电子的原子B.L(第2) 电子层上有4个电子的原子C.M(第3) 电子层上的电子数为(第1) 层上电子数的一半的原子D.L(第2) 电子层上电子数为M(第3) 层上电子数的2倍的原子(分数:1.00)A.B.C. √D.解析:23.下列说法正确的是( )。
A.稀有气体单质由原子组成,所以它们在固态时形成原子晶体B.常温下是气体的物质,在固态时都是分子晶体,所以熔、沸点都较低C.同族元素的共价型氢化物,其相对分子量愈大,分子间相互作用力愈小D.同族元素的共价型氢化物,其相对分子量愈大,分子间相互作用力愈大(分数:1.00)A.B.C.D. √解析:24.CH3OH和H2O分子之间存在什么形式的作用力( )。
A.色散力 B.色散力、诱导力C.色散力、诱导力、取向力 D.色散力、诱导力、取向力、氢键(分数:1.00)A.B.C.D. √解析:25.下列( )的排列顺序正好是电负性减少的顺序。
A.K、Na、Li B.O、Cl、H C.As、P、N D.Si、P、S(分数:1.00)A.B. √C.D.解析:26.下列各种晶体中,熔化时需破坏共价键的是( )。
A.CO2 B.SiO2 C.NaCl D.HCl(分数:1.00)A.B. √C.D.解析:27.下列( )共价键的形成可以用sp3杂化来描述。
A.H2O B.NH3C.CCl4 D.以上三种分子都可以(分数:1.00)A.B.C.D. √解析:28.现有一由Na2S、Na2SO3、Na2SO4组成的混合物,经测定硫的质量分数为25.6%,则此混合物中氧元素的质量分数为( )。
A.37.6% B.36.8% C.25.6% D.51.2%(分数:1.00)A. √B.C.D.解析:29.下列物质中,不污染空气的是( )。
A.硫在空气中燃烧的产物 B.煤燃烧的产物C.氢气在空气中燃烧的产物 D.工厂排放的废气(分数:1.00)A.B.C. √D.解析:30.下列物质中既含大量的氧单质,又含氧化物的是( )。
A.海水 B.液氧 C.空气 D.氧化钠(分数:1.00)A.C. √D.解析:31.下列物质中,属于单质的是( )。
A.冰 B.氨 C.苛性钠D.电解水时与电源正极相连接的一极产生的气体(分数:1.00)A.B.C.D. √解析:32.工业上用空气分离法制取氧气的依据是( )。
A.氧气与氮气的化学性质不同 B.氧气与氮气在水中的溶解性不同C.氧气与氮气的密度不同 D.氧气与氮气的沸点不同(分数:1.00)A.B.C.D. √解析:33.在下列关于水性质的说法中属于化学性质的是( )。
A.水在零度时结冰B.在通常状况下,纯水是没有颜色、没有气味的液体C.水在直流电作用下分解生成氢气和氧气D.水能溶解多种物质(分数:1.00)A.B.C. √D.解析:34.通过实验观察,已知X气体有下列性质:①五色、无味、难溶于水;②密度约是空气的1/14;③燃烧时发出淡蓝色火焰;④具有还原性。
则X为( )。
A.氧气 B.一氧化碳 C.氢气 D.二氧化碳(分数:1.00)A.B.C. √D.。