结构化学第六章教案
- 格式:ppt
- 大小:3.40 MB
- 文档页数:78


第六章配位化合物的结构和性质教学目的:通过学习,使学生对配位化合物的三大化学键理论(价键理论、晶体场理论、分子轨道理论)有所了解,并能够运用合适的理论对常见配合物的结构和性质进行理论分析和解释。
教学重点:1.晶体场理论;2.姜-泰勒效应;3.分子轨道理论。
引言:配位化合物简称配合物,又叫络合物,是一类含有中心金属原子(离子)(M)和若干配体(L) 的化合物(MLn)。
中心原子通常是过渡金属元素的原子或离子,具有空的价轨道;而配体则有一对或多对孤对电子。
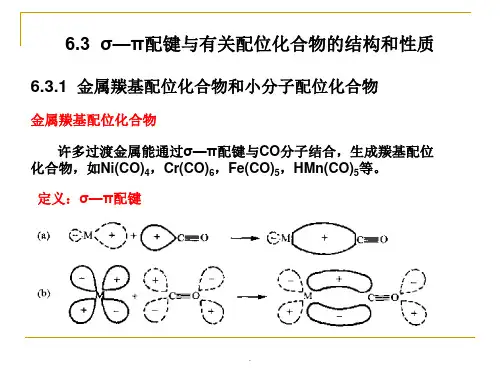
在广泛的化学实践和量子化学巨大发展的基础上,提出了各种解释中心原子和配体之间化学键本质的理论,主要有价键理论、晶体场理论和分子轨道理论第一节价键理论1928年Pauling把杂化轨道理论应用到配合物中,提出了配合物的价键理论。
一、理论要点:配体的配位原子提供孤对电子进入中心原子(或离子)的空的杂化轨道形成配位键;配位键可分为电价配键和共价配键两种,相应的配合物叫做电价配合物和共价配合物。
二、杂化轨道与空间构型三、电价配键和共价配键1、电价配合物中心离子的电子层结构和自由离子的一样,它与配体是以静电作用力结合在一起,常采用spd外轨道杂化,形成高自旋配合物。
电价配合物特点:配体往往电负性大,不易给出孤电子对,中心离子的结构不发生变化。
配合物中配位键共价性较弱,离子性较强;键能小,不稳定,在水中易分解简单粒子;2、共价配合物中心离子腾出内层能量较低的空d轨道,进行dsp内轨道杂化,接受配体的孤对电子,形成低自旋共价配合物。
共价配合物特点:配体往往电负性较小,较易给出孤电子对,对中心离子的影响较大,使其结构发生变化。
配合物中配位键共价性较强,离子性较弱;由于(n-1)d轨道比nd轨道能量低,所以一般共价配合物比电价配合物稳定,在水溶液中不易解离为简单离子。
3.实验测定:通过测定络合物的磁化率,可判断中央离子与配体间化学键性质kTN x A 32μμ=, )()(反顺O M x x x +=μ磁矩cn ehn n e B B πμμμ4,)2(=+=(玻尔磁子) n 未成对电子数有摩尔磁化率X m 可计算络合物的磁矩μ,由μ可估算出n(未成对电子数),从而可判断此络合物是电价配键,或共价配键。

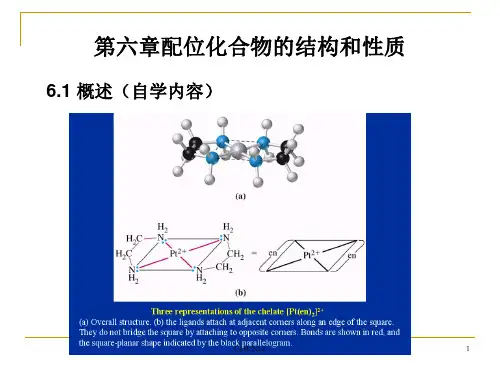
第六章配位化合物的结构和性质
一.基本概念:
1.配合物、中心原子、配体、单核配合物、多核配合物
2.电价配合物、共价配合物、高自旋配合物和低自旋配合物
3.分子磁矩与未成对电子数的关系
4.晶体场、分裂能、成对能、光谱化学序、强场、弱场、晶体场稳定化能5.姜太勒效应和络合物畸变
6. M中σ型轨道和π型轨道
7. M-L之间的σ键及能级次序
8.羰基配合物中的σ-π键
9.π络合物中的σ-π键
10.电子规则和9n-l规则
二.基本计算和应用:
1.VBT与CFT理论对配合物的结构与性质的解释
2.d电子的排布、影响分裂能的因素
3.稳定化能的计算及应用
4.姜太勒效应
5.过渡金属络合物的颜色
6.络合物的几何构型
7.用分子轨道理论说明配合物的成键情况
8.σ-π型配键
三.重点内容
1.晶体场理论,d电子的排布、影响分裂能的因素,稳定化能的计算及应用2.配位场理论,八面体场的分裂,配位场稳定化能及对化合物性质的影响3.姜太勒效应
4.σ-π型配键及配位化合物的结构
四.自学引导
1.由静电作用模型引出晶体场理论,通过d电子轨道分裂引出分裂能、稳定化能及对配合物的结构与性质的解释
2.由分子轨道理论引出配位场理论,通过八面体场的分裂引出配位场稳定化能、姜太勒效应及对化合物性质的解释
3.通过σ-π型配键引出对过渡金属的配位化合物的结构、性质的解释。
五.作业
6.3,6.4,6.5,6.7,6.12,6.14,6.15,6.20, 6.23。

《结构化学》教案教案主题:结构化学教学目标:1.了解分子和化学键的基本概念。
2.掌握常见化合物的结构和命名规则。
3.理解分子的立体构型和它对化学性质的影响。
4.能够用分子模型表示化学反应的过程。
教学重点:1.化学键的概念和分类。
2.分子的结构和命名规则。
3.分子的立体构型和它对化学性质的影响。
教学难点:1.立体构型的理解和应用。
2.分子模型在化学反应中的应用。
教学准备:1. PowerPoint课件。
2.分子模型。
教学过程:Step 1:导入1.引导学生思考:化学是由什么组成的?2.引出本课的主题:结构化学。
3.提出问题:你们知道分子是由什么组成的吗?Step 2:讲解分子的基本概念1.分子的定义:由两个或多个原子通过化学键相连接而成的粒子。
2.化学键的定义:原子之间的相互作用力。
3.分子的分类:单原子分子和多原子分子。
4.分子式的表示方法:用化学符号表示分子中各种原子的种类和数量。
Step 3:讲解化学键的分类1.离子键:电荷相互吸引形成的化学键。
2.共价键:原子之间通过共用电子形成的化学键。
3.金属键:金属原子之间因金属离子和自由电子的相互吸引而形成的化学键。
Step 4:讲解分子的结构和命名规则1.分子式的命名规则:先写元素符号,然后写下标。
2.分子结构的命名规则:根据元素化合价和化学键的性质确定分子结构。
Step 5:讲解分子的立体构型1.立体构型的定义:分子在空间中的排列方式。
2.饱和度的概念:分子中双键数量和环数的总和。
3.分子结构和饱和度的关系:饱和度越高,分子结构越稳定。
4.常见的分子构型:线性、平面三角形、平面四边形、平面五边形、立体四边形等。
Step 6:讲解分子模型在化学反应中的应用1.化学反应过程的表示方法:用分子模型表示反应物和产物。
2.分子模型和化学反应的关系:分子模型能够直观地表示化学反应的过程。
Step 7:小结和反思1.小结本课的主要内容。
2.引导学生思考:结构化学在哪些方面有应用?为什么分子模型在化学反应中有重要作用?教学延伸:1.学生可以自行选择一个分子进行立体构型推测,并用分子模型表示出来。

结构化学电子教案第一章:原子结构与元素周期律1.1 原子结构原子核:质子、中子电子:能量级、轨道量子数:主量子数、角动量量子数、磁量子数、自旋量子数1.2 元素周期律周期表结构:横行、纵列主族元素:性质与位置关系过渡元素:性质与位置关系稀有气体元素第二章:化学键与分子结构2.1 化学键类型离子键:形成条件、性质共价键:形成条件、性质金属键:形成条件、性质氢键:形成条件、性质2.2 分子的几何构型与键角VSEPR模型:预测分子几何构型杂化轨道:sp、sp^2、sp^3、sp^3d、sp^3d^2键角:孤对电子对键角的影响第三章:晶体结构与固体化学3.1 晶体类型离子晶体:构成微粒、性质分子晶体:构成微粒、性质金属晶体:构成微粒、性质原子晶体:构成微粒、性质3.2 固体化学半导体:导电性质、应用超导体:导电性质、应用绝缘体:导电性质、应用第四章:化学反应与化学平衡4.1 化学反应类型合成反应:特点、实例分解反应:特点、实例置换反应:特点、实例复分解反应:特点、实例4.2 化学平衡平衡常数:定义、计算、应用影响平衡的因素:温度、浓度、压强平衡移动原理:勒夏特列原理第五章:物质结构分析方法5.1 紫外光谱:原理、应用π-π吸收n-π吸收分子内电荷转移吸收5.2 红外光谱:原理、应用functional groups:吸收频率与化学键关系分子结构分析:多官能团化合物的红外光谱解析5.3 核磁共振谱:原理、应用核磁共振现象:进动频率、化学位移分子结构分析:一维、二维核磁共振谱解析第六章:X射线荧光光谱(XRF)6.1 XRF原理X射线与物质的相互作用激发态和荧光的产生谱图的解析6.2 XRF应用元素分析合金分析环境监测第七章:原子吸收光谱(AAS)7.1 AAS原理原子化过程吸收光谱的产生检测限和准确度7.2 AAS应用金属元素分析环境样品分析生物样品分析第八章:质谱分析8.1 质谱原理质量分析器离子源检测器8.2 质谱应用分子结构和组成的确定生物大分子分析药物分析第九章:电化学分析9.1 电化学原理电极过程电位滴定电流滴定9.2 电化学应用酸碱滴定氧化还原滴定离子选择性电极第十章:现代结构分析技术10.1 扫描电子显微镜(SEM)原理与操作图像解析样品制备10.2 透射电子显微镜(TEM)原理与操作图像解析样品制备10.3 核磁共振成像(MRI)原理与操作图像解析应用领域重点和难点解析:1. 原子结构与元素周期律:理解原子的内部结构,包括质子、中子、电子以及量子数的分布,是学习化学的基础。




结构化学电子教案第一章:原子结构与元素周期表1.1 原子结构电子的排布原子核的构成原子的大小和质量1.2 元素周期表周期表的构成主族元素的特点过渡元素的特点稀有气体的特点第二章:化学键与分子结构2.1 化学键离子键的形成与性质共价键的形成与性质金属键的形成与性质2.2 分子结构分子几何形状分子轨道理论键角和键长第三章:晶体结构与固体化学3.1 晶体结构晶体的基本概念晶体的类型与性质晶体的空间点阵3.2 固体化学固体的分类半导体的性质与应用超导体的性质与应用第四章:化学键的极性与分子的极性4.1 化学键的极性化学键极性的判断化学键极性对分子性质的影响4.2 分子的极性分子极性的判断分子极性对物质性质的影响分子极性与分子的溶脂性第五章:化学反应与键的变化5.1 化学反应的基本概念化学反应的类型化学反应的速率化学平衡5.2 键的变化化学键的断裂与形成化学反应中的能量变化化学反应的催化剂第六章:立体化学与分子轨道对称性6.1 立体化学基础手性碳原子立体异构体旋光性和偏振光6.2 分子轨道对称性群论基础分子轨道的对称性分子轨道对称性与化学键第七章:现代结构分析技术7.1 X射线晶体学X射线晶体学原理晶体学的布拉格定律X射线晶体衍射图谱分析7.2 核磁共振(NMR)NMR原理化学位移和耦合常数NMR谱图的解析第八章:化学键的电子效应与分子性质8.1 电子效应吸电子效应给电子效应诱导效应与共振效应8.2 分子性质分子极性与化学性质分子轨道与化学键的关系分子间作用力与物质的性质第九章:有机化合物的结构与性质9.1 有机化合物的基本结构碳原子四价键的特点有机化合物的命名规则有机化合物的结构式与键角9.2 有机化合物的性质有机化合物的反应类型有机化合物的官能团与性质有机化合物的生物活性第十章:现代化学研究方法简介10.1 量子化学计算量子化学基本原理分子轨道理论量子化学计算方法10.2 谱学方法红外光谱质谱紫外光谱和荧光光谱10.3 化学研究的新技术扫描隧道显微镜(STM)原子力显微镜(AFM)核磁共振成像(MRI)重点解析第一章:原子结构与元素周期表重点:元素周期表的构成、主族元素、过渡元素和稀有气体的特点。
《结构化学》课程大纲英文名称:Structural Chemistry 课程编号:407021030适用专业:化学本科学分数:4一、课程性质结构化学属于化学一级学科下的物理化学二级学科,在化学本科专业的培养计划中属于专业模块课程,是专业基础系列课程之一。
二、课程理念结构化学是化学的理论基础。
结构化学以量子力学基本原理为基础,主要任务是描述微观粒子的运动规律,揭示结构—性能之间的关系。
结构化学总结归纳出的许多重要的概念(如原子轨道和分子轨道)、规律(如对称性和对称原理)以及许多重要的实验手段(如衍射、光谱、能谱和磁共振)对化学学科及相关科学有重要的指导作用。
该课程对学生其它课程的理论知识学习和理解,以及科研素养的培养和提高有着至关重要的影响。
结构化学课程面向化学专业的学生。
结构化学课程所讲授的基本理论涵盖于各化学分支,是化学各相关专业学生应掌握的最基本、最重要的理论。
因此,这门课对化学教育专业的本科生培养都有重要意义。
针对我院化学专业三年级的学生开设。
学生已有《高等数学》、《大学物理》、《无机化学》、《分析化学》、《有机化学》、《物理化学》等化学以及数学、物理理论基础,而结构化学可以运用数学和物理方法,从理论的层面解释并讨论基础的化学知识。
因此,结构化学与《中级无机化学》、《中级有机化学》等课程关系密切。
通过本课程的教与学,使物质结构的理论与化学性质相结合,不仅使学生掌握结构的基本理论和基本知识,还能培养学生独立分析问题和解决问题的能力及严谨的科学作风,提高学生的化学专业素养,为将来从事化学方面研究及相关工作奠定良好的基础。
结构化学的学习对从事化学研究与化学教学都是必须的。
结构化学课程是大学本科化学各专业的重要主干基础课。
由于该课程涉及的面广,又比较抽象,要求学生具有较多的数理知识和较强的空间想象能力,该课程是大学阶段化学专业课程中最难学的课程之一,但该课程对培养学生逻辑思维和空间想象力有着至关重要的影响。