结构化学 第六章
- 格式:ppt
- 大小:1.86 MB
- 文档页数:42



结构化学第六章配位化合物结构6001试述正八而体场中,中心离子d轨道的分裂方式6002试用分子轨逍理论阐明X , NH3和CN-的配体场强弱的次序。
6003按配位场理论,在Oh场中没有高低自旋络合物之分的组态是:----------- ()(A)d3 (B)d4 (C) d5 (D) d6 (E) d76004凡是中心离子电子组态为d6的八而体络合物,苴LFSE都是相等的,这一说法是否正确?6005络合物的中心离子的d轨道在正方形场中,将分裂成几个能级:-------------- ()(A) 2 (B)3 (C)4 (D)56006Fe(CN)63-的LFSE= ________________ 「6007凡是在弱场配位体作用下,中心离子d电子一立取高自旋态:凡是在强场配位体作用下,中心离子d电子一立取低自旋态。
这一结论是否正确?6008Fc(CN)6#中,CN-是强场配位体,FJ+的电子排布为心,故LFSE为________________ 。
6009尖晶石的一般表示式为AB2O4,其中氧离子为密堆积,当金属离子A占据正四而体门空隙时,称为正常尖晶石,而当A占据Oh空隙时,称为反尖晶石,试从晶体场稳左化能计算说明NiAl2O4晶体是什么型尖晶石结构(Ni?+为於结构)。
6010在Fe(CN)64-中的F2+离子半径比Fe(H2O)62+中的F2+离子半径大还是小?为什么?6011 作图证明CO是个强配位体。
6012CoFf啲成对能为21? 000cm1,分裂能为13? 000cnr1,试写出:(l)d电子排布⑵LFSE值(3)电子自旋角动捲⑷ 磁矩6013已知ML6络合物中(M%为的,>1,尸20? 000 cm-1, P= 25? 000 cm1,它的LFSE 绝对值等于多少? ----------------------- ()(A)0 (B) 25? 000 cnr1 (C) 54? 000 cnr1 (D) 8000 cnr16014四角方锥可认为是正八而体从z方向拉长,且下端没有配体L的情况。

第六章配位化合物的结构和性质
一.基本概念:
1.配合物、中心原子、配体、单核配合物、多核配合物
2.电价配合物、共价配合物、高自旋配合物和低自旋配合物
3.分子磁矩与未成对电子数的关系
4.晶体场、分裂能、成对能、光谱化学序、强场、弱场、晶体场稳定化能5.姜太勒效应和络合物畸变
6. M中σ型轨道和π型轨道
7. M-L之间的σ键及能级次序
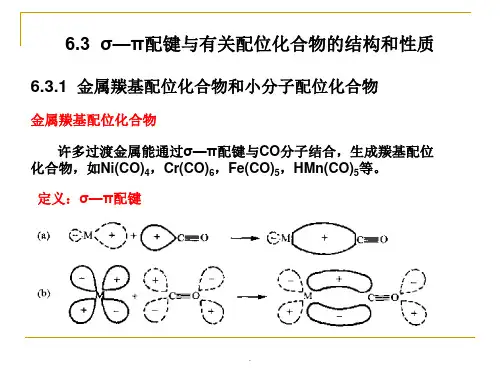
8.羰基配合物中的σ-π键
9.π络合物中的σ-π键
10.电子规则和9n-l规则
二.基本计算和应用:
1.VBT与CFT理论对配合物的结构与性质的解释
2.d电子的排布、影响分裂能的因素
3.稳定化能的计算及应用
4.姜太勒效应
5.过渡金属络合物的颜色
6.络合物的几何构型
7.用分子轨道理论说明配合物的成键情况
8.σ-π型配键
三.重点内容
1.晶体场理论,d电子的排布、影响分裂能的因素,稳定化能的计算及应用2.配位场理论,八面体场的分裂,配位场稳定化能及对化合物性质的影响3.姜太勒效应
4.σ-π型配键及配位化合物的结构
四.自学引导
1.由静电作用模型引出晶体场理论,通过d电子轨道分裂引出分裂能、稳定化能及对配合物的结构与性质的解释
2.由分子轨道理论引出配位场理论,通过八面体场的分裂引出配位场稳定化能、姜太勒效应及对化合物性质的解释
3.通过σ-π型配键引出对过渡金属的配位化合物的结构、性质的解释。
五.作业
6.3,6.4,6.5,6.7,6.12,6.14,6.15,6.20, 6.23。