
第一章蒸汽压缩式制冷的热力学原理
第三节液体过冷、蒸汽过热及回热循环
一、液体过冷
1. 定义
液体过冷:液体制冷剂的温度低于其压力所对应的饱和液体温度。
过冷度:液体过冷温度和其压力所对应的饱和液体温度之差。
具有液体过冷的循环称为液体过冷循环。
2. 分析
3. 实现方法
1. 冷凝器后装过冷器(★图1-6)
2. 设计,选型时,适当增大冷凝器面积F×1.15(较多使用)
3. 制冷系统中设置回热器,采用回热循环
二、蒸汽过热
1. 定义
蒸汽过热:制冷剂蒸汽的温度高于其压力所对应的饱和温度。
过热度:蒸汽过热后的温度和同压力下饱和温度的差值。
具有蒸汽过热的循环称为蒸汽过热循环。
有效过热:过热吸收热量来自被冷却介质,产生有用的制冷效果。
有害过热:过热吸收热量来自被冷却介质以外,无制冷效果。
3. 过热分析如p=1atm时,水的ts =100℃,而通常自来水的温度为20℃,自来水即为过冷液体,过冷度为80℃。
点4’的温度:过冷温度t rc
过冷度△t r c=t k-t rc
过冷器中通以温度较低的冷却水,如深井水等。可获得较大的过冷度。
液体过冷会增大初投资及运行费用,通常对大型的制冷装置才采用液体过冷,而且根据计算,当蒸发温度低于-5℃时,应用液体过冷才是有利的。故一般空调用制冷装置都不采用液体过冷。对于大型的且蒸发温度很低的制冷装置,在条件许可时尽可能采用液体过冷。
有效过热指能带来制冷效果的过热,如蒸汽
热发生在蒸发器本身,或发生在安装于被冷却室内的吸气管道上。
4. 压缩机的吸气比容增大,意味着每公斤制冷剂将需要更大的压缩机容积,或对给定的压缩机而言,它将意味着制冷量下降:循环的单位容积制冷量下降,制冷系数下降。
吸气过热对循环及压缩机都有不利影响。吸气管路中蒸汽过热的程度,与蒸发温度和管路的绝热程度有关。节
有效过热分析:对循环是否有益与制冷剂性质有关。
2. 过热原因
a. 蒸发器面积大于设计所需面积(有效过热)
b. 蒸发器与压缩机间的连接管道吸取外界环境热量而过热(有害)
c. 连接管道吸取被冷却对象的热量而过热(有效)
d. 系统中设置回热器(有害过热,但有过冷过程伴随)
★实际运行中,希望有适当的过热度:
氨:过热度5~8℃
氟利昂:可采取较大的过热度
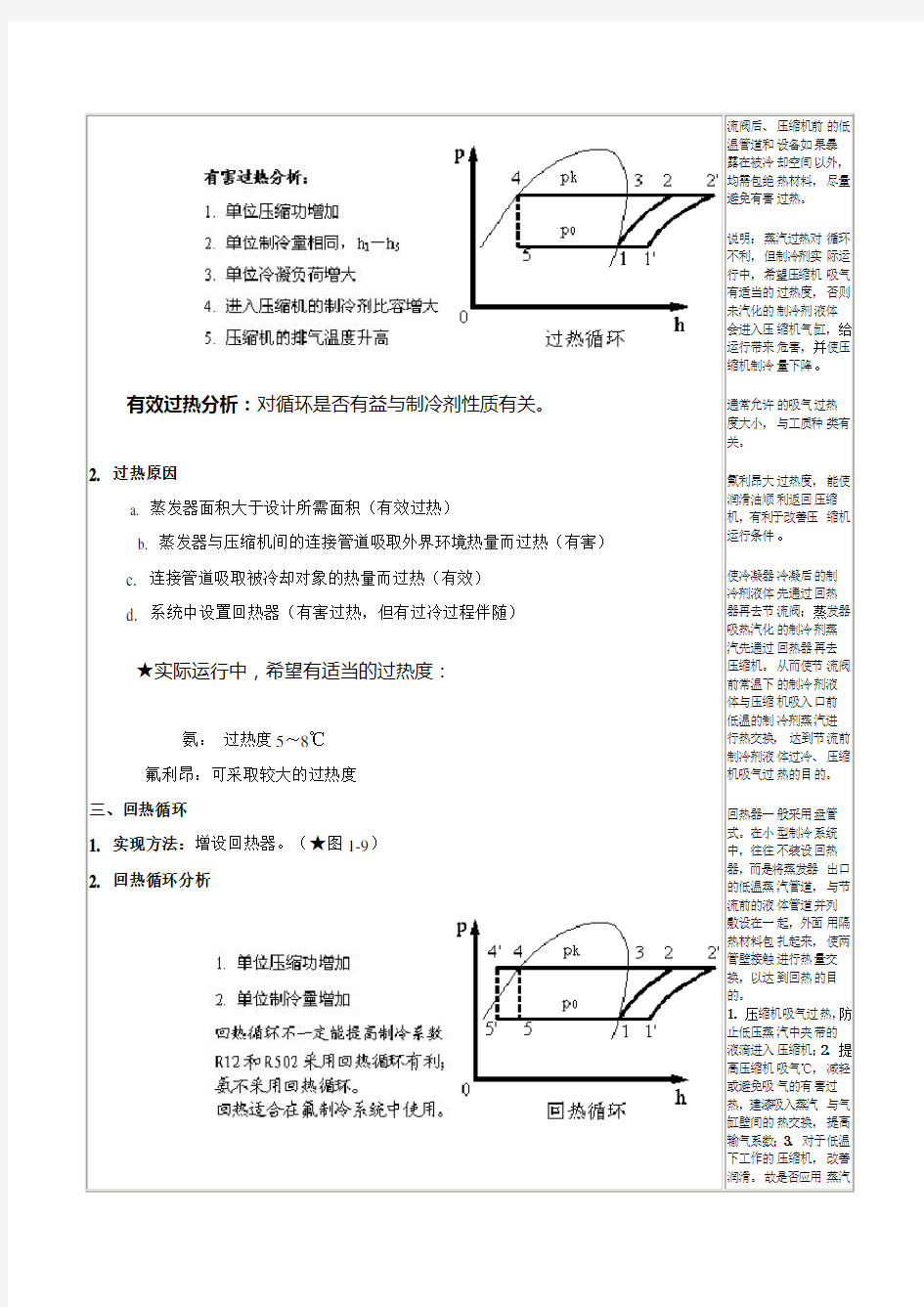
三、回热循环
1. 实现方法:增设回热器。(★图1-9)
2. 回热循环分析流阀后、压缩机前的低温管道和设备如果暴露在被冷却空间以外,均需包绝热材料,尽量避免有害过热。
说明:蒸汽过热对循环不利,但制冷剂实际运行中,希望压缩机吸气有适当的过热度,否则未汽化的制冷剂液体会进入压缩机气缸,给运行带来危害,并使压缩机制冷量下降。
通常允许的吸气过热度大小,与工质种类有关。
氟利昂大过热度,能使润滑油顺利返回压缩机,有利于改善压缩机运行条件。
使冷凝器冷凝后的制冷剂液体先通过回热器再去节流阀;蒸发器吸热汽化的制冷剂蒸汽先通过回热器再去压缩机。从而使节流阀前常温下的制冷剂液体与压缩机吸入口前低温的制冷剂蒸汽进行热交换,达到节流前制冷剂液体过冷、压缩机吸气过热的目的。
回热器一般采用盘管式。在小型制冷系统中,往往不装设回热器,而是将蒸发器出口的低温蒸汽管道,与节流前的液体管道并列敷设在一起,外面用隔热材料包扎起来,使两管壁接触进行热量交换,以达到回热的目的。
1. 压缩机吸气过热,防止低压蒸汽中夹带的液滴进入压缩机;
2.提高压缩机吸气℃,减轻或避免吸气的有害过热,建漆吸入蒸汽与气缸壁间的热交换,提高输气系数;
3. 对于低温下工作的压缩机,改善润滑。故是否应用蒸汽
《工程热力学与发动机原理》复习提纲 工程热力学基础部分 1、基本概念:工质、压力、温度、比容、内能、焓、熵、功、热 量、热力循环等概念。 2、热力学第一定律、热力学第二定律的内容。 3、评定理想循环的两个指标:定义式、各参数含义。 4、内燃机理想循环的简化条件。 5、内燃机三种理想循环:p-v图及T—s图;各循环特点。 6、 理想循环热效率的比较 1)在初态、循环吸热量Q1、压缩比ε 相等时比较;2)在初态、循环吸热量Q1、最高压力相等时比 较。 7、 压缩比ε、压力升高比λ、预胀比ρ及绝热指数k对发动机三种 理想循环的影响。 第1章发动机的性能 1、发动机实际循环与热损失 1、四行程发动机的实际循环行程与过程;两种示功图;排气温度Tr;压缩过程多变指数的变化;膨胀过程多变指数的变化。 2、实际循环的热损失。 3、非增压柴油机理论循环和实际循环p-V图的比较。 二、发动机性能指标 1、两类指标的作用。 2、各性能指标的定义、关系式、单位、符号。 三、机械损失 1)机械损失种类; 2)机械效率定义、意义及各计算式; 3)机械损失测定方法; 4)影响机械效率的因素分析。 第二章发动机的换气过程 一、四行程发动机换气过程进行情况 1、换气过程分期 2、影响超临界排气、亚临界排气废气流量的因素 3、燃烧室扫气的作用。 二、换气损失: 1、换气损失与泵气损失;2、换气损失图。 三、充气效率ηv
1、定义; 2、意义; 3)测定方法。 四、影响充气效率的因素分析 1、进气终了压力;2、进气终了温度; 3、压缩比; 4、残余废气系数; 5、配气定时; 6、进气状态。 五、提高充气效率的措施 1、减少进气系统的阻力。 2、合理选择配气定时: 1)配气定时合理程度的综合评定;2)充气效率特性;3)进气迟闭角对充气效率、有效功率的影响。 3、合理利用进气管内的动态效应。 4、使用可变技术。 第三章燃料与燃烧 1、柴油的使用性能、汽油的使用性能。 2、各概念及定义式:理论空气量;实际空气量;过量空气系数;空燃比;理论分子变更系数;燃料的热值;混合气热值。 第四章汽油机混合气形成和燃烧 一、燃烧过程 1、正常燃烧过程进行情况: 1)燃烧过程分期及各阶段特点与要求;2)影响燃烧速度的因素;3)不规则燃烧的产生原因。 2、不正常燃烧: 1)爆燃 产生原因及危害; 2)表面点 火 产生原因危害。 二、汽油机调整特性 1. 燃料调整特性:1)定义;2)曲线;3)功率混合比、经 济混合比。 2. 点火提前角调整特性:1)定义;2)曲线。 三、使用因素对燃烧过程及爆燃的影响 1、混合气浓度;2、点火提前角;3、转速;4、负荷;5、大气状况。 四、燃烧室 1、燃烧室设计原则; 2、几种常用典型燃烧室的特点;3、汽油机分层燃烧的目的、方案。 第五章柴油机混合气形成过程和燃烧 一、柴油机的燃烧过程
生活中的热力学 摘要:生活中的热力学现象无处不在,热力学现象的本质和原理亦来自生活。其实我们身边经常可以看到很多和热力学有关的现象。热力学第零定律、热力学第一定律、热力学第二定律、热力学第三定律是热力学的基本定律,高压锅、空调、电冰箱是生活中常见的用电器。 关键词:热力学定律 热力学第一定律也叫能量不灭原理,就是能量守恒定律。它指出,热能可以从一个物体传递给另一个物体,也可以与机械能或其他能量相互转换,在传递和转换过程中,能量的总值不变。 热力学第一定律的另一种表述是:第一类永动机是不可能造成的。表征热力学系统能量的是内能,通过做功和传热,系统与外界交换能量,使内能有所变化。根据普遍的能量守恒定律,系统由初态Ⅰ经过任意过程到达终态Ⅱ后,内能的增量ΔE应等于在此过程中外界对系统传递的热量Q和系统对外界做功W之差,即 EⅡ-EⅠ=ΔE=Q-W 或 Q=ΔE+W 这就是热力学第一定律的表达式。对于无限小过程,热力学第一定律的微分表达式为 dQ=dE+dW 其中,E是态函数,dE是全微分;Q、W是过程量,dQ和dW只表示微小量并非全微分,用符号d以示区别。又因ΔE或dE只涉及初、终态,只要求系统初、终态是平衡态,与中间状态是否是平衡态无关。 热力学第二定律一般有两个表述: 1.开尔文表述:不可能制成一种循环动作的热机,只从单一热源吸取热量,使之完全变成有用的功而不产生其他影响。 2.克劳休斯表述:热量不可能自动地从低温物体传到高温物体。 其实这两种表述是等价的,我们知道自然界中的各种不可逆过程都是互相关联的。而这两种表述的区别在,克氏表述指出:热传导过程是不可逆的;开氏表述指出:功变热(确切地说,是机械能转化为内能)的过程是不可逆的。两种表述均指出在自然界中任何的过程都不可能自动地复原,要使系统从终态回到初态必
第八章 热力学基础 一、选择题 [ A ]1.(基础训练4)一定量理想气体从体 积 V 1,膨胀到体积V 2分别经历的过程是:A →B 等压过程,A → C 等温过程;A → D 绝热过程,其中吸热量最多的过程 (A)是A →B. (B)是A →C. (C)是A →D. (D)既是A →B 也是A →C , 两过程吸热一样多。 【提示】功即过程曲线下的面积,由图可知AD AC AB A A A >>; 根据热力学第一定律:E A Q ?+= AD 绝热过程:0=Q ; AC 等温过程:AC A Q =; AB 等压过程:AB AB E A Q ?+=,且0 >?AB E [ B ]2.(基础训练6)如图所示,一绝热密闭的容器,用隔板分成相等的两部分,左边盛有一定量的理想气体,压强为p 0,右边为真空.今将隔板 抽去,气体自由膨胀,当气体达到平衡时,气体的压强是 (A) p 0. (B) p 0 / 2. (C) 2γp 0. (D) p 0 / 2γ. 【提示】该过程是绝热自由膨胀:Q=0,A=0;根据热力学第一定律Q A E =+?得 0E ?=, ∴0T T =;根据状态方程pV RT ν=得00p V pV =;已知02V V =,∴0/2p p =. [ D ]3.(基础训练10)一定量的气体作绝热自由膨胀,设其热力学能增量为E ?,熵增量为S ?,则应有 (A) 0......0=???=?S E 【提示】由上题分析知:0=?E ;而绝热自由膨胀过程是孤立系统中的不可逆过
第三章 流体的热力学性质 一、选择题(共7小题,7分) 1、(1分)对理想气体有( )。 )/.(??T P H B 0)/.(=??T P H C 0)/.(=??P T H D 2、(1分)对单位质量,定组成的均相流体体系,在非流动条件下有( )。 A . dH = TdS + Vdp B .dH = SdT + Vdp C . dH = -SdT + Vdp D. dH = -TdS -Vdp 3、(1分)对1mol 符合)/(b V RT P -=状态方程的气体,T P S )(??应是( ) A.R/V ; B.R ; C. -R/P ; D.R/T 。 4、(1分)对1molVan der Waals 气体,有 。 A. (?S/?V)T =R/(v-b) B. (?S/?V)T =-R/(v-b) C. (?S/?V)T =R/(v+b) D. (?S/?V)T =P/(b-v) 5、(1分)对理想气体有 A. (?H/?P)T <0 B. (?H/?P)T >0 C. (?H/?P)T =0 6、(1分)对1mol 理想气体 T V S )(??等于__________ A R V - B V R C R p D R p - 二、填空题(共3小题,3分) 1、(1分)常用的 8个热力学变量 P 、V 、T 、S 、h 、U 、A 、G 可求出一阶偏导数336个,其中独立的偏导数共112个,但只有6个可通过实验直接测定,因此需要用 将不易测定的状态性质偏导数与可测状态性质偏导数联系起来。 2、(1分)麦克斯韦关系式的主要作用是 。 3、(1分)纯物质T-S 图的拱形曲线下部称 区。 三、名词解释(共2小题,8分) 1、(5分)剩余性质: 2、(3分)广度性质 四、简答题(共1小题,5分) 1、(5分)简述剩余性质的定义和作用。(5分) 五、计算题(共1小题,12分) 1、(12分)(12分)在T-S 图上画出下列各过程所经历的途径(注明起点和箭头方向),并说明过程特点:如ΔG=0 (1)饱和液体节流膨胀;(3分) (2)饱和蒸汽可逆绝热膨胀;(3分) (3)从临界点开始的等温压缩;(3分) (4)过热蒸汽经冷却冷凝为过冷液体(压力变化可忽略)。(3分)
热力学部分 第一章 热力学的基本规律 1、热力学与统计物理学所研究的对象:由大量微观粒子组成的宏观物质系统 其中所要研究的系统可分为三类 孤立系:与其他物体既没有物质交换也没有能量交换的系统; 闭系:与外界有能量交换但没有物质交换的系统; 开系:与外界既有能量交换又有物质交换的系统。 2、热力学系统平衡状态的四种参量:几何参量、力学参量、化学参量和电磁参量。 3、一个物理性质均匀的热力学系统称为一个相;根据相的数量,可以分为单相系和复相系。 4、热平衡定律(热力学第零定律):如果两个物体各自与第三个物体达到热平衡,它们彼此 也处在热平衡. 5、符合玻意耳定律、阿氏定律和理想气体温标的气体称为理想气体。 6、范德瓦尔斯方程是考虑了气体分子之间的相互作用力(排斥力和吸引力),对理想气体状 态方程作了修正之后的实际气体的物态方程。 7、准静态过程:过程由无限靠近的平衡态组成,过程进行的每一步,系统都处于平衡态。 8、准静态过程外界对气体所作的功:,外界对气体所作的功是个过程量。 9、绝热过程:系统状态的变化完全是机械作用或电磁作用的结果而没有受到其他影响。绝 热过程中内能U 是一个态函数:A B U U W -= 10、热力学第一定律(即能量守恒定律)表述:任何形式的能量,既不能消灭也不能创造, 只能从一种形式转换成另一种形式,在转换过程中能量的总量保持恒定;热力学表达式: Q W U U A B +=-;微分形式:W Q U d d d += 11、态函数焓H :pV U H +=,等压过程:V p U H ?+?=?,与热力学第一定律的公 式一比较即得:等压过程系统从外界吸收的热量等于态函数焓的增加量。 12、焦耳定律:气体的内能只是温度的函数,与体积无关,即)(T U U =。 13.定压热容比:p p T H C ??? ????=;定容热容比:V V T U C ??? ????= 迈耶公式:nR C C V p =- 14、绝热过程的状态方程:const =γpV ;const =γ TV ;const 1 =-γγT p 。 15、卡诺循环过程由两个等温过程和两个绝热过程组成。正循环为卡诺热机,效率 211T T -=η,逆循环为卡诺制冷机,效率为2 11T T T -=η(只能用于卡诺热机)。 16、热力学第二定律:克劳修斯表述:不可能把热量从低温物体传到高温物体 而不引起其他变化(表明热传导过程是不可逆的); 开尔文(汤姆孙)表述:不可能从单一热源吸收热量使之完全变成有用的功而不引起其 他变化(表明功变热的过程是不可逆的); 另一种开氏表述:第二类永动机不可能造成的。 V p W d d -=
第一章 工程热力学基础 1) 工质(重点) 在工程热力学中,把实现热能与机械功相互转换的工作物质称为工质。 2) 热能的传递方式 热能可由工质通过传导、对流或辐射等方式来进行传递。 3) 热力学第一、第二定律-能量平衡方程(重点) 热力学第一定律:热和功可以相互转换,转换前、后的能量保持不变。 热力学第二定律:实现热功转换的条件以及自发过程进行的方向性和不可逆性 4) 理想气体状态方程。 在气体平衡状态下,理想气体的压力、温度和比容三者之间的关系式称为理想气体状 态方程式,它是根据分子运动学说导出的。 对于1kg 理想气体,状态方程式为: pv=RT 对于mkg 理想气体,状态方程式为: pV=mRT 式中:V=mv ,它是mkg 气体所占的总容积。 5) 气体的热力过程主要有哪几种? (重点) 定容、定温、定压、绝热 第二章 发动机工作循环和性能指标 1) 理论循环分为哪几种形式? (重点) 理论循环包括三种形式: a )定容循环; b )定压循环; c )混合循环 2) 发动机实际工作循环哪几个过程组成,哪几个行程组成? (重点) 实际工作循环则是由进气、压缩、燃烧、膨胀、排气五个过程所组成的,进气、压缩、 供气、排气四个行程组成。 3) 发动机的指示性能指标、有效性能指标(有效功率、有效转矩、有效燃油消耗 率)和强化指标(重点) 发动机的指示性能指标是以工质对活塞所做之功为计算基准的指标。指示指标不受动 力输出过程中机械摩擦和附件消耗等各种外来因素的影响,直接反映由燃烧到热功转换工作循环进行的好坏。 指示功率:发动机单位时间内所做的指示功,用 P i 表示 发动机的指示功率(每秒所做的指示功)为: 10330260-??=??=in i n V p W P s i i i ττ 式中:τ ——行程数(四行程τ =4,二行程τ =2)。 指示燃油消耗率:指单位指示功的耗油量,也就是发动机每小时发出1kW 指示功率 时所消耗的燃油量,用g i 表示 指示热效率:指实际循环指示功与所消耗的燃油热量的比值,用ηi 表示。
热力学基础作业 班级:_____________ 姓名:_____________ 学号:_____________ 日期:__________年_______月_______日 成绩:_____________ 一、选择题 1. 一定量某理想气体按pV 2=恒量的规律膨胀,则膨胀后理想气体的温度 (A) 将升高. (B) 将降低. (C) 不变. (D)升高还是降低,不能确定. [ ] 2. 若室内生起炉子后温度从15℃升高到27℃,而室内气压不变,则此时室内的分子数减少了 (A)0.500. (B) 400. (C) 900. (D) 2100. [ ] 3. 若理想气体的体积为V ,压强为p ,温度为T ,一个分子的质量为m ,k 为玻尔兹曼常量,R 为普适气体常量,则该理想气体的分子数为: (A) pV / m . (B) pV / (kT ). (C) pV / (RT ). (D) pV / (mT ). [ ] 4. 理想气体向真空作绝热膨胀. (A) 膨胀后,温度不变,压强减小. (B) 膨胀后,温度降低,压强减小. (C) 膨胀后,温度升高,压强减小. (D) 膨胀后,温度不变,压强不变. [ ] 5. 对于理想气体系统来说,在下列过程中,哪个过程系统所吸收的热量、内能的增量和对外作的功三者均为负值? (A) 等体降压过程. (B) 等温膨胀过程. (C) 绝热膨胀过程. (D) 等压压缩过程. [ ] 6. 如果卡诺热机的循环曲线所包围的面积从图 中的abcda 增大为da c b a '',那么循环abcda 与da c b a ''所作的净功和热机效率变化情况是: (A) 净功增大,效率提高. (B) 净功增大,效率降低. (C) 净功和效率都不变. (D) 净功增大,效率不变. [ ] 7. 两个卡诺热机的循环曲线如图所示,一个工作在温度为T 1 与T 3的两个热源之间,另一个工作在温度为T 2 与T 3的两个热源之间,已知这两个循环曲线所包围的面积相等.由此可知: (A ) 两个热机的效率一定相等. (B ) 两个热机从高温热源所吸收的热量一定相等. c ' d T 2 a b b ' c T 1V O p
The factors that cause a process to be irreversible are called irreversibilities. They include friction, unrestrained expansion, mixing of two fluids, heat transfer across a finite temperature difference, electric resistance, inelastic deformation of solids, and chemical reactions. The presence of any of these effects renders a process irreversible. A reversible process involves none of these. Some of the frequently encountered irreversibilities are discussed briefly below. Friction is a familiar form of irreversibility associated with bodies in motion. When two bodies in contact are forced to move relative to each other (a piston in a cylinder, for example, as shown in Fig. 6–32), a friction force that opposes the motion develops at the interface of these two bodies, and some work is needed to overcome this friction force. The energy supplied as work is eventually converted to heat during the process and is transferred to the bodies in contact, as evidenced by a temperature rise at the interface. When the direction of the motion is reversed, the bodies are restored to their original position, but the interface does not cool, and heat is not converted back to work. Instead, more of the work is converted to heat while overcoming the friction forces that also oppose the reverse motion. Since the system (the moving bodies) and the surroundings cannot be returned to their original states, this process is irreversible. Therefore, any process that involves friction is irreversible. The larger the friction forces involved, the more irreversible the process is. Friction does not always involve two solid bodies in contact. It is also encountered between a fluid and solid and even between the layers of a fluid moving at different velocities. A considerable fraction of the power produced by a car engine is used to overcome the friction (the drag force) between the air and the external surfaces of the car, and it eventually becomes part of the internal energy of the air. It is not possible to reversethis process and recover that lost power, even though doing so would not violate the conservation of energy principle. Another example of irreversibility is the unrestrained expansion of a gas separated from a vacuum by a membrane, as shown in Fig. 6–33. When the membrane is ruptured, the gas fills the entire tank. The only way to restore the system to its original state is to compress it to its initial volume, while transferring heat from the gas until it reaches its initial temperature. From the conservation of energy considerations, it can easily be shown that the amount of heat transferred from the gas equals the amount of work done on the gas by the surroundings. The restoration of the surroundings involves conversion of this heat completely to work, which would violate the second law. Therefore, unrestrained expansion of a gas is an irreversible process. A third form of irreversibility familiar to us all is heat transfer through a finite temperature difference. Consider a can of cold soda left in a warm room (Fig. 6–34). Heat is transferred from the warmer room air to the cooler soda. The only way this process can be reversed and the soda restored to its original temperature is to provide refrigeration, which requires some work input. At the end of the reverse process, the soda will be restored to its initial state, but the surroundings will not be. The internal energy of the surroundings will increase by an amount equal in magnitude to the work supplied to the refrigerator. The restoration of the surroundings to the initial state can be done only by converting this excess internal energy completely to work, which is impossible to do without violating the second law. Since only the system, not both the system and the surroundings, can be restored to its initial condition, heat transfer through a finite temperature difference is an irreversible process. Heat transfer can occur only when there is a temperature difference between a system and its surroundings. Therefore, it is physically impossible to have a reversible heat transfer process. But a heat transfer process becomes less and less irreversible as the temperature difference between the two bodies approaches zero. Then heat transfer through a differential temperature difference dT can be considered to be reversible. As dT approaches zero, the process can be reversed in direction (at least theoretically) without requiring any refrigeration. Notice that reversible heat transfer is a conceptual process and cannot be duplicated in the real world. The smaller the temperature difference between two bodies, the smaller the heat transfer rate will be. Any significant heat transfer through a small temperature difference requires a very large surface area and a very long time. Therefore, even though approaching reversible heat transfer is desirable from a thermodynamic point of view, it is impractical and not economically feasible.
大学物理课堂作业 热力学基础 一、填空题 1 在p?V图上 (1) 系统的某一平衡态用_____________来表示; (2) 系统的某一平衡过程用________________来表示; (3) 系统的某一平衡循环过程用__________________来表示; 2.处于平衡态A的一定量的理想气体,若经准静态等体过程变到平衡态B,将从外界吸收热量416 J,若经准静态等压过程变到与平衡态B有相同温度的平衡态C,将从外界吸收热量582 J,所以,从平衡态A变到平衡态C的准静态等压 过程中气体对外界所作的功为____________________. 3.一定量的某种理想气体在等压过程中对外作功为200 J.若此种气体为单 原子分子气体,则该过程中需吸热_____________ J;若为双原子分子气体,则 需吸热______________ J. 4.可逆卡诺热机可以逆向运转.逆向循环时, 从低温热源吸热,向高温热源放热,而且吸的热量和放出的热量等于它正循环时向低温热源放出的热量和从高温热源吸的热量.设高温热源的温度为T1 =450 K , 低温热源的温度为T2 =300 K, 卡诺热机逆向循环时从低温热源吸热Q2 =400 J,则该卡诺热机逆向循环一次外界必须 作功W=_________. 5. 一热机从温度为727℃的高温热源吸热,向温度为527℃的低温热源放热.若 热机在最大效率下工作,且每一循环吸热2000 J ,则此热机每一循环作功_____ ____________ J. 6. 从统计的意义来解释, 不可逆过程实质上是一个________________________ __________________________的转变过程, 一切实际过程都向着_____________ _____________________________的方向进行. γC p/C V为已知)的循环过程如T-V图所示,其中CA为绝热过程,7. 1 mol 理想气体(设= A点状态参量(T1,V1)和B点的状态参量(T2,V2)为已知.试求C点的状态参量:
一.习题部分 1.试由??-== 212 1,vdp w pdv w t .导出理想气体进行可逆绝热过程时过程功和技术功的计算式。 解:可逆过程的过程功?=21pdv w ,由绝热过程方式k k pv v p =11,得k k v v p p 11=。所以)(1 1)(112122111121T T k R v p v p k v dv v p w v v g k k --=--==? 考虑k k k k v v T T p p T T 1211211212)(,--==)( ])(1[1])1 (1[111211 21----=--=k g k k g v v k T R p p k T R w 可逆过程的技术功??-+=-=2121)(2211v v p p t v p v p pdv vdp w ,将?21v v pdv 关系式带人,整理得 kw p p T R k k T T R k k v p v p k k w k k g g t =--=--=--=-])(1[1)(1)(111 21212211 2.某气缸中空气初始参数,1300,811C t MPa p ? ==进行了一个可逆多变过程后,终态,400,4.022C t MPa p ?==空气的气体常数),/(287.0K kg kJ R g ?=试按下列两种方法计 算空气该过程是放热还是吸热?(1)按定值热容,);/(718.0K kg kJ c v ?=(2)比热容是温度的线性函数c t ?+=?}{000186.0708.0}{c K)kJ/(kg v 解:由2211,;,T p T p 确定多变指数 3955.1,283401.084.0ln 1573673ln ln ln 11212====-n MPa MPa K K p p T T n n (1) 所以是吸热过程 ,0/1.653/2.646/1.653)4001300(*)/(287.0*1 3955.11)(11/2.646)1300400(*)/(718.0)(2112>+-=+?==-?-=--= -=-?=-=?q kg kJ kg kJ w u q kg kJ K K kg kJ T T R n w kg kJ K K kg kJ T T c u g v (2)
第一次 热力学基础练习与答案 班 级 ___________________ 姓 名 ___________________ 班内序号 ___________________ 一、选择题 1. 如图所示,一定量理想气体从体积V 1,膨胀到体积V 2分别经历的过程 是:A →B 等压过程,A →C 等温过程;A →D 绝热过程,其中吸热量最 多的过程 [ ] (A) 是A →B. (B) 是A →C. (C) 是A →D. (D) 既是A →B 也是A →C , 两过程吸热一样多。 2. 有两个相同的容器,容积固定不变,一个盛有氨气,另一个盛有氢气(看 成刚性分子的理想气体),它们的压强和温度都相等,现将5J 的热量传给氢 气,使氢气温度升高,如果使氨气也升高同样的温度,则应向氨气传递热量 是: [ ] (A) 6 J. (B) 5 J. (C) 3 J. (D) 2 J. 3.一定量的某种理想气体起始温度为T ,体积为V ,该气体在下面循环过程中经过三个平衡过程:(1) 绝热膨胀到体积为2V ,(2)等体变化使温度恢复为T ,(3) 等温压缩到原来体积V ,则此整个循环过程中 [ ] (A) 气体向外界放热 (B) 气体对外界作正功 (C) 气体内能增加 (D) 气体内能减少 4. 一定量理想气体经历的循环过程用V -T 曲线表示如图.在此循 环过程中,气体从外界吸热的过程是 [ ] (A) A →B . (B) B →C . (C) C → A . (D) B → C 和B →C . 5. 设高温热源的热力学温度是低温热源的热力学温度的n 倍,则理想气体在 一次卡诺循环中,传给低温热源的热量是从高温热源吸取热量的 [ ] (A) n 倍. (B) n -1倍. (C) n 1倍. (D) n n 1 倍. 6.如图,一定量的理想气体,由平衡状态A 变到平衡状态 B (p A = p B ),则无论经过的是什么过程,系统必然 [ ] (A) 对外作正功. (B) 内能增加. (C) 从外界吸热. (D) 向外界放热. V V
第2章流体的p-V-T(x)关系 1.1 本章学习要求 本章的核心容是流体的PVT关系。 要求学生掌握纯物质的P-V-T立体相图中,点、线、面所代表的物理意义及在 PT面和 PV面上投影所形成的P-T相图和P-V相图。认识物质的气、液、固三类常见状态和气 -液、 气-固、液-固相平衡等在相图中的表征方法;掌握临界点的物理意义及其数学特征。 要求掌握理想气体的基本概念及其基本的数学表达方法;明确在真实条件下,物质都是以非理想状态存在的,掌握采用立方型状态方程和Virial方程进行非理想气体PVT计算的方法。 1.2 重点 1.2.1 纯物质的PVT关系 图1-1 纯物质的p-V-T相图 图1-2 纯物质的p-T图图1-3 纯物质的p-V图 临界点C在图上表现为拐点,数学上的可表述为: C T T P V = ?? ? = ? ? ?? (1-1) C 2 2 T T P V = ?? ? = ? ? ?? (1-2)
1.2.2 状态方程(Equations of State ,EOS) 状态方程是物质P-V-T 关系的解析式,可表达为函数关系: f (P,V,T)0= (1-3) 状态方程的重要价值在于: (1) 用状态方程可精确地代表相当广泛围的P-V-T 数据,大大减小实验测定的工作量; (2) 用状态方程可计算不能直接从实验测定的其它热力学性质; (3) 用状态方程可进行相平衡计算,如计算饱和蒸气压、混合物气液相平衡、液-液平衡等,尤其是在计算高压气液平衡时的简捷、准确、方便,为其它方法不能与之相比的。 1.2.3 理想气体状态方程 理想气体状态方程是流体状态方程中最简单的一种,理想气体的概念是一种假想的状态,实际上并不存在,它是极低压力或极高温度下各种真实气体的极限情况。数学表达式为: P 0 (V ) lim (PV)RT →→∞=或PV RT = (1-4) 1.2.4 真实气体状态方程 大体上分为三类: 第一类是立方型状态方程,如Van der Waals 、RK 、SRK 、PR 、PT 等; 第二类是多项级数展开式的状态方程,如Virial 、BWR 、MH 等; 第三类是理论型状态方程。 1.2.4.1 立方型状态方程 (1) Van der Waals(VdW ,1873年)方程 (2) Redlich-Kwong(RK ,1949年)方程 (3) Soave-Redlich-Kwong(SRK ,1972年)方程 (4) Peng-Robinson(PR ,1976年)方程 (5) Patel-Teja(PT,1982年)方程 立方型状态方程的应用: (1) 用一个EOS 即可精确地代表相当广泛围的实验数据,藉此可精确计算所需的数据; (2) EOS 具有多功能性,除了PVT 性质之外,还可用最少量的数据计算流体的其它热力学函数、纯物质的饱和蒸气压、混合物的气-液相平衡、液-液相平衡,尤其是高压下的相平衡计算; (3) 在相平衡计算中用一个EOS 可进行二相、三相的平衡数据计算,状态方程中的混合规则与相互作用参数对各相使用同一形式或同一数值,计算过程简捷、方便。 1.2.4.2 多项级数展开式方程 (1) Virial 方程 PV B Z 1RT V = =+ (1-38) 通常适用于C T T <,P 1.5MPa <压力下的真实气体PVT 关系和其它热力学性质计算。 截至第III 项的Virial 方程为:
发动机原理 (Internal Combustion Engine Principles) 一、课程基本情况 课程编号:() 课程总学时:48 (其中:讲课:44,试验:4) 课程学分: 3 课程分类:必修 开设学期:春 开课单位:工学院车辆与交通工程系 适用专业:热能与动力工程 所需先修课:工程热力学、流体力学、传热学、发动机构造 课程负责人:李淑艳 二、课程内容简介 发动机原理是热能与动力工程(汽车发动机)专业最重要的一门专业技术基础课。通过本课程的教学和试验环节,使学生具有分析和改进提高发动机性能的基本能力,具有初步进行和组织发动机性能试验的基本能力,从而为学习本专业后续课程和从事本专业工作打下坚实的专业基础。 本课程以发动机的性能指标作为主要研究对象,把合理组织热力工作过程,提高整机性能作为中心内容,系统阐明发动机原理的基本理论、基本概念和基本试验方法,并深入到工作过程的各个阶段,分析影响性能指标的各种因素,找出规律,研究提高性能指标的措施与途径。 课程主要内容包括发动机的工作性能指标,工作循环分析,充量更换,混合气形成和燃烧,燃料供给与调节,排气污染物的生成机理与控制,工作特性与匹配。重点是研究发动机工作过程,综合分析发动机性能与参数之间的相互关系。 Internal Combustion Engine Principles is a basic professional course of Thermal Energy and Power Engineering (IC engine), and it is the most important course in all major courses of IC engine. Through teaching and testing, enable students to analyze and improve the basic capacity for improving the performance of engine, and be in capacity for organizing the internal combustion engine test, and this could lay the solid professional foundation for follow-up study. The main study objective of this course is engine operating parameters, organizing the working process reasonably and improving engine performance. Then systematically illustrate the basic theory, the basic concept and the testing method of engine. And this could be in the depth of each stage of thermo working process, and analyze various factors of influencing the performance indicators, and identify the general rules
热力学原理在化学中的应用 有两个很基本的问题贯穿着整个化学学科: 第一个问题可以通过下面这个例子说明:我已经知道水分子是由氢原子和氧原子构成的,那么我现在有一些氢气和一些氧气,我把它们混合后能否产生水呢?如果不能,那么在什么条件下是可以的? 第二个问题可以沿用上面的例子:现在我有方法让氢气和氧气生成水了,那么我拿1mol氢气和0.5mol氧气就一定能产生1mol水么? 用化学的语言概括:1、如何判断化学反应的方向。2、如何计算化学反应的限度。 下面就以上述的两个问题进行说明热力学原理在化学中的应用: 1.判断化学反应的方向: a)根据“熵变”判断 当我们已知有材料A、B,并需要C、D时,我们就希望下列反应能够进行: A+B C+D 能否自发地进行,如果不能,我们又需要给予怎样的条件才能使它们进行? 熵变和吉布斯自由能函数给了我们衡量反应是否自发进行的标准。 在热力学中,我们赋予了反应物与产物“熵”这个概念,它的数值是一个状态函数,即无论在怎样的过程下,只要始态与终态确定了,那么这个过程的熵变就可以确定。
通过化学家反复实验论证,得到了克劳修斯不等式: 这个不等式说明了一个反应过程是否能自发进行,是由这个过程的热温商与其熵变的大小关系决定的。然而一个体系的熵变的测定是十分困难的,所以我们将体系与环境一并考虑: 这就是我们所熟知的热力学第二定律,孤立体系的熵变是恒大于或等于0的,特别的,自发过程的熵变总是大于0,因此它也被称作熵增原理。 于是,当我们需要判断一个反应是否自发发生时,就可以根据: 计算反应前后的系统熵变,并与0相比较即可。 b)根据“吉布斯自由能函数值”判断 事实上,孤立体系的熵变计算要同时考虑环境和体系的熵变,这很不方便,因此根据熵变判断反应方向仍然是有困难的。因此我们引入了一个新的量,叫做吉布斯自由能:
热力学三大定律 热力学第一定律 热力学第一定律是能量守恒定律。热力学第二定律有几种表述方式:克劳修斯表述热量可以自发地从较热的物体传递到较冷的物体,但不可能自发地从较冷的物体传递到较热的物;开尔文-普朗克表述不可能从单一热源吸取热量,并将这热量变为功,而不产生其他影响。热力学第三定律通常表述为绝对零度时,所有纯物质的完美晶体的熵值为零。或者绝对零度(T=0K)不可达到。 热力学第一定律也就是能量守恒定律。 内容 一个热力学系统的内能增量等于外界向它传递的热量与外界对它做功的和。(如果一个系统与环境孤立,那么它的内能将不会发生变化。) 表达式:△U=W+Q 符号规律 :热力学第一定律的数学表达式也适用于物体对外做功,向外界散热和内能减少的情况,因此在使用:△U=W+Q时,通常有如下规定: ①外界对系统做功,W>0,即W为正值。 ②系统对外界做功,也就是外界对系统做负功,W<0,即W为负值 ③系统从外界吸收热量,Q>0,即Q为正值 ④系统从外界放出热量,Q<0,即Q为负值 ⑤系统内能增加,△U>0,即△U为正值 ⑥系统内能减少,△U<0,即△U为负值 从三方面理解 1.如果单纯通过做功来改变物体的内能,内能的变化可以用做功的多少来度量,这时物体内能的增加(或减少)量△U就等于外界对物体(或物体对外界)所做功的数值,即△U=W 2.如果单纯通过热传递来改变物体的内能,内能的变化可以用传递热量的多少来度量,这时物体内能的增加(或减少)量△U就等于外界吸收(或对外界放出)热量Q的数值,即△U=Q 3.在做功和热传递同时存在的过程中,物体内能的变化,则要由做功和所传递的热量共同决定。在这种情况下,物体内能的增量△U就等于从外界吸收的热量Q和对外界做功W之和。即△U=W+Q 能量守恒定律 能量既不能凭空产生,也不能凭空消失,它只能从一种形式转化为另一种形式,或者从一个物体转移到另一个物体。 能量的多样性 物体运动具有机械能、分子运动具有内能、电荷具有电能、原子核内部的运动具有原子能等等,可见,在自然界中不同的能量形式与不同的运动形式相对应。 不同形式的能量的转化 “摩擦生热”是通过克服摩擦力做功将机械能转化为内能;水壶中的水沸腾时水蒸气对壶盖做功将壶盖顶起,表明内能转化为机械能;电流通过电热丝做功可将电能转化为内能。。。这些实例说明了不同形式的能量之间可以相互转化,且这一转化过程是通过做功来完成的。 能量守恒的意义