
不饱和烃习题
(一) 用系统命名法命名下列各化合物:
(1)
(2) 对称甲基异丙基乙烯
3-甲基-2-乙基-1-丁烯
4-甲基-2-戊烯
(3)
(4)
2,2,5-三甲基-3-己炔
3-异丁基-4-己烯-1-炔
(二) 用Z,E-标记法命名下列各化合物:
(1) ↓
↑
(2) ↑
↑
(E)-2,3-二氯-2-丁烯 (Z)- 2-甲基-1-氟-1-氯-1-丁烯
(3) ↑
↑ (4) ↑
↑
(Z)-1-氟-1-氯-2-溴-2-碘乙烯 (Z)-3-异基-2-己烯
(三) 写出下列化合物的构造式,检查其命名是否正确,如有错误予以改正,并
写出正确的系统名称。
(1) 顺-2-甲基-3-戊烯
(2) 反-1-丁烯
顺-4-甲基-3-戊烯
1-丁烯 (无顺反异构)
(3) 1-溴异丁烯
(4) (E)-3-乙基-3-戊烯
CH 3CH 2C
CHCH 3
CH 3
CH
2
12
34
12345
CH 3CH=CHCH(CH 3)2(CH 3)2
CHC
CC(CH 3)351
234
6CH 3CHCH 2CHC CH
CH 3
CH=CHCH 3
5
1
2
3
4
6
C=C CH 3CH 3
Cl
Cl
C=C CH 3Cl
CH 2CH 3
F
C=C
Br Cl
I
F
C=C CH 2CH 2CH 3CH 3
CH(CH 3)2
H
C=C CH 3
H
CH 3H
CH 3
1
2
3
4
5
CH 2=CHCH 2CH 3
2-甲基-1-溴丙烯
3-乙基-2-戊烯 (无顺反异构)
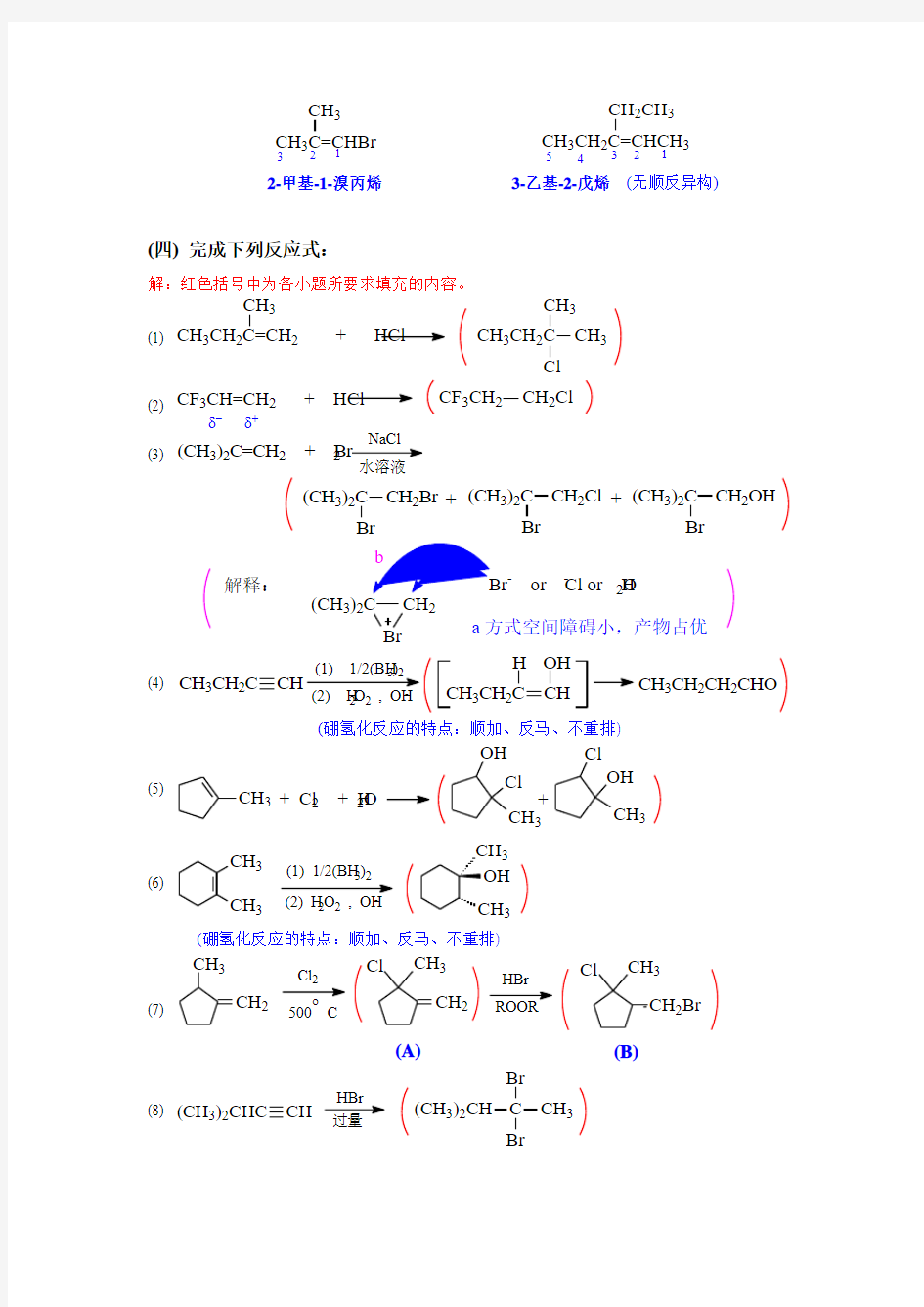
(四) 完成下列反应式:
解:红色括号中为各小题所要求填充的内容。
(1)
(2)
(3)
(4)
(硼氢化反应的特点:顺加、反马、不重排)
(5)
(6)
(硼氢化反应的特点:顺加、反马、不重排)
(7)
(8)
CH 3CH 31
23
CH 3CH 23
CH 2CH 3
1
2
3
4
5
CH 3CH 22 + HCl CH 3
CH 3CH 2C
CH 3
CH 3
CF 3CH=CH 2 + HCl
CF 3CH 2
CH 2
Cl
δ+
δ-
(CH 3)2C=CH 2 + Br 2
(CH 3)2C CH 2Br Br
(CH 3)2C CH 2Cl Br (CH 3)2C CH 2OH
Br +
+Br
(CH
3)2C
CH 2
- or Cl - or H 2O a 方式空间障碍小,产物占优
解释:
CH 3CH
2C
CH
CH 3CH 2CH 2
CHO CH 3CH 2C
CH
OH
H 3222-
CH 3+ Cl
2
+ H 2O
CH 3
OH
Cl
CH 3
Cl
OH
+
33
CH 3
CH 3
(1) 1/2(BH )22CH 3
CH
2
Cl 500 C
o
(A)
(B)
CH 3
CH 2
Cl
HBr ROOR
CH 3
CH 2Br
Cl
(CH 3)2CHC
CH
HBr 过量
(CH 3)2CH C CH 3Br
Br
(9)
(10)
(11)
(12)
(13)
(14)
(五) 用简便的化学方法鉴别下列各组化合物:
(1)
解:
(2)
解:
(六) 在下列各组化合物中,哪一个比较稳定?为什么?
(1) (A)
, (B)
解:(B)中甲基与异丙基的空间拥挤程度较小,更加稳定。 (2) (A)
, (B)
解:(A)中甲基与碳-碳双键有较好的σ-π超共轭,故(A)比较稳定。
CH 3CH 2C CH + H 2O
4H SO CH 3CH 2
CH
3
O
COOH + CH
3COOH
4
CH=CHCH 3
(1) O (2) H 2
O , Zn
O
O
Br + Br 2o
Br + NaC CH
C=C C 6H 5
C 6H 5
H
H
33
C
C
O H
6H 5
H
C 6
(A)
(B)
(C)
(A)(B)
(C)
4
褪色
褪色x
x
褪色(A)(B)(C)
CH
3
(C 2H 5)2C=CHCH 3CH 3(CH 2)4C CH
(A)(B)
(C)
褪色褪色
x
x
银镜
H
H
CH(CH 3)2
CH 3
C=C
H
CH(CH 3)2
H
CH 3
CH 3
CH 3
(3) (A) , (B) , (C)
解:(C)的环张力较小,较稳定。 (4) (A)
, (B)
解:(A)的环张力较小,较稳定。 (5) (A)
, (B)
, (C)
解:(C)最稳定。 (6) (A)
, (B)
解:(A)的环张力很大,所以(B)较稳定。
(七) 将下列各组活性中间体按稳定性由大到小排列成序:
(1)
(2)
解:(1)C >A >B (2)B >C >A
(八) 下列第一个碳正离子均倾向于重排成更稳定的碳正离子,试写出其重排后碳正离子的结构。
(1) (2) (3) (4)
解:题给碳正离子可经重排形成下列碳正离子:
(1) (2) (3) (4)
(九) 在聚丙烯生产中,常用己烷或庚烷作溶剂,但要求溶剂中不能有不饱和烃。如何检验溶剂中有无不饱和烃杂质?若有,如何除去?
解:可用Br 2/CCl 4或者KMnO 4/H 2O 检验溶剂中有无不饱和烃杂质。
若有,可用浓硫酸洗去不饱和烃。
(十) 写出下列各反应的机理:
(1)
解:
CH 3CH 2CH 3CHCH 3Cl 3CCHCH 3(CH 3)3C
(A)
(B)(C)(CH 3)2CHCH 2CH 2
(CH 3)22CH 3(CH 3)23(A)(B)(C)CH 3CH 2CH 2(CH 3)2CHCHCH 3(CH 3)3CCHCH 3CH 3CH 3CHCH 3(CH 3)2CCH 2CH 3(CH 3)2CCH(CH 3)2CH 3CH=CH 2
CH 2CH 3Br
(2)
解:
(3)
解:该反应为自由基加成反应:
引发:
增长:
… …
终止: 略。
(4)
解:
(箭头所指方向为电子云的流动方向!)
CH=CH 2
CH 2CH 3Br
+
CH 2CH 3
-
CH 3
CH 3OH H H (1) 1/2(BH )22CH 3BH 2
1/2(BH )CH 3
CH 3
3
B CH 3
2
CH 3OH
H H 22-
CH 3
Br
CH 3
ROOR
ROOR 2 RO + HBr
RO ROH + Br CH 3
CH + Br
+ HBr
Br
CH
3
CH + Br
(CH 3)2C=CHCH 2CHCH=CH 2
CH 3
+
CH 3
CH 3
CH 3
(CH 3)222CHCH=CH 2CH 3
+
(CH 3)2C=CHCH 2CHCH=CH 23
(十一) 预测下列反应的主要产物,并说明理由。
解:(1)
双键中的碳原子采取sp 2杂化,其电子云的s 成分小于采取sp 杂化的叁键碳,离核更远,流动性更大,更容易做为一个电子源。
所以,亲电加成反应活性:>
(2)
解释:在进行催化加氢时,首先是H 2及不饱和键被吸附在催化剂的活性中心上,而且,叁键的吸附速度大于双键。
所以,催化加氢的反应活性:叁键>双键。
(3)
解释:叁键碳采取sp 杂化,其电子云中的s 成分更大,离核更近,导致其可以发生亲
核加成。而双键碳采取sp 2
杂化,其电子云离核更远,不能发生亲核加成。
(4)
解释:双键上电子云密度更大,更有利于氧化反应的发生。 (5)
解释:氧化反应总是在电子云密度较大处。 (6)
解释 : C +
稳定性:3°C +
>2°C +
(十二) 写出下列反应物的构造式:
(1)
(2)
(3)
3
CH 3
CH 3+
3CH 3
CH 3
分子内亲电加成
CH 2=CHCH 2C
CH
HgCl
2
CH 3
2C CH
Cl C=C C C CH 2=CHCH 2C
CH
2Lindlar
CH 2=CHCH 2CH=CH 2CH 2=CHCH 2C CH
25
KOH
CH 2=CHCH 22
OC 2H 5
CH 2=CHCH 2C CH
653
CH
2C CH 2
CH CH 2
O
CH CO H
O
(CH 3)3C
CH=CH 2
浓 HI
CH 3
C
CH CH 3CH 3
I
CH 3
C 2H 4
2CO 2 + 2H
2O KMnO 4 , H +
2CH 2=CH 2
C 6H 12
(1) KMnO 4 , OH -, H 2O
(CH 3)2CHCOOH + CH 3COOH CH 3CHCH=CHCH 3
CH 3
C 6H 12
(1) KMnO , OH -, H O
(CH 3)2CO + C 2H 5COOH
(4)
(5)
(6)
(十三) 根据下列反应中各化合物的酸碱性,试判断每个反应能否发生?(pKa 的近似值:ROH 为16,NH 3为34,RC ≡CH 为25,H 2O 为15.7)
(1)
所以,该反应能够发生。 (2)
所以,该反应不能发生。 (3)
所以,该反应不能发生。 (4)
所以,该反应不能发生。
(十四) 给出下列反应的试剂和反应条件:
(1) 1-戊炔 → 戊烷 解:
(2) 3-己炔 → 顺-3-己烯 解:
(3) 2–戊炔 → 反-2-戊烯 解:
(4)
(CH 3)2C=CHCH 2CH 3C 6H 10
(1) KMnO , OH -, H O
2CH 3CH 2COOH CH 3CH 2C
CCH 2CH 3KMnO 4 , H +
H 2O
C 8H 12
(CH 3)2CO + HOOCCH 2CH 2COOH + CO 2 + H 2O (CH 3)2C=CHCH 2CH 2CH=CH 2
4C 7H 12
CH 3CH 2CH 2CH 2CH 2CH 2CH 3
C 7H 11Ag
CH 3CH 2CH 2CH 2CH 2C CH
强酸弱酸
强碱
弱碱
RC
CH + NaNH 2
RC
CNa + NH 3RC
CH + RONa RC CNa + ROH 强酸
弱酸
强酸
弱酸
CH 3C
CH + NaOH
CH 3C CNa + H 2O 强酸
弱酸
ROH + NaOH
RONa + H 2O CH 3CH 2CH 2C
CH
CH 3CH 2CH 2CH 2CH 3Ni
2CH 3CH 2C
CCH 2CH 3
CH 3CH 2
C=C
CH 2CH 3
H
H
(or P-2)
lindlar 2
CH 3CH 2CH 2C
CCH 3
CH 3CH 2CH 2
C=C
H CH 3
H
NH 3(l)
(CH 3)2CHCH 2CH=CH 2(CH 3)2CHCH 2CH 2CH 2OH
解:
(十五) 完成下列转变(不限一步):
(1) 解:
(2)
解:
(3)
解:
(4)
解:
(十六) 由指定原料合成下列各化合物(常用试剂任选):
(1) 由1-丁烯合成2-丁醇 解:
(2) 由1-己烯合成1-己醇 解:
(3)
解:
(4) 由乙炔合成3-己炔 解:
(1) B 2H 622-
(CH 3)2CHCH 2CH=CH 2
(CH 3)2CHCH 2CH 2CH 2OH CH 3CH=CH 2CH 3CH 2CH 2Br CH 3CH=CH 2
CH 3CH 2CH 2Br H 2O 2
CH 3CH 2CH 2CH 2OH
CH 3CH 2CClCH 3Br
CH 3CH 2CH=CH 2
CH 3CH 2CH 2Br Br
CH 3CH 2CH 2CH 2OH 24
?
24
CH 3CH 2C
CH 3Cl
NaOH C 2H 5OH
HBr
CH 3CH 2CH=CH 2
Cl
(CH 3)2CHCHBrCH 3(CH 3)2CCHBrCH 3(CH 3)2CHCHBrCH 3
(CH 3)2CCHBrCH 3
OH
(CH 3)2C=CHCH 3
C 2H 5OH
22CH 3CH 2CHCl 2CH 3CCl 2CH 3CH 3CH 2CHCl 2
CH 3CCl 2CH 3NaOH C 2H 5OH
2HCl
CH 3C CH
CH 3CH 2CH=CH 2
24
CH 3CH 2CH 3
OSO 2OH
CH 3CH 2CH 3
OH
2?
CH 3CH 2CH 2CH 2CH=CH 2
CH 3CH 2CH 2CH 2CH 2CH 2OH (1) B H 22-
CH 32
CH 3
ClCH 2C CH 2CH 3
CH 32
CH 3
ClCH 2C CH 2CH 3
233o
ClCH 22
CH 3
HC
CH
CH 3CH 2C CCH 2CH 3252Na NH 3(l)
NaC CNa
(5) 由1-己炔合成正己醛 解:
(6) 由乙炔和丙炔合成丙基乙烯基醚
解:
(十七) 解释下列事实:
(1) 1-丁炔、1-丁烯、丁烷的偶极矩依次减小,为什么?
解:电负性:>>
键的极性:>>
分子的极性:1-丁炔>1-丁烯>丁烷(即:1-丁炔、1-丁烯、丁烷的偶极矩依次减小)
(2) 普通烯烃的顺式和反式异构体的能量差为4.18kJ ?mol -1,但4,4-二甲基-2-戊烯顺式和反式的能量差为15.9 kJ ?mol -1,为什么?
解:
顺-4,4-二甲基-2-戊烯 反-4,4-二甲基-2-戊烯
由于叔丁基的体积大,空间效应强,导致在顺-4,4-二甲基-2-戊烯中,叔丁基与甲基处于双键同侧,空间障碍特别大,能量更高。
(3) 乙炔中的键比相应乙烯、乙烷中的键键能增大、键长缩短,但酸
性却增强了,为什么?
解:炔烃分子中的叁键碳采取sp 杂化。与sp 2
、sp 3
杂化碳相比,sp 杂化s 成分更多,电子云离核更近,受核的束缚更强,电负性更大。
由于sp 杂化碳的电子云离核更近,使乙炔中的键键能增大、键长缩短;
由于sp 杂化碳的电负性更大,使中的电子云更偏向碳原子一边,导致乙炔分
子中氢原子更容易以H +
的形式掉下来,酸性增强。
(4) 炔烃不但可以加一分子卤素,而且可以加两分子卤素,但却比烯烃加卤素困难,反应速率也小,为什么?
解:烯烃、炔烃与卤素的加成反应是亲电加成,不饱和键上的电子云密度越大,越有利于亲电加成。
由于炔烃中的叁键碳采取sp 杂化,电负性较大。所以,炔烃与卤素加成时,比烯烃加卤素困难,反应速率也小于烯烃。
CH 3CH 2CH 2CH 2C
CH
CH
3CH 2CH 2CH 2OH
(1) B H 22-
CH 3(CH 2)3CH 2CHO CH 3CH 2CH 2OH CH 3C CH CH 3CH CH 2
2622-
H CH 3CH 2CH
2OCH=CH 2C sp sp
2C sp 3C C H C H C H C H CH 3
C CH 3
CH 3C C H
CH 3H
CH 3
C CH 3
CH 3C C H
H CH 3
C H C H C H C sp H
(5) 与亲电试剂Br 2、Cl 2、HCl 的加成反应,烯烃比炔烃活泼。然而当炔烃用这些试剂处理时,反应却很容易停止在烯烃阶段,生成卤代烯烃,需要更强烈的条件才能进行第二步加成。这是否相互矛盾,为什么?
解:不矛盾。
烯烃与Br 2、Cl 2、HCl 的加成反应都是亲电加成。由于双键碳的电负性小于叁键碳,导致双键上的π电子受核的束缚程度更小,流动性更大,更有利于亲电加成反应。所以,与亲电试剂Br 2、Cl 2、HCl 的加成反应,烯烃比炔烃活泼
而
、都是吸电子基,它们的引入,导致双键上电子云密度降低,不利于亲电加成反应的进行。所以,当炔烃用亲电试剂Br 2、Cl 2、HCl 处理时,反应却很容易停止在烯烃阶段,生成卤代烯烃,需要更强烈的条件才能进行第二步加成
(6) 在硝酸钠的水溶液中,溴对乙烯的加成,不仅生成1,2-二溴乙烷,而且还产生硝酸-β-溴代乙酯(BrCH 2CH 2ONO 2),怎样解释这样的反应结果?试写出各步反应式。
解:溴与乙烯的加成是亲电加成反应,首先生成活性中间体——环状溴翁正离子。后者可与硝酸根负离子结合得到硝酸-β-溴代乙酯(BrCH 2CH 2ONO 2):
(7) (CH 3)3CCH=CH 2在酸催化下加水,不仅生成产物(A),而且
生成(B),但不生成(C)。 试解释为什么。
解:该实验现象与烯烃酸催化下的水合反应机理有关:
(2°C +
) (3°C +)
与(C)相关的C +
为(1°C +
),能量高,不稳定,因此产物(C)不易生成。
Cl Br HONO 2 + H 2O
H 3O + + ONO 2-CH 2=CH 2 + Br 2
CH 2
CH 2
Br
-
CH 2Br CH 2Br
CH 2Br
CH 2ONO 2(CH 3)3CCHCH 3OH
(CH 3)2CCH(CH 3)2OH
(CH 3)3CCH 2CH 2OH (CH 3)3CCH=CH 2(CH 3)3CCH CH 3
H +
3)2CCH CH 3
CH 3
( I )
( II )
甲基迁移
(A)
(CH 3)3CCHCH 3OH ( I )
2- H +
(B)
( II )
2- H +
(CH 3)2CCH CH 3CH 3
OH
(CH 3)3CCH 2
CH 2
(8) 丙烯聚合反应,无论是酸催化还是自由基引发聚合,都是按头尾相接的方式,生成甲基交替排列的整齐聚合物,为什么?
解:以自由基聚合为例。若按头尾相接的方式,生成甲基交替排列的整齐聚合物,则与之相关的自由基都是二级自由基:
二级自由基 二级自由基
二级自由基
头尾相接、甲基交替排列的整齐聚合物
反之,则会生成稳定性较差的一级自由基:
二级自由基 一级自由基
丙烯在酸催化下进行聚合反应,其活性中间体为碳正离子,其稳定性顺序同样为:
三级>二级>一级碳正离子。
(十八) 化合物(A)的分子式为C 4H 8,它能使溴溶液褪色,但不能使稀的高锰酸钾溶液褪色。1 mol (A)与1mol HBr 作用生成(B),(B)也可以从(A)的同分异构体(C)与HBr 作用得到。(C)能使溴溶液褪色,也能使稀和酸性高锰酸钾溶液褪色。试推测(A)、(B)和(C)的构造式。并写出各步反应式。
解:(A)
(B)
(C) 或 反应式略。
R
CH 2
CH 3
R
CH 2CH CH 3
CH 2CH CH 323
R
CH 2CH 3
CH 2CH 3
CH 2CH 3
23
23
... ...
CH 2=CHCH 3
R
CH 2
CH CH 3
R
CH 2
CH CH 3
CH 2
CH 3
23
CH 3CH 3CH 2CHCH 3
Br
CH 3CH 2CH=CH 2CH 3CH=CHCH 3
(十九) 分子式为C 4H 6的三个异构体(A)、(B)、(C),可以发生如下的化学反应: (1) 三个异构体都能与溴反应,但在常温下对等物质的量的试样,与(B)和(C)反应的溴量是(A)的2 倍;
(2) 三者都能HCl 发生反应,而(B)和(C)在Hg 2+催化下与HCl 作用得到的是同一产物;
(3) (B) 和(C)能迅速地与含HgSO 4的硫酸溶液作用,得到分子式为C 4H 8O 的化合物;
(4) (B)能与硝酸银的溶液反应生成白色沉淀。
试写出化合物(A)、(B)和(C)的构造式,并写出有关的反应式。
解:(A)
(B) (C)
有关的反应式略。
(二十) 某化合物(A)的分子式为C 7H 14,经酸性高锰酸钾溶液氧化后生成两个化合物(B)和(C)。(A)经臭氧化而后还原水解也得相同产物(B)和(C)。试写出(A)的构造式。
解:
(二十一) 卤代烃C 5H 11Br(A)与氢氧化钠的乙醇溶液作用,生成分子式为C 5H 10的化合物(B)。(B)用高锰酸钾的酸性水溶液氧化可得到一个酮(C)和一个羧酸(D)。而(B)与溴化氢作用得到的产物是(A)的异构体(E)。试写出(A)、(B)、(C)、(D)和(E)的构造式及各步反应式。
解:
各步反应式:
CH 3CH 2C
CH CH 3C CCH 3(CH 3)22CH 3
CH 3
(A)
(CH 3)22CH 3
CH 3
(A)
24+
CH 33 + CH 32CH 3
O O
CH 33 + CH 32CH 3
O
O
CH 3CHCHCH 3
CH 3Br
CH 33
CH 3CH 3CH 3CH 3COOH
CH 3
C CH 2CH 3CH 3
Br (A)
(B)
(C)
(D)
(E)
(二十二) 化合物C 7H 15Br 经强碱处理后,得到三种烯烃(C 7H 14)的混合物(A)、(B)和(C)。这三种烯烃经催化加氢后均生成2-甲基己烷。(A)与B 2H 6作用并经碱性过氧化氢处理后生成醇(D)。(B)和(C)经同样反应,得到(D)和另一异构醇(E)。写出(A)~(E)的结构式。再用什么方法可以确证你的推断?
解:C 7H 15Br 的结构为:
(A)~(E)的结构式:
将(A)、(B)、(C)分别经臭氧化-还原水解后,测定氧化产物的结构,也可推断(A)、(B)、(C)的结构:
(二十三) 有(A)和(B)两个化合物,它们互为构造异构体,都能使溴的四氯化碳溶液褪色。(A)与Ag(NH 3)2NO 3反应生成白色沉淀,用KMnO 4溶液氧化生成丙酸(CH 3CH 2COOH)和二氧化碳;(B)不与Ag(NH 3)2NO 3反应,而用KMnO 4溶液氧化只生成一种羧酸。试写出(A)和(B)的构造式及各步反应式。
解:
各步反应式:
CH 3CHCHCH 3CH 3Br
CH 33
CH 3CH 3CH 3
CH 3COOH CH 3
C CH 2CH 3CH 3
Br
(A)(B)
(C)(D)
(E)
NaOH
C 2H 5
OH
4H +
+CH 3CHCHCH 2CH 2CH 3CH 3
(B)
(A)CH 32CH 2CH 3
CH 3
(C)
CH 22CH 2CH 3CH 3
CH 32CH 3
CH 3
(D)
(E)
CH 3CHCHCH 2CH 2CH 3
CH 3
OH
CH 32CHCH 2CH 3
CH 3
OH (A)
CH 32CH 2CH 3CH 3
3
(2) H 2O/Zn CH 32CH 2CH 3CH 3
CH 2CH 3H +(B)3
(2) H 2O/Zn CH 32
CH 3C O H (C)
3
(2) H 2O/Zn CH 2=O + CH 32CH 2CH 3O CH 3CH 2C
CH (A)CH 3C CCH 3(B)
(二十四) 某化合物的分子式为C 6H 10。能与两分子溴加成而不能与氧化亚铜的氨溶液起反应。在汞盐的硫酸溶液存在下,能与水反应得到4-甲基-2-戊酮和2-甲基-3-戊酮的混合物。试写出C 6H 10的构造式。
解:
(二十五) 某化合物(A),分子式为C 5H 8,在液氨中与金属钠作用后,再与1-溴丙烷作用,生成分子式为C 8H 14的化合物(B)。用高锰酸钾氧化(B)得到分子式C 4H 8O 2为的两种不同的羧酸(C)和(D)。(A)在硫酸汞存在下与稀硫酸作用,可得到分子式为C 5H 10O 的酮(E)。试写出(A)~(E)的构造式及各步反应式。
解:
各步反应式:
CH 3CH 2C
CH (A)+ Br 2
CH 3CH 2CBr 2CHBr 2
4
Ag(NH )NO 4
CH 3CH
2C
CAg
CH 3CH 2C CH CH 3CH 2C CH
CH 3CH 2COOH + CO 2无色
棕红色
(灰白色)
CH 3CBr 2CBr 2CH 3
CH 3C
CCH 3+ Br 2
4
(B)
CH 3C CCH 3
4
2CH 3COOH
CH 3C CCH 3Ag(NH )NO x
无色
棕红色
CH 3CCH 3
CH 3
CH 3CCH 2CH 2CH 3
CH 3
CH 3CH
CH 3
(A)(B)(C)(D)(E)CH 3CH 3CH 3CH 2CH 2COOH CH 3CH 3
CH 3O Na NH 3(l)
CH 3CCH 2CH 2CH 3CH 3CH 3CH
CH 3(A)(B)CH 3CNa
CH 3322CH 3CCH 2CH 2CH 3CH 3(B)
4
(C)(D)CH 3CH 3
CH 3CH 2CH 2COOH
+
第一章 化学反应原理 1.今有一密闭系统,当过程的始终态确定以后,下列各项是否有确定值? Q , W , Q -W , Q +W , ΔH , ΔG 答: Q +W , ΔH , ΔG 有确定值,Q , W , Q -W 无确定值。 2.下列各符号分别表示什么意义? H ,ΔH ,ΔH θ,Δf θ298H (B ),θ298S (B ), Δf θ298G (B ) 答:H :焓;ΔH :焓变;ΔH θ :标准焓变;Δf θ298H (B ):298K 时B 物质的标准生成焓;θ298S (B ):298K 时 B 物质的标准熵; Δf θ298G (B ):298K 时B 物质的标准生成吉布斯函数。 3.下列反应的Q p 和Q V 有区别吗? (1)2H 2(g)+O 2(g)=2H 2O(g) (2)NH 4HS(s)=NH 3(g)+H 2S(g) (3)C(s)+O 2(g)=CO 2(g) (4)CO(g)+H 2O(g)=CO 2(g)+H 2(g) 答:(1)、(2)有区别。 4.已知下列热化学方程式: (1)Fe 2O 3(s)+3CO(g)=2Fe(s)+3CO 2(g);Δθ298H =-27.6kJ/mol ; (2)3Fe 2O 3(s)+CO(g)=2Fe 3O 4(s)+CO 2(g);Δθ298H =-58.6kJ/mol ; (3)Fe 3O 4(s)+CO(g)=3FeO(s)+CO 2(g);Δθ298H =38.1kJ/mol ; 不用查表,计算下列反应的Δθ298H : (4)FeO(s)+CO=Fe(s)+CO 2(g) 5.查表计算下列反应的Δθ298H : (1)Fe 3O 4(s)+4H 2(g)=3Fe(s)+4H 2O(g) (2)4NH 3(g)+5O 2(g)=4NO(g)+6H 2O(l) (3)CO(g)+H 2O(g)=CO 2(g)+H 2(g) (4)S(s)+O 2(g)=SO 2(g) 6.查表计算下列反应的Δθ298H : (1)Fe(s)+Cu 2+(aq)=Fe 2+(aq)+Cu(s)
第三章习题: 一、选择题 [1]下列化合物中哪些可能有E ,Z 异构体?D (A) 2-甲基-2-丁烯 (B) 2,3-二甲基-2-丁烯 (C) 2-甲基-1-丁烯 (D) 2-戊烯 [2]环己烯加氢变为环己烷的热效应如何?B (A) 吸热反应 (B) 放热反应 (C) 热效应很小 (D) 不可能发生 [3] 实验室中常用Br 2的CCl 4溶液鉴定烯键,其反应历程是:A (A) 亲电加成反应 (B) 自由基加成 (C) 协同反应 (D) 亲电取代反应 [4] 烯烃与卤素在高温或光照下进行反应,卤素进攻的主要位置是:B (A) 双键C 原子 (B) 双键的α-C 原子 (C) 双键的β-C 原子 (D) 叔C 原子 [5] CF 3CH =CH 2 + HCl 产物主要是:B (A) CF 3CHClCH 3 (B) CF 3CH 2CH 2Cl (C) CF 3CHClCH 3与CF 3CH 2CH 2Cl 相差不多 (D) 不能反应 [6] 由环戊烯转化为顺-1,2-环戊二醇应采用的试剂是:A (A ) KM n O 4 , H 2O (B)(1)(1)(1)(2)(2)(2)O 3Zn + H 2O OH - CH 3COOH , CH 3COOH O H 2O , OH - (BH 3)2(C)(D) [7] 分子式为C 7H 14的化合物G 与高锰酸钾溶液反应生成4-甲基戊酸,并有一种气体逸出,G 的结构式是:A (A) (CH 3)2CHCH 2CH 2CH =CH 2 (B) (CH 3)3CCH =CHCH 3 (C) (CH 3)2CHCH =C(CH 3)2 (D) CH 3CH 2CH =CHCH(CH 3)2 [8] 分子式为C 6H 12的化合物,经臭氧化并和锌及水反应得到乙醛和甲乙酮,其结构式为:B (A) C H 3C H C HC HC H 3 H 3 (B) C H 3C H C C H 3 C H 2C H 3 (C ) 丁基环己烷 丁基环己烷 甲基-(D ) 1- [9] 1-甲基环己烯 + HBr 反应的主要产物是:A (A) 1-甲基-1-溴代环己烷 (B) 顺-2-甲基溴代环己烷 (C) 反-2-甲基溴代环己烷 (D) 1-甲基-3-溴环己烷 [10] 下列哪一个反应主要产物为1-溴丁烷?B
《有机化学》(第四版)第三章-不饱和烃(习题答案)
第三章不饱和烃 思考题 习题3.1 写出含有六个碳原子的烯烃和炔烃的构造异构体的构造式。其中含有六个碳原子的烯烃,哪些有顺反异构?写出其顺反异构体的构型式(结构式)。(P69) 解:C6H12有13个构造异构体,其中4个有顺反异构体: CH2=CHCH2CH2CH2CH3CH3CH=CHCH2CH2CH3CH3CH2CH=CHCH2CH3 (Z,E) (Z,E) CH2=CCH2CH2CH3 CH3CH2=CHCHCH2CH3 CH3 CH2=CHCH2CHCH3 CH3 CH3C=CHCH2CH3 3CH3CH=CCH2CH3 CH3 CH3CH=CH2CHCH3 3 (Z,E) (Z,E) CH2=CHCCH3 CH3 CH3CH2=CCHCH3 CH3 CH3 CH3C=CCH3 CH3 CH3 CH22CH3 CH2CH3 C6H10有7个构造异构体: CH CCH2CH2CH2CH3CH3C CCH2CH2CH3CH3CH2C CCH2CH3 CH CCHCH2CH3 3CH CCH2CHCH3 3 CH CC(CH3)3CH3C CCHCH3 3 习题3.2 用衍生物命名法或系统命名法命名下列各化合物:(P74) (1) (CH3)2CHCH=CHCH(CH3)2对称二异丙基乙烯
or 2,5-二甲基-3-己烯 (2) (CH 3)2CHCH 2CH=CHCHCH 2CH 3 CH 3 1234567 8 2,6-二甲基-4-辛烯 (3) CH 3CH 2C CCH 2CH 3 1 2 3 45 6 二乙基乙炔 or 3-己炔 (4) CH 3CH 2C(CH 3)2C CH 1 2 3 4 5 3,3-二甲基-1-戊炔 (5) CH 2=CHCH 2C CH 12345 1-戊烯-4-炔 (6) HC C C=C CH=CH 2 CH 2CH 2CH 3CH 2CH 2CH 3 1 2 3 4 5 6 3,4-二丙基-1,3-己二烯 -5-炔 (7) CH 3 CH 3 2,3-二甲基环己烯 (8) CH 3CH 3 5,6-二甲基-1,3-环己二烯 习题3.3 用Z,E-命名法命名下列各化合物:(P74) (1) ↑C=C CH 2CH 3 H Cl Br ↑ (Z)-1-氯-1-溴 -1-丁烯 (2) ↓C=C F CH 3Cl CH 3 CH 2 ↑ (E)-2-氟-3-氯-2- 戊烯
第三章不饱和烃 学习指导: 1.烯烃的异构和命名:构造异构和顺反异构(顺式、反式和Z、E表示法); 2. 烯烃的化学性质:双键的加成反应—催化加氢和亲电加成(亲电加成反应历程,不对称加成规则,诱 导效应,过氧化物效应、双键的氧化反应(高锰酸钾氧化,臭氧化,催化氧化)、—氢原子的反应(氯化); 3、炔烃的命名和异构; 4、炔烃的化学性质:亲电加成反应;氧化反应(高锰酸钾氧化,臭氧化);炔烃的 活泼氢反应(酸性,金属炔化物的生成) 5、烯烃的制备(醇脱水,氯代烷脱氯化氢);炔烃的制备(二卤代烷脱卤化氢,炔烃的烷基化)。 6. 二烯烃的分类和命名; 7. 共轭二烯烃的化学性质:加成反应(1、4—加成和1、2—加成)双烯合成(Diels-Alder反应) 习题 一、命名下列各物种或写出结构式。 1、写出的系统名称。 2、写出(Z)-3-甲基-4-异丙基-3-庚烯的构型式。 3、写出的系统名称。 写出的系统名称。 4、 二、完成下列各反应式(把正确答案填在题中括号内)。 1、 2、( ) 3、 4、
5、 6、 7、 三、理化性质比较题(根据题目要求解答下列各题)。 1、排列下列烯烃与HCl加成的活性次序: (A) (CH3)2C == CH2 (B) CH2 == CH2 (C) CH3CH == CH2 (D) CF3CH == CH2 2、将下列碳正离子按稳定性大小排序: 3、将下列碳正离子按稳定性大小排列: 4、排列与下列化合物进行双烯加成的活性次序: 5、比较下列化合物与1, 3-丁二烯进行Diels-Alder反应的活性大小: 6、由下列哪一组试剂经Diels-Alder反应生成产物?
第1章 化学热力学 参考答案: (一)选择题 1.A 2.A 3.C 4.B 5.D 6.C 7.C 8.C 9. A 10. C 11. A 12.C (二)填空题 1.40; 2.等温、等容、不做非体积功,等温、等压,不做非体积功; 3.>,<,=,> 4.增大、不变 5.不变 6.3.990 kJ·mol - 1 (三)判断题 1. × 2. × 3. × 4. × 5. √ 6. × 7. × 8. × 9. × 10. × (四)计算题 1.解:(g) O N (l)H 2N 4242+O(l)4H (g)3N 22+ (l)H N 42摩尔燃烧热为 2.解: ) mol ·(kJ 28.254166.963.502)84.285(401f B r --=-?--?+=?=?∑H H ν)mol ·(kJ 14.6272 11r -Θ-=?=H Q p K 1077.3109.9824.3733 3 m r r ?=?--= ??= -S T 转) mol ·(kJ 78.34357 .86)15.137(36.3941 f B r --=---=?=?∑ G ν)K ·mol ·(J 9.9865.21056.1975.1912 1 6.21311B r ---=--?+==?∑ νNO(g )CO(g )+(g) N 2 1(g)CO 22+) mol ·(kJ 24.37325 .90)52.110(5.3931f B r --=----=?=?∑ H ν
此反应的 是较大的负值,且)(,)(-?-?S H 型反应,从热力学上看,在 T 转的温度以内反应都可自发进行。 3.解:外压kPa 50e =p ,11p nRT V = ,2 2p nRT V =,2e p p = 系统所做功: 定温变化,0=?U 0=+=?W Q U ,所以Q =1 247.1(J ) 定温过程pV =常数 ?(pV )=0 所以 0)(=?+?=?pV U H 4.解:查表知 CaO(s) + SO 3(g) = CaSO 4(s) 求得 同理求得 因为 所以根据经验推断可知,反应可以自发进行。 但由于该反应 ,故存在一个能使反应自发进行的最高温度,该 温度为 一般的炉温是1 200℃左右,所以热学上,用CaO 来吸收SO 3以减少天气污染的可能性是存在的。这种方法在实际中已有应用。 5.解:(1) ) mol ·kJ (4.116108.21515.29874.18013 r r r --=??-=???T )K 298(r ?) (J 1.247150 100100 50300314.8150RT 2112e 21 e e e e -=?-? ???=? ??? ??-=? ??? ??--=?-=?-=p p p p n p p nRT p nRT p V p V p W 7 .10676 .25675 .39) k ·mol ·(J 79.321106.37103.604)mol ·(kJ 11.434172.39509.634)mol ·(kJ 111f 1f -------?---?S G H 11r 1r K ·m ol · J 81.189,m ol ·kJ 7.346----=?-?S 11r mol ·kJ 42mol ·kJ 7.346---<<-?℃8571 K 0.130281 .189103.4043 ==-?-==H T )mol · kJ (74.180) 37.90(21f B r -=-?-=?=?∑ ν0,0r r ?? < ) K ·mol ·J (8.2150 .7220.2044.77211B r --=?-+?==?∑ ν1 3f 3f 4f r mol ·kJ 3.404)09.634()72.395(11.4341)CaO )SO )CaSO --=-----=?-?-?=?H H H H
不饱和烃第三章思考题其中含有六写出含有六个碳原子的烯烃和炔烃的构造异构体的构造式。习题3.1 (P69) 。个碳原子的烯烃,哪些有顺反异构?写出其顺反异构体的构型式(结构式)个 有顺反异构体:解:CH有13个构造异构体,其中4126 CHCHCH=CHCHCHCHCHCH=CHCHCHCHCHCHCH=CHCH3222233233222(Z,E)(Z,E)CH CH=CCHCHCHCH=CHCHCHCH=CHCHCHCH 3232232222CHCHCH333 CHCHCH=CCHCHCHCHCHCH=CHCHC=CHCH 332333322 CHCHCH333(Z,E)(Z,E) CHCHCH 33CHCH332C=CCHCH=CCHCHCH=CHCCHCH3233CHCH=CCH32322 CHCHCH333 有CH7个构造异构体:106CHCCHCHCCHCHCCHCHCCHCHCHCCHCHCH323232223232 CCHCHCHCCHCHCHCCHCHCHCCHCH)CC(CHCH 33332233CHCHCH333 (P74) 用衍生物命名法或系统命名法命名下列各化合物:习题3.2 )CHCH=CHCH(CH(CH)-3- or 2,5-(1) 己烯对称二异丙基乙烯二甲基233276453281CHCH=CHCHCH)(CHCHCH32232-4- 2,6-(2) 辛烯二甲基CH3132645or 3-(3)己炔二乙基乙炔CHCHCHCCCH322328 / 1 13245-1-(4)3,3-戊炔二甲基CHCCHCHC(CH)232343152-4-(5)1-炔戊烯 CHCCH=CHCH22CHCHCH322512634CH=CHHCCC=C(6) 3,4--1,3--5-炔二丙基己二烯2CHCHCH322CH32,3-(7) 二甲基环己烯CH3CH35,6--1,3-(8) 环己二烯二甲基CH3(P74) 习题3.3 用Z,E-命名法命名下列各化合物:HClC=C-1-Z)-1-(1) -1-丁烯↑ (溴↑氯BrCHCH32CHCl3C=C(2) -3-E)-2--2-↓氯↑(戊烯氟 FCHCH23CHHCHCH322C=C(3) E)-3--2-↑乙基(↓己烯 CHCHCH332CHCHCHCH3232C=C(4) E)-3--2-↓↑异丙基(己 烯)HCH(CH23(P83) 完成下列反应式:习题3.4 HH 催化剂lindlar C=CHCCCHC(1) 7733HHCC7337HHC NHLi , 液733HCCCHCC=C7733(2) CHH7328 / 2
科目一考试题库 (1073题完整版、含标准答案) 1、驾驶机动车在道路上违反道路交通安全法的行为,属于什么行为? A、违章行为 B、违法行为 C、过失行为 D、违规行为 答案:B 2、机动车驾驶人违法驾驶造成重大交通事故构成犯罪的,依法追究什么责任? A、刑事责任 B、民事责任 C、经济责任 D、直接责任 答案:A 3、机动车驾驶人造成事故后逃逸构成犯罪的,吊销驾驶证且多长时间不得重新取得驾驶证? A、5年内 B、10年内 C、终生 D、20年内 答案:C 4、驾驶机动车违反道路交通安全法律法规发生交通事故属于交通违章行为。 答案:× 5、驾驶机动车在道路上违反道路通行规定应当接受相应的处罚。 答案:√ 6、对未取得驾驶证驾驶机动车的,追究其法律责任。
答案:√ 7、对违法驾驶发生重大交通事故且构成犯罪的,不追究其刑事责任。 答案:× 8、造成交通事故后逃逸且构成犯罪的驾驶人,将吊销驾驶证且终生不得重新取得驾驶证。答案:√ 9、驾驶机动车在道路上违反交通安全法规的行为属于违法行为。 答案:√ 10、驾驶机动车应当随身携带哪种证件? A、工作证 B、驾驶证 C、 D、职业资格证 答案:B 11、未取得驾驶证的学员在道路上学习驾驶技能,下列哪种做法是正确的? A、使用所学车型的教练车由教练员随车指导 B、使用所学车型的教练车单独驾驶学习 C、使用私家车由教练员随车指导 D、使用所学车型的教练车由非教练员的驾驶人随车指导 答案:A 12、机动车驾驶人初次申领驾驶证后的实习期是多长时间? A、6个月 B、12个月 C、16个月 D、18个月 答案:B 13、在实习期内驾驶机动车的,应当在车身后部粘贴或者悬挂哪种标志? A、注意新手标志 B、注意避让标志
第一章绪论 2. (1) (2) (5)易溶于水;(3) (4) (6)难溶于水。 4.80*45%/12=3 80*7.5%/1=6 80*47.5%/19=2 C3H6F2 第二章有机化合物的结构本质及构性关系 1.(1) sp3(2) sp (3) sp2(4) sp (5) sp3(6)sp2 第四章开链烃 1.(1) 2-甲基-4,5-二乙基庚烷(2) 3-甲基戊烷(3) 2,4-二甲基-3-乙基戊烷 (4) (顺)-3-甲基-3-己烯or Z-3-甲基-3-己烯(12) 3-甲基-1-庚烯-5-炔 2. 7. 11.
14. (5) > (3) > (2) > (1) > (4) 即: CH 2=CHC + HCH 3 >(CH 3 )3C + >CH 3CH 2C +HCH 3 >CH 3CH 2CH 2C +H 2> (CH 3)2CHC + H 2 16. (1) (2) (3) 17. 21 A B . 10.(1)CH 3-CH=CH 2?????→?+ H /KMnO 4 CH 3COOH (2)CH 3-C ≡ CH+HBr (2mol ) CH 3CBr 2CH 3 (3)CH 3-C ≡3-C=CH 2??→?2 Br CH 3CBr 2CH 2Br Br 第四章 环 烃 2. 1-戊烯 1-戊炔 戊 烷Br 2/CCl 4 室温,避光 √ 溴褪色√ 溴褪色× × √灰白色1-丁炔 2-丁炔 丁 烷 Br 2/CCl 4 室温,避光 √溴褪色 × Ag(NH 3)2+ √灰白色↓ × × 1,3-丁二烯 1-己炔 2,3-二甲基丁烷Br 2/CCl 4 √ 溴褪色 √ 溴褪色 × Ag(NH 3)2+ × √ 灰白色↓
大学化学课后习题答案..
第一章化学反应热 教学内容 1.系统、环境等基本概念; 2. 热力学第一定律; 3. 化学反应的热 效应。 教学要求 掌握系统、环境、功、热(恒容反应热和恒压反应热)、状态函数、 标准态、标准生成焓、反应进度等概 念;熟悉热力学第一定律;掌握化学 反应标准焓变的计算方法。 知识点与考核点 1.系统(体系) 被划定的研究对象。化学反应系统是由大量微观粒子(分子、原子和 离子等)组成的宏观集合体。 2.环境(外界) 系统以外与之密切相关的部分。 2
系统和环境的划分具有一定的人为性,划分的原则是使研究问题比较方便。 系统又可以分为敞开系统(系统与环境之间既有物质交换,又有能量交换); 封闭体系(系统与环境之间没有 ..能量交 ..物质交换,只有 换); 孤立系统(体系与环境之间没有物质交换,也没有能量交换) 系统与环境之间具有边界,这一边界 可以是实际的相界面,也可以是人为的边界,目的是确定研究对象的空间范围。 3.相 系统中物理性质和化学性质完全相同的均匀部分。在同一个系统中,同一个相 可以是连续的,也可以是不连续的。例如油水混合物中,有时水是连续相,有 时油是连续相。 3
4.状态函数 状态是系统宏观性质(T、p、V、U等)的综合表现,系统的状态是通过 这些宏观性质描述的,这些宏观性质 又称为系统的状态函数。 状态函数的特点:①状态函数之间往 往相互制约(例如理想气体状态 方程 式中p、V、n、T之间互为函数关系);②其变化量只与系统的始、末态有关, 与变化的途径无关。 5*.过程 系统状态的变化(例如:等容过程、等压过程、等温可逆过程等) 6*.途径 完成某过程的路径。若系统的始、末 态相同,而途径不同时,状态函 数的 4
第三章不饱和烃 3.1用系统命名法命名下列化合物 a. b.c. (CH 3CH 2)2C=CH 2CH 3CH 2CH 2CCH 2(CH 2)2CH 3 2 CH 3C=CHCHCH 2CH 3 C 2H 5CH 3 d. (CH 3)2CHCH 2CH=C(CH 3)2 答案: a. 2-乙基-1-丁烯 2-ethyl -1-butene b. 2-丙基-1-己烯 2-propyl -1-hexene c. 3,5-二甲基-3-庚烯 3,5-dimethyl -3-heptene d. 2,5-二甲基-2-己烯 2,5-dimethyl -2-hexene 3.2写出下列化合物的结构式或构型式,如命名有误,予以更正。 a. 2,4-二甲基-2-戊烯 b. 3-丁烯 c. 3,3,5-三甲基-1-庚烯 d. 2-乙基-1-戊烯 e.异丁烯 f. 3,4-二甲基-4-戊烯 g. 反-3,4-二甲基-3-己烯 h. 2-甲基-3-丙基-2-戊烯 答案: a. b.错,应为1-丁烯 c. d. e. f. 错,应为2,3-二甲基-1-戊烯 g. h. 错,应为2-甲基-3-乙基-2-己烯 3.3写出分子式C 5H 10的烯烃的各种异构体的结构式,如有顺反异构,写出它们的构型式,并用系统命名法命名。 pent-1-ene (E )-pent-2-ene (Z )-pent-2-ene 3-methylbut-1-ene
2-methylbut-2-ene2-methylbut-1-ene 3.4用系统命名法命名下列键线式的烯烃,指出其中的sp2及sp3杂化碳原子。分子中的σ键有几个是sp2-sp3型的,几个是sp3-sp3型的? 3-ethylhex-3-ene 3-乙基-3-己烯,形成双键的碳原子为sp2杂化,其余为sp3杂化,σ键有3个是sp2-sp3型的,3个是sp3-sp3型的,1个是sp2-sp2型的。 3.5写出下列化合物的缩写结构式 答案:a、(CH3)2CHCH2OH;b、[(CH3)2CH]2CO;c、环戊烯;d、(CH3)2CHCH2CH2Cl 3.6将下列化合物写成键线式 A、O ;b、;c、 Cl ; d 、
第一章化学反应热 教学内容 1.系统、环境等基本概念;2. 热力学第一定律;3. 化学反应的热效应。 教学要求 掌握系统、环境、功、热(恒容反应热和恒压反应热)、状态函数、标准态、标准生成焓、反应进度等概念;熟悉热力学第一定律;掌握化学反应标准焓变的计算方法。 知识点与考核点 1.系统(体系) 被划定的研究对象。化学反应系统是由大量微观粒子(分子、原子和离子等)组成的宏观集合体。 2.环境(外界) 系统以外与之密切相关的部分。 系统和环境的划分具有一定的人为性,划分的原则是使研究问题比较方便。 系统又可以分为敞开系统(系统与环境之间既有物质交换,又有能量交换); 封闭体系(系统与环境之间没有 ..能量交换); ..物质交换,只有 孤立系统(体系与环境之间没有物质交换,也没有能量交换) . 学习帮
系统与环境之间具有边界,这一边界可以是实际的相界面,也可以是人为 的边界,目的是确定研究对象的空间范围。 3.相 系统中物理性质和化学性质完全相同的均匀部分。在同一个系统中,同一个相 可以是连续的,也可以是不连续的。例如油水混合物中,有时水是连续相,有时油是连续相。 4.状态函数 状态是系统宏观性质(T、p、V、U等)的综合表现,系统的状态是通过这些宏观性质描述的,这些宏观性质又称为系统的状态函数。 状态函数的特点:①状态函数之间往往相互制约(例如理想气体状态方程 式中p、V、n、T之间互为函数关系);②其变化量只与系统的始、末态有关,与变化的途径无关。 5*.过程 系统状态的变化(例如:等容过程、等压过程、等温可逆过程等) 6*.途径 完成某过程的路径。若系统的始、末态相同,而途径不同时,状态函数的 . 学习帮
机动车驾驶培训理论考试题库科目一500题[含答案] 一、单选题 1.山区道路车辆进入弯道前,在对面没有来车的情况下,应怎样做? A.应“减速.鸣喇叭.靠右行” B.可靠弯道外侧行驶 C.可短时间借用对方的车道 D.可加速沿弯道切线方向通过 答案:A 2.车辆在较窄的山路上行驶时,如果靠山体的一方不让行,应怎样做? A.向左占道,谨慎驶过 B.提前减速或停车避让 C.保持正常车速行驶 D.鸣喇叭催其让行 答案:B 3.驾驶车辆向右变更车道时,应提前开启右转向灯,注意观察,在确保安全的情况下,驶入要变更的车道。 答案:√ 4.雨天行车,遇撑雨伞和穿雨衣的行人在公路上行走时,应怎样做? A.以正常速度行驶 B.持续鸣喇叭示意其让道 C.加速绕行 D.提前鸣喇叭,并适当降低车速 答案:D 5.车辆在雪天临时停车时,应开启什么灯? A.前后雾灯 B.倒车灯 C.前大灯 D.危险报警闪光灯 答案:D 6.车辆在主干道上行驶,驶近主支干道交汇处时,为防止与从支路突然驶入的车辆相撞,应怎样做?
A.提前减速.观察,谨慎驾驶 B.保持正常速度行驶 C.鸣喇叭,迅速通过 D.提前加速通过 答案:A 7.夜间驾驶车辆遇自行车对向驶来时,应怎样做? A.连续变换远.近光灯 B.不断鸣喇叭 C.使用远光灯 D.使用近光灯,减速或停车避让 答案:D 8.行车中超越同向行驶的自行车时,应怎样做? A.让自行车先行 B.注意观察动态,减速慢行,留有足够的安全距离 C.连续鸣喇叭提醒其让路 D.持续鸣喇叭并加速超越 答案:B 9.车辆通过凹凸路面时,应怎样做? A.低速缓慢平稳通过 B.依靠惯性加速冲过 C.挂空挡滑行驶过 D.保持原速通过 答案:A 10.行车中遇列队横过道路的学生时,应怎样做? A.提前加速抢行 B.停车让行 C.降低车速.缓慢通过 D.连续鸣喇叭催促 答案:B 11.行车中遇儿童时,应怎样做? A.长鸣喇叭催促 B.减速慢行,必要时停车避让 C.迅速从一侧通过 D.加速绕行
第一章 化学反应热 教学内容 1.系统、环境等基本概念; 2. 热力学第一定律; 3. 化学反应的热效应。 教学要求 掌握系统、环境、功、热(恒容反应热和恒压反应热)、状态函数、标准态、标准生成焓、反应进度等概念;熟悉热力学第一定律;掌握化学反应标准焓变的计算方法。 知识点与考核点 1.系统(体系) 被划定的研究对象。化学反应系统是由大量微观粒子(分子、原子和离子等)组成的宏观集合体。 2.环境(外界) 系统以外与之密切相关的部分。 系统和环境的划分具有一定的人为性,划分的原则是使研究问题比较方便。 系统又可以分为敞开系统(系统与环境之间既有物质交换,又有能量交换); 封闭体系(系统与环境之间没有物质交换,只有能量交换); 孤立系统(体系与环境之间没有物质交换,也没有能量交换)系统与环境之间具有边界,这一边界可以是实际的相界面,也可以是人为 的边界,目的是确定研究对象的空间范围。 3.相 系统中物理性质和化学性质完全相同的均匀部分。在同一个系统中,同一个相 可以是连续的,也可以是不连续的。例如油水混合物中,有时水是连续相,有时油是连续相。 4.状态函数 状态是系统宏观性质(T、p、V、U等)的综合表现,系统的状态是通过这些
宏观性质描述的,这些宏观性质又称为系统的状态函数。 状态函数的特点:①状态函数之间往往相互制约(例如理想气体状态方程 式中p、V、n、T之间互为函数关系);②其变化量只与系统的始、末态有关,与变化的途径无关。 5*.过程 系统状态的变化(例如:等容过程、等压过程、等温可逆过程等) 6*.途径 完成某过程的路径。若系统的始、末态相同,而途径不同时,状态函数的 变量是相同的。 7*.容量性质 这种性质的数值与系统中的物质的量成正比,具有加合性,例如m(质量)V、U、G等。 8*.强度性质 这种性质的数值与系统中的物质的量无关,不具有加合性,例如T、 (密度)、p(压强)等。 9.功(W) 温差以外的强度性质引起的能量交换形式[W=W体+W有]。 环境对系统做功,其符号为(+);反之为(–)。功不是状态函数,是过程量。因为功总是与系统变化的途径有关。例如盐酸与锌单质在烧杯中发生氧化还原反应时会有热效应,但是系统并不做功(W有= 0)。但是,若将其组成原电池,系统就可以对环境做电功(W有<0)。又例如一个带活塞的汽缸膨胀,分别经过①向真空中膨胀;②向大气中等外压膨胀。设活塞的两个过程的始、末状态相同,则W体1=0;而W体2 = p环境(V2–V1)≠0。 10.热(Q) 系统与环境之间因温差引起的能量交换形式。系统吸收热量,热的符号为(+),系统放热为(–)。热是与变化途径有关的物理量,任何一个系统只能说它在某过程中吸收或放出多少热量,不能说它本身含有多少热量,所以热不是状态函数。
不饱和烃补充练习(反应式、推断、合成) 一、完成反应式: 1、CH 3CH=CH 2 + H 2SO 4→ 解: CH 3CHCH 3 OSO 2OH → CH 3CHCH 3 OH 2、CCl 3CH=CH 2 + HCl → 解: CCl 3CHCH 2 (CHCl=CH 2+HCl →? 解:CHCl 2CH 3) 注:此题分析过程可见“电子效应”部分。 3、[O] (CH 3)2C=CH 2 解: CH 3CCH 3 + CO 2 + H 2O O 4、 CH 3CH 2C ≡CH + H 2HgSO 4 H 2SO 4 解: OH H CH 3CH 2C=CH CH 3CH 2CCH 3 二、合成题:(合成有多种路径可完成,要求是理论上可行的都可以) 1、由乙炔合成反-3-己烯 H 3CH 2H H CH 2CH 3 解:分析:产物与原料相比,需要在两个端基引入新基团(乙基),故考虑通过炔钠与伯卤 代烃(溴乙烷)的反应来实现,增长碳链后再将炔烃还原至反式烯烃。 HC CH NaNH 2CNa 3C 2H 5C CC 2H 5 C 2H 5Br Na 3C 25 H C 2H 5 2、由1-丁炔合成顺-2-戊烯 HC CCH 2CH 3 H 3C C 2H 5 解:分析:产物与原料比,端基需引入甲基且需还原为顺式烯烃,故考虑由炔钠合成高级炔 烃后经林德拉还原体系得到目标化合物。 NaNH 23HC CC 2H 5 NaC CC 2H CH 3I H 3CC CC 2H 5 H 2 Lindlar H 3C C 2H 5 3、由1-丁炔合成反-2-戊烯 HC CC 2H 5 H C 2H 5 CH 3H
c1驾照科目一模拟考试题库及答案 1、在道路上发生交通事故造成人身伤亡时,要立即抢救受伤人员并迅速报警。 A.正确 B.错误 正确答案是:A 2、安装防抱死制动装置(ABS)的机动车紧急制动时,可用力踏制动踏板。 A.正确 B.错误 正确答案是:A 3、装有ABS系统的机动车在冰雪路面上会最大限度缩短制动距离。 A.正确 B.错误 正确答案是:B 4、发现前方道路堵塞,正确的做法是什么? A.按顺序停车等候 B.鸣喇叭示意前方车辆快速行驶 C.选择空当逐车超越 D.继续穿插绕行 正确答案是:A 5、夜间在道路上会车时,距离对向来车多远将远光灯改用近光灯? A.100米以内 B.50米以内 C.200米以外
D.150米以外 正确答案是:D 6、这个标志是何含义? A.两侧街道 B.干路先行 C.停车让行 D.单行路 正确答案是:B 7、这是什么操纵装置? A.倒车灯开关 B.刮水器开关 C.危险报警闪光灯开关 D.灯光、信号组合开关 正确答案是:D 8、这两辆车发生追尾的主要原因是什么? A.前车采取制动时没看后视镜 B.前车采取制动过急 C.后车超车时距离前车太近 D.后车未与前车保持安全距离 正确答案是:D 9、驾驶机动车在沙尘天气条件下行车不用开启前照灯、示廓灯和后位灯。 A.正确 B.错误
正确答案是:B 10、驾驶车辆通过人行横道线时,应注意礼让行人。 A.正确 B.错误 正确答案是:A 11、下长坡时,控制车速除了刹车制动以外还有什么有效的辅助方法? A.挂入空挡滑行 B.利用发动机制动 C.关闭发动机熄火滑行 D.踏下离合器滑行 正确答案是:B 12、这个标志是何含义? A.向左绕行 B.连续弯路 C.向左急转弯 D.向右急转弯 正确答案是:C 13、这个标志是何含义? A.向右急转弯 B.向右绕行 C.连续弯路 D.向左急转弯 正确答案是:A
如何正确使用食品防腐剂? 问:使用食品防腐剂应注意哪些问题?怎样使用食品防腐剂才能达到最佳效? 答:食品防腐方法很多,其中,由于添加食品防腐剂的方法投资少、见效快,不需要特殊仪器和设备,不改变食品的形态品质而被广泛采用。 添加食品防腐剂,首先必须严格按照《食品卫生法》规定的使用剂量和范围来使用,以对人体无毒无害为前提。为使食品防腐剂达到最佳使用效果,必须注意影响防腐效果的各种因素:(1)pH值与水的活度在水中,酸型防腐剂处于电离平衡状态,除H+离子外,主要靠未电离的酸发挥防腐作用,这类防腐剂在pH值低时使用效果好。 水的活度高则有利于细菌和霉菌的生长。细菌生存的水的活度在..9以上,霉菌在0.7以上。降低水的活度有利于防腐效果的发挥。在水中加入电解质,或加入其他可溶性物质,当达到一定的浓度时,可降低水的活度,起到增效作用。 (2)溶解与分散对水果、薯类、冷藏食品,腐败一般从表面开始,只需将防腐剂均匀地分散于食品表面;而对于饮料就需将防腐剂配成溶液后均匀地分散在饮料中。 (3)防腐剂的配合使用没有 一种防腐剂能够抑制一切腐败性微生物,所以应将不同作用范围的防腐剂配合使用。防腐剂配合使用,可以有增效或协同效应;增加或相加效应;对抗或拮抗效应。一般采用同类型防腐剂配合使用,如,酸性防腐剂与其盐,同种酸的几种酯配合使用等。 (4)防腐剂的使用时间同种防腐剂因加入场合和时间不同,效果可能不同。首先要保证食品本身处于良好的卫生条件下,并将防腐剂的加入时间放在细菌的诱导期。如果细菌的增殖进入了对数期,防腐剂就丧失了原有作用。 防腐剂应尽早加入,加入得早,效果好,用量也少。食品染菌情况越严重,则防腐剂效果越差,如果食品已经变质,任何防腐剂也不可逆转。 (5)食品的原料和成分的影响防腐剂的作用受食品的原料和成分的影响,如食品中的香味剂、调味剂、乳化剂等具有抗菌作用,食盐、糖类、乙醇可以降低水的活度,有助于防腐,食盐还可干扰微生物中酶的活性,但会改变防腐剂的分配系数,使其分布不均。 食品中的某些成分与防腐剂起化学反应,会使防腐剂部分或全部失效或产生副作用。防腐剂还易被食品中的微生物分解。 西气东输的战略意义 西气东输工程是盘活集团公司存量资产的有利时机 天然气资源具备,有良好的开发效益 西气东输工程对于加快新疆地区经济发展,保持新疆地区政治和社会稳定具有重大的战略意义 利用天然气可以大幅度减少建设投资 作为清洁能源,利用天然气可节约大量污染治理费 如何发扬两弹一星精神 两弹一星”精神是爱国主义、集体主义、社会主义精神和科学精神活生生的体现.今天,面对世界科技革命的深刻变化和迅猛发展,新一代的航天科技工作者,继承并发扬老一代科
不饱和烃习题答案 习题1 2-乙基-1-戊烯;3-乙基环己烯;2,2-二甲基-3-庚炔;3-乙基-1,6-庚二烯;2,3-二甲基丁二烯;顺,反-2,4-己二烯;E-2-戊二烯;E-1-氯-2-甲基-1-丁烯;E-1-氯-1-溴-3,3--二甲基-1-丁烯;1,5-二甲基环戊二烯;1,4-环己二烯;1-异丙基环丁烯。 习题2 C H 3CH 3 H 3C H 3 C H 3CH 3 CH 3 Cl C H 2CH 2 H 3 CH 3 CH 3 CH 3 CH 3 C H 3 C H 3CH 3 C H 3C H 2CH C H 2CH C H 3CH 3 习题3,(1) C H 3O C H 33 SO 3H (2) CH 3 Br (3)CH 3 Br (4) C H 3H 3CH 3 O (5) C H 3CH 3 H CH 3Cl (6) CH 3 Br (7) C H 3CH 3 O (8)Br Br Br CH 3 Br (9)OH CH 3O H (10)HOOC O OH (11) O CH 3 O (12) Br 习题4,(1. C 3C H 33B ,C H 3C H 3OH
(2)CH 2 Cl CH 3 (3) COOE t COOH (4) C H 3H 3Br (5) CH 3 C H 3(6)C H 3COOM e COOM e (7) O O C H 3O (8)COOH C H 3CH 3 (9) CH 3 O (10)CN C H 3C H 3CN 习题5,(4)最活泼,不对称二甲基推电子,(2)次之,一个甲基推电子,(1)又次之,乙基推电子(位阻比较大),(3)活泼性排最后,无推电子基。 习题6,(1) C H 3C H 3CH 3CH 3 CH 33 C H 3CH 23 KM nO 4 褪色 C H 3CH 23 C H 3C H 3CH 3CH 3 CH 33 Br Br 褪色 不褪色 CH 3CH 3C H 3H 3CH 3CH 3 (2) KM nO 4 褪色 不褪色 正己烷1-己炔 2-己炔 正己烷 1-己炔 2-己炔己炔 己炔 习题7,叔碳正离子稳定性最大,9个C-H 西格玛键超共轭; 仲碳正离子稳定性次之,6个C-H 西格玛键超共轭; 伯碳正离子稳定性又次之,3个C-H 西格玛键超共轭; 甲基碳正离子最不稳定无C-H 西格玛键超共轭。 习题8, (1) C H 3CH C H 3Cl Cl Zn C H 3CH 3 3 KM O C H 33 O C H 3COOH + A B
第三章 不饱和烃 思考题 习题3.1 写出含有六个碳原子的烯烃和炔烃的构造异构体的构造式。其中含有六个碳原子的烯烃,哪些有顺反异构?写出其顺反异构体的构型式(结构式)。(P69) 解:C 6H 12有13个构造异构体,其中4个有顺反异构体: C H 2=C H C H 2C H 2C H 2C H 3 C H 3C H =C H C H 2C H 2C H 3 C H 3C H 2C H =C H C H 2C H 3 (Z ,E ) (Z ,E ) C H 2=CC H 2C H 2C H 3C H 3 C H 2=C H C H C H 2C H 3 C H 3 C H 2=C H C H 2C H C H 3 C H 3 C H 3C =C H C H 2C H 3 C H 3 C H 3C H =C C H 2C H 3 C H 3C H 3C H =C H 2C H C H 3 C H 3 (Z ,E ) (Z ,E ) C H 2=C H C C H 3 C H 3 C H 3 C H 2=C C H C H 3 C H 3 C H 3 C H 3C =C C H 3 C H 3C H 3 C H 2=C C H 2C H 3 C H 2C H 3 C 6H 10有7个构造异构体: C H C C H 2C H 2C H 2C H 3C H 3C C C H 2C H 2C H 3 C H 3C H 2C C C H 2C H 3 C H C C H C H 2C H 3C H 3 C H C C H 2C H C H 3 C H 3 C H C C (C H 3)3 C H 3C C C H C H 3C H 3 习题3.2 用衍生物命名法或系统命名法命名下列各化合物:(P74) (1) (CH 3)2CH CH =CH CH (CH 3)2 对称二异丙基乙烯 or 2,5-二甲基-3-己烯 (2) (C H 3)2C H C H 2C H =C H C H C H 2C H 3 C H 3 1 2 3 4 5 6 7 8 2,6-二甲基-4-辛烯 (3) C H 3C H 2 C C C H 2C H 3123 456 二乙基乙炔 or 3-己炔
第四章电化学与金属腐蚀 1.是非题(对的在括号内填“+”,错的填“-”号) (1)取两根铜棒,将一根插入盛有0.1mol·dm-3CuSO4溶液的烧杯中,另一根插入盛有1mol·dm-3CuSO4溶液的烧杯中,并用盐桥将两只烧杯中的溶液连结起来,可以组成一个浓差原电池。( ) (2)金属铁可以置换Cu2+,因此三氯化铁不能与金属铜反应。( ) (3)电动势E(或电极电势φ)的数值与反应式(或半反应式)的写法无关,而标准平衡常数Kθ的数据,随反应式的写法(即化学计量数不同)而变。( ) (4)钢铁在大气的中性或弱酸性水膜中主要发生吸氧腐蚀,只有在酸性较强的水膜中才主要发生析氢腐蚀。( ) (5)有下列原电池 (-)Cd|CdSO4(1.0mol·dm-3)||CuSO4(1.0mol·dm-3)|Cu(+) 若往CdSO4溶液中加入少量Na2S 溶液,或往CuSO4溶液中加入少量CuSO4·5H2O晶体,都会使原电池的电动势变小。( ) 解:(1)+;(2)–;(3)+;(4)+;(5)–。 2.选择题(将所有正确答案的标号填入空格内) (1)在标准条件下,下列反应均向正方向进行: Cr2O72 - +6Fe2++14H+=2Cr3++6Fe3++7H2O 2Fe3++Sn2+=2Fe2++Sn4+ 它们中间最强的氧化剂和最强的还原剂是______。 (a)Sn2+和Fe3+(b)Cr2O72 -和Sn2+
(c)Cr3+和Sn4+(d)Cr2O72 -和Fe3+ (2)有一个原电池由两个氢电极组成,其中有一个是标准氢电极,为了得到最大的电动势,另一个电极浸入的酸性溶液[设p(H2)=100kPa]应为 (a)0.1mol·dm-3HCl (b)0.1mol·dm-3HAc+0.1mol·L-1NaAc (c)0.1mol·dm-3Hac (d)0.1mol·dm-3H3PO4 (3)在下列电池反应中 Ni(s)+Cu2+(aq)→Ni2+(1.0mol·dm-3)+Cu(s) 当该原电池的电动势为零时,Cu2+浓度为 (a)5.05×10-27mol·dm-3(b)5.71×10-21mol·dm-3 (c)7.10×10-14mol·dm-3(d)7.56×10-11mol·dm-3 (4)电镀工艺是将欲镀零件作为电解池的();阳极氧化是将需处理的部件作为电解池的()。 (a)阴极(b)阳极(c)任意一个极 解:(1)b;(2)b;(3)b;(4)a,b。 3.填空题 (1)有一种含Cl-、Br-和I-的溶液,要使I-被氧化而Cl-、Br-不被氧化,则在常用的氧化剂 (a)KMnO4酸性溶液,(b)K2Cr2O7酸性溶液,(c)氯水和(d)Fe2(SO4)3溶液中应选()为最适宜。 (2)有下列原电池 (-)pt|Fe2+(1mol· d m-3) Fe3+(0.01mol· dm-3)||Fe2+(1mol · dm-3) ,