1、定义:在相同条件下(定温定容或定温定压),对同一可逆反应,由于起始 有关物质的量“相当”,无论从正反应幵始还是从逆反应幵始, 均可达到平衡, 且任何组分的含量(通常为百分含量)相同,这样的平衡互称为等效平衡 2、等效平衡的类型及建立等效平衡的条件 规律一:恒温恒容条件下,对于任何(无论反应前后气体分子数是否相同 ) 可逆反应,如果起始加入物质的物质的量不同 ,按化学方程式中的化学计量关 系换算成同一方向的物质(即“一边倒”)后,各组分的物质的量与原平衡相同 则两平衡等效,平衡时,同种组分的体积分数、物质的量浓度、物质的量均相同 (也可叫全等平衡)。 mA(g)+nB(g) — p C(g)+qD(g) 起始① mmol nmol 0 0 起始② 0 P mol qmol 上述两种情况投料不同,但是将②中投料“左边倒”后,四种物质的物质的 量均同①相同, 因此两种情况可达到等效平衡,平衡时,同种组分(如 A )的体积分数、物质 的量浓度、物质的量均相同。 例1.在一固定体积的密闭容器中通入 2molA 和ImolB 发生反应 2A(g)+B(g) = l3C(g)+D(g) 反应达到平衡时,测得 C 的物质的量浓度为wmol/L.若维持容器的容积不 专题
变,按下列四种配比做起始浓度,达平衡后,C的浓度仍维持wmol/L的是
2C(g)达到平衡时,C 的质量分数为co %,在相同条件下按下列情况充入物质达到 平衡时C 的质量分数仍为 o %勺是() ,2molB ,2molC 例3、在一个固定体积的密闭容器中,保持一定浓度,进行以下反应:4A(g)+5B(g) —=4C(g)+6D(g),已知加入4molA 和5molB 时,反应进行到一定程度时,反应 混合物就处于平衡状态,现在该容器中,保持温度不变,令 初始加入的A,B,C,D 的物质的量,如果a,b,c,d 取不同的数值,它们必须满足 定关系,才能保证达到平衡时,反应混合物中几种物质的百分含量仍跟上述 平衡时完全相同,请填写下列空白: (1) 若 a=0,b=0,贝y c= ,d=. (2) 若 a=1,则 b= ,c= ,d= (3) a,b,c,d 取值必须满足的一般条件是(请用方程式表示,其中一个只含 和c,另一个只含b 和c ): 规律二:恒温恒压条件下,对于任何(无论反应前后气体分子数是否相同 可逆反应,如果起始加入物质的物质的量不同 ,按化学方程式中的化学计量关 系“一边倒”后,各组分的物质的量之比与原平衡相同 ,则两平衡等效,平衡 时,同种组分的体积分数、物质的量浓度相同,但物质的量不同。 A 4molA+2molB 、2molA+1molB+3molC+1molD C 、3molC+1molD+1molB D 、3molC+1molD 例2、在固定体积的密闭容器中,加入 2molA,1molB,发生反应:A(g)+B(g)丨—| a,b,c,d 分别代表
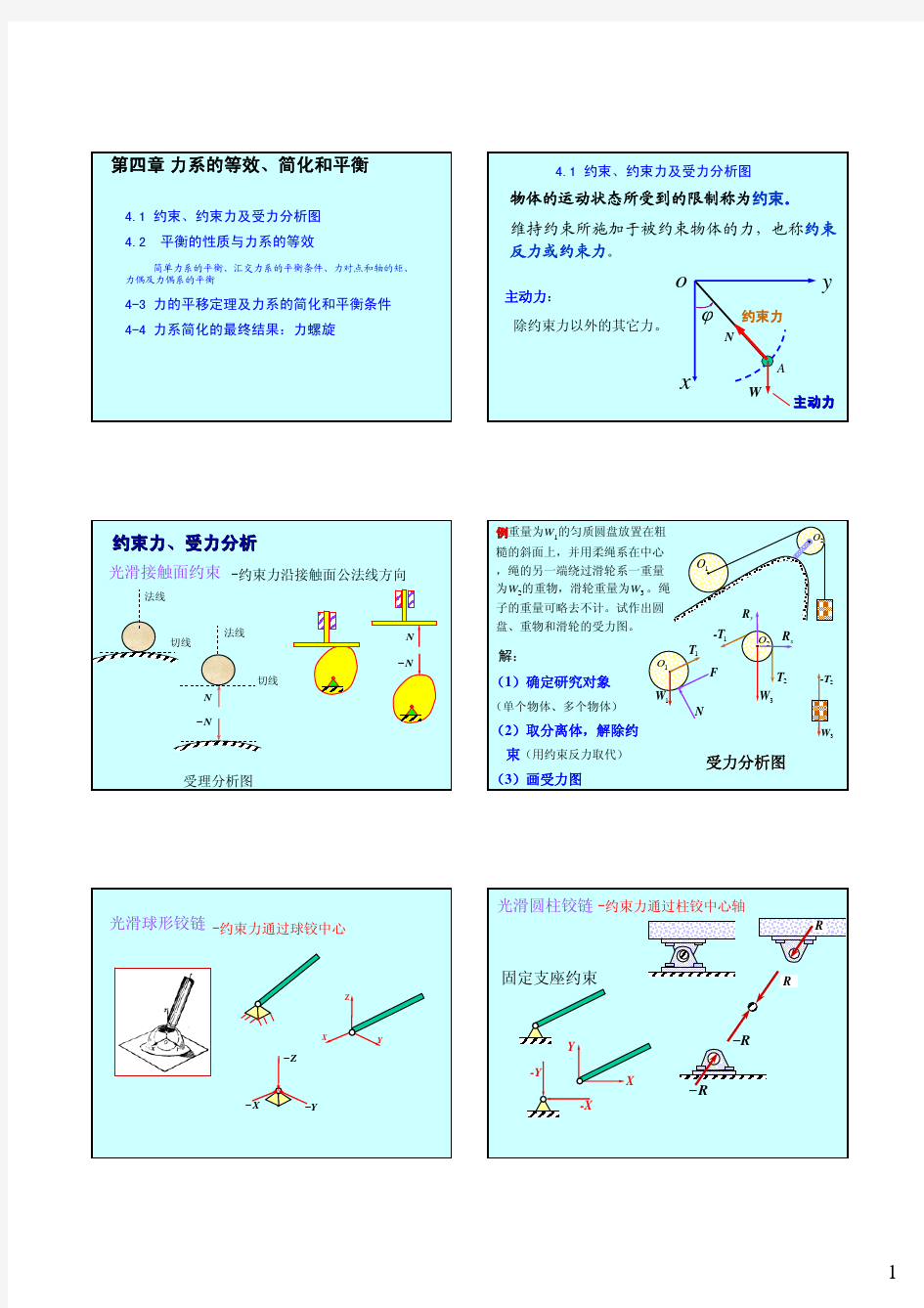
第2章 力系的等效与简化 2-1试求图示中力F 对O 点的矩。 解:(a )l F F M F M F M M y O y O x O O ?==+=αsin )()()()(F (b )l F M O ?=αsin )(F (c ))(sin cos )()()(312l l Fl F F M F M M y O x O O +--=+=ααF (d )2 22 1sin )()()()(l l F F M F M F M M y O y O x O O +==+=αF 2-2 图示正方体的边长a =0.5m ,其上作用的力F =100N ,求力F 对O 点的矩及对x 轴的力矩。 解:)(2 )()(j i k i F r F M +-? +=?=F a A O m kN )(36.35) (2 ?+--=+--= k j i k j i Fa m kN 36.35)(?-=F x M 2-3 曲拐手柄如图所示,已知作用于手柄上的力F =100N ,AB =100mm ,BC =400mm ,CD =200mm , α = 30°。试求力F 对x 、y 、z 轴之矩。 解: )cos cos sin (sin )4.03.0()(2k j i k j F r F M αααα--?-=?=F D A k j i αααα22sin 30sin 40)sin 4.03.0(cos 100--+-= 力F 对x 、y 、z 轴之矩为: m N 3.43)2.03.0(350)sin 4.03.0(cos 100)(?-=+-=+-=ααF x M m N 10sin 40)(2?-=-=αF y M m N 5.7sin 30)(2?-=-=αF z M 2—4 正三棱柱的底面为等腰三角形,已知OA=OB =a ,在平面ABED 内沿对角线AE 有一个力F , 图中θ =30°,试求此力对各坐标轴之矩。 习题2-1图 A r A 习题2-2图 (a ) 习题2-3图
平面一般力系的平衡 一、 判断题: 1.下图是由平面汇交力系作出的力四边形,这四个力构成力多边形封闭,该力系一定平衡。( ) 图 1 2.图示三个不为零的力交于一点,则力系一定平衡。( ) 图 2 3.如图3所示圆轮在力F和矩为m的力偶作用下保持平衡,说明力可与一个力偶平衡。( ) 4.图4所示力偶在x轴上的投影ΣX=0,如将x轴任转一角度 轴,那么Σ =0。( ) 图 3 图 4
5.如图5所示力偶对a的力矩Ma(F,F')=F·d,如将a任意移到b,则力矩Mb(F,F')将发生变化。( ) 图 5 图 6 6.图6所示物体的A、B、C、D四点各有一力作用,四个力作出的力多边形闭合,则此物体处于平衡状态。( ) 7.如果两个力偶的力偶矩大小相等,则此两个力偶等效。( ) 8.图示构件A点受一点力作用,若将此力平移到B点,试判断其作用效果是否相同( ) 图 7 图 8 9.图8所示梁,若求支反力 时,用平面一般力系的平衡方程不能全部求出。 ( ) 10.图9所示物体接触面间静摩擦系数是f,要使物体向右滑动。试判断哪种施力方法省力。( ) 图 9 图 10 11.力在坐标轴上的投影和该力在该轴上分力是相同的。( )
12.如果将图10所示力F由A点等效地平移到B点,其附加力矩M =Fa ( )。 13.平面任意力系,其独立的二力矩式平衡方程为 ∑Fx=0, ∑M A =0, ∑M B=0,但要求矩心A、B的连线不能与x轴垂直。( ) 二、选择题 1.同一个力在两个互相平行的同向坐标轴上的投影( )。 A.大小相等,符号不同 B.大小不等,符号不同 C.大小相等,符号相同 D.大小不等,符号相同 2.图11所示圆轮由O点支承,在重力P和力偶矩m作用下处于平衡。这说明( )。 图 11 A. 支反力R0与P平衡 B. m与P平衡 C. m简化为力与P平衡 D. R0与P组成力偶,其m(R0,P)=-P·r与m平衡 3. 图12所示三铰刚架,在D角处受一力偶矩为m的力偶作用, 如将该力力偶移到E角出,支座A、B的支反力 ( )。 图12 A.A、B处都变化 B.A、B处都不变 C.A处变,B处不变
高三等效平衡试题精选精练(含答案) A组基础巩固型 i.恒压下,在-个可变容积的密闭容器中发生如下反应: 2NH3(g)+CO2(g)CO(NH2)2(g)+H2O(g) 若开始时放入2mol NH3和1mol CO2,达平衡后,生成amol H2 O;若开始时放入xmol NH3、2mol CO2和1mol H2O(g),达平衡后,H2O的物质的量是3a mol,则x为 A 1mol B 2mol C 3mol D 4mol ii.在密闭容器中,加入3mol A和1mol B,一定条件下发生反应3A(g)+B(g)2C (g)+D(g),达平衡时,测得C的浓度为w mol/L,若保持容器中压强和温度不变,重新按下列配比作起始物质,达到平衡时,C的浓度仍然为w mol/L的是 A 6mol A+2mol B B 1.5mol A+0.5mol B+1mol C+0.5mol D C 3mol A+1mol B+2mol C+1mol D D 2mol C+1mol D iii.一定条件下,向一带活塞的密闭容器中充入2mol SO2和1molO2,发生下列反应:2SO2(g)+O2(g)2SO3(g)达到平衡后改变下述条件,SO3气体平衡浓度不改变的是 A 保持温度和容器体积不变,充入1mol SO2(g) B 保持温度和容器内压强不变,充入1mol SO3(g) C 保持温度和容器内压强不变,充入1mol O2(g) D 保持温度和容器内压强不变,充入1mol Ar(g) iv.在一个固定容积的密闭容器中,加入mmol A、nmol B,发生下列反应:mA(g)+nB(g)pC(g)平衡时C的浓度是wmol/L,若容器体积和温度不变,起始时放入amol A、bmol B、cmol C,若要平衡后C的浓度仍为wmol/L,则a、b、c应满足的关系是 A a︰b︰c=m︰n︰p B a︰b=m︰n (ap/m)+c=p C (mc/p)+a=m,(nc/p)+b=n D a=m/3,b=n/3,c=2p/3 v.在VL密闭容器中,通入0.2mol SO2和0.2mol SO3气体,在一定条件下发生反应:2SO2+O22SO3。平衡时SO3为amol;在相同温度下按下列配比在VL密闭容器中放入起始物质,平衡时有关SO3的正确叙述是 A 放入0.2mol SO2、0.1molO2、0.1mol SO3,达到平衡时SO3必小于amol B 放入0.2mol SO2、0.1molO2、0.2mol SO3,达到平衡时SO3必大于amol C 放入0.4mol SO2、0.1molO2,达到平衡时SO3会等于0.4mol D 放入0.2mol SO2、0.1molO2,达到平衡时SO3必小于amol vi.一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
化学平衡中的等效平衡问题 知识整理 相同条件下,同一可逆反应体系,不管从正反应开始,还是从逆反应开始,达到平衡时,任何相同物质的含量(体积分数、质量分数或物质的量分数)都相同的化学平衡互称等效平衡。可分为“全等效”平衡和“相似等效”平衡。判断等效平衡的方法:使用极限转化的方法将各种情况变换成同一反应物或生成物,然后观察有关物质的数量是否相当。 在一定条件下(恒温恒容或恒温恒压),对同一可逆反应,起始时加入物质的物质的量不同,达平衡时的状态规律如下表: 一、恒温恒容(定T、V)的等效平衡 1.在定T、V条件下,对于反应前后气体体积改变的反应:若改变起始加入情况,只要通过可逆反应的化学计量数比换算成平衡时左右两边同一边物质的物质的量与原平衡相同,则二平衡等效。 2.在定T、V条件下,对于反应前后气体体积不变的反应:只要反应物(或生成物)的物质的量的比例与原平衡相同,则二平衡等效。 二、恒温恒压(定T、P)的等效平衡 在定T、P条件下:若改变起始加入情况,只要通过可逆反应的化学计量数比换算成平衡时左右两边同一边物质的物质的量之比。 即:对于反应前后气体体积发生变化的可逆反应而言,恒容容器中要想达到同一平衡状态,投料量必须相同;恒压容器中要想达到同一平衡状态,投料量可以不同,但投入的比例得相同。 例1.在一个固定体积的密闭容器中,加入2molA和1molB,发生反应2A(g)+B(g) 2C(g),达到平衡时,C的物质的量浓度为K mol/L,若维持容器体积和温度不变,按下列配比作为起始物质,A.4 molA+2 molB B.2 molA+1 molB+2 molC C.2 molC+1 molB D.2 molC E.1 molA+0.5 molB+1 molC ①达到平衡后,C的物质的量浓度仍是K mol/L的是(DE ) ②A项平衡时,c(C)与2K mol/L的关系? 分析:→ 扩大一倍若平衡不动,则[C]=2K mol/L,现右移∴>2K mol/L ③平衡时各选项中C的平衡浓度c(C)的大小顺序。 分析:C项,相当于D、E项达平衡基础上,再加1molB,右移,c(C)增大,A=B>C>D=E ④若令a、b、c分别代表初始加入的A、B、C的物质的量,如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时完全相同,填写: Ⅰ若a=0,b=0,则c=__2___。
等效平衡原理及练习 一、等效平衡概念 等效平衡是指在一定条件(恒温恒容或恒温恒压)下,只是起始加入情况不同的同一可逆反应达平衡后,任何相同组分的体积分数或物质的量分数均相等的平衡。 在等效平衡中,有一类特殊的平衡,不仅任何相同组分X的含量(体积分数、物质的量分数)均相同,而且相同组分的物质的量均相同,这类等效平衡又称为同一平衡。同一平衡是等效平衡的特例。 如,常温常压下,可逆反应: 2SO2 + O2 2SO2 ①2mol 1mol 0mol ②0mol 0mol 2mol ③0.5mol 0.25mol 1.5mol ①从正反应开始,②从逆反应开始,③从正逆反应同时开始,由于①、②、③三种情况如果按方程式的计量关系折算成同一方向的反应物,对应各组分的物质的量均相等(如将②、③折算为①),因此三者为等效平衡 二、等效平衡规律 判断是否建立等效平衡,根据不同的特点和外部条件,有以下几种情况: ①在恒温、恒容条件下,对于反应前后气体分子数改变的可逆反应,改变起始时加入物质的物质的量,通过化学计量数计算,把投料量换算成与原投料量同一则物质的物质的量,若保持其数值相等,则两平衡等效。此时,各组分的浓度、反应速率等分别与原平衡相同,亦称为同一平衡。 ②在恒温、恒容条件下,对于反应前后气体分子数不变的可逆反应,改变起始时加入物质的物质的量,通过化学计量数计算,把投料量换算成与原投料量同一则物质的物质的量,只要物质的量的比值与原平衡相同则两平衡等效。此时,各配料量不同,只导致其各组分的浓度反应速率等分别不同于原平衡,而各组分的百分含量相同。 ③在恒温、恒压下,不论反应前后气体分子数是否发生改变,改变起始时加入物质的物质的量,根据化学方程式的化学计量数换算
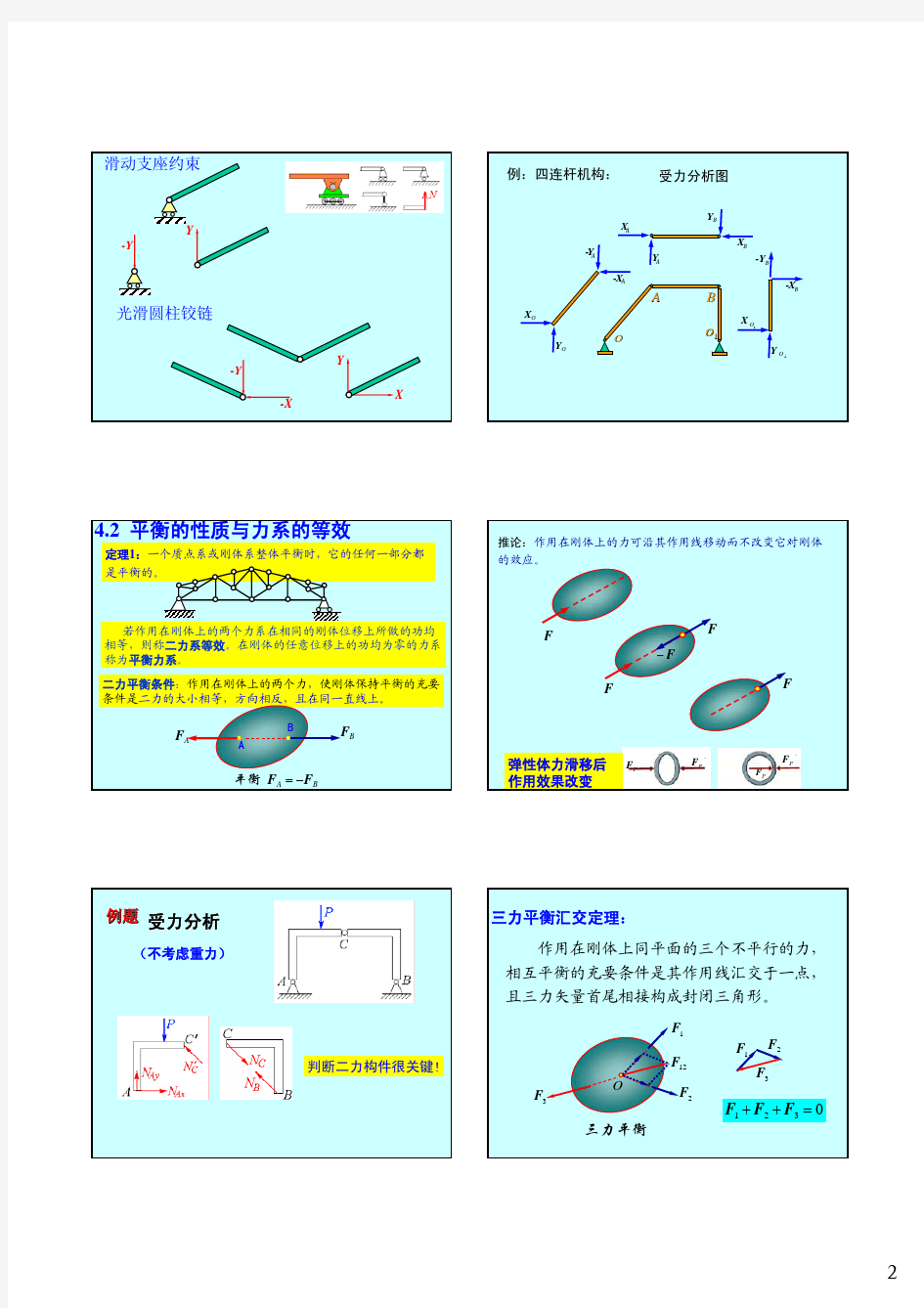
第二章力系的等效与简化 一、刚体和平衡的概念 刚体:在受力作用后而不产生变形的物体称为,刚体是对实际物体经过科学的抽象和简化而得到的一种理想模型。而当变形在所研究的问题中成为主要因素时(如在材料力学中研究变形杆件),一般就不能再把物体看作是刚体了。 平衡:指物体相对于地球保持静止或作匀速直线运动的状态。显然,平衡是机械运动的特殊形态,因为静止是暂时的、相对的,而运动才是永衡的、绝对的。 二、力系、等效力系、平衡力系 力系:作用在物体上的一组力。按照力系中各力作用线分布的不同形式, 力系可分为: (1)汇交力系力系中各力作用线汇交于一点; (2)力偶系力系中各力可以组成若干力偶或力系由若干力偶组成; (3)平行力系力系中各力作用线相互平行; (4)一般力系力系中各力作用线既不完全交于一点,也不完全相互平行。 按照各力作用线是否位于同一平面内,上述力系各自又可以分为平面力系和 空间力系两大类,如平面汇交力系、空间一般力系等等。 等效力系:两个力系对物体的作用效应相同,则称这两个力系互为等效力系。当一个力与一个力系等效时,则称该力为力系的合力;而该力系中的每一个力称为其合力的分力。把力系中的各个分力代换成合力的过程,称为力系的合成;反过来,把合力代换成若干分力的过程,称为力的分解。 平衡力系:若刚体在某力系作用下保持平衡。在平衡力系中,各力相互平衡,或者说,诸力对刚体产生的运动效应相互抵消。可见,平衡力系是对刚体作用效应等于零的力系。 第一节静力学基本公理 静力学公理是人们从实践中总结得出的最基本的力学规律,这些规律的正确性已为实践反复证明,是符合客观实际的。 一、二力平衡公理 作用于刚体上的两个力平衡的充分与必要条件是这两个力大小相等、方向相反、作用线相同。 这一结论是显而易见的。如图所示直杆,在杆的两端施加一对大小相等的拉力(F1、F2)或压力(F2、F1),均可使杆平衡。 图2-1 应当指出,该条件对于刚体来说是充分而且必要的;而对于变形体,该条件只是必要的而不充分。如柔索当受到两个等值、反向、共线的压力作用时就不能平衡。 在两个力作用下处于平衡的物体称为二力体;若为杆件,则称为二力杆。根据二力平衡公理可知,作用在二力体上的两个力,它们必通过两个力作用点的连线(与杆件的形状无关)且等值、反向。
等效平衡问题的基本模型 等效平衡问题是高中化学中《化学平衡》这一章的一个难点,也是各级各类考试的重点和热 点。学生如何正确理解并运用相关知识进行解题是非常必要的。经过对大量试题的对比分析, 笔者认为可以归纳为以下三种情形: 完全等效平衡,这类等效平衡问题的特征是在同T、 P、 V 的条件下,同一化学反应经过不 同的反应过程最后建立的平衡相同。解决这类问题的方法就是构建相同的起始条件。下面看例题一: 【例题一】:温度一定,在一个容器体积恒定密闭容器内,发生合成氨反应:N2+3H2 2NH3。若充入 1molN2 和 3molH2 ,反应达到平衡时NH3 的体积百分含量为W% 。若改变开始时投 入原料的量,加入amolN2,bmolH2 ,cmolNH3 ,反应达到平衡时,NH3 的体积百分含量仍 为 W% ,则: ①若 a=b=0, c= ②若 a=0.75, b= , c= ③若温度、压强恒定,则a、 b、 c 之间必须满足的关系是 分析:通过阅读题目,可以知道建立平衡后两次平衡之间满足同 T、 P、 V ,所以可以断定是完全 等效平衡,故可以通过构建相同的起始条件来完成。 N2 + 3H2 2NH3 起始条件Ⅰ:1mol 3mol 0 起始条件Ⅱ:amol bmol cmol (可以把 cmolNH3全部转化为 N2, H2) 转化: 0.5cmol 1.5cmol cmol 构建条件:( a+0.5c)mol ( b+1.5c) mol 0 要使起始条件Ⅰ和起始条件Ⅱ建立的平衡一样,那么必须是起始条件Ⅰ和构建条件完全相 同。则有:( a+0.5c) mol = 1mol ( b+1.5c) mol = 3mol 其实这两个等式就是③的答案,①②的答案就是代入数值计算即可。 不完全等效平衡,这类等效平衡问题的特征是在同T、P 不同 V 的条件下,同一化学反应经过不同的反应过程最后建立的平衡中各成分的含量相同。解决这类问题的方法就是构建相似 的起始条件,各量间对应成比例。下面看例题二: 【例题二】:恒温恒压下,在一个可变容积的容器中发生中下反应: A ( g)+B(g) = C(g)(1)若开始时放入1molA 和 1molB ,到达平衡后,生成 a molC,这时 A 的物质的量为 mol 。 (2)若开始时放入3molA 和 3molB ,到达平衡后,生成 C 的物质的量为mol 。 (3)若开始时放入xmolA 、2molB 和 1molC ,到达平衡后, A 和 C 的物质的量分别是y mol 和 3a mol ,则 x=, y= ,平衡时, B 的物质的量(选填一个编号) 甲:大于 2mol 乙:等于 2mol 丙:小于 2mol 丁:可能大于,等或小于2mol 作出判断的理由是。 (4)若在( 3)的平衡混合物中再加入3molC ,待到达平衡后, C 的物质的量分数是。分析:通过阅读题目,可以知道建立平衡后两次平衡之间满足同T、P 不同 V ,所以可以断定是不完全等效平衡,故可以通过构建相似的起始条件各量间对应成比例来完成。解答过程如下: A ( g) + B(g) = C(g) (1)起始条件Ⅰ:1mol 1mol 0 平衡Ⅰ:( 1-a ) mol ( 1-a ) mol amol (2)起始条件Ⅱ:3mol 3mol 0 平衡Ⅱ: 3( 1-a) mol 3 ( 1-a ) mol 3amol (各量间对应成比例)
高中化学等效平衡问题的解题技巧 等效平衡问题是指利用等效平衡(相同平衡或相似平衡)来进行的有关判断和计算问题,即利用与某一平衡状态等效的过渡平衡状态(相同平衡)进行有关问题的分析、判断,或利用相似平衡的相似原理进行有关量的计算。所以等效平衡也是一种思维分析方式和解题方法。这种方法往往用在相似平衡的计算中 关于概念的理解: (1)外界条件相同:通常可以是①恒温、恒容,②恒温、恒压。 (2)“等效平衡”与“完全相同的平衡状态”不同:“完全相同的平衡状态”是指在达到平衡状态时,任何组分的物质的量分数(或体积分数)对应相等,并且反应的速率等也相同,但各组分的物质的量、浓度可能不同。而“等效平衡”只要求平衡混合物中各组分的物质的量分数(或体积分数)对应相同,反应的速率、压强等可以不同。 (3)平衡状态只与始态有关,而与途径无关,(如:①无论反应从正反应方向开始,还是从逆反应方向开始②投料是一次还是分成几次③反应容器经过扩大—缩小或缩小—扩大的过程,)只要起始浓度相当,就达到相同的平衡状态。 等效平衡的条件和判断: (1)恒温恒容下,改变起始加入物质的物质的量,如通过
可逆反应的化学计量数换算成同一半边的物质的物质的量与原平衡相等,则达平衡后与原平衡等效 (2)恒温恒容下,对于反应前后都是气体且物质的量相等的可逆反应,只要反应物(或生成物)的物质的量的之比与原平衡相同,两平衡等效 (3)恒温恒压下,改变起始加入物质的物质的量,只要按化学计量数,换算成同一半边的物质的物质的量之比与原平衡相同,则达平衡后与原平衡等效 不同条件下的等效平衡问题: 1.对于一般可逆反应,在恒温、恒容条件下建立平衡,改变起始时加入物质的物质的量,如果能够按化学计量数换算成同一半边的物质的物质的量与原平衡相同,则两平衡等效。 如:按下列三条途径,在恒温、恒容下建立的平衡等效3H2(g)+N2(g)=2NH3(g) Ⅰ3mol1mol0 Ⅱ002mol Ⅲabc Ⅲ中,应满足:b+c/2=1,a+3c/2=3。 例1.一可逆反应:2A(g)+3B(g)=xC(g)+4D(g),若按下列两种配比,在同温、同体积的密闭容器中进行反应。 有
平面一般力系的平衡 一、判断题: 1.下图是由平面汇交力系作出的力四边形,这四个力构成力多边形封闭,该力系一定平衡。() 图1 2.图示三个不为零的力交于一点,则力系一定平衡。() 图2 3.如图3所示圆轮在力F和矩为m的力偶作用下保持平衡,说明力可与一个力偶平衡。() 4.图4所示力偶在x轴上的投影ΣX=0,如将x轴任转一角度轴,那么Σ=0。()
图3 图4 5.如图5所示力偶对a的力矩Ma(F,F')=F·d,如将a任意移到b,则力矩Mb(F,F')将发生变化。() 图5 图6 6.图6所示物体的A、B、C、D四点各有一力作用,四个力作出的力多边形闭合,则此物体处于平衡状态。() 7.如果两个力偶的力偶矩大小相等,则此两个力偶等效。() 8.图示构件A点受一点力作用,若将此力平移到B点,试判断其作用效果是否相同()
图7 图8 9.图8所示梁,若求支反力时,用平面一般力系的平衡方程不能全部求出。() 10.图9所示物体接触面间静摩擦系数是f,要使物体向右滑动。试判断哪种施力方法省力。() 图9 图10 11.力在坐标轴上的投影和该力在该轴上分力是相同的。() 12.如果将图10所示力F由A点等效地平移到B点,其附加力矩M =Fa ()。 13.平面任意力系,其独立的二力矩式平衡方程为∑Fx=0,∑M A=0,∑M B =0,但要求矩心A、B的连线不能与x轴垂直。() 二、选择题 1.同一个力在两个互相平行的同向坐标轴上的投影()。
A.大小相等,符号不同 B.大小不等,符号不同 C.大小相等,符号相同 D.大小不等,符号相同 2.图11所示圆轮由O点支承,在重力P和力偶矩m作用下处于平衡。这说明()。 图11 A.支反力R0与P平衡 B.m与P平衡 C.m简化为力与P平衡 D.R0与P组成力偶,其m(R0,P)=-P·r与m平衡 3. 图12所示三铰刚架,在D角处受一力偶矩为m的力偶作用, 如将该力力偶移到E角出,支座A、B的支反力()。 图12
第2章 力系的等效与简化 作用在实际物体上的力系各式各样,但是,都可用归纳为两大类:一类是力系中的所有力的作用线都位于同一平面内,这类力系称为平面力系;另一类是力系中的所有力的作用线位于不同的平面内,称为空间力系。这两类力系对物体所产生的运动效应是不同的。同一类力系,虽然其中所包含的力不会相同,却可能对同一物体产生相同的作用效应。在就是前一章中提到的力系等效的概念。 本章将在物理学的基础上,对力系的基本特征量加以扩展,引入力系主矢与主矩的概念;以此为基础,导出力系等效定理;进而应用力向一点平移定理以及力偶的概念对力系进行简化。力系简化理论与方法将作为分析所有静力学和动力学问题的基础。 §2-1 力系等效定理 2-1-1 力系的主矢和主矩 2-1-2 力系等效定理 §2-2 力偶与力偶系 2-2-1 力偶与力偶系 2-2-2 力偶的性质 2-2-3 力偶系的合成 §2-3 力系的简化 2-3-1 力向一点平移定理 2-3-2 空间一般力系的简化 2-3-3 力系简化在固定端约束力分析中的应用
§2-4 结论和讨论 2-4-1 关于力矢、主矢、力矩矢、力偶矩矢以及 主矩矢的矢量性质 2-4-2 关于合力之矩定理及其应用 2-4-3 关于力系简化的最后结果 2-4-4 关于实际约束的简化模型 2-4-5 关于力偶性质推论的应用限制 习 题 本章正文 返回总目录
第2章 力系的等效与简化 §2-1 力系等效定理 物理学中,关于质点系运动特征量已有明确论述,这就是:质点系的线动量和对某一点的角动量。 物理学中还指明线动量对时间的变化率等于作用在质点系上的合外力;角动量对时间的变化率等于作用在质点系上外力对同一点的合力矩。这里的合外力,实际上只有大小和方向,并未涉及作用点或作用线。因而,需要将其中的合外力与外力的合力矩扩展为力系的主矢和主矩。 2-1-1 力系的主矢和主矩 主矢:一般力系(F 1,F 2,…,F n )中所有力的矢量和(图2—1),称为力系的主矢量,简称为主矢(principal vector ),即 ∑=n i i 1 R F F = (2-1) 图2-1力系的主矢 其中F R 为力系主矢;F i 为力系中的各个力。式(2-1)的分量表达式为 ∑∑∑===== =n i iy y n i iy y n i ix x F F F F F F 1 R 1R 1R (2-2) 主矩:力系中所有力对于同一点之矩的矢量和(图2-2),称为力系对这一点的主矩(principal moment ),即 ()∑∑==×n i i i n i i O O 1 1 F r F M M == (2-3) 主矩的分量式为
1、定义:在相同条件下(定温定容或定温定压),对同一可逆反应,由于起始有关物质的 量“相当”,无论从正反应开始还是从逆反应开始,均可达到平衡,且任何组分的含量(通常为百分含量)相同,这样的平衡互称为等效平衡。 2、等效平衡的类型及建立等效平衡的条件 规律一: 恒温恒容 ....条件下,对于任何 ....,如果 ..(无论反应前后气体分子数是否相同)可逆反应 起始加入物质的物质的量不同,按化学方程式中的化学计量关系换算成同一方向的物质(即“一边倒”)后,各组分的物质的量与原平衡相同,则两平衡等效,平衡时,同种组分的体积分数、物质的量浓度、物质的量均相同(也可叫全等平衡)。 如: mA(g)+nB(g)pC(g)+qD(g) 起始①mmol nmol 0 0 起始②0 0 pmol qmol 上述两种情况投料不同,但是将②中投料“左边倒”后,四种物质的物质的量均同①相同, 因此两种情况可达到等效平衡,平衡时,同种组分(如A)的体积分数、物质的量浓度、物质的量均相同。 例1.在一固定体积的密闭容器中通入2molA和1molB发生反应 2A(g)+B(g)3C(g)+D(g) 反应达到平衡时,测得C的物质的量浓度为wmol/L.若维持容器的容积不变,按下列四种配比做起始浓度,达平衡后,C的浓度仍维持wmol/L的是() A、4molA+2molB B、2molA+1molB+3molC+1molD C、3molC+1molD+1molB D、3molC+1molD 例2、在固定体积的密闭容器中,加入2molA,1molB,发生反应:A(g)+B(g)2C(g)达到平衡时,C的质量分数为ω%,在相同条件下按下列情况充入物质达到平衡时C的质量分数仍为ω%的是() A.2molC B.3molC C.4molA,2molB D.1mola,2molC 例3、在一个固定体积的密闭容器中,保持一定浓度,进行以下反应:4A(g)+5B(g) 4C(g)+6D(g),已知加入4molA和5molB时,反应进行到一定程度时,反应混合物就处于平衡状态,现在该容器中,保持温度不变,令a,b,c,d分别代表初始加入的A,B,C,D的物质的量,如果a,b,c,d取不同的数值,它们必须满足一定关系,才能保证达到平衡时,反应混合物中几种物质的百分含量仍跟上述平衡时完全相同,请填写下列空白: (1)若a=0,b=0, 则c= ,d= . (2)若a=1,则b= ,c= ,d= (3)a,b,c,d取值必须满足的一般条件是(请用方程式表示,其中一个只含a和c,另一个只含b和c): , . 规律二:恒温恒压 ..(无论反应前后气体分子数是否相同)可逆反应 ....,如果....条件下,对于任何 起始加入物质的物质的量不同,按化学方程式中的化学计量关系“一边倒”后, 各组分的物质的量之比与原平衡相同,则两平衡等效,平衡时,同种组分的体积分数、物质的量浓度相同,但物质的量不同。 如: mA(g) + nB(g) pC(g) + qD(g) 起始①mmol nmol 0 0
等效平衡问题及解题技 巧 Revised as of 23 November 2020
专题一、等效平衡问题 1、定义:在相同条件下(定温定容或定温定压),对同一可逆反应,由于起始有关 物质的量“相当”,无论从正反应开始还是从逆反应开始,均可达到平衡,且任何组分的含量(通常为百分含量)相同,这样的平衡互称为等效平衡。 2、等效平衡的类型及建立等效平衡的条件 规律一: 恒.温.恒.容.条件下,对于任何 ...., ..(无论反应前后气体分子数是否相同)可逆反应如果起始加入物质的物质的量不同,按化学方程式中的化学计量关系换算成同一方向的物质(即“一边倒”)后,各组分的物质的量与原平衡相同,则两平衡等效,平衡时,同种组分的体积分数、物质的量浓度、物质的量均相同(也可叫全等平衡)。 如: mA(g)+nB(g)pC(g)+qD(g) 起始① mmol nmol 0 0 起始② 0 0 pmol qmol 上述两种情况投料不同,但是将②中投料“左边倒”后,四种物质的物质的量均同①相同, 因此两种情况可达到等效平衡,平衡时,同种组分(如A)的体积分数、物质的量浓度、物质的量均相同。 例1.在一固定体积的密闭容器中通入2molA和1molB发生反应 2A(g)+B(g)3C(g)+D(g) 反应达到平衡时,测得C的物质的量浓度为wmol/L.若维持容器的容积不变,按下列四种配比做起始浓度,达平衡后,C的浓度仍维持wmol/L的是() A、4molA+2molB B、2molA+1molB+3molC+1molD C、3molC+1molD+1molB D、3molC+1molD
化学平衡中的等效平衡的类型及解题思路 [等效平衡的概念] 相同条件下,同一可逆反应体系,不管从正反应开始,还是从逆反应开始,达到平衡时,任何相同物质的含量(体积分数、质量分数或物质的量分数)都相同的化学平衡互称等效平衡。可分为“全等效”平衡和“相似等效”平衡。判断等效平衡的方法:使用极限转化的方法将各种情况变换成同一反应物或生成物,然后观察有关物质的数量是否相当。[等效平衡的类型] 在一定条件下(恒温恒容或恒温恒压),对同一可逆反应,起始时加入物质的物质的量不同,达平衡时的状态规律如下表: [各种不同类型的等效平衡的解题思路] 一、恒温恒容(定T、V)的等效平衡 1.在定T、V条件下,对于反应前后气体体积改变的反应:若改变起始加入情况,只要通过可逆反应的化学计量数比换算成平衡时左右两边同一边物质的物质的量与原平衡相同,则二平衡等效。 2.在定T、V条件下,对于反应前后气体体积不变的反应:只要反应物(或生成物)的物质的量的比例与原平衡相同,则二平衡等效。
二、恒温恒压(定T、P)的等效平衡 在定T、P条件下:若改变起始加入情况,只要通过可逆反应的化学计量数比换算成平衡时左右两边同一边物质的物质的量之比。 即:对于反应前后气体体积发生变化的可逆反应而言,恒容容器中要想达到同一平衡状态,投料量必须相同;恒压容器中要想达到同一平衡状态,投料量可以不同,但投入的比例得相同。 例1.在一个固定体积的密闭容器中,加入2molA和1molB,发生反应2A(g)+B(g) 2C(g),达到平衡时,C的物质的量浓度为K mol/L,若维持容器体积和温度不变,按下列配比作为起始物质, A.4 molA+2 molB B.2 molA+1 molB+2 molC C.2 molC+1 molB D.2 molC E.1 molA+ molB+1 molC ①达到平衡后,C的物质的量浓度仍是K mol/L的是( DE ) ② A项平衡时,c(C)与2K mol/L的关系 分析:→ 扩大一倍若平衡不动,则[C]=2K mol/L,现右移∴>2K mol/L ③平衡时各选项中C的平衡浓度c(C)的大小顺序。 分析:C项,相当于D、E项达平衡基础上,再加1molB,右移,c(C)增大, A=B>C>D=E ④若令a、b、c分别代表初始加入的A、B、C的物质的量,如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时完全相同,填写: Ⅰ若a=0,b=0,则c=__2___。 Ⅱ若a=,b=0,则,c=。 Ⅲa、b、c的取值必须满足的一般条件是(用两个方程式表示,一个只含a、c,另一个只含b、c):_a+c=2___;___b+c/2=1____。
等效平衡练习题 【例1】将3 mol A和1 mol B混合于一体积可变的密闭容器P中,以此时的温度、压强和体积作为起始条件,发生了如下反应:达到平衡时C的浓度为w mol·L-1。回答⑴~⑸小题: (1)保持温度和压强不变,按下列四种配比充入容器P中,平衡后C的浓度仍为w mol·L-1的是( ) (A)6 mol A+2 mol B (B)3 mol A+1 mol B十2 mol C, (C)2 mol C+1 mol B+1 mol D (D)1 mol C+2mol D (2)保持原起始温度和体积不变,要使平衡后C的浓度仍为w mol·L-1,应按下列哪种 配比向容器Q中充入有关物质( ) (A)3 mol A+1 mol B (B)4 mol C十2 mol D (C)1.5 mol A+0.5mol B+1 mol C +0.5 mol D (D)以上均不能满足条件, (3)保持原起始温度和体积不变,若仍按3 mol A和1 mol B配比在容器Q中发生反应, 则平衡时C的浓度和w rml·L-1的关系是( ) (A)>w(B)<w(C)= w(D)不能确定 (4)将2 mol C和2 mol D按起始温度和压强充入容器Q中,保持温度和体积不变,平 衡时C的浓度为V mol·L-1,V与w的关系是( ) (A) V>w(B) V<w(C) V=w(D)无法比较 (5)维持原起始温度和体积不变,按下列哪种配比充入容器Q可使平衡时C的浓度为 V mol·L-1 ( ) (A)1 mol C+0.5 m01 D .(B)3 mol A+2 mol B (C)3 mol A+1 mol B+1 mol D (D)以上均不能满足条件 解析⑴(A)⑵(D).⑶(B).⑷(B).⑸(C). 【例2】某温度下向1L密闭容器中充入1mol N2和3 mol H2,使反应N2+3H3 达到平衡,平衡混合气中N2、H2、NH3的浓度分别为M、N、G(mol/L).如果温度不变,只改变初始物质的加入量,要求M、N、G保持不变,则N2、H2、NH3的加入量用x、y、z表示时应满足的条件是: ①若x=0,y=0,则z= ; ②若x=0.75 mol,则y= ,z= ; ③x、y、z取值必须满足的一般条件是(用含x、y、z方程表示,其中一个含x、z,另一 个含y、z) 。 若将上述条件改为恒温、恒压,其它均不变,则 a.若x=0,y=0,则z= ; b.若x=0.75 mol,则y= ,z= ;
第九讲内容 一、平面一般力系平衡方程的其他形式 前面我们通过平面一般力系的平衡条件导出了平面一般力系平衡方程的基本形式,除了这种形式外,还可将平衡方程表示为二力矩形式及三力矩形式。 1.二力矩形式的平衡方程 在力系作用面内任取两点A 、B 及X 轴,如图4-13所示,可以证明平面一般力系的平衡方程可改写成两个力矩方程和一个投影方程的形式,即 ?? ? ?? =∑=∑=∑000B A M M X (4-6) 式中X 轴不与A 、B 两点的连线垂直。 证明:首先将平面一般力系向A 点简化,一般可得到过A 点的一个力和一个力偶。若0A =M 成立,则力系只能简化为通过A 点的合力R 或成平衡状态。如果0B =∑M 又成立,说明R 必通过B 。可见合力R 的作用线必为AB 连线。又因0=∑X 成立,则0X =∑=X R ,即合力R 在X 轴上的投影为零,因AB 连线不垂直X 轴,合力R 亦不垂直于X 轴,由0X =R 可推得 0=R 。可见满足方程(4-6)的平面一般力系,若将其向A 点简化,其主 矩和主矢都等于零,从而力系必为平衡力系。 2.三力矩形式的平衡方程 在力系作用面内任意取三个不在一直线上的点A 、B 、C ,如图4-14所示,则力系的平衡方程可写为三个力矩方程形式,即
?? ? ?? =∑=∑=∑000C B A M M M (4-7) 式中,A 、B 、C 三点不在同一直线上。 同上面讨论一样,若0A =∑M 和0B =∑M 成立,则力系合成结果只能是通过A 、B 两点的一个力(图4-14)或者平衡。如果0C =∑M 也成立,则合力必然通过C 点,而一个力不可能同时通过不在一直线上的三点,除非合力为零,0C =∑M 才能成立。因此,力系必然是平衡力系。 综上所述,平面一般力系共有三种不同形式的平衡方程,即式(4-5)、 式(4-6)、式(4-7),在解题时可以根据具体情况选取某一种形式。无论采用哪种形式,都只能写出三个独立的平衡方程,求解三个未知数。任何第四个方程都不是独立的,但可以利用这个方程来校核计算的结果。 【例4-7】 某屋架如图4-15(a )所示,设左屋架及盖瓦共重 kN 31=P ,右屋架受到风力及荷载作用,其合力kN 72=P ,2P 与BC 夹角 为?80,试求A 、B 支座的反力。 【解】 取整个屋架为研究对象,画其受力图,并选取坐标轴X 轴和Y 轴,如图4-15(b )所示,列出三个平衡方程 kN 39.2342.0770cos 0 70cos 02A 2A =?=?==?-=∑P X P X X 30tan 470cos 1270sin 416 0221B A =????+??-?-?=∑P P P Y M
....................... 装.............订.......... 线 ..................... .
分配记 20 ∑Fy=0 ∑MO(F)=0 不难看出,平面平行力系的二矩式平衡方程为 ∑MA(F) =0 ∑MB(F) =0 其中A、B两点的连线不能与各力平行。 平面平行力系只有两个独立的方程,因而最多能解出两个未知量。 三.应用平面一般力系平衡方程的解题步骤如下: (1) 根据题意,选取适当的研究对象。 (2) 受力分析并画受力图。 (3) 选取坐标轴。坐标轴应与较多的未知反力平行或垂直。 (4) 列平衡方程,求解未知量。列力矩方程时,通常选未知力较多的交点为矩心。 (5) 校核结果。 应当注意:若由平衡方程解出的未知量为负,说明受力图上原假定的该未知量的方向与其实际方向相反。而不要去改动受力图中原假设的方向。 例4-2 已知F=15kN,M=3kN.m,求A、B处支座反力。 解(1) 画受力图,并建坐标系 (2) 列方程求解 图4-8
分配记 20例4-3 如图3-9所示外伸梁上作用有集中力FC=20kN,力偶矩M=10kN.m ,载荷集度为q=10kN/m的均布载荷。求支座A、B处的反力。 图4-9 解取水平梁AB为研究对象, 画受力图如图4-9(b)所示。 列平衡方程并求解
分配记 结果均为正,说明图示方向与实际方向一致。 例3-4 塔式起重机如图4-10所示。设机架自重为G,重心在C点,与右轨 距离为e,载重W,吊臂最远端距右轨为l,平衡锤重Q,离左轨的距离为a, 轨距为b。试求塔式起重机在满载和空载时都不致翻倒的平衡锤重量的范围。 图4-10 解取塔式起重机为研究对象,作用在起重机上的力有重物W、机架重G、 平衡锤的重力Q及钢轨的约束反力NA和NB,这些力构成了平面平行力系,起 重机在该平面平行力系作用下平衡。 (1)满载时W=Wmax,Q=Qmin,机架可能绕B点右翻,在临界平衡状 态,A处悬空,NA=0,受力图如图3-10b所示。则
化学平衡练习题 【例1】将3 mol A和1 mol B混合于一体积可变的密闭容器P中,以此时的温度、压强和体 积作为起始条件,发生了如下反应:3A(g)+B(g) C(g)+D(g)达到平衡时C的浓度为w mol·L-1。回答⑴~⑸小题: (1)保持温度和压强不变,按下列四种配比充入容器P中,平衡后C的浓度仍为w mol·L-1的是( ) (A)6 mol A+2 mol B (B)3 mol A+1 mol B十2 mol C, (C)2 mol C+1 mol B+1 mol D (D)1 mol C+2mol D (2)保持原起始温度和体积不变,要使平衡后C的浓度仍为w mol·L-1,应按下列哪种 配比向容器Q中充入有关物质( ) (A)3 mol A+1 mol B (B)4 mol C十2 mol D (C)1.5 mol A+0.5mol B+1 mol C +0.5 mol D (D)以上均不能满足条件, (3)保持原起始温度和体积不变,若仍按3 mol A和1 mol B配比在容器Q中发生反应, 则平衡时C的浓度和w rml·L-1的关系是( ) (A)>w(B)<w(C)= w(D)不能确定 (4)将2 mol C和2 mol D按起始温度和压强充入容器Q中,保持温度和体积不变,平 衡时C的浓度为V mol·L-1,V与w和叫的关系是( ) (A) V>w(B) V<w(C) V=w(D)无法比较 (5)维持原起始温度和体积不变,按下列哪种配比充入容器Q可使平衡时C的浓度为 V mol·L-1 ( ) (A)1 mol C+0.5 m01 D .(B)3 mol A+2 mol B (C)3 mol A+1 mol B+1 mol D (D)以上均不能满足条件 解析⑴(A)⑵(D).⑶(B).⑷(B).⑸(C). 【例2】某温度下向1L密闭容器中充入1mol N2和3 mol H2,使反应N2+3H3 达到平衡,平衡混合气中N2、H2、NH3的浓度分别为M、N、G(mol/L).如果温度不变,只改变初始物质的加入量,要求M、N、G保持不变,则N2、H2、NH3的加入量用x、y、z表示