
非那西丁的药代动力学研究实验报告
一.概述:
非那西丁(Phenacetin)为一种解热镇痛药,因为潜在副作用在临床已基本不使用。但由于其是CYP1A2酶的特异性底物,被广泛选择作为底物用于酶活性测定实验以及影响酶活性作用药物的研究。本学期临床药代动学实验课以非那西丁在大鼠体内的代谢实验、大鼠肝微粒体温孵实验两部分为例,通过实验设计,实验操作,结果评价等一系列过程,系统地学习了药代动力学中药物体内外的简单研究方法、实验数据的处理、以及相关药动学参数的计算与评价。
二.正文
1.非那西丁在大鼠体内的药代动力学研究
1.1实验目的
研究非那西丁在大鼠体内代谢的药代动力学,学习大鼠眼底静脉丛取血等操作。
1.2实验材料与方法
仪器:HPLC-UV色谱仪,高速冷冻离心机,涡旋振荡器;
HPLC色谱条件:检测波长:254nm
色谱柱:inertsil-ODS-SP,5um,4.6*150mm
流速:1.0ml/min
柱温:40℃
流动相:40(乙腈):60(50mM磷酸盐缓冲液)(注:50mM磷酸盐缓冲液配制:6.8g磷酸二氢钾,加入150ml氢
氧化钠溶液(0.1M),配制成1L的磷酸盐缓冲液)
试剂:非那西丁注射剂,对乙酰氨基酚标准品,肝素钠,10%高氯酸;
实验动物:雄性大鼠,180g—220g
1.3实验步骤
1.3.1标准曲线的制备:取空白血浆,加入对乙酰氨基酚标准品,使其
浓度分别为0.156,0.313,0.625,1.25,2.50,5.00,10.00ug/ml。在给定的色谱条件下进行HPLC分析,以样品的峰面积对样品浓度进行线性回归。
1.3.2给药及血浆采集处理:取大鼠一只,尾静脉注射非那西丁
(10mg/kg)后,分别于0,5,10,15,30,45,60,90,120min于尾静脉取血
0.5ml ,肝素抗凝。离心取200ul 血浆。向血浆中加入100ul 10%高氯酸,涡旋振荡1min (转速为15000转/分钟),离心10min ,取上清供HPLC 分析。
1.4实验结果处理
表1 体内实验中对乙酰氨基酚标准曲线
组别 浓度(ug/ml) 峰面积 理论峰面积 准确度 1 0.156 14359 19283 (0.2554)
2 0.312 54390
3 0.625 33219 36462 (0.0889)
4 1.2
5 65033 59355 0.0957 5 2.50 106799 105142 0.0158
6 5.00 20006
7 196714 0.0170 7
10.00
377336
379859
(0.0066)
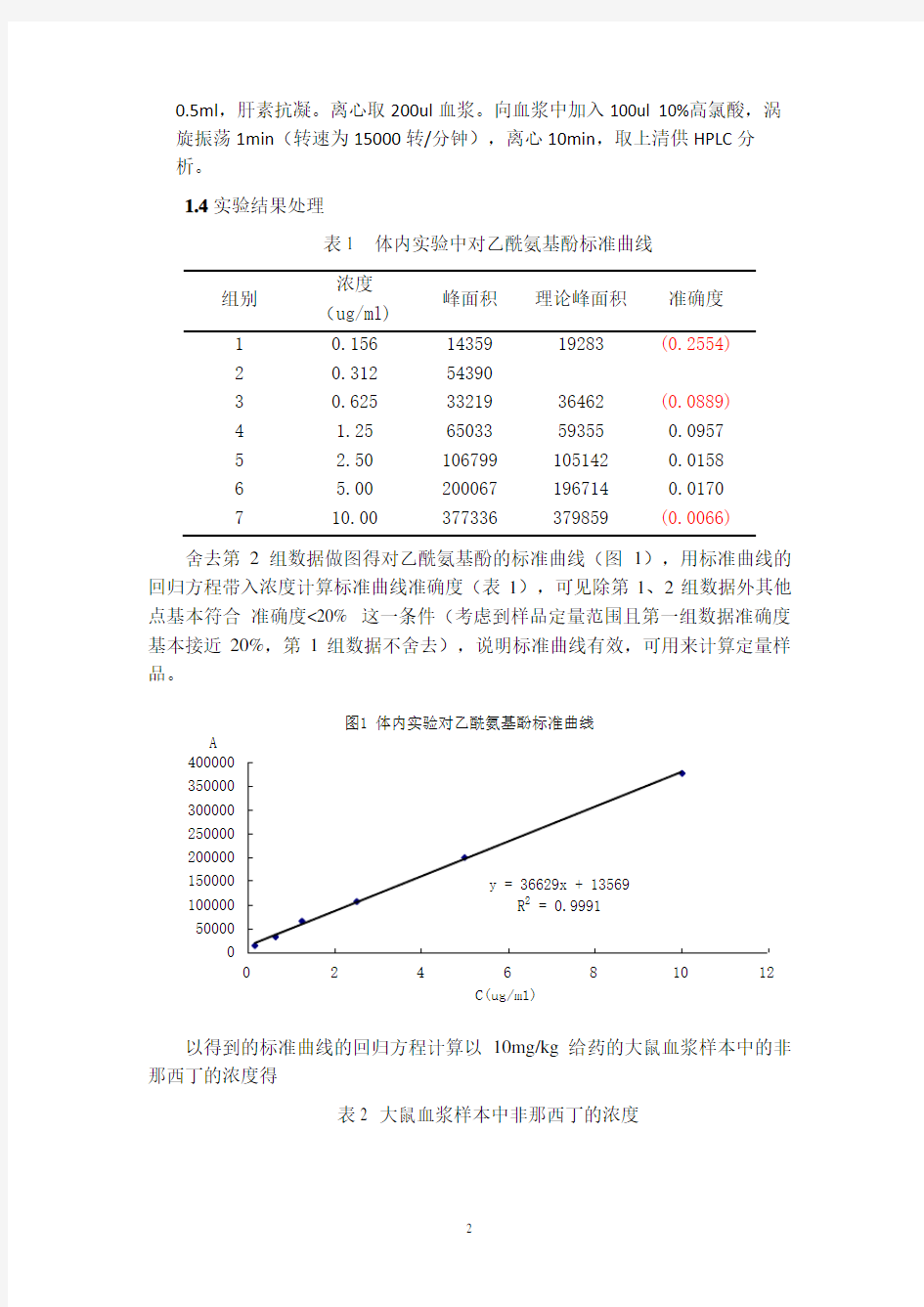
舍去第2组数据做图得对乙酰氨基酚的标准曲线(图1),用标准曲线的回归方程带入浓度计算标准曲线准确度(表1),可见除第1、2组数据外其他点基本符合 准确度<20% 这一条件(考虑到样品定量范围且第一组数据准确度基本接近20%,第1组数据不舍去),说明标准曲线有效,可用来计算定量样品。
图1 体内实验对乙酰氨基酚标准曲线
050000
1000001500002000002500003000003500004000000
2
4
68
10
12
C(ug/ml)
A
以得到的标准曲线的回归方程计算以10mg/kg 给药的大鼠血浆样本中的非那西丁的浓度得
表2 大鼠血浆样本中非那西丁的浓度
组别 取血时间/min 峰面积 (ug/ml)
1 6.5 50464 1.007
2 10.5 4928
3 0.975 3 14.5 42107 0.779
4 29.
5 35993 0.612 5
45
13359
-0.006
注:第5组数据是有问题的,有可能与大鼠的死亡前代谢状态改变有关系,故后续处理舍去第5组数据。
静脉注射后非那西丁在大鼠体内的代谢符合一房室模型,以一房室模型拟合得
图2 非那西丁c-t一房室拟合
0.20.40.60.811.21.40
5
10
15
2025
303540
t/min
c /(u g /m l )
根据拟合方程计算非那西丁的药动学参数,得 c 0 =1.1621ug/ml
Vd=x 0/ c 0=10(mg/kg)/1.1621(ug/ml)=8.60L/kg t 1/2=0.693/k=0.693/0.0223=31.08min
CL=kVd=0.0223*8.60L/kg=0.192L/(min ·kg)
AUC= x 0/(kVd)=10(mg/kg)/0.192L/(min ·kg)=52.08mg/L ·min 1.5讨论
1)标准曲线组数据为其他实验组同学数据,本组由于HPLC 测定时仪器出倒峰,未取得实验数据。
2)取血点的设定:取血点应覆盖药物的吸收相、平衡相和消除相,一般设计在吸收相和平衡相各2-3个点,消除相内4-5个点。整个采样时间至少应为3-5个半衰期,或采样持续至峰浓度的1/10-1/20。查文献得非那西丁静注后在
大鼠体内的半衰期一般为0.5h左右,故整个取血时间持续 1.5-2.5h时较为合理。
3)色谱条件的设定:色谱条件的选择首先应保证测定物质能够良好的分离,同时还应该考虑方法的可行性,需要的操作时间等因素。
4)取血操作:应在取血前向EP管中加入适量肝素溶液,取入血液后立即上下翻动2-3次使肝素与血液混合防止血液凝固,但不可用力过猛以免溶血影响后续测定。
5)数据分析:本组实验中,由于大鼠死亡,取得血浆样本的时间点较少,故拟合曲线的偏差也比较大。因此虽然最后由此求得的t1/2处于一般范围内,但因为数据较少,且为单只动物实验,不排除结果的偶然性。
2.大鼠肝微粒体温孵实验
2.1实验目的
了解肝微粒体及肝微粒体酶活性的评价方法,学习肝微粒体温孵液中对乙酰氨基酚浓度测定方法的建立。
2.2实验材料与方法
仪器:HPLC-UV色谱仪(色谱条件同前)、高速冷冻离心机、涡旋振荡器、恒温水浴锅;
试剂:大鼠肝微粒蛋白溶液、NADPH再生系统(0.5mM·NADP+、5mM·MgCl、10mM·G-6-P、1U·G-6-P脱氢酶)、对乙酰氨基酚、非那西丁、冰甲醇
2.3实验步骤
2.3.1.标准曲线的配制:180ul大鼠空白肝微粒体,加入20ul不同浓度的对乙酰氨基酚,配成对乙酰氨基酚浓度分别为1.56、3.12、6.25、12.5、25、50、100uM的一系列溶液,再加入100ul冰甲醇沉淀,涡旋2min,12000rpm,离心10min,取上清,20ul进样分析。
2.3.2.温孵实验及样品处理:80ul大鼠肝微粒体溶液,分别加入80ul浓度依次为6.25、12.5、25、50、100、200、400uM的非那西丁探针底物,37°C预温孵5min后,再分别加入NADPH溶液40ul,于37°C温孵30min。加入100ul冰甲醇沉淀,涡旋2min,12000rpm,离心10min,取上层有机相200ul,20ul进样分析
2.4实验结果:
表3 温孵实验中对乙酰氨基酚标准曲线
组别浓度(umol/l) 峰面积理论峰面积准确度
1 1.56 3669 433
2 (0.1531)
2 3.12 613
3 7731 (0.2067)
3 6.25 14488 14552 (0.0044)
4 12.
5 28850 28170 0.0241
5 25 58782 55408 0.0609
6 50 108154 109883 (0.0157)
7 100 139879
第7组数据偏差较大,舍去第7组数据后作图得标准曲线(图3),用标准曲线的回归方程带入浓度计算标准曲线准确度(表3),第2组数据准确度>20% ,但舍去第2组数据后,得到的标准曲线虽然R2稍有提高(R2=0.998),但再次代入计算准确度时另几组值准确度均有偏大倾向,且考虑到数据组数减少时误差组数据。
变大,故保留第2
用此标准曲线计算通过标准曲线计算出产物中对乙酰氨基酚浓度(表4),以非那西丁浓度和对乙酰氨基酚的生成速率,用双倒数作图法作图(图4),求得相关药代动力学参数。
表4 温孵实验中相关数值计算
组别峰面积
c-PARA
(umol/l)
c-
PHE(umol/L)
1/c-
PHE
v-
(umol/h/g.protein)
1/v
1 2591 1.1743 6.25 0.16 11.7426 0.0852
2 9340 4.2329 12.5 0.08 42.3295 0.0236
3 6035 2.7351 25 0.0
4 27.3510 0.0366
4 1622
5 7.3533 50 0.02 73.5327 0.0136
5 27474 12.4514 100 0.01 124.5139 0.0080
6 34462 15.6184 200 0.005 156.1840 0.0064
7 43747 19.8264 400 0.0025 198.2642 0.0050
第1组数据不在标准曲线定量范围内,第 3 组数据偏差过大,故舍去第
1、3组数据,剩下5组数据以双倒数法作图。
由图4:
km/vmax =0.2289 1/vmax =0.006 进而,
vmax=166.67umol/h/g km=
38.15umol/L
求得的vmax 为166.67 umol/h/g ,但显然测得的实测数据中的v 最大值大于此值,以底物浓度对反应速率作图(图5),也可看出曲线在最后一个点时仍呈上升趋势,也就是说在曲线范围内并未达vmax,结果存在偏差。
继续舍去表4中第2组数据进行双倒数回归,
图6 双倒数法作图(2)
0.0000
0.00200.00400.00600.00800.01000.01200.01400.01600
0.005
0.010.015
0.020.025
1/c-PHE
1/v
由图6:
km/vmax =0.4832 1/vmax =0.0037
进而,
vmax=270.27umol/h/g km=
130.59umol/L
该条件下求得的vmax 虽然不在标准曲线定量范围内,但比较符合图5中的反应趋势,更接近反应的真实状态。
2.5讨论:
1)终止试剂的选择:酶反应实验中,终止试剂的选择非常重要,该类型实验中一般可选的终止试剂有乙腈和冰甲醇等,有实验表明乙腈终止时易产生干扰,故本实验选择了冰甲醇作为终止剂。
2)数据分析:根据温孵实验结果的结果分析,实验中反应并未达到最大反应速率。一般在酶促反应中,反应的速率取决于底物浓度、反应时间、酶活性
等因素,本次实验中在实验条件下未达到vmax,可能是由于此次所用的肝微粒体酶活性活性较高,在所设定的底物浓度范围内酶仍未达到饱和,可以通过减少肝微粒体酶的使用量,或者扩大底物浓度的设定范围来进行改善实验,使实验结果更具有科学性。
三.个人总结
相较于往常的按照既定实验步骤操作的实验,本学期的实验需要实验者更加注重细节与思考,探索实验中每一项设定的原因、合理性、以及不同的条件设定对实验结果的影响,在此基础下,进行实验、处理结果时又更容易促发对实验原理和过程的反思,从而对整个实验以及药代动实验的设计有了一个比较深的认识。另外得到的一点教训是,实验过程中数据及相关信息的记录至关重要,尤其是实验时间跨度较大时,应当仔细记录、妥善保存。
四.参考文献:
1.王新敏,彭蕴茹.HPLC法测定大鼠血浆、微粒体中非那西丁与其代谢物含量及其
应用.中国药理学通报[J],2013,29(4):591-592
2. 张艳辉.高效液相色谱法测定鼠肝微粒体中CYP1A2酶的活性及动力学考察. 药
物分析杂志 , 2012,32( 2):191-193
3.缪海均, 佘佳红, 蔡飞.非那西丁及其代谢物对乙酰氨基酚的高效液相色谱测定
[J].中国现代应用药学杂志,2004,22(1):10-12
附件 儿科人群药代动力学研究技术指导原则 一、概述 临床药代动力学(pharmacokinetic,PK)研究旨在阐明药物在人体内的吸收(Absorption,A)、分布(Distribution,D)、代谢(Metabolism,M)和排泄(Excretion,E)的动态变化规律。药效动力学(pharmacodynamics,PD)研究药物对机体的作用、作用原理及作用规律。人体对药物的处置过程(ADME)和药物在体内作用规律的共同研究,有助于全面认识人体与药物间的相互作用,为临床制定合理的用药方案提供依据。本指导原则重点探讨药代动力学研究的相关问题,也提及部分药效动力学的相关内容。 儿科人群药代动力学研究无论是研究设计还是方法学,都遵循与成年人群的药代动力学研究一致的科学原则,但由于儿科人群在不同的发育阶段各有其特殊性,与成人的药代动力学研究又存在诸多不同之处,需要从伦理和科学性方面给予更多关注。因此,本指导原则在系统地阐述儿科人群药代动力学特点的基础上,以研究设计和方法学为重点,就如何安全、有效并且符合医学伦理地在儿科人群中进行药代动力学研究的关键技术要点进行分析和说明。其重点阐明儿科人群研究的特殊性,为计划在儿科人群中开展药代动力学研究的注册申请人和科研机构提供指导性建议,鼓励和推动针对
我国儿科人群的药物研发。 本指导原则主要适用于小分子化学药物,其他药物如生物制品可以参照其中的适用内容。本原则鼓励注册申请人针对儿科人群药代动力学研究中的技术问题与药品注册监管部门进行沟通交流。 二、儿科人群药代动力学特点 (一)总体考虑 在儿科人群开展药代动力学研究的目的在于通过给予不同年龄阶段儿科人群相应剂量的药物后,了解其体内过程,重点明确全身暴露的水平,从而尽可能地依据现有的研究数据,推导出拟用于该目标人群的用药剂量。 通常情况下,在开展儿科人群药代动力学研究之前,会有一定的成人药代动力学研究数据。因此,在设计儿科人群的药代动力学研究方案时,应充分借鉴成人研究数据,保证在儿科人群开展的研究设计的科学性和合理性。 当药物在儿科人群中拟用于已在成人经过充分研究并获得批准的适应症,其疾病进程在儿科患者与成人相似,且药物全身暴露水平与预期治疗结果具有较好的相关性时,可通过儿科人群药代动力学与成人数据的相似性来外推在儿科人群的预期有效性。因此,在儿科人群进行的PK和安全性研究可为推荐儿科人群拟用剂量提供依据。通过以上外推难以确认儿科人群体内的药物浓度-效应关系与成人的相似性时,尽管儿科患者疾病过程与成人基本一致,仍应该进行儿科患者体内的药代动力学/药效动力学(PK/PD)的相关研究。
附件5 药物非临床药代动力学研究技术指导原则 一、概述 非临床药代动力学研究是通过体外和动物体内的研究方法,揭示药物在体内的动态变化规律,获得药物的基本药代动力学参数,阐明药物的吸收、分布、代谢和排泄(Absorption, Distribution, Metabolism, Excretion, 简称ADME)的过程和特征。 非临床药代动力学研究在新药研究开发的评价过程中起着重要 作用。在药物制剂学研究中,非临床药代动力学研究结果是评价药物制剂特性和质量的重要依据。在药效学和毒理学评价中,药代动力学特征可进一步深入阐明药物作用机制,同时也是药效和毒理研究动物选择的依据之一;药物或活性代谢产物浓度数据及其相关药代动力学参数是产生、决定或阐明药效或毒性大小的基础,可提供药物对靶器官效应(药效或毒性)的依据。在临床试验中,非临床药代动力学研究结果能为设计和优化临床试验给药方案提供有关参考信息。 本指导原则是供中药、天然药物和化学药物新药的非临床药代动力学研究的参考。研究者可根据不同药物的特点,参考本指导原则,科学合理地进行试验设计,并对试验结果进行综合评价。 本指导原则的主要内容包括进行药物非临床药代动力学研究的 基本原则、试验设计的总体要求、生物样品的测定方法、研究项目(血
药浓度-时间曲线、吸收、分布、排泄、血浆蛋白结合、生物转化、对药物代谢酶活性及转运体的影响)、数据处理与分析、结果与评价等,并对研究中其他一些需要关注的问题进行了分析。附录中描述了生物样品分析和放射性同位素标记技术的相关方法和要求,供研究者参考。 二、基本原则 进行非临床药代动力学研究,要遵循以下基本原则: (一)试验目的明确; (二)试验设计合理; (三)分析方法可靠; (四)所得参数全面,满足评价要求; (五)对试验结果进行综合分析与评价; (六)具体问题具体分析。 三、试验设计 (一)总体要求 1. 受试物 中药、天然药物:受试物应采用能充分代表临床试验拟用样品和/或上市样品质量和安全性的样品。应采用工艺路线及关键工艺参数确定后的工艺制备,一般应为中试或中试以上规模的样品,否则应有充分的理由。应注明受试物的名称、来源、批号、含量(或规格)、保存条件、有效期及配制方法等,并提供质量检验报告。由于中药的特殊性,建议现用现配,否则应提供数据支持配制后受试物的质量稳定性及均匀性。当给药时间较
附件6 药物毒代动力学研究技术指导原则 一、概述 毒代动力学研究目的是获知受试物在毒性试验中不同剂量水平下的全身暴露程度和持续时间,预测受试物在人体暴露时的潜在风险(注释1)。毒代动力学是非临床毒性试验的重要研究内容之一,其研究重点是解释毒性试验结果和预测人体安全性,而不是简单描述受试物的基本动力学参数特征。 毒代动力学研究在安全性评价中的主要价值体现在: (一)阐述毒性试验中受试物和/或其代谢物的全身暴露及其与毒性反应的剂量和时间关系;评价受试物和/或其代谢物在不同动物种属、性别、年龄、机体状态(如妊娠状态)的毒性反应;评价非临床毒性研究的动物种属选择和用药方案的合理性。 (二)提高动物毒性试验结果对临床安全性评价的预测价值。依据暴露量来评价受试物蓄积引起的靶部位毒性(如肝脏或肾脏毒性),有助于为后续安全性评价提供量化的安全性信息。 (三)综合药效及其暴露量和毒性及其暴露信息来指导人体试验设计,如起始剂量、安全范围评价等,并根据暴露程度来指导临床安全监测。 本指导原则适用于中药、天然药物和化学药物。生物制品的毒代动力学研究可参考本指导原则(注释2)。
二、基本原则 毒代动力学研究需执行《药物非临床研究质量管理规范》(GLP)(注释3)。 毒代动力学试验通常伴随毒性试验进行,常被称为伴随毒代动力学试验。开展研究时可在所有动物或有代表性的亚组或卫星组动物中进行,以获得相应的毒代动力学数据(注释4)。 三、基本内容 (一)暴露量评估 毒代动力学试验的基本目的是评估受试物和/或其代谢物的全身暴露量,常通过适当数量的动物和剂量组来开展研究。伴随毒代动力学研究所用动物数量应保证能获得足够的毒代动力学数据。由于毒性试验中通常采用两种性别动物,暴露测定也应包括两种性别的动物。选择单性别动物时应说明理由(注释5)。 暴露评估应考虑以下因素(注释6):血浆蛋白质结合、组织摄取、受体性质和代谢特征的种属差异、代谢物的药理活性、免疫原性和毒理学作用。在血浆药物浓度相对较低时,特殊的组织或器官也可能会有较高水平的受试物和/或其代谢物。对于血浆蛋白结合率高的化合物,用游离(未结合)浓度来表示暴露更为合适。 暴露评估中需关注血浆或体液中代谢物浓度的情况有:1)受试物为“前体化合物”且其转化生成的代谢物为主要活性成分;2)受试物可被代谢为一种或多种具有药理或毒理活性代谢物,且代谢物可导致明显的组
【H】G C L 1-2 指导原则编号: 化学药物临床药代动力学研究 技术指导原则 二○○五年三月
目 录 一、概述 (1) 二、药代动力学研究生物样品分析方法的建立和确证 (2) (一)常用分析方法 (2) (二)方法学确证 (2) 1、特异性 (3) 2、标准曲线和定量范围 (3) 3、定量下限 (4) 4、精密度与准确度 (4) 5、样品稳定性 (5) 6、提取回收率 (5) 7、微生物学和免疫学分析 (5) 8、方法学质控 (6) (三)分析数据的记录与保存 (6) 1、方法建立与确认的数据 (7) 2、样品分析的数据 (7) 3、其他相关信息 (7) 三、药代动力学研究的具体内容 (7) (一)健康志愿者药代动力学研究 (8) 1、单次给药药代动力学研究 (8) 2、多次给药药代动力学研究 (11) 3、进食对口服药物制剂药代动力学影响的研究 (13) 4、药物代谢产物的药代动力学研究 (14) 5、药物-药物的药代动力学相互作用研究 (14) (二)目标适应症患者的药代动力学研究 (15)
(三)特殊人群药代动力学研究 (15) 1、肝功能损害患者的药代动力学研究 (15) 2、肾功能损害患者的药代动力学研究 (16) 3、老年人药代动力学研究 (17) 4、儿科人群药代动力学研究 (17) 四、结语 (18) 五、参考文献 (19) 六、著者 (20)
化学药物临床药代动力学研究技术指导原则 一、概述 新药的临床药代动力学研究旨在阐明药物在人体内的吸收、分布、代谢和排泄的动态变化规律。对药物上述处置过程的研究,是全面认识人体与药物间相互作用不可或缺的重要组成部分,也是临床制定合理用药方案的依据。 在药物临床试验阶段,新药的临床药代动力学研究主要涉及如下内容: 1、健康志愿者药代动力学研究 包括单次给药的药代动力学研究、多次给药的药代动力学研究、进食对口服药物药代动力学影响的研究、药物代谢产物的药代动力学研究以及药物-药物的药代动力学相互作用研究。 2、目标适应症患者的药代动力学研究 3、特殊人群药代动力学研究 包括肝功能损害患者的药代动力学研究、肾功能损害患者的药代动力学研究、老年患者的药代动力学研究和儿童患者的药代动力学研究。 上述研究内容反映了新药临床药代动力学研究的基本要求。在新药研发实践中,可结合新药临床试验分期分阶段逐步实施,以期阐明临床实践所关注的该药药代动力学的基本特征,为临床合理用药奠定基础。 鉴于不同类型药物的临床药代动力学特征各不相同,故应根据所研究品种的实际情况进行综合分析,确定不同阶段所拟研究的具体内容,合理设计试验方案,采用科学可行的试验技术,实施相关研究,并作出综合性
全国药物安全性评价专题负责人第二期高级培训班
中国毒理学会药物毒理与安全性评价专业委员会 中国药学会药物安全性评价专业委员会 中国药理学会药物毒理专业委员会
毒代动力学及 其研究方法
李川
(021-********;chli@https://www.doczj.com/doc/d39249284.html,) 中国科学院上海药物研究所 上海药物代谢研究中心
2009年11月·成都
演讲内容
一 新药安评与体内药物暴露 二 影响体内药物暴露的因素 三 毒代动力学的概念 四 毒代动力学的研究方法与实施 五 小结
一 新药安评与体内药物暴露
过去20多年在新药研发领域发生的变化
45% 30%
ADME/PK
15%
0%
Financial
CaImndpirdoavteed
Formulation
Commercial Human AEs
ToAxnicimityal
EfCficliancicyal
Other
Br. J. Clin. Pharmacol. 25: 387 (1988)
Nature Rev./Drug discovery 3: 711 (2004)
化合物资源
新药上市前必须对其 安全性进行仔细评估
药物发现
1 药物先导化合物的发现 2 药物先导化合物的结构优化
药药物物候候选选化化合合物物
非临床安评研究
由于开展临床试验的伦理限制,必须先在
新药开发
1 临床前研究 2 临床试验
动物上进行全面的新药安评,以揭示新药 对动物器官组织的毒副作用,研究其剂量
药药安
质
新
依赖性、体内暴露相关性和可恢复性等, 帮助确定临床试验的初始安全剂量和应观
效代评
量
药
察的潜在毒副作用。
临床试验中的新药安全性考察
新药安全有效评价体系
安全性始终是临床试验关注的重点,影响临床试
验的推进。先从低剂量、小范围人群开展临床试
验,在安全性得以保证后,再增加给药剂量、扩
大人群已验证药物的有效性。
为什么在药物安评中要考虑体内药物暴露?
(确定药物的两个要素:功能和物质)
剂量-暴露
体内药物暴露
(化学形式/浓度)
机体对药物的作用
反映药物“物质” 的一种形式 相对准确
浓度-效应
给药剂量
反映药物“物质” 的一种形式
好用,但不准确
药物对机体的作用
毒副作用
1
中药药代动力学研究进展 摘要:近年来,为了全面阐述中药吸收、分布、代谢、排泄的体内过程,推动中药现代化,研究者们在生物效应法和药物浓度法等经典药代动力学研究方法的基础上提出了一些新方法、新思路,大大推进了中药药代动力学研究的发展。在查阅通过近年来中药药代动力学相关研究的文献,并对其中新方法新思路进行总结,综述了中药药代动力学近年来的研究现况和前沿进展。 关键词:药代动力学,药代标记物,指征药代动力学,方法学 前言:药代动力学是应用动力学原理与数学处理方法,定量地描述药物通过各种途径 (如静脉注射液、静脉滴注、口服给药等)进入体内的吸收、分布、代谢、排泄过程的“量时”变化或“血药浓度经时”变化动态规律的一门科学,已经在生物药剂学、临床药剂学、药物治疗学、分析化学、药理学等学科领域中得到了广泛应用。在中药学研究中,药代动力学被广泛的应用于揭示中药作用机制及设计优化的研究,并衍生出了中药药代动力学这门新兴学科。中药药代动力学基于动力学原理研究中草药活性成分、组分、中药单方和复方体内吸收、分布、代谢和排泄(ADME)的动态变化规律及其体内时量-时效关系,并用数学函数对其加以定量描述。 1.中药药代动力学研究方法 1.1生物效应法 药效的变化取决于体内药量的变化,可以通过测定药效的经时过程来反映体内药量动态变化。生物效应法从整体观点出发研究中药的药代动力学特征,更符合中医药理论。该法包括药理效应法、药物累计法,微生物指标法。 1.1.1药理效应法 药理效应法是一种以药理效应为指标研究药代动力学的方法。该法己越来越广泛地用于中药及其复方,特别是有效成分不明的中草药及其复方的药代动力学研究。肇丽梅[1]采用小鼠热板致痛模型,以镇痛效应为指标,测定黄芩苷及清热合剂的药物动力学参数,结果黄芩苷及清热合剂口服给药后体存药量的表观动力学过程符合一室开放模型,中药复方清热合剂的达峰时间明显慢于单方黄芩苷。李成洪[2]等以血清一氧化氮变化为药理效应指标,研究了中药复方制剂禽病康在免疫抑制雏鸡体内的药代动力学特征。以时间标本存量进行数学模型拟合,符合一级吸收二室模型,禽病康药代动力学结果表明其口服后吸收较快,分布也快,而消除较慢,体内存留时间长,药效维持时间长。宋丽
前言 药物代谢动力学是定量研究药物在生物体吸收、分布、排泄和代谢规律的一门学科。随着细胞生物学和分子生物学的发展,在药物体代谢物及代谢机理研究已经有了长足的发展。通过药物在体代谢产物和代谢机理研究,可以发现生物活性更高、更安全的新药。近年来,国外在创新研制过程中,药物代谢动力学研究在评价新药中与药效学、毒理学研究处于同等重要的地位。药物进入体后,经过吸收入血液,并随血流透过生物膜进入靶组织与受体结合,从而产生药理作用,作用结束后,还须从体消除。通过在实验的基础上,建立数学模型,求算相应的药物代谢动力学参数后,对可以药物在体过程进行预测。因此新药和新制剂均需要进行动物和人体试验,了解其药物代谢动力学过程。药物代谢动力学已成为临床医学的重要组成部分。中国药科大学药物代谢动力学研究中心为本科生、研究生开设《药物代谢动力学》课程教学已有二十多年历史,本书是在原《药物动力学教学讲义》基础,经多年修正、拓展而成的。全书十三章,三十余万字,重点阐述围绕药物代谢动力学理论及其在新药研究中的作用,与其它教材相比,创新之处在于重点阐述现代药物代谢动力学理论及其经典药物代谢动力学在新药及其新制剂研究中的应用以及目前迅 速发展的药物代谢动力学体外研究模型等新容。 本书编著者均是长期在药物代谢动力学教学和研究第一线的教师。因此,本书的实践性与理论性较强,可作为高年级本科生、硕士生教材使用,也可作为从事药物代谢动力学研究及相关科研人员的参考书。编者 药物代谢动力学 主编:王广基 副主编:晓东,柳晓泉 编者(姓氏笔画为序) 王广基、晓东、西敬、劲、柳晓泉
容提要: 药物代谢动力学是定量研究药物在机体吸收、分布、排泄和代谢规律的一门学科。在创新研制过程中,药物代谢动力学研究与药效学、毒理学研究处于同等重要的地位,已成为药物临床前研究和临床研究重要组成部分。本书重点阐述围绕药物代谢动力学理论及其在新药研究中的作用,与其它教材相比,创新之处在于重点阐述现代药物代谢动力学理论及其经典药物代谢动力学在新药及其新制剂研究中的应用以及目前迅速发展的药物代谢动力学体外研究模型等新容。共十三章,分别为概述、药物体转运、药物代谢、经典的房室模型理论、非线性药物代谢动力学、统计矩理论及其应用、生物利用度及其生物等效性评价、临床药物代谢动力学、药物代谢动力学与药效动力学结合模型、生理药物代谢动力学模型及其应用实践、手性药物代谢动力学、新药临床前药物代谢动力学研究和计算机在药物代谢动力学研究中的应用。本书的实践性与理论性较强,可作为高年级本科生、研究生教材使用,也可作为从事药物代谢动力学研究及相关科研人员 的参考书. 1 目录 第一章药物代谢动力学概述 一、什么是药物代谢和动力学 二、药物代谢动力学研究与医学其它学科的关系 第二章药物体转运 第一节概述 第二节药物跨膜转运及其影响因素 一、生物膜 二、药物的跨膜转运方式 第三节药物的吸收 一、药物在胃肠道中吸收 二、药物在其它部位吸收 第四节药物的分布 一、药物的分布及其影响因素 二、血浆蛋白结合率及常用的测定方法
生物技术药物的药代动力学研究进展 摘要:本文介绍了生物技术药物药代动力学的特点和基本机制,概述了生物技术药物药代动力学的研究方法。 关键词:生物技术药物药代动力学方法学 1.简介 近年来,生物技术药物飞速发展,为了正确评价各种生物制品在人体内的疗效及安全性,必须研究生物因子在动物体内和人体内的吸收、分布、代谢和排泄的规律。而与传统的药物相比生物技术药物具有种族特异性、免疫原性和非预期的多向活性等特点,使得其在体内的药代动力学的研究受到诸多因素的限制。蛋白多肽类药物因其生理活性强、疗效高,而日益受到人们的重视。对于蛋白质类药物来说,最重要的一个特性是,这类药物蛋白质与内源性的蛋白质结构相似,由共同的氨基酸组成,微量的需要被测定的生物因子及蛋白质存在于大量的内源性蛋白质中。蛋白多肽类药物的药动学有其特征,吸收方面来看,一般而言,小分子肽的吸收是由被动扩散或载体转运完成的,脂溶性多肽可通过膜脂扩散,高度亲脂性的药物则能通过淋巴系统被吸收;水溶性分子则可通过水合孔和/或细胞间隙扩散,通过内吞或胞饮过程摄取入细胞,还有一些细胞转运肽(cell penetrating peptide)可通过非耗能途径穿过真核细胞的质膜,这些多肽已被成功地用于在细胞内转运比自身的相对分子质量大许多倍的大分子物质。由于大多数蛋白多肽类药物具有相对分子质量大和水溶性的特点,若无主动的转运或消除机制,它们大多保留在细胞间隙。蛋白多肽类药物的主要代谢途径是体内广泛存在的蛋白多肽酶使其失活。不同的给药途径、给药方案、体内蛋白结合、种属特异性、内源性物质等对蛋白多肽类药物的体内药物动力学有至关重要的影响。 因此, 设计合适的实验方案、选择正确的药代动力学研究方法和可靠的测定方法至关重要。 2.药代动力学的研究方法 2.1 同位素示踪法 同位素示踪法是通过目标蛋白质多肽上标记同位素,从而鉴别目标蛋白质和内源性多肽的方法。所使用的同位素有H3、C14、S32、I125等,I125其因比放射性高、半衰期适宜、标记制备简单而最为常用。标记方法有两种,一是内标法,即把含有同位素的氨基酸加入生长细胞或合成体系,该法对生物活性的影响可能较小,但由于制备复杂而限制了其广泛应用;二是外标法,常用的化学方法如氯胺T或Lodogen法将I125连接于大分子上,其标记的样品比放射性高,制备容易半衰期短,成为现在最常用的生物技术药物标记物。姚文兵等运用同位素示踪法I125标记来研究聚已二醇修饰干扰素а2b的药代动力学,赵宁等用碘标法研究重组人肿瘤坏死因子在小鼠体内药代动力学和组织分布,都证明了同位素示踪法的灵敏度高,省时省力的特点,特别是对研究基因工程产品在动物体内的组织分布具有与其它方法相比有不可比的优越性。关于标记位点的选择,理论上任何部位均可被标记,但需考虑是否存在标记氨基酸被机体再利用合成新的蛋白质而影响检测结果的问题。当然,如果生物技术药物含有非天然氨基酸(如D氨基酸),标记位点的选择就不必再担心这样的问题了。
药物非临床药代动力学研究技术指导原则(第二稿)起草说明 (2013年5月7日) 1、本指导原则的修订背景 2005年SFDA发布了化学药物非临床药代动力学研究技术指导原则,但中药、天然药物的相关指导原则一直未制定。近年来创新药物的研发与申报不断增加,药代动力学研究的技术手段与观念也不断更新。为适应新药研发进展和审评需要,于2012年4 月启动了本指导原则的修订工作。历经初稿的征询专家意见、药审中心内部讨论,撰写第一稿后于2013年3月28日召开了专家讨论会,之后根据专家意见在药审中心内部讨论后,撰写成第二稿。 本指导原则在2005年版化学药物非临床药代动力学研究技术指导原则的基础上,针对中药、天然药物的特点,增加了相关描述,将适用范围扩大为中药、天然药物和化学药物。生物制品非临床药代动力学研究的指导原则有待另行制定,仍不在本指导原则的讨论范畴。 2、本指导原则的主要修订内容 2.1 关于生物样品分析方法 生物样品分析方法的相关要求仍然以附录形式存在,并请有关专家结合中国药典2015版的修订情况对部分内容进行了更新,使二者保持一致。鉴于该部分内容在非临床药代动力学、临床药代动力学等研究中的通用性,建议在适当的时间单独制定指导原则。 2.2 增加了“药物代谢酶及转运体研究”的研究项目 药物的有效性及毒性与血药浓度或靶器官浓度密切相关。一定剂
量下的血药浓度或靶器官浓度取决于该药物的吸收、分布、代谢及排除过程(ADME),而转运体和代谢酶是影响药物体内过程的两大生物体系,是药物ADME的核心机制之一。因此,本指导原则强调创新药物的研究开发应该重点关注药物主要清除途径的确定、代谢酶和转运体对药物处置相对贡献的描述、基于代谢酶或转运体的药物-药物相互作用的评估等。 2.3 关于“物质平衡” 经讨论,将“Mass Balance”由2005版指导原则的“物料平衡”确定为“物质平衡”,进一步强调了物质平衡研究的重要性,并推荐采用放射性同位素标记技术进行物质平衡研究。 2.4 关于“放射性同位素标记技术” 低能量放射性同位素标记技术安全有效、结果简单明了,已被公认为药代动力学试验的“金标准”之一。本指导原则增加了附录2,对放射性同位素标记技术进行介绍,旨在推动国内放射性同位素标记技术在非临床药代动力学研究中的应用。具体试验方法的介绍仍在进一步修订中。 2.5 关于附录3 经讨论,将2005版指导原则中“六、常见问题与处理思路”改为“几个需要关注的问题”,以附录3的形式出现,并删除了药代动力学与制剂研究、关于多次给药(将多次给药的相关考虑放在正文中)、关于改变酸根晶型的药物、药代动力学与毒代动力学(毒代动力学研究指导原则已同步修订,会在其中体现相关考虑)。
第16卷第7期中国现代医学杂志 Vol.16No.72006年4月 ChinaJournalofModernMedicine Apr.2006 收稿日期:2006-01-20 本文就国内近年来纳米药物药动学研究的动向及成果加以概述。 1纳米药物药代动力学的研究方法 纳米药代动力学的研究方法与化学药品的药代 动力学研究没有本质区别,其方法分为血药浓度法和生物效应法。1.1血药浓度法 血药浓度法是药动学研究的经典方法,主要研究纳米药物中有效成分明确者,也是计算药代动力学最常用最准确的一种方法。常采用分光光度法、原子吸收光谱法、薄层层析法、薄层扫描法、高效液相色谱法、气相色谱法、放射性同位素法和放射性免疫法等方法进行测定。如张阳德等[1]利用荧光分光光度法建立了半乳糖化白蛋白磁性阿霉素纳米粒在大鼠体的研究。刘炜等[2]建立高效液相色谱法测定小鼠血浆中丝裂霉素C聚氰基丙烯酸正丁酯磁性纳米球浓度的方法。 1.2 生物效应法 纳米中药复方成分复杂,干扰因素多,难以用常 规的血药浓度的方法测定其药代参数。80年代产生 了以药效为指标进行药代动力学研究的的理论和方法。 1.2.1药理效应法药理效应法是以药物的效应强度,包括量效关系,时效关系为基础的研究药代动力学的方法。目前,该法已越来越广泛地用于纳米中药及其复方,尤其是有效成分不明的中草药药代动力学研究。薛焰等[3]用药理效应法测定药动学,比较了超细粉马钱子和普通粉马钱子的药动学参数。1.2.2微生物指标法其原理主要是含有试验菌株的琼脂平板中抗菌药扩散产生的抑菌圈直径大小与抗菌药浓度的对数呈线性关系。选择适宜的敏感菌株测定体液中抗菌中草药的浓度,然后按照药代动力学原理确定房室模型,并计算其药代动力学参数。如陈鹏,毛天球等[4]以抑菌效应为指标,测定纳米羟基磷灰石复合胶原材料药动学参数。 文章编号:1005-8982(2006)07-1028-04 ?综述? 纳米药物的药代动力学研究进展 张阳德1,赵志坚1,张浩伟2,张彦琼3 (1.中国卫生部肝胆肠外科研究中心,湖南长沙410008;2.美国加州医疗中心, 加利弗尼亚州文图拉CA93003;3.中南大学生物医学工程研究院,湖南长沙410008) 摘要:纳米药物载体在近年研究已取得飞跃的发展。该文从药物代谢动力学的角度综述了纳米药物的吸收、分布和转化的研究进展。 关键词:纳米药物;药代动力学中图分类号:R318文献标识码:A Newdevelopmentofpharmacokineticofnano-drug ZHANGYang-de1,ZHAOZhi-jian1,ZHANGHao-wei2,ZHANGYan-qiong3 (1.NationalHepatobiliary&EntericSurgeryResearchCenter,MinistryofHealth,Changsha,Hunan410008,P.R.China;2.MedicalCenterofCalifornia,CaliforniaCA93003,USA;3.Biomedicaland EngineeringInstituteofCentralSouthUniversity,Changsha,Hunan410008,P.R.China) Abstract:Theresearchofnano-drug-loadedcarrierhasmadefastprogressaspotentialdrugdeliverysystems.Fromthepointofpharmacokinetic,thispaperreviewsthepresentstateoftheabsorpation,distributionandinvertionofnano-drugs. Keywords:nano-drug;pharmacokinetic
指导原则编号: 【H】G P T 5-1 化学药物非临床药代动力学研究 技术指导原则 二○○五年三月
目 录 一、概述 (1) 二、基本原则 (2) 三、试验设计 (2) (一)总体要求 (2) (二)生物样本的药物测定方法 (3) (三)研究项目 (4) 四、数据处理与分析 (9) 五、结果与评价 (9) 六、常见问题与处理思路 (10) 七、参考文献 (13) 八、附录(生物样品的分析方法) (15) 九、著者 (21)
化学药物非临床药代动力学研究技术指导原则 一、概述 非临床药代动力学研究是通过动物体内、外和人体外的研究方法,揭示药物在体内的动态变化规律,获得药物的基本药代动力学参数,阐明药物的吸收、分布、代谢和排泄的过程和特点。 非临床药代动力学研究在新药研究开发的评价过程中起着重要作用。在药效学和毒理学评价中,药物或活性代谢物浓度数据及其相关药代动力学参数是产生、决定或阐明药效或毒性大小的基础,可提供药物对靶器官效应(药效或毒性)的依据;在药物制剂学研究中,非临床药代动力学研究结果是评价药物制剂特性和质量的重要依据;在临床研究中,非临床药代动力学研究结果能为设计和优化临床研究给药方案提供有关参考信息。 本指导原则是供药物研究开发机构进行化学药品新药的非临床药代动力学研究的参考,而不是新药申报的条框要求。研究者可根据不同药物的特点,参考本指导原则,科学合理地进行试验设计,并对试验结果进行综合评价。 本指导原则的主要内容包括进行非临床药代动力学研究的基本原则、试验设计的总体要求、生物样品的药物分析方法、研究项目(血药浓度-时间曲线、吸收、分布、排泄、血浆蛋白结合、生物转化、对药物代谢酶活性的影响)、数据处理与分析、结果与评价等,并对研究中的一些常见问题及处理思路进行了分析。
非那西丁的药代动力学研究实验报告 一.概述: 非那西丁(Phenacetin)为一种解热镇痛药,因为潜在副作用在临床已基本不使用。但由于其是CYP1A2酶的特异性底物,被广泛选择作为底物用于酶活性测定实验以及影响酶活性作用药物的研究。本学期临床药代动学实验课以非那西丁在大鼠体内的代谢实验、大鼠肝微粒体温孵实验两部分为例,通过实验设计,实验操作,结果评价等一系列过程,系统地学习了药代动力学中药物体内外的简单研究方法、实验数据的处理、以及相关药动学参数的计算与评价。 二.正文 1.非那西丁在大鼠体内的药代动力学研究 1.1实验目的 研究非那西丁在大鼠体内代谢的药代动力学,学习大鼠眼底静脉丛取血等操作。 1.2实验材料与方法 仪器:HPLC-UV色谱仪,高速冷冻离心机,涡旋振荡器; HPLC色谱条件:检测波长:254nm 色谱柱:inertsil-ODS-SP,5um,4.6*150mm 流速:1.0ml/min 柱温:40℃ 流动相:40(乙腈):60(50mM磷酸盐缓冲液)(注:50mM磷酸盐缓冲液配制:6.8g磷酸二氢钾,加入150ml氢 氧化钠溶液(0.1M),配制成1L的磷酸盐缓冲液) 试剂:非那西丁注射剂,对乙酰氨基酚标准品,肝素钠,10%高氯酸; 实验动物:雄性大鼠,180g—220g 1.3实验步骤 1.3.1标准曲线的制备:取空白血浆,加入对乙酰氨基酚标准品,使其 浓度分别为0.156,0.313,0.625,1.25,2.50,5.00,10.00ug/ml。在给定的色谱条件下进行HPLC分析,以样品的峰面积对样品浓度进行线性回归。 1.3.2给药及血浆采集处理:取大鼠一只,尾静脉注射非那西丁 (10mg/kg)后,分别于0,5,10,15,30,45,60,90,120min于尾静脉取血
专业:药学(专升本,专)适用年级:2017级科目:药物代动力学满分:100分 总页数:4页出题日期:2019-5-8 一、概念解释(每概念2分,共10概念,共20分) 1. 血脑屏障 2. 肝药酶抑制剂 3. 肝肠循环 4. 零级动力学消除 5. 生物利用度 6. 血浆半衰期 7. 稳态血药浓度 8. 易化扩散 9. 体过程 10. 药物的排泄
二、问答题(共2题,每题4-6分,共10分) 1、Caco-2细胞作为体外吸收模型的优点?(4分) 2、举例说明药代动力学在药剂学中的应用。(6分) 三、选择题(共60题,每题1分,共60分) 1.大多数脂溶性药物跨膜转运是通过 A.易化扩散 B.简单扩散 C.膜孔滤过 D.主动转运 E.胞饮2.被动转运的特点是 A.从高浓度侧向低浓度侧转运 B.从低浓度侧向高浓度侧转运 C.需消耗能量 D.有竞争性抑制现象 E.有饱和限速现象 3.下列关于主动转运的叙述中,错误的是 A.从低浓度侧向高浓度侧转运 B.需特异性载体 C.不消耗能量 D.有竞争性抑制现象 E.有饱和限速现象 4.某弱酸药物的pka=3.4,在pH=7.4的血浆中其解离度为 A.90% B.99% C.99.9% D.99.99% E.10% 5.以下何种情况药物易通过简单扩散转运 A.解离型药物在酸性环境中 B. 解离型药物在碱性环境中 C. 弱碱性药物在酸性环境中 D. 弱酸性药物在碱性环境中 E. 弱酸性药物在酸性环境中 6.下列关于药物解离度的叙述中,错误的是( C ) A.弱酸性药物在酸性环境中解离度小,易吸收 B.弱碱性药物在碱性环境中解离度小,易吸收 C.弱酸性药物在酸性环境中解离度大,难吸收 D.弱酸性药物在碱性环境中解离度大,难吸收 E.弱碱性药物在酸性环境中解离度大,难吸收 7. 下列关于易化扩散的叙述中错误的是( B )
论文关键词:中药;药代动力学;中医药现代化 论文摘要:从中药复方的特点和研究现状入手,对有效成分明确和不明确的中药及其复方制剂在药动学上的应用进行了论述和比较,指出了各种研究方法存在的不足;强调应进一步加强对中药复方药理学和药物动力学的研究,用科学的语言阐明中药复方的作用过程和机理;此举将对中医药实现现代化,走向国际市场产生重要影响。 1中药药代动力学研究意义 中药及其复方的药物动力学研究,是近十多年兴起的中药药理学分支,主要是研究药物在体内的吸收、分布、代谢和排泄,用数学模型来定量描述药物在体内的动态过程。它对中药药理学及中医临床医学的发展有着重要的意义。中药药动力学研究是阐明中药作用机理必不可少的环节。药代动力学参数可以为毒性试验设计和毒理效应分析提供依据。受多种因素的影响,毒性试验观察到的毒性反映往往不与剂量相关而与血药浓度相关,如果高浓度的药物剂型不利于药物吸收,进入体内的药量与剂量不成正比,就有可能造成毒性剂量评估上的偏差。众所周知,进行中药及其复方制剂的药代动力学研究会有不小的困难,因此,更需要广大的医药学工作者集中力量,找出中药作用中有代表性,有规律性的机理或具有可行性、可操作性的系统研究方法学,使中药药代动力学的研究更科学、更系统,更能满足现代临床治疗的要求。 2中药复方的自身特点及中医对药代动力学的认识 中药复方是中医防治疾病的主要手段。中医理论的特色之一就在于强调“人”的整体观,发挥药物的整体调节作用,并用辩证施治的思维方法来处方用药。现代药理学研究已初步证明复方药效的发挥并非是简单的单味药相加或毒性的相减,而是方中药物之间所发生的协同、制药或改性等作用,使复方达到预期的治疗目的。目前,国内对复方的研究中,有相当一部分在药理效应及临床疗效的观察阶段,虽然也引用了一些西药药理学手段,但仅表现在对几个特异性指标的观测上,且重复研究居多,所研究的中药复方组成不稳定,药效重现性差,难以全面而准确地反映出复方药物的作用机制,这使得国内复方制剂稳定性差,质量标准不高,较难与国际医药市场接轨。中药成分十分复杂,即使是单味药物,其所含的有效成分也达数种之多;而且在多数情况下又是以复方制剂给药。许多中药到目前为止其有效成分和作用机制还不是很清楚,加之中药中的一些有效成分含量很少,并且还有不少结构相似的类似物。来源产地不同,不同季节采收,不同方式加工等特点,使得常规的化学分析以及数据的解析产生困难,实验结果不易重复,给药代动力学的研究带来了许多困难。 3中药药代动力学研究的现状 中药的药物代谢动力学的研究与西药相比有很多不同的地方,因此决定了其研究方法也存在一定的差异。一般按有效成分明确的中药及其制剂的药物代谢动力学研究和有效成分不明的中药及其制剂的药物代谢动力学研究两种情况来进行评述。 3.1有效成分明确的中药及其制剂的药代动力学现状 有效成分明确的中药及其制剂的药代动力学研究方法与西药类似。随着对中药中有效成分的研究方法和检测技术的改进和完善,目前许多中药特别是单味中草药的有效成分已相当明确,据统计在九十年代前就已对120多种中药的有效成分进行过研究[1]。并已对相当一部分进行了体内外代谢的研究,且得出了明确的代谢产物,并对其体外药代动力学参数进行了研究。如毕惠嫦[2]研究了丹参酮Ⅱ_A在大鼠肝微粒体酶中的代谢动力学,指出了参与丹参酮Ⅱ_A体内代谢的肝微粒体酶。艾路等[3]对复方中药中乌头生物碱在人体内的代谢产物进行了研究,采用液相色谱-电喷雾离子阱多级质谱(LC-ESI-MSn)法检测出5种乌头生物碱代谢产物。陈勇[4]等对葫芦巴碱在大鼠体内的代谢产物进行了推测,从大鼠尿中检测出原药及其三种代谢产物。 3.2中药复方及其制剂的药代动力学研究现状 到目前为止还有许多中药及其复方制剂或因化学结构不明,或由于是混合物而非单体,无
眼部药物代谢动力学的研究 摘要:药代动力学研究在药品研发及评价过程中具有重要作用。本文对眼用制剂的药代动力学研究的进行了探讨。本文介绍了眼的药物代谢途径及其特点,眼部药代动力学样本采集以及常见的分析方法。通过药代动力学的研究可以了解药物在体内的代谢特征,指导临床用药的给药剂量、间隔、途径等,保证药物疗效,减少毒副作用。 关键词:眼;药代动力学;分析方法 对药品研发人员、技术审评人员以及临床医师来说, 人体药代动力学研究所提供的信息是非常重要的, 有时甚至是其他研究所无法替代的。通过眼部药代动力学的研究,学者们可以获得药物在眼部代谢的浓度一时间曲线,了解药物在眼内的代谢特征,对于药物剂型设计、给药方案、治疗监测等起着重要的作用。但是眼具有特殊屏障作用, 眼用制剂的药代动力学过程不同于系统给药的过程, 那么其药代动力学的特点及一般过程如何? 其意义何在? 常用的分析方法用哪些?另外,现有眼科局部给药的突破点在于,如何通过改进药物剂型和给药方式保证病人良好的依从性和药物应用的便捷性, 安全性。因此,对眼局部的药物代谢动力学加以了解和考察,能够更好的针对不同的疾病选择不同的给药方式和药物剂型, 对于临床诊治及用药安全具有重要的指导意义。同时,眼部给药系统研究的兴起也要求有方便、准确、安全、有效的检测方法来进行说明和验证。 1 眼的药物代谢途径及其特点 1.1 药物在眼球表面的流失 在眼局部应用滴眼剂时, 由于泪液在眼表的涂布,流动和循环使药物在接触眼表时即发生了流失。泪液在眼表的更新速度仅为1μl/min,相对多量的滴眼剂可在数分钟之内随着泪液的循环快速流入鼻泪管发生排泄[1]。由此可见,滴眼剂药物的全身吸收不仅在结膜囊的局部毛细血管中进行,同时也存在于滴眼剂流入鼻腔从而进入全身的情况。因此, 大多数以局部滴眼剂方式给药的小分子量药物在数分钟内即会进入全身循环,从而导致其在眼表的生物利用度仅在5%甚至更少。全身循环中的吸收降低了药物在眼表的有效浓集, 因此,通过应用固体药物
药物代谢动力学研究中的生物样品分析 王宁生 主题词:@生物样品/分析;@生物样品分析/药代动力学 分类号:R912.1;R927.2 文献标识码:A 无论在临床药理、药物作用机理研究或新药开发研究,药物代谢动力学越来越显示出其重要性和必要性。药物代谢动力学研究获得的资料最终能否用于临床实践或药物研究结果的说明和解释,取决于研究方案和生物样品分析方法的设计和实施。 应用于化学药品及天然药物有效成分(包括中药和中药复方)分离、检测的方法和技术已有大量文献资料和研究报导,尤其是一些新技术、新方法的应用,使分析和检测手段越来越快捷、准确。然而应用于药物代谢动力学研究的生物样品分析方法,除正确设计和精心实施外,尚应包括了解该方法的特性及其限制因素。方法的特性包括被测物在体液中的稳定性,分析测试方法的灵敏度,选择性,萃取过程的回收率,定量计算的线性关系,工作曲线,以及方法的精密度和准确度。 1 方法学验证 1.1 稳定性 从生物样品(体液)的收集到样品的分析完成,样品中的待测药物(有效成分)必须是稳定的。否则将导致易变的回收率并降低测定的准确度和精密度。在分析方法建立的过程中,应了解待测成分(药物)在不同的pH、光照等情况下的稳定性,同时也应了解、考察生物样品及分析操作过程中待测成分的稳定性。这一点对中药药代动力学的研究来说应特别注意,因为除待测的有效活性成分外,中药中尚有许多未知成分,在不同的环境和条件下,这些成分与待测成分的相互作用,可能导致待测成分“量”和/或“质”的改变。 体液中药物稳定性的考察应包括在室温和储藏温度(-20℃或-80℃)两种情况的研究。如发现有明显的降解,则应采取特殊措施来防止。(如尿液中加甲苯以抑制细菌生长,含三硝基甘油血清中添加少量硝酸银抑制三硝基甘油的降低等)。如要了解较长时间的储藏对药物稳定性的影响,一般是制备与分析样品含有相同药物(成分)和代谢物的对照样品,两者作平行处理,从对照样品的分析结果可判断药物稳定性的情况。 1.2 灵敏度 分析方法灵敏度的要求取决于药代动力学研究时所用药物的剂量,给药次数及药物在体内的吸收、分布、代谢和消除等特征。临床前或临床(药理)资料有助于分析方法的选择和确定。一般来说,分析方法应有一定的浓度范围。但在药代动力学研究中,药物或代谢物的浓度不是一成不变的,此时可采用一些简便的方法(如样品的稀释),使样品中待测成分的浓度落在测定的浓度范围内。虽然在同一研究中可用不同的分析方法,但应尽量避免,以利于研究结
发布日期 20140327 化药药物评价 >> 临床安全性和有效性评价 临床药代动力学试验的常见设计类型与统计分析 张学辉,卓宏,王骏 化药临床二部 一、临床药代动力学试验的统计分析问题现状 临床药代动力学试验在新药上市注册申请中占有重要地位。 与大样本量的 临床试验相比,这类试验样本数少、 观测指标少,其统计分析问题要简单很多, 未引起申请人或研究者的重视,一般较少邀请统计专业人员参与。甚至一些人 认为这类试验是描述性试验,不需要进行专业的统计分析。其实正是因为这类 试验的样本数少,才要更加重视其试验设计和统计分析的规范性,才能得出相 对可靠的专业结论。从目前申报资料看,存在较多问题: 1 )研究设计时未充 分考虑三要素”(受试者、试验因素、观察指标),无法满足研究目标的专业 需要;2)研究设计不符合 四原则”(随机、对照、重复和均衡),不采用常见 的设计类型,设计出一些不同寻常的异型试验; 3)资料整理和统计分析方法 选用不当,与研究设计类型不匹配,尤其是滥用 t 检验和单因素多水平设计资 料的方差分析方法。 临床药代动力学试验的一般要求参见技术指导原则 ⑴。本文拟介绍这类试 验的常见研栏目 标题 作者 部门 正文内容
究设计类型与统计分析方法,供大家参考。 二、创新药物临床药代动力学试验 这里的创新药物是指新化学实体。这类药物通常在健康受试者中进行多项 的临床药代动力学试验,包括单次给药、多次给药、食物影响、药代动力学相互作用等药代动力学试验。后续还要进行目标适应症患者和特殊人群的药代动力学试验。 2.1创新药物单次给药药代动力学试验 创新药物的健康受试者单次给药药代动力学试验通常在I期耐受性试验结 束后进行。受试者例数一般要求每个剂量组8?12例,男女各半。药物剂量, 一般选用低、中、高三种剂量,有时会选用更多剂量。剂量的确定主要根据I 期临床耐受性试验的结果,并参考动物药效学、药代动力学及毒理学试验的结果,以及经讨论后确定的拟在∏期临床试验时采用的治疗剂量推算。高剂量组剂量必须接近或等于人最大耐受的剂量。 由于该类药物初上人体试验,出于安全性和伦理的考虑,每位受试者只给药一次,最常采用多剂量组平行设计。一般设计为在健康受试者(男女各半)中、随机、开放、多剂量组平行、单次给药的药代动力学试验。整理这类试验的药代动力学参数时,可以归类为两因素(剂量、性别)析因设计。各剂量组内性别间差异无统计学意义或者不考虑性别因素时,可以将该试验简化为单因素(剂量)的平行组设计。 安全性好的药物,在伦理允许情况下,也可采用多剂量组、多周期的交叉设计。交叉设计的优点是节省样本量、自身对照、减少个体间变异,缺点是多周期时间长、重复测量次数多、受试者依从性差易脱落、统计分析方法复杂。 当选用低、中、高三个剂量组时,通常采用随机、开放、单次给药、三剂量组