
第18卷 第1期2001年3月实验动物科学与管理
LABORATORY ANIMAL SCIENCE AND ADMINSTRATION Vol .18 No .1Mar .2001
小鼠胚胎移植技术方法比较
管 彤,王凤山,王 静,王晓军,于国德,杨梦礼
(天津市劳动卫生职业病研究所,天津 300204)
摘要:以近交系小鼠C 57BL 6J 、BDF 1小鼠作为供体胚小鼠,封闭群昆明种小鼠作为代母,对实验小鼠胚胎移植的三种方法,即:对小鼠受精卵(或2个细胞期胚)经由代母输卵管口移植、经由代母输卵管壁移植及对小鼠进行子宫移植(8细胞期胚)的方法了进行实验研究,并对各方法适于使用的动物对象、实验要求、产仔率、优势与不足等做了进一步的探讨,为今后的实验动物与动物实验提供参考依据。关键词:近交系小鼠;输卵管口(壁);移植;子宫移植
中图分类号:S865.13 文献标识码:A 文章编号:1006-6179(2001)01-0029-03
收稿日期:2000-07-07
第一作者简介:管彤(1968-),女,助理研究员,主要从事野生小鼠资源开发及实验小鼠胚胎毒理学研究。
自五十年代以来人类建立了受精卵和早期胚胎的采集技术之后,很快就完成了早期胚向代母体内
输卵管及子宫移植的胚胎移植技术的开发和研究[1]
。小鼠的胚胎移植技术对于实验动物学研究及生命科学研究具有重要价值。人类由小鼠进行发育生物学研究,包括胚胎的发生、发育、突变基因的研究、转基因动物的研究、基因打靶技术及小鼠胚胎冷冻种子库技术等涉及胚胎体外操作的各种研究,均需要进行胚胎移植入代母体内来完成。按照胚胎发
生的阶段不同,移植部位也不同[2]
。1~2个细胞期胚胎进行输卵管口移植,8细胞期至桑椹期胚进行
子宫移植。1992年,日本学者Nakagata [3]
又报道了经由输卵管壁进行输卵管移植的技术,以解决移植中一些代母品系输卵管口较小、较短的问题。
本文主要是将此三种移植方法引入,使之在本实验室成为常规后,将其应用于实验小鼠并进行了方法上的比较,重点比较了方法上的难易程度、产仔率、方法选择的前提因素。
1 材料与方法
1.1 实验动物
实验动物作为参比对照的成年近交系C 57BL 6J 小鼠、B DF 1小鼠(♀C 57BL 6J ×♂DBA 2)和作为代母的昆明种封闭群小鼠。
1.2 试剂
PMSG (pregnant mare serum gonadotropin )、HC G
(human chorionic gonadotropin )、胚胎移植用Injection Medium 培养液、M 2培养基等。1.3 假孕代母的准备
1.3.1 昆明种雄性小鼠的结扎
为输卵管移植及子宫移植用代母(昆明种封闭群小鼠)交配用的雄性昆明种小鼠进行输精管结扎手术,以便制备假孕代母。进行输精管结扎手术的雄性昆明种小鼠应提前三周施行手术,术后备用。1.3.2 制备假孕代母
胚胎移植前一日(子宫移植,前三日)将已施行输精管结扎手术术后三周的昆明种雄性小鼠以1∶2与其雌性小鼠进行同笼交配,次日检查阴道栓有无,以阴道栓形成者作为移植用代母。1.4 卵的采集
1.4.1 超排卵
[4]
取出生后8~10周的C 57BL 6J 及B DF 1雌性小鼠进行PMSG 处理(腹腔注射,5IU 只),48h 后进行HC G 超排卵处理,方法、剂量相同,HC G 处理14~17h 后可进行受精卵的采集(子宫移植,为HC G 处理后第三日)。
1.4.2 交配
取已注射PMS 、HCG 后的C 57BL 6J 、B DF 1雌性小鼠与其相应的C 57B L 6J 、BDF 1雌性小鼠进行同笼
相配,比例为1∶1。
1.4.3 受精卵的采集[5](无菌条件下)
a.取同笼相配后阴道栓阳性的雌性C57BL6J、BDF1小鼠,断椎处死后仰面(腹部朝上)置于解剖台上,酒精消毒后剪开外皮、真皮、打开腹腔,剪下卵巢、输卵管连同输卵管壶腹部后,置于盛有PBS的平皿中,镜下找出输卵管的壶腹部并用游丝镊子撕破,使其中的受精卵释放到带有透明质酸酶的培养液中,用受精卵采集毛细管将培养液中的受精卵转移至盛有三滴(400ul滴)受精卵培养液平皿中的一滴,用同样方式再洗二次后最终将受精卵置于微滴培养液(50ul滴)中,放入37℃、5%CO2中温育3~4 h,等待移植。
b.采取子宫移植的方法,将同笼相配后阴道栓阳性的雌性C57B L6J、B DF1小鼠挑出,单独饲养至第3d(8细胞期胚)处死,剪开外侧皮肤后将内侧皮肤剪为“横T”型,打开腹腔后找出子宫及卵巢,剪断取出放入盛有PB S缓冲液的平皿中,并剪掉系膜及附着物后放入盛有M2培养液的平皿中,在M2平皿中将子宫与卵巢连接的根部剪断并作“十”字切口,在1mL针管中吸入0.5~0.6mL M2液从阴道根部扎入到子宫中将M2冲入到子宫中,反复3次冲洗后用8细胞胚采集用毛细管吸入后移至盛有三滴M16培养液平皿中的一滴,同样方式再洗二次后置于第三滴M16中,放入37℃、5%C O2中温育,等待移植。1.5 胚胎移植
1.5.1 输卵管伞口移植[4]
麻醉代母并进行胚胎移植显微手术。消毒杀菌后,剪开毛皮层、真皮层,镜下取出卵巢部,剪开卵巢膜,将2个细胞期胚经代母输卵管伞口移植入代母输卵管中。将卵巢部轻推小鼠体内,进行真皮毛皮术后缝和,消毒伤口后,注意保温,第二日观察至苏醒后置于小鼠饲育室中至仔鼠出生。
1.5.2 输卵管壁移植[3]
麻醉代母并进行胚胎移植显微手术。消毒杀菌后,剪开毛皮层、真皮层,镜下取出卵巢部,剪开卵膜,确认输卵管伞端后,在输卵管伞端至壶腹部之间靠近壶腹部13处的输卵管壁切一斜口(250μm左右),将受精卵经由此剪开的斜口移植入壶腹部内。将卵巢部轻推小鼠体内,进行真皮毛皮术后缝和,消毒伤口后,注意保温,第二日观察至苏醒后置于小鼠饲育室中至仔鼠出生。
1.5.3 子宫移植[6]
麻醉代母并进行胚胎移植显微手术。消毒杀菌后,剪开毛皮层、真皮层,镜下找出一侧子宫,左手以游丝镊子轻轻夹住子宫与输卵管结合部使子宫与鼠体成45℃角,右手用5#针头经由子宫壁扎入子宫腔内,上下轻轻移动以确认针头未扎入子宫腔内壁,同时迅速沿这个针眼将移植用毛细管扎入并轻轻将卵吹入子宫内。将卵巢部轻推小鼠体内,进行真皮毛皮术后缝和,消毒伤口后,注意保温,第二日观察至苏醒后置于小鼠饲育室中至仔鼠出生。
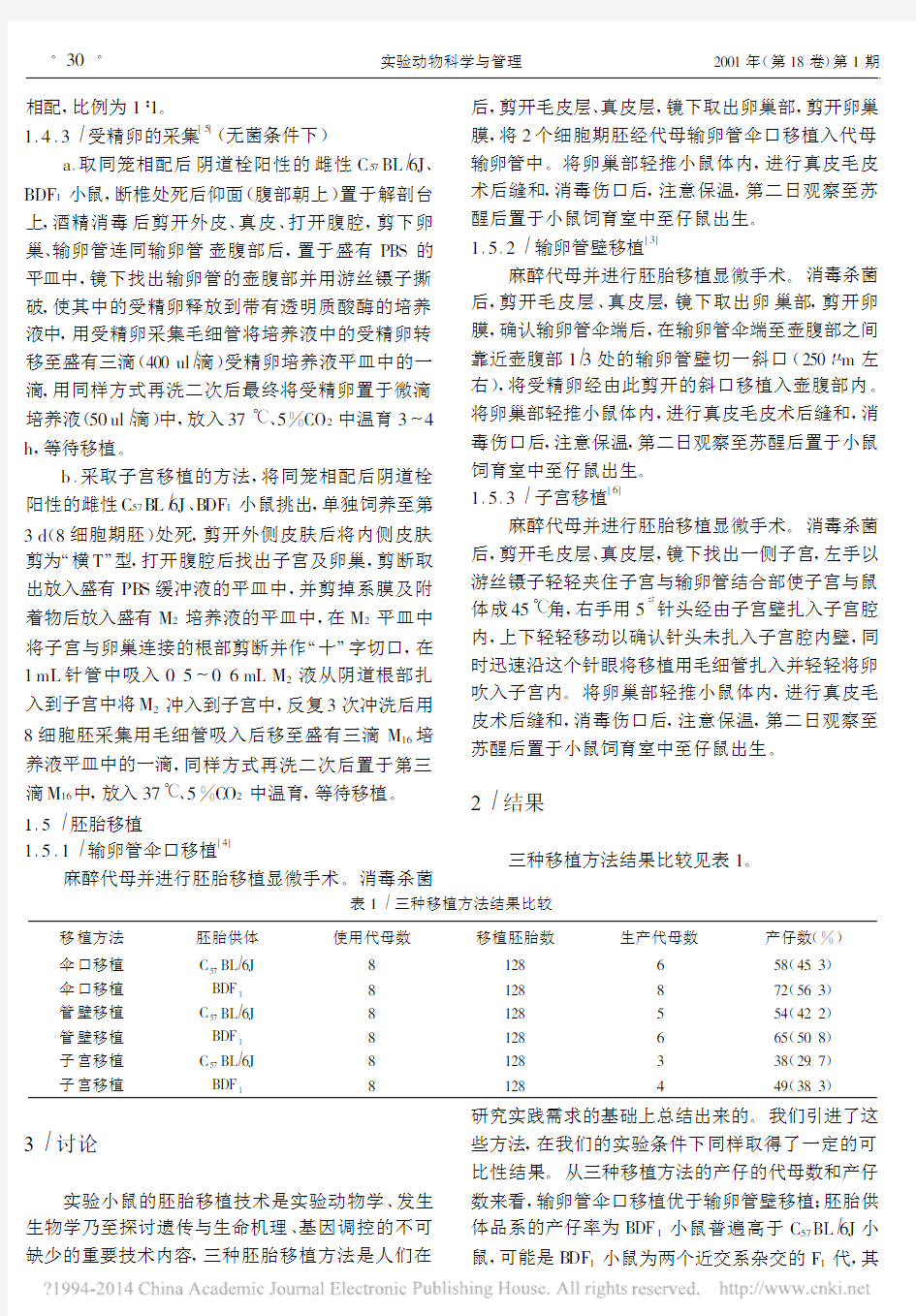
2 结果
三种移植方法结果比较见表1。
表1 三种移植方法结果比较
移植方法胚胎供体使用代母数移植胚胎数生产代母数产仔数(%)伞口移植C
57
BL6J8128658(45.3)伞口移植BDF18128872(56.3)管壁移植C57BL6J8128554(42.2)管壁移植BDF18128665(50.8)子宫移植C57BL6J8128338(29.7)子宫移植BDF18128449(38.3)
3 讨论
实验小鼠的胚胎移植技术是实验动物学、发生生物学乃至探讨遗传与生命机理、基因调控的不可缺少的重要技术内容,三种胚胎移植方法是人们在研究实践需求的基础上总结出来的。我们引进了这些方法,在我们的实验条件下同样取得了一定的可比性结果。从三种移植方法的产仔的代母数和产仔数来看,输卵管伞口移植优于输卵管壁移植;胚胎供体品系的产仔率为BDF1小鼠普遍高于C57BL6J小鼠,可能是B DF1小鼠为两个近交系杂交的F1代,其
·
30
·实验动物科学与管理2001年(第18卷)第1期
生命力总体上比一般近交系小鼠为强,而国际上一般也都采用BDF 1小鼠作为转基因的载体动物。同国外的工作相比,我们实验条件下的产仔率平均较之低约10%~15%,考虑原因如下:一是国际上一般使用的是SPF 级别的小鼠,至少是清洁级小鼠,而我们使用的则是清洁级来源的普通级小鼠;二是国外使用的代母一般为I CR 通用封闭群小鼠,其具有较好的受孕能力;三是我们技术条件的限制。
实验研究的目的不同,选用的移植方法也不同。一般说来,进行小鼠胚胎冷冻种子库建库、经由小鼠受精卵雄性前核显微注射DNA 进行转基因动物制备研究,均需使用输卵管伞口移植;代母的输卵管较短或伞口较小移植较为困难时,可使用输卵管壁移植方法。子宫移植的产仔率相对较低,方法上也略为繁琐,一般在进行胚胎融合技术、制备嵌合体动物时使用。
参考文献:
[1] 山村研一.遗
子工学による动物モデル作成.病态生
理,1995,14(12):961-66.
[2] 铃木 操.トランスヅユニツケマウス.临床免疫,
1997,29(Supp1.17):581-87.
[3] Nakagata N .Embryo trans fer through the wall of the fallopian
tube in mice .Exp .Anim ,1992,41(3):387-88.[4] 横山
介,
木元也,野村达次.トランスヅユニツク
マウスの研究を支える周边技术.实验医学,1988,6(3):246-251.
[5] Hogan B ,Beddin gto R ,Costantini ,et al .Manipulating the
Mouse Embryo .Cold Spring Harbor Laboratory Press ,1994.[6] 野村达次,
木元也.发生工学实验マニユアル-トラ
ンスツユニツクマウスの作リ方.讲谈社サイエンテイフイク,1987.
The Comparison of Embryo Transfer Methods of Laboratory Mice
G UA N Tong ,W A NG Feng -shan ,WA NG Jing ,W ANG Xiao -jun ,YU Guo -de
(Tianjin Institute of Industrial Hygiene and Occupational Diseases ,Tianjin 300204)
A bstract :Three e mbryo trans fer methods of laborat ory mice :the oviduct trans fer ,the transfer through the wall of the fall opian tube and the uterine transfer were
studied and co mpared by using the embryos from C 57BL 6J mous e ,BDF 1mouse and Kunming mous e as fos ter mother .It was al so discuss ed for each trans fer meth -od that which is better to different mouse s trains ,different experiment ,and different litter birth rates .The results ma y provide a useful reference material for some of l aboratory ani mals and ani mal experiments .
Key words :Inbred strain of mice ;oviduct (or through wall )transfer ;uterine transfer
(上接25页)
Determination of some Hematological and Biochemical Values
of Closed Colony Cricetulus Migratorus
LIA O Li -fu 1
,DING Yan -ping 2
,LI Li 2
,W A NG Chen 1
,LI Wei
1
(1.Xinjian g Institute for Endemic Disease Control and Research ,Urumqi 830002;
2.Urumq i General Hospital of Lanzhou Command ,Uru mqi 830000)
A bstract :He matol ogical indices and biochemical indices have been measured and anal yz ed for getting the phys iological reference values of hematology and bio -chemistry in F 14~F 15of grey hamsters (C ric etulus migratorus ).Compars ion of the referenc val ues were made between the t wo -month and ten -month age and be -tween male and female .It was different in sex for RBC ,Hgb ,HCT ,CL ,Glu ,Tp ,AL
B and CREA in the ten -month age and PLT ,L ,N ,ALB ,Glu and Amy in the t wo -month age ,and between ages for MCV ,MCH ,PLT ,Ca ,P ,TG ,UR EA ,ALP ,ALT and LD .The enzyme activities and electolyte contents in serum of grey hamsters were higher than ones of human being ,whic h is one of the wa ys for the rodents adapting to arid environments .
Key words :Cr icetus migratorius ;Hematol ogy ;Biochemistry ;Phys iological reference values
·
31·2001年(第18卷)第1期实验动物科学与管理
小鼠灌胃 小鼠灌胃方法比较简单,需要关注的只有两点: 一是要保持小鼠的头部和颈部成一直线,方便灌胃针头进入; 二是动作要轻柔,从口角进入,防止损失食道。做的多了自然就熟练了。 具体操作过程如下: 1.准备灌胃针头。一般可以从市场上面买到,实在没有的话,可以用12号的针头,剪去针尖,用砂纸将头端磨平,也可以用。但是买的灌胃针头的头端用锡或者适宜的方法处理了针头的锐口,自己用砂纸不可能将所有的锐口都磨掉,用这样的针头灌胃,损失小鼠食道的可能性比较大。 2.抓住小鼠,使其头、颈和身体呈一直线。抓小鼠的动作很简单,左手的小指和无名指抓住小鼠的尾巴,另外三个手指抓住小鼠的颈部即可。因为小鼠始终在活动中,若一次抓的感觉不是很顺手,要放开重新抓,不要逞强进行下一步操作。 3.抓好小鼠就可以灌胃了,一般用1ml的注射器配灌胃针头。灌胃针头从小鼠的嘴角进入,压住舌头,抵住上颚,轻轻向内推进,进入食管后会有一个刺空感,进入食道后就可以推注药液了。(我认为,所谓的灌胃,不必要灌胃针头进入小鼠的胃部,进入食管后就可以推药了,这样对小鼠食道的损伤要小点,特别是要长期灌胃给药的情况下。)当然,灌胃针头也可以再往里面深入一点,防止药液从口中流出。 4.灌胃容积一般是0.1~0.2ml/10g,最大0.35ml/10g,每只小鼠的灌胃最大容积不超过0.8ml。 小鼠腹腔注射 腹腔注射是常见的给药方式,尤其是在麻醉时。常见的麻醉方法均是麻醉药物腹腔注射。 1.小鼠腹腔注射可以用1ml的注射器,配合4号针头。
2.腹腔注射时右手持注射器,左手的小指和无名指抓住小鼠的尾巴,另外三个手指抓住小鼠的颈部,使小鼠的头部向下。这样腹腔中的器官就会自然倒向胸部,防止注射器刺入时损伤大肠、小肠等器官。进针的动作要轻柔,防止刺伤腹部器官。 3.尤其是对于体重较小的小鼠,腹腔注射时针头可以在腹部皮下穿行一小段距离,最好是从腹部一侧进针,穿过腹中线后在腹部的另一侧进入腹腔,注射完药物后,缓缓拔出针头,并轻微旋转针头,防止漏液。 4.小鼠腹腔注射的给药容积一般为5~10ml/kg。 小鼠静脉注射 这也是常见的操作,稍微有点难度,没有指导的话,一开始可能会感觉有点手足无措。但是可以肯定的说,只要掌握了方法,小鼠的尾静脉注射还是很容易的。 操作步骤: 1.首先要固定小鼠,最简单的固定方法就是把小鼠放在盒子里面,让它的尾巴伸在盒盖的外面,用手抓住小鼠尾巴,轻轻往外拽,就可以固定好小鼠了。这种固定方法,小鼠可以在盒子里面活动,固定的也不是很牢固,但是只要你尾静脉注射的手法很熟练,就足以用来注射了。 还有的固定方法就是用一个小的圆筒,最好是金属做的,(可以在当地的铁匠铺,或者买白铁铺里面定做)首先是金属比较结实,而且可以用来固定在铁架台上,方便操作。圆筒的一段有个盖子可以拿下来,盖子中间有个小孔,可以让小鼠的尾巴伸出来(中间的小孔可以用胶布缠一下,防止锐利的边缘割伤小鼠尾巴)。另外一段可以用金属网的结构,网的形状可以做成子弹头的头端形状。网状结构可以让光线透近来,方便小鼠钻进圆筒里面。圆筒的长度约10cm,直径约3~4cm,可以做个系列长度和直径的圆筒,适合不同大小的小鼠。 2.固定好小鼠后就是注射了,一般用一次性的1ml的注射器就可以了,玻璃的1ml的注射器也可以用,针头用4号的就可以了。
奶牛胚胎移植技术 上海交通大学农业与生物学院 朱淑文 一、概述 牛胚胎移植的商业化应用开始于七十年代初期。当时,必须通过手术方法才能采集胚胎,由于奶牛的乳房影响手术的顺利进行,手术后往往还会影响奶牛以后的繁殖性能,因此,胚胎移植主要在肉牛中应用。1976年,一些研究小组报道了应用导管高效采集胚胎的非手术方法。随后,胚胎移植在奶牛中的应用得到了飞速发展。1974年,第一头胚胎移植登记荷斯坦奶牛在美国出生。七十年代后期,胚胎移植(ET)登记荷斯坦奶牛的数量每年以100%以上的速度增长,1980年达到8298头年。进入80年代后,随着非手术采胚法和移植技术的改进以及胚胎冷冻保存技术的发展,每年(ET)登记奶牛的数量在稳步增长,至1990年达到18727头年。截止1991年,美国登记的胚胎移植荷斯坦奶牛总数量已达到142598头。目前,44%的荷斯坦优秀种公牛是由胚胎移植培育的。九十年代以来,胚胎移植在发达国家中的增长速度有所减缓,但是技术含量越来越高,例如体外受精胚胎生产技术、转基因技术以及克隆技术的应用和研究得到加强。近几年来,胚胎移植在亚洲和南美一些国家中增长速度很快。从整个世界范围来看,牛胚胎移植的增长速度仍然很快。 二、胚胎移植技术 (一)体内受精胚的移植 1 超数排卵 在常规胚胎移植技术中,获得大量可用胚胎的主要途径是超数排卵(简称超排),因此,高效率的超排技术是胚胎移植技术能否在生产中推广应用的关键。应用于奶牛的超排激素主要有PMSG(孕马血清促性腺激素)和FSH(促卵胞素)。PMSG尽管只需一次性注射,省时省力,但是半衰期过长,可以导致卵巢的过度刺激以及对排卵、受精和随后的胚胎发育产生不利的影响,因此现在一般已不采用PMSG对奶牛进行超排处理。目前广泛应用于母牛的超排激素是FSH。用于奶牛超排的商品FSH均是从屠宰家畜的脑垂体中提取的,脑垂体不但能够分泌
1 1 范围 本标准规定了绵羊的胚胎生产和移植的供体羊的选择和饲养管理、供体羊的超数排卵及人工授精、手术冲卵技术及胚胎质量鉴定、冻胚的解冻、受体羊的选择及饲养管理、胚胎手术移植技术和妊娠受体羊的饲养管理技术。 本标准适用于秦皇岛地区绵羊的胚胎生产和移植。 2 2 规范性引用文件 下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。 DB 1303/T 098-2000 羊的人工授精技术操作规程 3 3 供体羊的选择和饲养管理 3.1 3.1 供体羊的选择 a)a)体羊品种优良、生产性能好; b)b)传性稳定、谱系清楚; c)c)体质健壮。繁殖机能正常,无遗传和传染性疾病。年龄在2岁至7岁为宜; d)d)具有畜牧部门颁发的种畜禽鉴定合格证书。 3.2 3.2 供体羊的饲养管理 3.2.1 3.2.1 保持饲养环境稳定,饲养环境卫生、干燥、棚舍温度适宜。避免应激反应。 3.2.2 3.2.2 制定合理的供体羊日粮配方,保证正常的营养平衡。 3.2.3 3.2.3 满足供体羊清洁饮水的需要。 4 4 供体羊的超数排卵及人工授精 4.1 4.1 超数排卵 4.1.1 4.1.1 超数排卵的季节和发情周期:绵羊最适超数排卵季节为9月下旬至11月上旬。绵羊的发情周期在15d—17.5d。供体母羊在超数排卵前需观察1—2个完整的发情周期。 4.1.2 4.1.2 用于超数排卵的激素选择 FSH—P(垂体促滤泡素) LH—P(垂体促黄体生成素) ICI80996(氯前列烯醇) 4.1.3 4.1.3 激素剂量(注射总量/只) FSH—P剂量(肌注):120IU—160IU LH—P剂量:根据FSH的注射剂量,肌注100—120IU。 ICI80996:肌注0.08mg/次,注射两次/d。 4.1.4 4.1.4 超数排卵方法 FSH—P 3天注射法 以母羊发情之日作为发情周期的0d,在母羊发情周期的第13d或13.5d(周期大于17.5d的羊在第13.5d)开始,每天早:(6:00—7:00)和晚(18:00—19:00)各注射1次FSH,连续3天,递减注射。 FSH、LH用生理盐水稀释。 在第5、6次注射FSH—P时,同时肌肉注射ICI80996。 确定供体羊发情后立即注射LH。如果FSH—P未注射完供体羊已发情,停止注射FSH—P,立即注射LH。
常见小鼠给药及采血方法 小鼠灌胃 小鼠灌胃方法比较简单,需要关注的只有两点: 一是要保持小鼠的头部和颈部成一直线,方便灌胃针头进入; 二是动作要轻柔,从口角进入,防止损失食道。做的多了自然就熟练了。 具体操作过程如下: 1. 准备灌胃针头。一般可以从市场上面买到,实在没有的话,可以用12号的针头,剪去针尖,用砂纸将头端磨平,也可以用。但是买的灌胃针头的头端用锡或者适宜的方法处理了针头的锐口,自己用砂纸不可能将所有的锐口都磨掉,用这样的针头灌胃,损失小鼠食道的可能性比较大。 2.抓住小鼠,使其头、颈和身体呈一直线。抓小鼠的动作很简单,左手的小指和无名指抓住小鼠的尾巴,另外三个手指抓住小鼠的颈部即可。因为小鼠始终在活动中,若一次抓的感觉不是很顺手,要放开重新抓,不要逞强进行下一步操作。 3. 抓好小鼠就可以灌胃了,一般用1ml的注射器配灌胃针头。灌胃针头从小鼠的嘴角进入,压住舌头,抵住上颚,轻轻向内推进,进入食管后会有一个刺空感,进入食道后就可以推注药液了。(我认为,所谓的灌胃,不必要灌胃针头进入小鼠的胃部,进入食管后就可以推药了,这样对小鼠食道的损伤要小点,特别是要长期灌胃给药的情况下。)当然,灌胃针头也可以再往里面深入一点,防止药液从口中流出。 4. 灌胃容积一般是0.1~0.2ml/10g,最大0.35ml/10g,每只小鼠的灌胃最大容积不超过0.8ml。 小鼠腹腔注射 腹腔注射是常见的给药方式,尤其是在麻醉时。常见的麻醉方法均是麻醉药物腹腔注射。 1. 小鼠腹腔注射可以用1ml的注射器,配合4号针头。 2. 腹腔注射时右手持注射器,左手的小指和无名指抓住小鼠的尾巴,另外三个手指抓住小鼠的颈部,使小鼠的头部向下。这样腹腔中的器官就会自然倒向胸部,防止注射器刺入时损伤大肠、小肠等器官。进针的动作要轻柔,防止刺伤腹部器官。 3. 尤其是对于体重较小的小鼠,腹腔注射时针头可以在腹部皮下穿行一小段距离,最好是从腹部一侧进针,穿过腹中线后在腹部的另一侧进入腹腔,注射完药物后,缓缓拔出针头,并轻微旋转针头,防止漏液。 4. 小鼠腹腔注射的给药容积一般为5~10ml/kg。 小鼠静脉注射
羊的胚胎移植 一、胚胎移植概述 二、胚胎移植原理 三、胚胎移植技术程序 一、胚胎移植概述 1.胚胎移植的发展历史 2.胚胎生物技术的研究意义及其在畜牧生产中的应用 3.胚胎移植目前存在的问题 4.影响胚胎移植的主要因素 5.胚胎移植的经济效益 6.胚胎移植的发展前景 1.1国外胚胎移植发展史 George是世界上第一个提出动物胚胎移植的人。1890年4月,Walter Heape用兔作为实验动物,成功地获得了世界上第一个动物胚胎移植后代。Heape兔胚胎移植的成功,极大的影响着繁殖生物学和畜牧业的发展。1900年,Heape的杰出接班人FHA Marshall和John Hammond总结了他的主要工作内容,提出了哺乳动物性季节的概念,也就是现在所说的发情周期。1911-1913年,奥地利维也纳的Biedl 等进行了兔的胚胎移植实验,但由于战争,直到1922年才报道了其研究结果。虽然他们做了70多个实验,但由于把输卵管的胚胎移植到子宫,结果只有一只受体兔妊娠,这充分证明了胚胎和受体的同步性是非常重要的。1932年和1933年,Warwick,Berry和Horlache第
一次把胚胎移植技术用在绵羊和山羊上,Dr. Berry也因此成为了第一个国际胚胎移植协会先驱奖的获得者。1948年,张明觉用超数排卵技术从2只母兔获得88枚受精卵,给7只受体母兔移植,成功地产出76只小兔,这次试验的成功具有划时代的意义。1950年12月19日,33岁的美国人Elwyn Willed成功地获得了世界上第一头胚胎移植牛犊。60年代初,全部采用的是手术回收胚胎和移植,1964年Mutter 等和1965年Sugie相继报道了非手术移植胚胎获得成功。70年代中期,牛的非手术移植完全取代了手术移植. 1974年,成立了国际胚胎移植协会(IETS ),随后相继成立了美国胚胎移植协会、加拿大胚胎移植协会、欧洲胚胎移植协会 1.2 国内胚胎移植发展史 我国的胚胎移植研究起步较晚,于20世纪70年代初才开始。1973年首先在家兔上获得成功。1974年,中科院遗传所在绵羊胚胎移植上取得成功。1976年郭志勤、谭丽玲等在家兔胚胎和绵羊胚胎低温(100C)保持1天和10天后移植成功。手术法和非手术法牛胚胎移植在1978年和1980年也相继成功。1980年中国农业科学院畜牧所在绵羊胚胎超低温保存后移植产羔。20世纪80年代,胚胎移植进入了实验阶段,掀起了全国的研究高潮,20几个省近30个单位相继开展了胚胎移植研究工作。20世纪90年代初期,我国的胚胎移植工作逐渐进入了生产应用初始阶段。生产应用比较好的地区主要是内蒙古、新疆和黑龙江、北京 1.3 羊的胚胎移植发展历史
一、小鼠腹腔注射: 腹腔注射是常见的给药方式,尤其是在麻醉时。常见的麻醉方法均是麻醉药物腹腔注射。 1. 小鼠腹腔注射可以用 2. 腹腔注射时右手持注射器,左手的小指和无名指抓住小鼠的尾巴,另外三个手指抓住小鼠的颈部,使小鼠的头部向下。这样腹腔中的器官就会自然倒向胸部,防止注射器刺入时损伤大肠、小肠等器官。进针的动作要轻柔,防止刺伤腹部器官。 3. 尤其是对于体重较小的小鼠,腹腔注射时针头可以在腹部皮下穿行一小段距离,最好是从腹部一侧进针,穿过腹中线后在腹部的另一侧进入腹腔,注射完药物后,缓缓拔出针头,并轻微旋转针头,防止漏液。液体外漏的主要原因是抓取小鼠时,腹部过紧而致腹内压过高所致,应该紧抓颈部但使其腹部皮肤松软,此时进针注射,不会外漏。 4. 小鼠腹腔注射的给药容积一般为5~10ml/kg 二、皮下注射给药 将药液推入皮下结缔组织,经毛细血管、淋巴管吸收进入血液循环的过程。作皮下注射常选项背或大腿内侧的皮肤。操作时,常规消毒注射部位皮肤,然后将皮肤提起,注射针头取一钝角角度刺入皮下,把针头轻轻向左右摆动,易摆动则表示已刺入皮下,再轻轻抽吸,如无回血,可缓慢地将药物注入皮下。拔针时左手拇、食指捏住进针部位片刻,以防止药物外漏。注射量约为0.1~0.3ml/10g体重。 三、皮内注射给药 将药液注入皮肤的表皮河真皮之间,观察皮肤血管的通透性变化或皮内反应,接种、过敏实验等一般作皮内注射。先将注射部位的被毛剪掉,局部常规消毒,左手拇指和食指按住皮肤使之绷紧,在两指之间,用结核菌素注射器连接4.5针头穿刺,针头进入皮肤浅层,再向上挑起并梢刺入,将药液注入皮内。注射后皮肤出现一白色小皮丘,而皮肤上的毛孔极为明显。注射量为0.1ml/次。 四、肌肉注射给药 小鼠体积小,肌肉少,很少采用肌肉注射。当给小鼠注射不溶于水而混悬于油或其他溶剂中的药物时,采用肌肉注射。操作时1人固定小鼠,另一人用左手抓住小鼠的1条后肢,右手拿注射器。将注射器与半腱肌呈90°角迅速插入1/4,注入药液,用药量不超0.1ml/10g体重。 五、静脉注射给药
转基因、基因敲入/敲除动物技术已经成为现代生命科学基础研究和药物研发领域不可或缺的重要技术,该技术从上世纪七八十年代诞生以来,已有近四十年的历史,经典技术如DNA原核显微注射、胚胎干细胞显微注射技术一直以来经久不衰,并逐渐从基 础研究实验室转向商业模式,成为一项高度标准化的新兴产业 一、技术介绍与研究进展 转基因、基因敲入/敲除动物技术已经成为现代生命科学基础研究和药物研发领域不可或缺的重要技术,该技术从上世纪七八十年代诞生 以来,至今已有近四十年的历史,经典技术如DNA原核显微注射、胚胎干细胞显微注射技术一直以来经久不衰,在小鼠模型构建方面日趋完善,并且如同剪切酶和抗体等 常规分子生物学试剂的制备技术一样,逐渐从基础研究实验室转向商业模式,成为一项高度标准化的新兴产业,催生了数以百计的创新药物和数以千计的优秀文章。尽管 如此,传统技术仍然存在一些难以克服的缺陷,如步骤繁琐、周期漫长、成功率低、费用高昂等,而ZFN和TALEN等新技术的出现,或有可能将这一局面彻底改变。 二、同源重组技术原理 基因敲除鼠技术是上世纪80年代中后期基于DNA同源重组的原理发展起来的,Capecchi和Smithies在1987年根据同源重组(homologous recombination)的原理,首次实现了ES的外源基因的定点整合(targeted integration),这一技术称为"基 因打靶"(gene targeting)或"基因敲除"(gene knockout),利用这种ES的显微注射就可以制作出基因敲出小鼠(KO Mice: knockout mice);由于这一工作,Capecchi 和Smithies于2007年与Evans分享了诺贝尔医学奖。 同源重组(homologous recombination)定义:是指发生在姐妹染色单体(sister chromatin) 之间或同一染色体上含有同源序列的DNA分子之间或分子之内的重新组合。在基因敲除小鼠制作过程中,需要针对目的基因两端特异性片段设计带有相同片段的
《动物遗传育种与繁殖专论》 课程作业 胚胎移植技术在畜牧业中的应用 姓名: 学号:
胚胎移植技术在畜牧业中的应用 畜牧业发展水平占农业的比重是衡量一个国家和地区现代化水平的重要标志,近年来,畜牧业已成为我国农业发展的重心.胚胎移植技术也称受精卵移植技术,就是将良种母畜配种后的早期胚胎取出,移植到同种的生理状态相同的母畜体内,使之继续发育成为新个体,所以该项技术又被称为“借腹怀胎”。胚胎工程技术是胚胎移植技术发展到一定程度而出现的名词, 是由发育工程演变而来的。由于胚胎移植技术可最大限度的发挥优秀母畜在品种改良和育种中的作用,同时它又是体外受精、转基因、体细胞核移植等胚胎工程的基础性环节,因此,胚胎移植技术被誉为家畜繁殖技术的第二次革命。 胚胎工程技术根据其发展现状包括以下9类:胚胎移植技术;胚胎冷冻保存技术;胚胎分割技术;试管动物技术(体外受精技术);性别控制技术,即XY精子分离和胚胎性别鉴定技术;转基因动物技术;动物克隆技术(细胞核移植技术);胚胎干细胞技术;胚胎嵌合技术。目前, 前5种技术已在生产实践中得到不同程度的应用,但应用较多的是前2种技术, 其他几种技术由于设备投入成本较大、成功率较低, 尚处于实验室向生产转化阶段。 胚胎移植技术可使引进的种畜在较短时间内快速纯种繁殖,成为大群体,满足牛羊业迅猛发展的需要。同时,牛、羊业的快速发展和这种市场化发展的需求,使胚胎移植技术受到更多研究者和生产者的
高度重视,进而促进了胚胎移植技术快速发展和商业化。20世纪90年代后期,胚胎移植技术在畜牧生产中得到应用推广,同时胚胎移植技术又解决了畜牧业发展中的一些难点问题。 胚胎移植技术是继人工授精之后发展起来的繁殖高新技术, 目前已成为扩大优秀家畜遗传资源的主要手段, 有的称作MOET技术( 超数排卵与胚胎移植技术)。作为家畜育种的重要手段之一, 自20 世纪50年代初第一头胚胎移植牛在美国诞生以来, 胚胎移植技术飞速发展。据不完全统计, 全世界目前年产胚胎移植牛超过35万头, 美国、法国等发达国家每年参加后裔测定的青年公牛的80%来自胚胎移植所产的后代。20世纪80年代后期, 我国在生产中开始应用牛、羊胚胎移植技术, 近几年该技术在全国得到迅速发展。本实验室1990年奶牛新鲜胚移植妊娠率达62.2%, 达76%。在6省区规模化生产中, 绵羊和山羊的移植妊娠率在60%左右, 达76.8%。根据国际胚胎协会的统计, 20多年来,进行胚胎移植的动物数量和种类每年都在增加, 胚胎移植已经成为畜牧业中最活跃的产业。 胚胎移植技术在畜牧业发展中的作用主要体现在促进家畜的遗传改良,充分发挥优良母畜的繁殖潜力,提高繁殖效率.优良后代的增加,既取决于种公畜,也有赖于优良母畜。尤其是生产性能取决于父母双方,如果说人工授精技术的出现使公畜的繁殖潜力得到最大限度地发挥的话,那么胚移技术的出现可以使母畜的繁殖潜力得以充分发挥,从而有效促进家畜的遗传改良。更为重要的是,如果超数排卵时利用优良公畜冻精配种优良母畜(供体),然后利用采出的胚胎进行
肉牛胚胎移植技术 胚胎移植又称受精卵移植,是将l头良种母畜(供体)配种后的早期胚胎取出,移植到另一头同种的生理状态相同的母畜(受体)的子宫内,使之继续发育成为个体,所以也叫人工授胎或“借腹怀胎”。 (一)胚胎移植的意义 1.充分发挥优良母畜的繁殖潜力,提高繁殖效率由于牛的胚胎移植可以利用非手术法反复从一头供体中收集胚胎,所以繁殖率得以更加提高。据报道国外已能做到从一头供体牛一年获得40~50头犊牛。 2.加速品种改良,扩大良种畜群利用超数排卵、胚胎移植技术能使母畜排出较多卵子,山东永丰牧业同时解除其妊娠胚胎的职能,这样一头良种母牛就可产生多量的后代。使一头优良母畜在育种工作中的意义大为提高。 3.诱发肉牛怀双胎,提高生产效率在肉牛业中,有一种由胚胎移植技术演化出来的所谓“诱发双胎”的方法,即向已配种的母畜(排卵的对侧子宫角)移植一个胚胎,这样配种后未受胎的母畜可能因接受移植的胚胎而妊娠,而已受精的母畜由于增加了一个外来胚胎而可能怀双胎o 4.代替种畜的引进,保存品种资源通过胚胎的运输代替以往的种牛进出Vl山东永丰牧业,大大节约了购买和运输种牛的费用。同时可用保存胚胎的方式解决牛品种资源保存的问题。 (二)胚胎移植的操作原则 1.胚胎移植前后所处环境的一致性即胚胎移植后的生活环境和胚胎的发育阶段相适应山东永丰牧业。包括生理上的一致性(即供体和受体在发情时问上的一致性)和解剖位上的一致性(即移植后的胚胎与移植前所处的空问环境的相似性)以及种属一致性(即供体与受体应属同一物种,https://www.doczj.com/doc/c05414116.html,但并不排除种间移植成功的可能性)。 2.胚胎收集期限胚胎收集和移植的期限(胚胎的日龄)不能超过周期黄体的寿命,最迟要在周期黄体退化之前数日进行移植。通常是在供体发情配种后3~8日内收集和移植胚胎。 3.在全部操作过程中,胚胎不应受到任何不良因素(物理的、化学的、微生物的)的影响而危及生命力。移植的胚胎必须经鉴定并认为是发育正常者。 (三)胚胎移植技术的基本程序胚胎移植的基本程序包括:供授体母牛的同期发情、供体母牛的超数排卵、供体母牛的配种、胚胎的收集、山东永丰牧业胚胎的检查、胚胎的保存和移植等程序。如图3—4所示。关于超排和同期发情处理在前面已有叙述,下面仅介绍其余部分。 1.供体母牛的配种经超数排卵的供体母牛,为了使排出的卵子有较多的受精机会,一般在发情后输精2~3次,每次间隔8~12 h。 2.胚胎的收集 从供体母牛收集胚胎的方法,可采用手术法和非手术法两种。手术法是按外科剖腹术的要求进行山东永丰牧业,手术部位在右肋部或腹下乳房至脐部之问的白线切开。 https://www.doczj.com/doc/c05414116.html,伸进手指找到输卵管和子宫角,引出供。母体十畜同期发情处理受体母畜 辛辛辛辛
碱法提取小鼠总DNA及基因鉴定: 一、实验器材:加样枪(1ml、200ul、20ul、10ul)、枪头(大中小一套)、EP管(20ul、1.5ml、 10ml)、试管架、浮标、温度计、胶布、手套、记号笔、锥形瓶、称量匙、冰盒 二、实验试剂:A液、B液、引物、mix、双蒸水、三蒸水、琼脂糖、TBE(5x、1x、回收液)、 核苷酸染料、Marker 三、母液配置: 1.10M NaOH:NaOH 40g加双蒸水至90ml,待NaOH完全溶解冷却后定容至100ml 2.0.5M EDTA:EDTA.Na2盐18.61g, NaOH 1.5g, 加双蒸水至80ml,逐滴加入10M NaOH 至EDTA完全溶解后加双蒸水定容至100ml 3.1M TrisHCl(pH8.0):Tris碱12.1g,加水至70ml,边搅拌边加入浓盐酸4ml,然后 边逐滴加入1M HCl边测PH值,直至PH升至8.0(+\-0.05),定容至100ml(pH=8.8 的TrisHCl中边加入浓盐酸边测PH值至PH=8.0(+\-0.05)为止) 四、实验步骤: 1.剪取鼠尾(约芝麻大小)储存于-20度冰箱(-20度冰箱,主要是防止DNA降解,4度不 行) 2.提取DNA: 1)配置工作液——20ml体系液:50ul 10M NaOH 加双蒸水至20ml 8ul 0.5M EDTA B液:800ul 1M TrisHCl(pH8.0)加双蒸水至20ml 2)加150ulA液(液体应完全浸没标本),95度水浴锅煮1.5h(将EP管插入浮标 中后用胶布缠好防止EP管在加热过程中爆开) 3)加150ulB液,混匀(上下颠倒3-5下) 4)12000r/min 4度离心5分钟(可储存于-20度冰箱) 3.PCR(冰上操作):P1 0.5ul(P为AC3I,G为AAA) 1)配置PCR体系——15ul体系P2 0.5ul Mix 7.5ul 三蒸水4.5ul DNA 2ul 2)加2ul上述离心后的上清液至PCR体系,瞬离 3)PCR仪扩增,参数设定:预变性:94度——3min 变性:94度——30s 退火:55度——30s 30个循环 延伸:72度——24s 72度——5min 4度——∞ 4.琼脂糖凝胶电泳: 1)制胶——2%琼脂糖凝胶配方: 总体积(ml)20 30 40 50 60 120 琼脂糖(g)0.4 0.6 0.8 1 1.2 2.4 TBE 1x(ml)20 30 40 50 60 120 Tris-base 13.6g TBE 5x配方:硼酸 6.56g EDTA 0.73g
课题-基因敲除小鼠的pcr鉴定
一、技术介绍与研究进展 转基因、基因敲入/敲除动物技术已经成为现代生命科学基础研究和药物研发领域不可或缺的重要技术,该技术从上世纪七八十年代诞生以来,至今已有近四十年的历史,经典技术如DNA原核显微注射、胚胎干细胞显微注射技术一直以来经久不衰,在小鼠模型构建方面日趋完善,并且如同剪切酶和抗体等常规分子生物学试剂的制备技术一样,逐渐从基础研究实验室转向商业模式,成为一项高度标准化的新兴产业,催生了数以百计的创新药物和数以千计的优秀文章。尽管如此,传统技术仍然存在一些难以克服的缺陷,如步骤繁琐、周期漫长、成功率低、费用高昂等,而ZFN和TALEN 等新技术的出现,或有可能将这一局面彻底改变。 二、同源重组技术原理 基因敲除鼠技术是上世纪80年代中后期基于DNA同源重组的原理发展起来的,Capecchi和Smithies在1987年根据同源重组(homologous recombination)的原理,首次实现了ES的外源基因的定点整合(targeted integration),这一技术称为"基因打靶"(gene targeting)或"基因敲除"
(gene knockout),利用这种ES的显微注射就可以制作出基因敲出小鼠(KO Mice: knockout mice);由于这一工作,Capecchi和Smithies于2007年与Evans分享了诺贝尔医学奖。 同源重组(homologous recombination)定义:是指发生在姐妹染色单体(sister chromatin) 之间或同一染色体上含有同源序列的DNA分子之间或分子之内的重新组合。在基因敲除小鼠制作过程中,需要针对目的基因两端特异性片段设计带有相同片段的重组载体,将重组载体导入到胚胎干细胞后外源的重组载体与胚胎干细胞中相同的片段会发生同源重组,如图1所示: 图1.基因敲除鼠制作同源重组原理示意图 三、制作流程
2000只肉用种羊胚胎移植扩繁养殖基地扩建可行性研究报告 此文档word版本下载后可任意编辑修改
目录 第一章总论 (3) 第二章项目建设的意义及必要性 (11) 第三章项目选址及建设条件 (15) 第四章建设方案 (18) 第五章环境保护及节能减排措施 (24) 第六章项目投资估算与资金来源 (26) 第七章效益分析 (28)
第一章总论 1.1 项目单位基本情况 1.1.1 概况 项目实施主体:某某市某某生物工程有限责任公司 项目服务对象:全市及周边旗县的农牧民 发展历程:某某生物工程有限责任公司,始建于2003年,公司占地16亩,建筑面积2000㎡,饲草料基地200亩。公司设董事会、理事会、监事会,下设技术服务部,经营服务部,综合管理部,是某某市第一家畜牧业产业化民营企业。内设人工采精、授精,胚胎移植、兽医防疫等多功能配套设施。公司现有员工50人,高级职称2人,中级职称4人;其中:经济师、会计师各1人。同年申请办理了相关手续证书。是我区仅有的几个手续完备,技术专业,较具规模的良种羊扩繁基地之一。原自治区党委书记储波、原政府主席杨晶,盟市各级领导曾多次到我公司视察、调研、指导工作。对我公司所取得的成绩给予充分的肯定。 公司初创时,聘请国家级胚胎移植专家张立博士为技术总顾问,同内蒙古家畜改良站、内蒙古大学、内蒙古农业大学等院校、研究机构建立了稳定的技术合作关系。引进了“多赛特、特克赛尔、萨福克”种公羊4只,种母羊16只,受体羊100只。利用“胚胎移植技术”实现良种羊的迅速扩繁。目前,公司拥有种公羊120只,种母羊508只,受体羊1000多只。几年来,累计扩繁种公羊800多只。全部投放到某某市各乡镇和周边旗县,开创了农民“以养促种,以
基因敲除小鼠的PCR鉴定 一、实验目的: 通过PCR扩增程序及琼脂糖凝胶电泳方法鉴定凝血因子IX基因敲除小鼠的基因型。 二、实验原理: 真核生物的一切有核细胞(包括培养细胞)都能用来制备基因DNA。真核生物的DNA是以染色体的形式存在于细胞核内,因此,制备DNA的原则是既要将DNA与蛋白质、脂类和糖类等分离,又要保持DNA分子的完整。提取DNA的一般过程是将分散好的组织细胞在含SDS(十二烷基硫酸钠)和蛋白酶K的溶液中消化分解蛋白质,再用酚和氯仿/异戊醇抽提分离蛋白质,得到的DNA溶液经乙醇沉淀使DNA从溶液中析出。 1.PCR原理: PCR技术的基本原理类似于DNA的天然复制过程,其特异性依赖于与靶序列两端互补的寡核苷酸引物。PCR由变性-退火-延伸三个基本反应步骤构成: 1) 模板DNA的变性:模板DNA经加热至93℃左右一定时间后,使模板DNA双链或经PCR扩增形成的双链DNA解离,使之成为单链,以便它与引物结合,为下轮反应作准备; 2) 模板DNA与引物的退火(复性):模板DNA经加热变性成单链后,温度降至55℃左右,引物与模板DNA单链的互补序列配对结合; 3) 引物的延伸:DNA模板-引物结合物在TaqDNA聚合酶的作用下,以dNTP为反应原料,靶序列为模板,按碱基配对与半保留复制原理,合成一条新的与模板DNA 链互补的半保留复制链重复循环变性-退火-延伸三过程,就可获得更多的“半保留复制链”,而且这种新链又可成为下次循环的模板。每完成一个循环需2~4分钟,2~3小时就能将待扩目的基因扩增放大几百万倍 2.琼脂糖凝胶电泳原理: 在pH8.0~8.3的缓冲液中,核酸分子带负电荷,向正极移动。由于不同大小和构象的核酸分子电荷密度大致相同,因此在自由泳动时,各种核酸分子的迁移率相似,无法分开。然而,在浓度适当的凝胶中,由于分子筛效应,使大小和构象不同的核酸迁移率出现差异,从而把它们分开。核酸在凝胶中的迁移率取决于其分子大小、高级结构、胶浓度和电场强度,与分子的碱基组成及电泳温度(4~30℃之间)无明显关系。一般说,同样构象的分子迁移率与分子量对数及胶浓度成反比,与电场强度(小于5V/cm)成正比。 三、实验操作 1.获取鼠尾组织 剪鼠尾0.5cm置于试管中,加入500ul裂解液和10ul蛋白酶K(20mg/ml),55℃水浴过夜,至鼠尾溶解 2.提取基因组DNA 1) 试管中加入300ul饱和NaCl,充分混匀,12500rpm 离心20min
腹腔注射 【定义】:腹腔注射是将药物注入胃肠道浆膜以外,腹膜以内.其吸收速度较快(2小时左右)。 【适应症】:人不常应用,有时可以作为特殊治疗手段,如多巴胺、速尿联合腹腔注射治疗肝硬化顽固性腹水。当猪只较小而难以寻找耳静脉时,或天冷皮肤血管收缩或猪处于贫血消瘦情况血管不明显时,可以通过腹腔注射补液.以防脱水死亡,因下痢脱水1/3以上即有生命危险. 【操作步骤】:小鼠腹腔注射 腹腔注射是常见的给药方式,尤其是在麻醉时。常见的麻醉方法均是麻醉药物腹腔注射。 1. 小鼠腹腔注射可以用1ml的注射器,配合4号针头。 2. 腹腔注射时右手持注射器,左手的小指和无名指抓住小鼠的尾巴,另外三个手指抓住小鼠的颈部,使小鼠的头部向下。这样腹腔中的器官就会自然倒向胸部,防止注射器刺入时损伤大肠、小肠等器官。进针的动作要轻柔,防止刺伤腹部器官。 3. 尤其是对于体重较小的小鼠,腹腔注射时针头可以在腹部皮下穿行一小段距离,最好是从腹部一侧进针,穿过腹中线后在腹部的另一侧进入腹腔,注射完药物后,缓缓拔出针头,并轻微旋转针头,防止漏液。 【禁忌】:⒈忌不等渗液体,如50%葡萄糖。 ⒉药液须加温至体温 ⒊选用无刺激性药液,忌葡萄糖酸钙等。 ⒋油乳剂,有沉淀,半固体药物不宜腹腔注射。 【优点】:操作方便,任何动物不论大小都可腹腔注射。腹膜面积大.密布血管和淋巴管,吸收能力特强,每小时可吸收占动物体重3%~8 %的液体.且腹腔补液时间短,速度快大号针头2分钟即可输入500毫升药液,还不考虑心脏超负荷。【其他声音】:某些兽医认为腹腔注射液不宜过大,20KG的猪20-30ml,30kg 的猪40ml,50kg的猪50ml。 【个人体会】:一般情况下,输入体重5%的适宜液体是安全可靠的。
一、技术介绍与研究进展 转基因、基因敲入/敲除动物技术已经成为现代生命科学基础研究和药物研发领域不可或缺的重要技术,该技术从上世纪七八十年代诞生以来,至今已有近四十年的历史,经典技术如DNA原核显微注射、胚胎干细胞显微注射技术一直以来经久不衰,在小鼠模型构建方面日趋完善,并且如同剪切酶和抗体等常规分子生物学试剂的制备技术一样,逐渐从基础研究实验室转向商业模式,成为一项高度标准化的新兴产业,催生了数以百计的创新药物和数以千计的优秀文章。尽管如此,传统技术仍然存在一些难以克服的缺陷,如步骤繁琐、周期漫长、成功率低、费用高昂等,而ZFN和TALEN 等新技术的出现,或有可能将这一局面彻底改变。 二、同源重组技术原理 基因敲除鼠技术是上世纪80年代中后期基于DNA同源重组的原理发展起来的,Capecchi和Smithies在1987年根据同源重组(homologous recombination)的原理,首次实现了ES的外源基因的定点整合(targeted integration),这一技术称为"基因打靶"(gene targeting)或"基因敲除"(gene knockout),
利用这种ES的显微注射就可以制作出基因敲出小鼠(KO Mice: knockout mice);由于这一工作,Capecchi和Smithies于2007年与Evans分享了诺贝尔医学奖。 同源重组(homologous recombination)定义:是指发生在姐妹染色单体(sister chromatin) 之间或同一染色体上含有同源序列的DNA分子之间或分子之内的重新组合。在基因敲除小鼠制作过程中,需要针对目的基因两端特异性片段设计带有相同片段的重组载体,将重组载体导入到胚胎干细胞后外源的重组载体与胚胎干细胞中相同的片段会发生同源重组,如图1所示: 图1.基因敲除鼠制作同源重组原理示意图 三、制作流程
一次性使用胚胎移植导管 适用范围:与注射器配合,经阴道向子宫内转移经过体外受精(IVF)的胚胎或受精卵用。 1.1 产品型号 表1一次性使用胚胎移植导管尺寸及公差
1.2 划分说明 XXXXX –d –L XXXXX:表示胚胎移植导管(PTYZ/PTYZ1) d:一次性使用胚胎移植导管外径(F)(1F=0.333mm) L:一次性使用胚胎移植导管长度(cm) 1.3 结构组成 一次性使用胚胎移植导管结构如图1所示。PTYZ型由引导导管、移植管和可塑型的不锈钢内芯组成;PTYZ1型由引导导管、移植管和标记环组成。 引导导管管材:PTYZ-d-L为:医用聚氨酯,针座为ABS;PTYZ1-d-L为:聚醚-聚酰胺共聚物,针座为ABS,标记环:为医用硅胶。 移植管:由304不锈钢管、聚氨酯管和ABS针座组成。 可塑型的不锈钢内芯:由304不锈钢丝和ABS手柄组成。 针座和导管的连接为机械螺旋拧压方法。 PTYZ-3-23/ PTYZ-5-23
PTYZ1-3-23/ PTYZ1-5-23 图1一次性使用胚胎移植导管示意图 2.1 尺寸 一次性使用胚胎移植导管尺寸及公差应符合表1的规定。 2.2 外观 外表面应清洁无杂质,不应有加工缺陷和表面缺陷,末端圆滑、无毛刺。 2.3 物理性能 2.3.1 断裂力 管材的断裂力:直径<1.15mm的管材最小断裂力为5N,≥1.15mm ~ <1.85mm 的管材最小断裂力为10N,≥1.85mm管材最小断裂力为15N。 2.3.2 标记线应清晰可见。 2.3.3 接头 2.3.3.1 移植管的管座头端与引导导管的接头应相匹配,连接后无明显摆动。 2.3.3.2 移植管的接头应符合GB/T 1962.2-2001的要求。 2.3.4 无泄漏 移植管的针座和导管连接部分应无泄漏现象。 2.3.5 耐腐蚀性:一次性使用胚胎移植导管中的不锈钢管和不锈钢内芯不应有腐蚀痕迹。 2.4 化学性能:(除金属部件外)
PCR方法在ApoE基因敲除小鼠基因型鉴定中的应用 摘要目的为ApoE基因敲除鼠探索快速、简单的基因型PCR检测方法。方法设计两对引物扩增野生型ApoE基因和ApoE缺陷突变基因的DNA片段,用PCR仪梯度方案测试最佳退火温度,然后用PCR鉴定方案检测小鼠基因型并将所得基因型结果与已经过经典的Southern blot方法检测得到的基因型结果比较。结果野生型仅在155 bp处有一条条带,突变纯舍子仅在245 bp处有一条条带,杂合子则在155和245bp处出现两条条带。用PCR方法获得的ApoE基因分析结果与经典的Southern blot方法获得的结果完全一致。结论用PCR方法分析ApoE基因敲除鼠的基因型具有快速、简单、廉价和适用的特点。 关键词聚合酶链反应基因型基因打靶载脂蛋白E Genotype identification of ApoE Gene Knockout Mice with Polymerase Chain Reaction Objective This study was to explore a simple and quick polymerase chain reaction(PCR)method for genotyping of ApoE knockout mice.Method Two pairs of primers were designed to amplify genomic DNA fragment of wild-type ApoE gene and the same region on ApoE targeting veceor respectively.A gradient PCR strategy was used to test the best annealing temperature. Results A 155bp band was found in wild-type ApoE mice,a 245 bp band in homozygous mutated ApoE mice and both bands in hetemzygous mice.The genotyping results were completely coincided with those from typical Southern blot. Conclusion PCR is a simple,fast and practical method for the genotyping of ApoE gene knockout mice. Key words Poiymerase Chain Reaction genotype gene targeting ApoE 载脂蛋白(apolipoprotein,ApoE)是清除乳糜微粒和极低密度脂蛋白的受体的配体,因此,缺乏ApoE则会导致血液循环中富含胆同醇的物质积累而更加容易引起动脉粥样硬化
动物胚胎移植技术
摘要 胚胎移植又称受精卵移植,是把一头雌性动物的早期胚胎从输卵管或子宫内冲洗出来,移植到另一头雌性动物的输卵管或是子宫内,使之继续发育成新个体的技术。 动物胚胎移植主要是通过对优良供体母畜作同期排卵处理和体内胚胎生产或体外人工授精(IVF)的方法,以大量获得优良的动物胚胎后再将其移植给普通代孕受体母牛进行快速繁殖优良动物的生物技术。胚胎移植技术主要用于快速扩大优秀种公牛和核心母牛的数量。尽管单个胚胎的生产成本较高,但由于种公牛和种母牛较高的经济价值和社会价值,以及利用胚胎移植在育种方面可以获得同胞或同卵双生牛进行后裔测定等优势,因此,该技术在种公牛的选育和优质核心母牛群的培育以及加快育种步伐方面均具有极大的优越性。 本论文将对动物胚胎技术作比较全面的阐述,使大家对动物胚胎技术有一个比较全面的认识。 关键词:供受体超数排卵同期发情胚胎回收胚胎检查胚胎移植
1.1 发情后生殖器官的孕向发育 家畜在发情后生殖器官会发生一系列变化,如:卵巢中功能性黄体的形成,孕酮的分泌和维持,子宫内膜组织的增生和分泌机能的增强,以及其他生理生化的特异现象。这些变化都为胚胎的生存和发育创造了适宜的条件,为妊娠作准备。 配种受孕后的动物其生殖系统朝着妊娠的方向继续发生变化以适应胚胎发育的需要,如黄体的持续存在以及孕酮的分泌和维持,子宫内膜的继续发育。而未受孕的动物其生殖系统会退回到发情前状态。 发情供体和受体发情周期的同期化程度前后不超过一天,否则移植成功率就会降低,甚至移植失败 因此发情后或交配刺激后雌性动物生殖器官的孕向变化是进行胚胎移植的主要生理学基础。 1.2 早期胚胎的游离状态 胚胎在发育的早期有相当一段时间是游离存在于子宫内的,和子宫黏膜没有建立紧密联系,其发育主要靠自身贮存的养分。这样,早期的胚胎容易从生殖道中取出,而且在离体情况下,可短期培养,易存活。 早期胚胎处于游离状态是能够进行胚胎移植技术的基础 1.3 子宫对早期胚胎的免疫耐受性 1.4 胚胎遗传物质的稳定性 在同一物种之内进行胚胎移植不会产生排斥现象;同时,受体对胚胎不产生遗传上的影响,不会改变新个体的遗传特性,也不会减弱起优良性状在出生后的表现程度。
小鼠基因组提取与基因型鉴定 一.小鼠基因组提取 1.试剂与纯化柱 2.方法 2.1 剪0.4- 0.6 CM鼠尾,切成小块,装进1.5mlEP管中,加300ul 裂解 液.(自配的裂解液,配方见下表) 2.2 加入10ul蛋白酶K,充分混匀,56℃过夜(约16个小时),或加入30ul蛋白 酶K,充分混匀,56℃2h。 2.3 尾巴完全裂解后,取出,充分混匀,直至混液成均匀且无结块,向管内 加入50ul Buffer AL,充分混匀。然后加入200ul无水乙醇,充分混匀 (用手上下颠倒混匀,动作不宜过猛,防止DNA断裂)。 2.4 将上述混合液加入到装有2ml收集管的柱子中,12000rpm离心1min,倒 掉废液,将柱子放回收集管。 2.5 向柱子中加入250ul Buffer AW1,静置2-3min,12000rpm离心1min,倒 掉废液,将柱子放回收集管。 2.6 向柱子中加入250ul Buffer AW2,静置2-3min,12000rpm离心1min,倒 掉废液,空离2min。注意:此步拿柱子时不要碰到收集管中的液体。2.7 将柱子放到一个干净的1.5ml离心管中,开口放15min左右,(残留的液
体蒸发干,残留的乙醇对PCR有影响))(有条件的可放在安全柜中通风吹干10-15min) 2.8 向柱子中心慢慢滴加200ul无菌去离子水。室温静置3min,12000rpm离 心2min,为增加基因组DNA的回收率,可将离心得到的溶液再加入吸 附柱中,室温放置2min,12000prm离心2min。 小鼠基因组裂解液的配制(1000ml为例) 二.小鼠基因型鉴定 1. 基因型鉴定方法:采用PCR检测方法,以确定小鼠为纯合子/杂合子/野生型1.1引物 引物对及扩增片段大小