
植物蛋白质提取方法总汇 一、植物组织蛋白质提取方法 1、根据样品重量(1g样品加入3.5ml提取液,可根据材料不同适当加入),准备提取液放在冰上。 2、把样品放在研钵中用液氮研磨,研磨后加入提取液中在冰上静置(3-4小时)。 3、用离心机离心8000rpm40min4℃或11100rpm20min4℃ 4、提取上清液,样品制备完成。蛋白质提取液:300ml 1、1Mtris-HCl(PH8) 45ml 2、甘油(Glycerol)75ml 3、聚乙烯吡咯烷酮(Polyvinylpolypyrrordone)6g这种方法针对SDS-PAGE,垂直板电泳! 二、植物组织蛋白质提取方法 氯醋酸—丙酮沉淀法 1、在液氮中研磨叶片 2、加入样品体积3倍的提取液在-20℃的条件下过夜,然后离心(4℃8000rpm以上1小时)弃上清。 3、加入等体积的冰浴丙酮(含0.07%的β-巯基乙醇),摇匀后离心(4℃8000rpm以上1小时),然后真空干燥沉淀,备用。 4、上样前加入裂解液,室温放置30分钟,使蛋白充分溶于裂解液中,然后离心(15℃8000rpm 以上1小时或更长时间以没有沉淀为标准),可临时保存在4℃待用。 5、用Brandford法定量蛋白,然后可分装放入-80℃备用。 药品:提取液:含10%TCA和0.07%的β-巯基乙醇的丙酮。裂解液:2.7g尿素0.2gCHAPS 溶于3ml灭菌的去离子水中(终体积为5ml),使用前再加入1M的DTT65ul/ml。 这种方法针对双向电泳,杂质少,离子浓度小的特点!当然单向电泳也同样适用,只是电泳的条带会减少! 三、组织:肠黏膜 目的:WESTERN BLOT检测凋亡相关蛋白的表达 应用TRIPURE提取蛋白质步骤: 含蛋白质上清液中加入异丙醇:(1.5ml每1mlTRIPURE用量) 倒转混匀,置室温10min
蛋白质提取与制备蛋白质种类很多,性质上的差异很大,既或是同类蛋白质,因选用材料不同,使用方法差别也很大,且又处于不同的体系中,因此不可能有一个固定的程序适用各类蛋白质的分离。但多数分离工作中的关键部分基本手段还是共同的,大部分蛋白质均可溶于水、稀盐、稀酸或稀碱溶液中,少数与脂类结合的蛋白质溶于乙醇、丙酮及丁醇等有机溶剂中。因此可采用不同溶剂提取、分离及纯化蛋白质和酶。 蛋白质与酶在不同溶剂中溶解度的差异,主要取决于蛋白分子中非极性疏水基团与极性亲水基团的比例,其次取决于这些基团的排列和偶极矩。故分子结构性质是不同蛋白质溶解差异的内因。温度、pH、离子强度等是影响蛋白质溶解度的外界条件。提取蛋白质时常根据这些内外因素综合加以利用。将细胞内蛋白质提取出来。并与其它不需要的物质分开。但动物材料中的蛋白质有些可溶性的形式存在于体液(如血浆、消化硫等)中,可以不必经过提取直接进行分离。蛋白质中的角蛋白、胶原及丝蛋白等不溶性蛋白质,只需要适当的溶剂洗去可溶性的伴随物,如脂类、糖类以及其他可溶性蛋白质,最后剩下的就是不溶性蛋白质。这些蛋白质经细胞破碎后,用水、稀盐酸及缓冲液等适当溶剂,将蛋白质溶解出来,再用离心法除去不溶物,即得粗提取液。水适用于白蛋白类蛋白质的抽提。如果抽提物的pH用适当缓冲液控制时,共稳定性及溶解度均能增加。如球蛋白类能溶于稀盐溶液中,脂蛋白可用 稀的去垢剂溶液如十二烷基硫酸钠、洋地黄皂苷(Digitonin)溶液或有机溶剂来抽提。其它不溶于水的蛋白质通常用稀碱溶液抽提。 蛋白质类别和溶解性质 白蛋白和球蛋白: 溶于水及稀盐、稀酸、稀碱溶液,可被50%饱和度硫酸铵析出。真球蛋白 : 一般在等电点时不溶于水,但加入少量的盐、酸、碱则可溶解。拟球蛋白: 溶于水,可为50%饱和度硫酸铵析出 醇溶蛋白: 溶于70~80%乙醇中,不溶于水及无水乙醇 壳蛋白: 在等电点不溶于水,也不溶于稀盐酸,易溶于稀酸、稀碱溶液 精蛋白: 溶于水和稀酸,易在稀氨水中沉淀 组蛋白: 溶于水和稀酸,易在稀氨水中沉淀 硬蛋白质: 不溶于水、盐、稀酸及稀碱 缀合蛋白(包括磷蛋白、粘蛋白、糖蛋白、核蛋白、脂蛋白、血红蛋白、金属蛋白、黄素蛋白和氮苯蛋白等) : 此类蛋白质溶解性质随蛋白质与非蛋白质结合部分的不同而异,除脂蛋白外,一般可溶于稀酸、稀碱及盐溶液中,脂蛋白如脂肪部分露于外,则脂溶性占优势,如脂肪部分被包围于分子之中,则水溶性占优势。 蛋白质的制备是一项十分细致的工作。涉及物理学、化学和生物学的知识很广。近年来虽然有了不改进,但其主要原理仍不外乎两个方面: 一是利用混合物中几个组分分配率的差别,把它们分配于可用机械方法分离的两个或几个物相中,如盐析、有机溶剂提取、层析和结晶等; 二是将混合物置于单一物相中,通过物理力场的作用使各组分分配于不同区域而达到分离的目的,如电泳、超离心、超滤等。由于蛋白质不能溶化,也不能蒸发,所能分配的物相只限于固相和液相,并在这两相间互相交替进行分离纯化。 制备方法可按照分子大小、形状、带电性质及溶解度等主要因素进行分类。按分子大小和形态
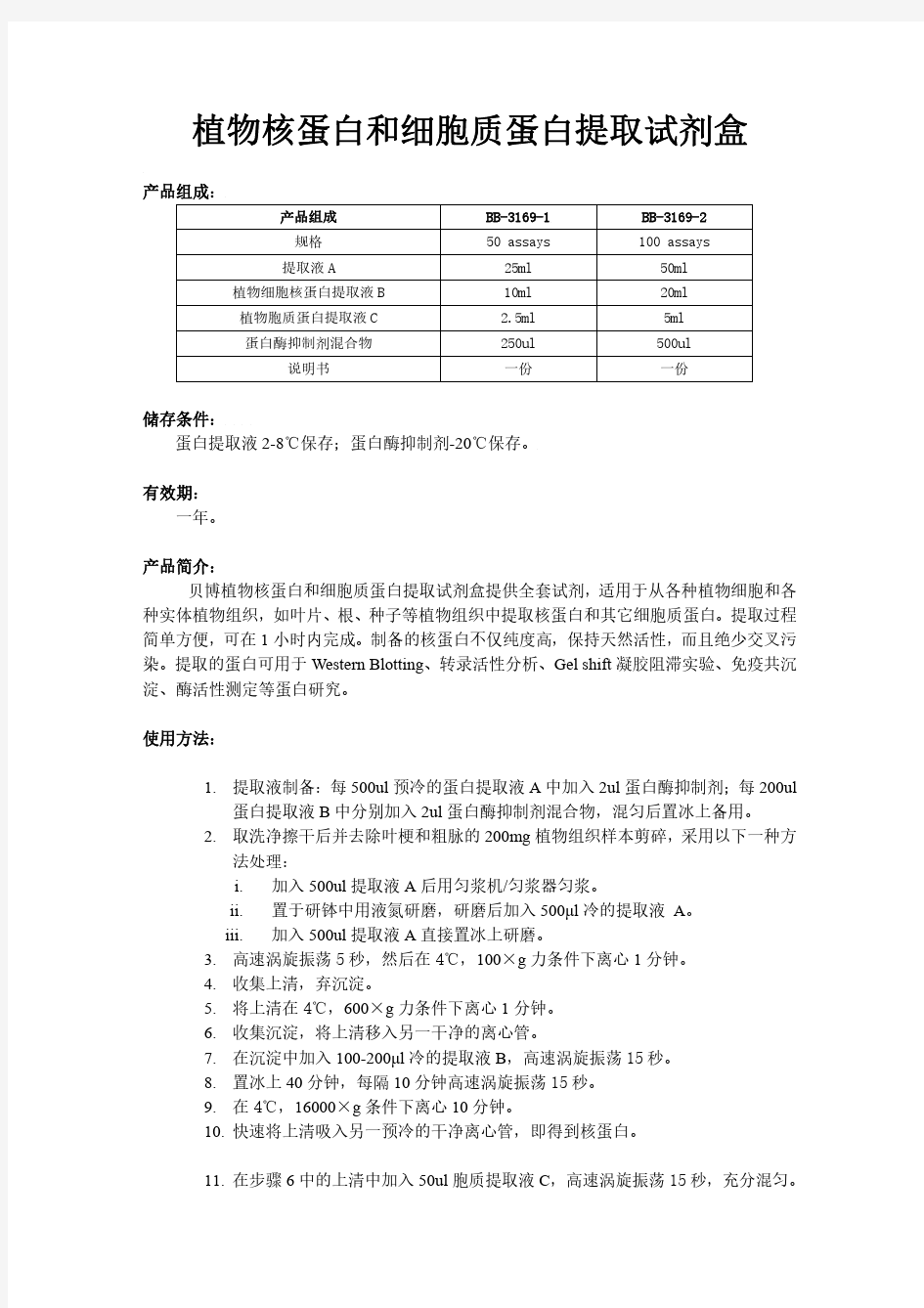
凯基核蛋白和胞浆蛋白提取试剂盒 Cat Number:For Research Use Only Store at -20℃for one year Expire date: 一、试剂盒说明 本试剂盒用于从哺乳动物组织和培养细胞中提取核蛋白和/或胞浆蛋白,提取制备过程简便。制备的核蛋白和胞浆蛋白能保持天然活性,并且纯度较高。提取的蛋白可用于进一步的转录因子活性分析、凝胶阻滞实验(gel shift assay)、免疫共沉淀、Western Blotting、酶活性测定等后续蛋白质研究。 二、试剂盒组份 三、操作步骤 Ⅰ 实体组织蛋白的提取 1、组织样本,将组织剪切成小块,加入适量的冰冷PBS均浆后,静置5 min , 弃沉淀,小心吸取上清转移至另一离心管中; 2、上清4℃离心500×g,3 min,弃上清,估计细胞压积PCV(离心后的 紧实细胞体积); 3、每20μL细胞压积中,加入200μL预冷的Buffer A【使用前每mL Buffer A加入1μL DTT,5μL 100mM PMSF,5μL蛋白酶抑制剂】,最大转速涡旋剧烈振荡15s,放置冰上10~15min; 4、加入11μL冷Buffer B,最大转速涡旋剧烈振荡5s,放置冰上1min; 5、再次最大转速涡旋剧烈振荡5s后,4℃离心,16000×g,5min; 6、尽快将上清转入另一预冷的洁净微量离心管,置于冰上,即得胞浆蛋白; 7、在离心沉淀物(细胞核)中加入100μL预冷的Buffer C (使用前每mL Buffer C加入1μL DTT,5μL 100mM PMSF,5μL蛋白酶抑制剂),最大转速涡旋剧烈振荡15s,放置冰上40min,每间隔10 min涡旋剧烈振荡 15 seconds; 8、4℃离心,16000×g,,10min,尽快将上清转入一预冷的洁净微量离心管, 即得核蛋白; 9、上述提取的胞浆蛋白和核蛋白进行蛋白定量(Braford法或BCA法), 分装并保存于-80℃,避免反复冻融。 Ⅱ 培养细胞蛋白提取
1、原料的选择 早年为了研究的方便,尽量寻找含某种蛋白质丰富的器官从中提取蛋白质。但至目前经 常遇到的多是含量低的器官或组织且量也很小,如下丘脑、松果体、细胞膜或内膜等原材料, - 105 - 蛋白质提取与制备Protein Extraction and Preparation 因而对提取要求更复杂一些。 原料的选择主要依据实验目的定。从工业生产角度考虑,注意选含量高、来源丰富及成 本低的原料。尽量要新鲜原料。但有时这几方面不同时具备。含量丰富但来源困难,或含量 来源均理想,但分离纯化操作繁琐,反而不如含量略低些易于获得纯品者。一般要注意种属 的关系,如鲣的心肌细胞色素C 较马的易结晶,马的血红蛋白较牛的易结晶。要事前调查 制备的难易情况。若利用蛋白质的活性,对原料的种属应几乎无影响。如利用胰蛋白酶水解 蛋白质的活性,用猪或牛胰脏均可。但若研究蛋白质自身的性质及结构时,原料的来源种属 必须一定。研究由于病态引起的特殊蛋白质(本斯.琼斯氏蛋白、贫血血红蛋白)时,不但 使用种属一定的原料,而且要取自同一个体的原料。可能时尽量用全年均可采到的原料。对 动物生理状态间的差异(如饥饿时脂肪和糖类相对减少),采收期及产地等因素也要注意。 2、前处理 a、细胞的破碎 材料选定通常要进行处理。要剔除结缔组织及脂肪组织。如不能立即进行实验,则应冷 冻保存。除了提取及胞细外成分,对细胞内及多细胞生物组织中的蛋白质的分离提取均须先 将细胞破碎,使其充分释放到溶液中。不同生物体或同一生物体不同的组织,其细胞破坏难 易不一,使用方法也不完全相同。如动物胰、肝、脑组织一般较柔软,作普通匀浆器磨研即 可,肌肉及心组织较韧,需预先绞碎再制成匀桨。 ⑴机械方法 主要通过机械切力的作用使组织细胞破坏。常用器械有:①高速组织捣碎机(转速可达 10000rpm,具高速转动的锋利的刀片),宜用于动物内脏组织的破碎;②玻璃匀浆器(用两 个磨砂面相互摩擦,将细胞磨碎),适用于少量材料,也可用不锈钢或硬质塑料等,两面间
蛋白质提取与制备的原理和方法 蛋白质提取与制备蛋白质种类很多,性质上的差异很大,既或是同类蛋白质,因选用材料不同,使用方法差别也很大,且又处于不同的体系中,因此不可能有一个固定的程序适用各类蛋白质的分离。但多数分离工作中的关键部分基本手段还是共同的,大部分蛋白质均可溶于水、稀盐、稀酸或稀碱溶液中,少数与脂类结合的蛋白质溶于乙醇、丙酮及丁醇等有机溶剂中。因此可采用不同溶剂提取、分离及纯化蛋白质和酶。 蛋白质与酶在不同溶剂中溶解度的差异,主要取决于蛋白分子中非极性疏水基团与极性亲水基团的比例,其次取决于这些基团的排列和偶极矩。故分子结构性质是不同蛋白质溶解差异的内因。温度、pH、离子强度等是影响蛋白质溶解度的外界条件。提取蛋白质时常根据这些内外因素综合加以利用。将细胞内蛋白质提取出来。并与其它不需要的物质分开。但动物材料中的蛋白质有些可溶性的形式存在于体液(如血浆、消化硫等)中,可以不必经过提取直接进行分离。蛋白质中的角蛋白、胶原及丝蛋白等不溶性蛋白质,只需要适当的溶剂洗去可溶性的伴随物,如脂类、糖类以及其他可溶性蛋白质,最后剩下的就是不溶性蛋白质。这些蛋白质经细胞破碎后,用水、稀盐酸及缓冲液等适当溶剂,将蛋白质溶解出来,再用离心法除去不溶物,即得粗提取液。水适用于白蛋白类蛋白质的抽提。如果抽提物的pH用适当缓冲液控制时,共稳定性及溶解度均能增加。如球蛋白 类能溶于稀盐溶液中,脂蛋白可用 稀的去垢剂溶液如十二烷基硫酸钠、洋地黄皂苷(Digitonin)溶液或有机溶剂来抽提。其它不溶于水的蛋白质通常用稀碱溶液抽提。 蛋白质类别和溶解性质 白蛋白和球蛋白: 溶于水及稀盐、稀酸、稀碱溶液,可被50%饱和度硫酸铵析出。 真球蛋白: 一般在等电点时不溶于水,但加入少量的盐、酸、碱则可溶解。 拟球蛋白: 溶于水,可为50%饱和度硫酸铵析出 醇溶蛋白: 溶于70~80%乙醇中,不溶于水及无水乙醇 壳蛋白: 在等电点不溶于水,也不溶于稀盐酸,易溶于稀酸、稀碱溶液 精蛋白: 溶于水和稀酸,易在稀氨水中沉淀 组蛋白: 溶于水和稀酸,易在稀氨水中沉淀 硬蛋白质: 不溶于水、盐、稀酸及稀碱 缀合蛋白(包括磷蛋白、粘蛋白、糖蛋白、核蛋白、脂蛋白、血红蛋白、金属蛋白、黄素蛋白和氮苯蛋白等) : 此类蛋白质溶解性质随蛋白质与非蛋白质结合部分的不同而异,除脂蛋白外,一般可溶于稀酸、稀碱及盐溶液中,脂蛋白如
提取细胞核蛋白的步骤: 1.向培养细胞的平皿中加入少量(保证在1.5ml TUBE内能放下)冷PBS(或1*D-Hanks) 2.,用细胞刮刀尽可能多的刮下细胞,收集到1.5ml的离心管中。 在预冷的离心机中,4度,1000rcf,1-3分钟,沉降细胞。 为尽可能多的获得细胞,可将一次离心后的上清再重复刮细胞一次; 2. 将细胞重悬于cell lysis buffer中(加入体积106细胞/200uL,体积估计方法还是没确 定,should be sufficient; 一般就是一个10cm平皿加1ml cell lysis buffer),添加蛋白酶抑 制剂;先破细胞膜,得到细胞核(没有用B DOUNCE); 冰上放置(不震荡,可偶尔用枪轻吹)30分钟至1小时(此时核膜没有破,有核染色为证),充分裂解; cell lysis buffer: 5mM PIPES pH 8.0 85mM KCL, 0.5% NP40, 1% protein inhibitor; 3. 4度,1000rcf,20分钟,上清为胞质蛋白(蛋白浓度比较低,如需要检测,建议先 浓缩一下),沉淀为细胞核; 此时可以将沉淀冻存于-70℃; 4. 将沉淀重悬于100-200 ul nucleai lysis buffer(体积视目的蛋白表达丰度而定,一般 50-100ul)中,添加蛋白酶抑制剂,冰上放置30分钟至1小时(每5分钟震荡一次),充分裂解;可以观察到沉淀慢慢消失,溶液变澄清; nucleai lysis buffer:成分同SDS lysis buffer; 50mM Tris-Cl pH 8.1, 10mM EDTA, 1% SDS, 1% protein inhibitor; 5. 四度,最大转速离心,10分钟以上(尽可能沉淀完全),上清即为细胞核蛋白; (此文档部分内容来源于网络,如有侵权请告知删除,文档可自行编辑修改内容, 供参考,感谢您的配合和支持) 编辑版word
一提取植物总蛋白(以植物花粉为例): 1.三氯乙酸法(TCA)/丙酮(acetone)提取花粉总蛋白质 花粉在liquid nitrogen中研磨成粉末,用含10%TCA和1%DTT的acetone沉淀蛋白质,-20度2个小时(必要时过夜),4度25000g离心20min后去上清,用含1%DTT的acetone溶液悬浮沉淀,-20度1个小时,再次离心去上清,将真空干燥的沉淀在等电聚焦缓冲液中(8M urea,20mmDTT,4%CHAPS,2%ampholyte,PH:3-10) 20度震荡1小时,20度25000g离心20min,收集上清,沉淀再次用IEF缓冲液离心收集上清,可为后续试验做准备。 2.苯酚(phenol)提取法 花粉在liquid nitrogen中研磨成粉末,添加1ml的phenol(tris 8.8 缓冲液)继续研磨5min,加提取缓冲液(0.1mol/L 8.8 Tr i s –HCl,5mmEDTA,20mmDTT,30%sucrose)。将样本转移至离心管中,4度震荡30min,25000g离心10min,将上层的phenol层转移进另一个试管,将下边的水相层加1ml的phenol(tris 8.8 缓冲液)及提取缓冲液,震荡,离心,将再次收集到的phenol与前边收集的混合,加5倍体积的0.1 M ammonium acetate in 100%methanol,在-20度震荡沉淀蛋白质,必要时过夜,4度 25000g离心10min,将沉淀用0.1 M ammonium acetate in 100%methanol及80% acetone各洗两次, 含10mmDTT的80% acetone再洗一次,在每一步中蛋白沉淀都要完全重悬— -20度震荡30min,4度 25000g离心20min,洗剂完成后,沉淀真空干燥,IEF buffer提取蛋白质,如方法1。3.直接IEF buffer提取蛋白质 直接IEF buffer提取蛋白质,花粉在liquid nitrogen中研磨成粉末,然后加入IEF buffer(8M尿素,20mmDTT,4%CHAPS,5mmEDTA,5mmTris base,2%ampholyte,PH:3-10).如方法1。 4.Tris-HCL缓冲液法 花粉在liquid nitrogen中研磨成粉末,加入Tris-HCL缓冲液(50mm,8.8,Tris-HCL, 5mmEDTA,20mmDTT,100mmKCL,2mmPMSF),在融化后,混合液在4度放30min, 25000g离心20min,收集上清,对沉淀重新提取一次,将收集到的上清混合,用5倍体积的100%丙酮沉淀蛋白质,-20度孵育2h,离心后,用80%的丙酮洗剂沉淀2次,IEF buffer重悬沉淀,方法如1 5.利用Bradford试剂法估测提取的总蛋白浓度,并调整浓度行蛋白电泳,-80度保存。 本人翻译的,具体方法流程见附件原文。 ·
一、植物蛋白质提取 1. TCA-丙酮法 (1)称量一定量的样品置于液氮预冷的研钵中,加少许PVPP,反复加液氮研磨至粉末。 (2)研磨好的样品用10 倍体积(w/V)的10%的TCA-丙酮溶液悬浮,加入0.1 M PMSF、 1 M DTT 至终浓度为1 mM PMSF、10mM DTT,超声5 分钟,于-20℃静置6 小时或 过夜后,4℃,20000g 离心15 分钟,弃上清。 (3)沉淀用10 倍体积于样品的丙酮溶液重悬浮,于-20℃静置1 小时后,4℃,20000g 离 心15 分钟,弃上清。 (4)重复步骤(3)一次。 (5)沉淀用10 倍体积于样品的乙醇/乙醚=1:1 洗,于-20℃静置1 小时后,4℃,20000g 离 心15 分钟,弃上清。 (6)重复步骤(3)一次。 (7)取出沉淀真空干燥约5 分钟,除尽有机溶剂。 (8)按10mg 干粉末加200 微升裂解液的比例,加入1 mM PMSF、10mM DTT,超声5 分钟,充分溶解1 小时,10℃,35000g 离心30 分钟,上清为所需的蛋白溶液。(9)用Bradford 法测定蛋白样品的蛋白浓度。 (10)蛋白样品溶液小量分装,-80℃保存。 注意事项: (1)TCA 有利于去除酚类色素等物质,但不利于蛋白的抽提,使用浓度不宜过高,在后 面丙酮处理中,尽量除去。 (2)蛋白样品保存:样品浓度不宜过高,建议将高浓度样品适度调整,为避免反复冻融 应分装保存,长期保存用-80℃,短期保存用-20℃。 (3)1M DTT:0.1542g DTT 用1ml MilliQ 水溶解,-20℃保存。 (4)0.1M PMSF:0.0174g PMSF 用1ml 异丙醇溶解,-20℃保存。
植物膜蛋白提取试剂盒(2D电泳用) 货号:BB-31841 V2.16 试剂盒组成: 产品组成 BB-31841-1 BB-31841-2 组份编号 规格 50T 100T 试剂A:植物膜蛋白提取液A 25ml 50ml 31841A 试剂B:植物膜蛋白提取液B 250ul 500ul 31841B 试剂C:膜蛋白溶解液C 10ml 20ml 31841C 试剂D:蛋白酶抑制剂混合物 100ul 200ul 31841D 使用说明书 1 1 知识产权: 贝博TM BBproExtra TM试剂盒及其使用方法包含专有技术。 产品简介: 膜蛋白承担各种生物功能,扮演重要角色。膜蛋白样品的制备需要充分考虑到与下游的胶分析及质谱分析等应用配套,因此膜蛋白样本制备成为一个难以逾越的挑战。传统制备膜蛋白样品的方法是使用去污剂和表面活性剂增溶。去污剂处理会使膜蛋白丧失其天然结构,因而妨碍了膜蛋白的功能研究。 贝博TM BBproExtra TM植物膜蛋白提取试剂盒(二维电泳用)是一种基于化学方法的高产膜蛋白提取试剂盒。植物膜蛋白提取试剂盒可以从各种植物中提取膜蛋白,可用于纯化膜蛋白的粗品制备及膜蛋白制备。提取过程简单方便。该试剂盒含有蛋白酶抑制剂混合物和磷酸酶抑制剂混合物,阻止了蛋白酶对蛋白的降解,为提取高质量的蛋白提供了保证。 本试剂盒提取的蛋白用于双向电泳。如需要用于报告基因检测、SDS-PAGE电泳检测、Western blotting、凝胶阻滞实验、免疫共沉淀、酶活分析等下游实验的试剂盒,请联系贝博,选用其它产品号的产品。 使用方法: 1、试剂准备: 每500ul膜提取液A中加入2ul蛋白酶抑制剂混合物,充分混匀后置冰上备用。 2、取洗净擦干后并去除叶梗和粗脉的200mg植物组织样本用手术剪刀尽可能剪碎,加 入500ul提取液A,用组织匀浆机/匀浆器充分匀浆。 3、匀浆或研磨后加入500ul提取液A,混匀后于一个干净离心管中在2-8℃振荡1小时。 4、将提取液在2-8℃条件下12000g离心5分钟,取上清。 5、在上清中加入5ul提取液B,充分混匀。 6、在37℃水浴10分钟。 7、在37℃ 1000g离心3分钟。 8、此时液体分为2层,小心移除上层部分,吸取下层管底部大约50ul液体。 9、用50-150μl冷的膜蛋白溶解液C溶解下层溶液,即得膜蛋白样品。
第五章植物蛋白质 目前,人类在对蛋白质代谢的研究和认识过程中,逐步得出了以下四个方面的结论:(1)任何生物细胞并不会合成全部自身遗传信息中所具有的蛋白质。但那些维持细胞生命活动基本代谢过程所需要的酶和蛋白质是必须合成的。 (2)由于细胞分化作用导致了各种专业化细胞的生成,使得不同的生物细胞所拥有的蛋白质各不相同,而且细胞的专业化可导致某些基本酶和蛋白质的合成终止。例如,在种子中,专门贮存蛋白质的细胞所含有的蛋白质,在叶片细胞中就没有;反之,在叶片细胞中专门进行光合作用的蛋白质在种子中也不存在。 (3)在一个细胞内,其合成和拥有的蛋白质种类,将随着生物的生长发育过程而发生一定的变化。例如,同工酶谱的变化。 (4)由人类DNA测序结果可知,真核生物基因不是一个基因决定一种蛋白质多肽链。由于DNA转录产物RNA可剪接和编辑,因而一个基因可以编码两条以上蛋白质多肽链。 第一节种子贮存蛋白质 人们通常将植物在某发育阶段合成、需保存到另一发育阶段才能发挥作用的蛋白质称为贮存蛋白质(storage proteins)。典型的贮存蛋白质一般都具有水溶性低、细胞中存在量大和脱水状态下几乎无生物活性的特征。 在粮食作物中最重要的种子贮存蛋白主要有两种,即谷类作物种子蛋白和豆类作物种子蛋白。 一、谷类作物种子蛋白 禾谷类种子的胚乳除含有大量淀粉外,还含有许多蛋白质。虽然胚中的蛋白质含量很高,但由于胚比胚乳小得多,所以从种子蛋白的总量上看,大部分蛋白质存在于胚乳中。 禾谷类种子蛋白质的分离提取通常按溶解性不同分为四个组分,即清蛋白、球蛋白、醇溶蛋白和谷蛋白。其中清蛋白可溶于水;球蛋白则溶于稀盐溶液中。由于这两种蛋白在胚乳中含量较少,所以,有人认为它们可能是种子形成过程中酶蛋白的剩余物,并不是典型的种子贮存蛋白。 禾谷类种子中的蛋白质含量因品种、气候和栽培条件而异,其主要谷类蛋白质含量变化幅度见表1。 由表1可见,燕麦与其它谷物不同,其主要贮存蛋白是一种球蛋白。这种球蛋白由6条α-链和6条β-链组成,α-链分子量为22000Da,β-链分子量为32000Da。 用甲醇、乙醇、异丙醇提取的种子蛋白称为醇溶谷蛋白。它是大部分禾谷类作物种子中最主要的贮存蛋白,而且它常集中分布于一种专门用于贮存蛋白质的特化细胞器——蛋白体
蛋白质的十种提取方法.txt大人物的悲哀在于他们需要不停地做出选择;而小人物的悲哀在于他们从来没有选择的机会。男人因沧桑而成熟,女人因成熟而沧桑。男人有了烟,有了酒,也就有了故事;女人有了钱,有了资色,也就有了悲剧。蛋白质提取方法-------列举10种方法 [ 来源:绿谷生物网点击数: 4587 更新时间: 2008年05月30日 ][ 收藏本文 ] 一、 植物组织蛋白质提取方法(summer) 1、根据样品重量(1g样品加入3.5ml提取液,可根据材料不同适当加入),准备提取液放在冰上。 2、把样品放在研钵中用液氮研磨,研磨后加入提取液中在冰上静置(3-4 小时)。 3、用离心机离心8000rpm40min4℃或11100rpm20min4℃ 4、提取上清夜,样品制备完成。 蛋白质提取液:300ml 1、1Mtris-HCl(PH8) 45ml 2、甘油(Glycerol)75ml 3、聚乙烯吡咯烷酮(Polyvinylpolypyrrordone)6g 这种方法针对SDS-PAGE,垂直板电泳! 二、 植物组织蛋白质提取方法 (summer) 三氯醋酸—丙酮沉淀法 1、在液氮中研磨叶片 2、加入样品体积3倍的提取液在-20℃的条件下过夜,然后离心(4℃8000rpm以上1小时)弃上清。 3、加入等体积的冰浴丙酮(含0.07%的β-巯基乙醇),摇匀后离心(4℃8000rpm以上1 小时),然后真空 干燥沉淀,备用。 4、上样前加入裂解液,室温放置30 分钟,使蛋白充分溶于裂解液中,然后离心(15℃8000rpm 以上1小 时或更长时间以没有沉淀为标准),可临时保存在4℃待用。 5、用Brandford法定量蛋白,然后可分装放入-80℃备用。 药品: 提取液:含10%TCA 和0.07%的β-巯基乙醇的丙酮 裂解液:2.7g 尿素0.2gCHAPS 溶于3ml 灭菌的去离子水中(终体积为5ml),使用前再加入1M 的 DTT65ul/ml。 这种方法针对双向电泳,杂质少,离子浓度小的特点!当然单向电泳也同样适用,只是电泳的条带会减少! 三、 组织:肠黏膜(newinbio) 目的:WESTERN BLOT检测凋亡相关蛋白的表达
植物全蛋白提取方法: TCA丙酮沉淀法、Tris-HC1法、Trizol沉淀法提取法。 1 TCA丙酮沉淀法 基于蛋白在酸或疏水条件下变性使蛋白浓缩并去除污染物原理的TCA丙酮沉淀法,最早用于小麦蛋白的提取,是目前提取植物蛋白的常用方法之一。 具有降低次生代谢物质的干扰、减少蛋白降解等优点。 TCA能有效地抑制蛋白酶对蛋白质的水解作用,保证在制样过程中蛋白质不被降解;丙酮溶液能除去样品中的酚类及色素等干扰物质,同时实验过程中采用的高速离心办法能较好地去除多糖的影响。然而该方法的一个最大缺点是蛋白质很难重新溶解,而且样品中的非蛋白成分很难除去,可能会丢失膜蛋白和疏水性蛋白,导致2-DE图谱上有明显的横纵条纹。 在研磨样品时加入聚乙烯吡咯烷酮(PVP)或交联聚乙烯基吡咯烷酮(PVPP)用来吸附样品中富含的酚、醌类物质。它们能通过疏水键与酚类形成复合物,离心可以去除该复合物。然而,TCA丙酮沉淀法中与蛋白共沉淀的污染物在随后的有机溶剂清洗步骤中通常难以去除,可以通过振荡和延长蛋白沉淀在裂解缓冲液中温育时间的方法来增加蛋白的溶解能力。在提取的过程中同时加入了TCA、β-巯基乙醇及DTT 3 种药剂可以更好的抑制蛋白质的水解及去除干扰物质。TCA丙酮提取法耗时少且容易操作,一般作为植物蛋白提取的初始方案,该方法常用于幼嫩组织中蛋白的提取,对更为复杂的植物组织该方法并非最佳选择。但该方法还是在植物蛋白的提取中占有重要位置,很多木本植物的样品应用该方法效果很好,如鹅掌楸叶片、巴东木莲的雌蕊柱头、槟榔叶片、银杏叶片及枝条、茶树叶片及芽、红豆杉的愈伤组织、石斛叶片等。草本植物中的大豆叶片、生菜叶片、黄瓜叶片、番茄子叶、龙胆花芽、灰木相思叶片等应用该方法都获得了较清晰的2-DE图谱。 TCA protein precipitation protocol Stock Solutions: 100% (w/v) Trichloroacetic acid (TCA) recipe: dissolve 500g TCA (as shipped) into 350 ml dH2O, store at RT. Precipitation Protocol: 1. Add 1 volume of TCA stock to 4 volumes of protein sample. i.e. in 1.5ml tube with maximum vol., add 250μl TCA to 1.0ml sample. 2. Incubate 10 min at 4°C. 3. Spin tube in microcentrifuge at 14K rpm, 5 min. 4. Remove supernatant, leaving protein pellet intact. Pellet should be formed from whitish,fluffy ppt. 5. Wash pellet with 200μl cold acetone. 6. Spin tune in microfuge at 14K rpm, 5min. 7. Repeat steps 4-6 for a total of 2 acetone washes. 8. Dry pellet by placing tube in 95°C heat block for 5-10 min to drive off acetone. 9. For SDS-PAGE, add 2X or 4X sample buffer (with or without bME) and boil smaple for 10 min in 95°C herat block before loading smaple onto polyacrylamide gel. 2 Trizol沉淀法 与TCA 丙酮沉淀法相比,Trizol沉淀蛋白质的方法可有效地除去色素、酚类等干扰电泳的化学物质,特别是对植物样品中高丰度蛋白——Rubisco1,5-二磷酸核酮糖羧化酶/加氧酶(Ribulose-1,5-bisphosphate carboxylase/oxygenase,通常简写为RuBisCO)。采用此方法能够减少高丰度蛋白对2-DE结果的干扰。植物样品中高丰度蛋白(如Rubisco)的存在对其他蛋白质,尤其是低丰度蛋白的检测的影响也很大,因此,选择合适的蛋白质制备方法尤其重
蛋白质提取的方法总汇 中国生命科学论坛 Ⅰ、植物组织蛋白质提取方法(summer) 1、根据样品重量(1g样品加入3.5ml提取液,可根据材料不同适当加入),准备提取液放在冰上。 2、把样品放在研钵中用液氮研磨,研磨后加入提取液中在冰上静置(3-4小时)。 3、用离心机离心8000rpm40min4℃或11100rpm20min4℃ 4、提取上清夜,样品制备完成。 蛋白质提取液:300ml 1、1Mtris-HCl(PH8) 45ml 2、甘油(Glycerol)75ml 3、聚乙烯吡咯烷酮(Polyvinylpolypyrrordone)6g 这种方法针对SDS-PAGE,垂直板电泳! Ⅱ、三氯醋酸—丙酮沉淀法 1、在液氮中研磨叶片 2、加入样品体积3倍的提取液在-20℃的条件下过夜,然后离心(4℃8000rpm以上1小时)弃上清。 3、加入等体积的冰浴丙酮(含0.07%的β-巯基乙醇),摇匀后离心(4℃8000rpm以上1小时),然后真空干燥沉淀,备用。 4、上样前加入裂解液,室温放置30分钟,使蛋白充分溶于裂解液中,然后离心(15℃8000rpm以上1小时或更长时间以没有沉淀为标准),可临时保存在4℃待用。 5、用Brandford法定量蛋白,然后可分装放入-80℃备用。 药品: 提取液:含10%TCA和0.07%的β-巯基乙醇的丙酮 裂解液:2.7g尿素0.2gCHAPS溶于3ml灭菌的去离子水中(终体积为5ml),使用前再加入1M的DTT65ul/ml。 这种方法针对双向电泳,杂质少,离子浓度小的特点!当然单向电泳也同样适用,只是电泳的条带会减少!
Ⅲ、组织:肠黏膜(newinbio) 目的:WESTERN BLOT检测凋亡相关蛋白的表达 应用TRIPURE提取蛋白质步骤: 1.含蛋白质上清液中加入异丙醇:(1.5ml每1mlTRIPURE用量) 2.倒转混匀,置室温10min 3.离心:12000 g,10min,4度,弃上清 4.加入0.3M盐酸胍/95%乙醇:(2ml每1mlTRIPURE用量) 5.振荡,置室温20min 6.离心: 7500g,5 min,4度,弃上清 7.重复0.3M盐酸胍/95%乙醇步2次 8.沉淀中加入100%乙醇 2ml 9.充分振荡混匀,置室温20 min 10.离心: 7500g,5min,4度,弃上清吹干沉淀 11.1%SDS溶解沉淀 12.离心:10000g,10min,4度 13.取上清-20度保存(或可直接用于WESTERN BLOT) 存在的问题:加入1%SDS后沉淀不溶解,还是很大的一块,4度离心后又多了白色沉定,SDS结晶?测浓度,含量才1mg/ml左右。 解决:提蛋白试剂盒,另外组织大小适中,要碎,立即加2X BUFFER,然后煮5-10 分钟,效果很好的。 Ⅳ、lysis solution:(yog) Protein extraction buffer (Camiolo buffer): 100 ml= (0.075M Potassium Acetate) 0.736g (0.3M) NaCl 1.753g (0.1M) L-arginine basic salt 1.742g (0.01M) EDTA-HCl 0.292g (0.25%) Triton X-100 250. ul up to 100 ml with dH20. pH 7.4. Then 0.2 um filter. 1. Freeze tissue in liquid nitrogen. 2. Rinse in PBS then mince.
胞浆蛋白—核蛋白抽提试剂盒 产品编号产品名称包装 SINP001 胞浆-核蛋白抽提试剂盒50× 产品简介:细胞核和细胞浆目前成为研究细胞组分的两个热点,获得高浓度的细胞核蛋白和细胞浆蛋白成为得到好的研究结果的重要实验过程。本试剂盒主要原理是在低渗透压条 件下,使细胞充分膨胀,然后破坏细胞膜,释放出细胞浆蛋白,离心得到细胞核沉 淀。最后通过高盐的细胞核蛋白抽提试剂抽提得到细胞核蛋白。本试剂盒是本公司 非放射性EMSA试剂盒(cat; SIDET001, SIDET003, SIDET004,)实验成功的重要部 分,经BCA测定24cm2贴壁细胞(或50ml规格培养瓶养的悬浮细胞)抽提物,核蛋白 浓度约为 2.5ug/ul或更高。抽提得到的蛋白可以用于Western,EMSA, footprinting,报告基因检测以及酶活力测定等后续操作。本试剂盒可足够您进行 50次抽提操作! 包装清单: 试剂包装总量 5X Buffer A 1瓶35ml/瓶 2X Buffer B1支 1.5ml/支 Solution I(溶液I)1支 1.75ml/支 Solution II(溶液II)1支 1.75ml/支 Solution III(溶液III)1支 1.5ml/支 PMSF Solution 1支0.85ml/支 User Manual (说明书) 1份1份/Kit 保存温度: 4℃保存。 Ⅰ.准备抽提试剂:按照下列方法制备胞浆-核蛋白抽提液: 1.制备3ml胞浆蛋白裂解液I : 试剂体积 5X Buffer A0.6ml Solution I(溶液I)30ul Solution II(溶液II)30ul PMSF Solution 15ul dd-H2O 2.325ml 总体积 3.0ml 注:PMSF Solution须在抽提试剂加入到样品中前2-3分钟内加入。
蛋白质提取常用试剂及操作方法 一、原料选择和前处理 (一)原料的选择 早年为了研究的方便,尽量寻找含某种蛋白质丰富的器官从中提取蛋白质。但至目前经常遇到的多是含量低的器官或组织且量也很小,如下丘脑、松果体、细胞膜或内膜等原材料,因而对提取要求更复杂一些。原料的选择主要依据实验目的定。从工业生产角度考虑,注意选含量高、来源丰富及成本低的原料。尽量要新鲜原料。但有时这几方面不同时具备。含量丰富但来源困难,或含量来源均理想,但分离纯化操作繁琐,反而不如含量略低些易于获得纯品者。一般要注意种属的关系,如鲣的心肌细胞色素C 较马的易结晶,马的血红蛋白较牛的易结晶。要事前调查制备的难易情况。若利用蛋白质的活性,对原料的种属应几乎无影响。如利用胰蛋白酶水解蛋白质的活性,用猪或牛胰脏均可。但若研究蛋白质自身的性质及结构时,原料的来源种属必须一定。研究由于病态引起的特殊蛋白质(本斯.琼斯氏蛋白、贫血血红蛋白)时,不但使用种属一定的原料,而且要取自同一个体的原料。可能时尽量用全年均可采到的原料。对动物生理状态间的差异(如饥饿时脂肪和糖类相对减少),采收期及产地等因素也要注意。 (二)前处理 1.细胞的破碎 材料选定通常要进行处理。要剔除结缔组织及脂肪组织。如不能立即进行实验,则应冷冻保存。除了提取及胞细外成分,对细胞内及多细胞生物组织中的蛋白质的分离提取均须先将细胞破碎,使其充分释放到溶液中。不同生物体或同一生物体不同的组织,其细胞破坏难易不一,使用方法也不完全相同。如动物胰、肝、脑组织一般较柔软,作普通匀浆器磨研即可,肌肉及心组织较韧,需预先绞碎再制成匀桨。 ⑴机械方法 主要通过机械切力的作用使组织细胞破坏。常用器械有:①高速组织捣碎机(转速可达10000rpm,具高速转动的锋利的刀片),宜用于动物内脏组织的破碎;②玻璃匀浆器(用两个磨砂面相互摩擦,将细胞磨碎),适用于少量材料,也可用不锈钢或硬质塑料等,两面间隔只有十分之几毫米,对细胞破碎程度较高速捣碎机高,机械切力对分子破坏较小。小量的也可用乳钵与适当的缓冲剂磨碎提取,也可加氧化铝、石英砂及玻璃粉磨细。但在磨细时局部往往生热导致变性或pH 显著变化,尤其用玻璃粉和氧化铝时。磨细剂的吸附也可导致损失。 ⑵物理方法 主要通过各种物理因素的作用,使组织细胞破碎的方法。 Ⅰ.反复冻融法 于冷藏库或干冰反复于零下15~20℃使之冻固,然后缓慢地融解,如此反复操作,使大部分细胞及细胞内颗粒破坏。由于渗透压的变化,使结合水冻结产生组织的变性,冰片将细胞膜破碎,使蛋白质可溶化,成为粘稠的浓溶液,但脂蛋白冻结变性。 Ⅱ.冷热变替法 将材料投入沸水中,于90℃左右维持数分钟,立即置于冰浴中使之迅速冷却,绝大部分细胞被破坏。 Ⅲ.超声波法 暴露于9~10 千周声波或10~500 千周超声波所产生的机械振动,只要有设备该法方便且效果也好,但一次处理量较小。应用超声波处理时应注意避免溶液中气泡的存在。处理一些
https://www.doczj.com/doc/be11284613.html, 膜蛋白的提取方法-全攻略 一、膜蛋白简介 膜蛋白在细胞中扮演着重要的角色:例如被熟知的识别、信号转导、运输等功能,也是用药的理想的靶点,虽动物细胞主要有9种膜脂,而膜蛋白的种类繁多,多数膜蛋白分子数目较少,但却赋予细胞膜非常重要的生物学功能。 根据膜蛋白分离的难易及其与脂分子的结合方式,膜蛋白可分为两大类型:外在膜蛋白、内在膜蛋白。 (1) 外在膜蛋白为水溶性蛋白,靠离子键或其它较弱的键与膜表面的蛋白质分子或脂分子结合,因此只要改变溶液的离子强度甚至提高温度就可以从膜上分离下来,膜结构并不被破坏。 (2) 内在膜蛋白与膜结合非常紧密,一般只有用去垢剂(detergent)使其膜解后才可分离出来。 附注:使用分级抽提方法获得的“膜蛋白”中只有很少一部分是具备多跨膜区的整合膜蛋白。 二、膜蛋白的提取方法 谈及蛋白分离,我们想到:超速离心,盐析法、超滤法、凝胶过滤法、等电点沉淀法、离子交换层析、亲和层析、吸附层析、逆流分溶、酶解法……有时这些方法常常组合到一起对特定的物质进行分离纯化。由于蛋白质种类繁多,不同的蛋白质由于结构和组成的差异,其溶解
https://www.doczj.com/doc/be11284613.html, 度也各不相同.根据蛋白质的溶解特性,同时可选择不同的溶剂提取,分为水溶液提取和有机溶剂提取. 但是与胞质蛋白,核蛋白提取不同之处在于膜蛋白是嵌在膜中的,水溶性不好,基本方法就是用不同的离心速度去掉胞质蛋白等,然后用去污剂把蛋白从膜中释放出来。膜蛋白分离纯化的重要步骤是选择适当的增溶用表面活性剂,一般常用的有胆酸盐,CHAPS(一种离子去污剂),Emulgen和Lubrol等表面活性剂。 1)先分离膜,然后提取;如选用冷热交替法、反复冻融法、超声破碎法、玻璃匀浆法、自溶法和酶处理法使得细胞破碎,然后通过梯度离心得到含有膜蛋白的粗组分。(例如:用液氮研磨组织,加入匀浆缓冲液及蛋白酶抑制剂,然后差速离心、蔗糖密度梯度离心。收集37%与41%间的成分,即为质膜部分。裂解即可收集膜蛋白) 2)用特殊的去污剂选择性的分离。从膜上提取蛋白有许多困难。在多数情况下,都是采用去垢剂将疏水蛋白从其膜结构中溶解下来,然后将蛋白质稳定。去垢剂的选择通常是依据他对所需要蛋白质的提取效率来确定,但在某些情况下,还要考虑到以后的纯化步骤。虽然许多膜蛋白必须在去垢剂存在的情况下进行纯化,但最终仍可能需要除去去垢剂。这常常会引起蛋白质失活,但如果蛋白质是用于测序的,他将不是一个问题。如果不是用于测序的,可考虑使用能够黏附去垢剂的疏水珠.许多文献和生化试剂供应商的产品目录中,都介绍有许多种不同的可用来溶解膜蛋白的去垢剂.然而,他们并不是普遍适用的.在设计膜蛋白溶解方案时,必须考虑某一去垢剂的特殊性质.如 triton X-100在280nm处有吸收,如果某蛋白质的测试与280nm 处的吸收有关,就应避免使用这类去垢剂. 将膜制剂与胞质蛋白及细胞核分离后,再进一步从细胞膜制剂中将所需的膜蛋白增溶下来.这种做法的好处是可以用强烈的去垢剂提取细胞骨架的相关蛋白,而无需考虑胞质蛋白、细胞核成分或染色质成分的混入.使用这种方法所获得的膜蛋白,无论在种类上还是数量上,都比酸溶解法所得到的蛋白(<5000Da)要多.一般提取的膜蛋白量往往只占膜蛋白总量的不足0.1%,所以充分的膜蛋白的提取,无疑对于研究膜蛋白的结构和功能都是非常重要的. 酸溶解法简单,可靠,但有时含有其他蛋白。一般的都是利用4℃时所有的蛋白质原则上都溶于Triton X-114水溶液,在温度超过20℃时,此溶液分为水相和去污相;此时亲水性蛋白溶于水相,疏水的膜蛋白溶于去污剂相中。利用此性质可提取膜蛋白。 3 )膜蛋白色谱(Chromatography of Membrane Protein,CMP):CMP分离强疏水性蛋白、多肽混合物的层析系统,一般有去垢剂(如SDS)溶解膜蛋白后形成SDS-融膜蛋白,并由羟基磷灰石为固定相的柱子分离纯化。羟基磷灰石柱具有阴离子磷酸基团(P-端),又具有阳离子钙(C-端),与固定相结合主要决定于膜蛋白的大小、SDS结合量。利用原子散射法研究cAMP的
蛋白质提取的方法总汇 https://www.doczj.com/doc/be11284613.html, 2005-4-15 23:00:00 来源:生命经 1、植物组织蛋白质提取方法 1、根据样品重量(1g样品加入3.5ml提取液,可根据材料不同适当加入),准 备提取液放在冰上。 2、把样品放在研钵中用液氮研磨,研磨后加入提取液中在冰上静置(3-4小时)。 3、用离心机离心8000rpm40min4℃或11100rpm20min4℃ 4、提取上清夜,样品制备完成。 蛋白质提取液:300ml 1、1Mtris-HCl(PH8) 45ml 2、甘油(Glycerol)75ml 3、聚乙烯吡咯烷酮(Polyvinylpolypyrrordone)6g 这种方法针对SDS-PAGE,垂直板电泳! 2、植物组织蛋白质提取方法 三氯醋酸—丙酮沉淀法 1、在液氮中研磨叶片 2、加入样品体积3倍的提取液在-20℃的条件下过夜,然后离心(4℃8000rpm 以上1小时)弃上清。 3、加入等体积的冰浴丙酮(含0.07%的β-巯基乙醇),摇匀后离心(4℃8000rpm 以上1小时),然后真空干燥沉淀,备用。 4、上样前加入裂解液,室温放置30分钟,使蛋白充分溶于裂解液中,然后离心 (15℃8000rpm以上1小时或更长时间以没有沉淀为标准),可临时保存在4℃ 待用。
5、用Brandford法定量蛋白,然后可分装放入-80℃备用。 药品: 提取液:含10%TCA和0.07%的β-巯基乙醇的丙酮 裂解液:2.7g尿素0.2gCHAPS溶于3ml灭菌的去离子水中(终体积为5ml),使用前再加入1M的DTT65ul/ml。 这种方法针对双向电泳,杂质少,离子浓度小的特点!当然单向电泳也同样适用,只是电泳的条带会减少! 3、组织:肠黏膜 目的:WESTERN BLOT检测凋亡相关蛋白的表达 应用TRIPURE提取蛋白质步骤: 含蛋白质上清液中加入异丙醇:(1.5ml每1mlTRIPURE用量) 倒转混匀,置室温10min 离心:12000 g,10min,4度,弃上清 加入0.3M盐酸胍/95%乙醇:(2ml每1mlTRIPURE用量) 振荡,置室温20min 离心: 7500g,5 min,4度,弃上清 重复0.3M盐酸胍/95%乙醇步2次 沉淀中加入100%乙醇 2ml 充分振荡混匀,置室温20 min 离心: 7500g,5min,4度,弃上清吹干沉淀 1%SDS溶解沉淀 离心:10000g,10min,4度 取上清-20度保存(或可直接用于WESTERN BLOT) 存在的问题:加入1%SDS后沉淀不溶解,还是很大的一块,4度离心后又多了白色沉定,SDS结晶?测浓度,含量才1mg/ml左右。 解决:提蛋白试剂盒,另外组织大小适中,要碎,立即加2X BUFFER,然后煮5-10分钟,效果很好的。