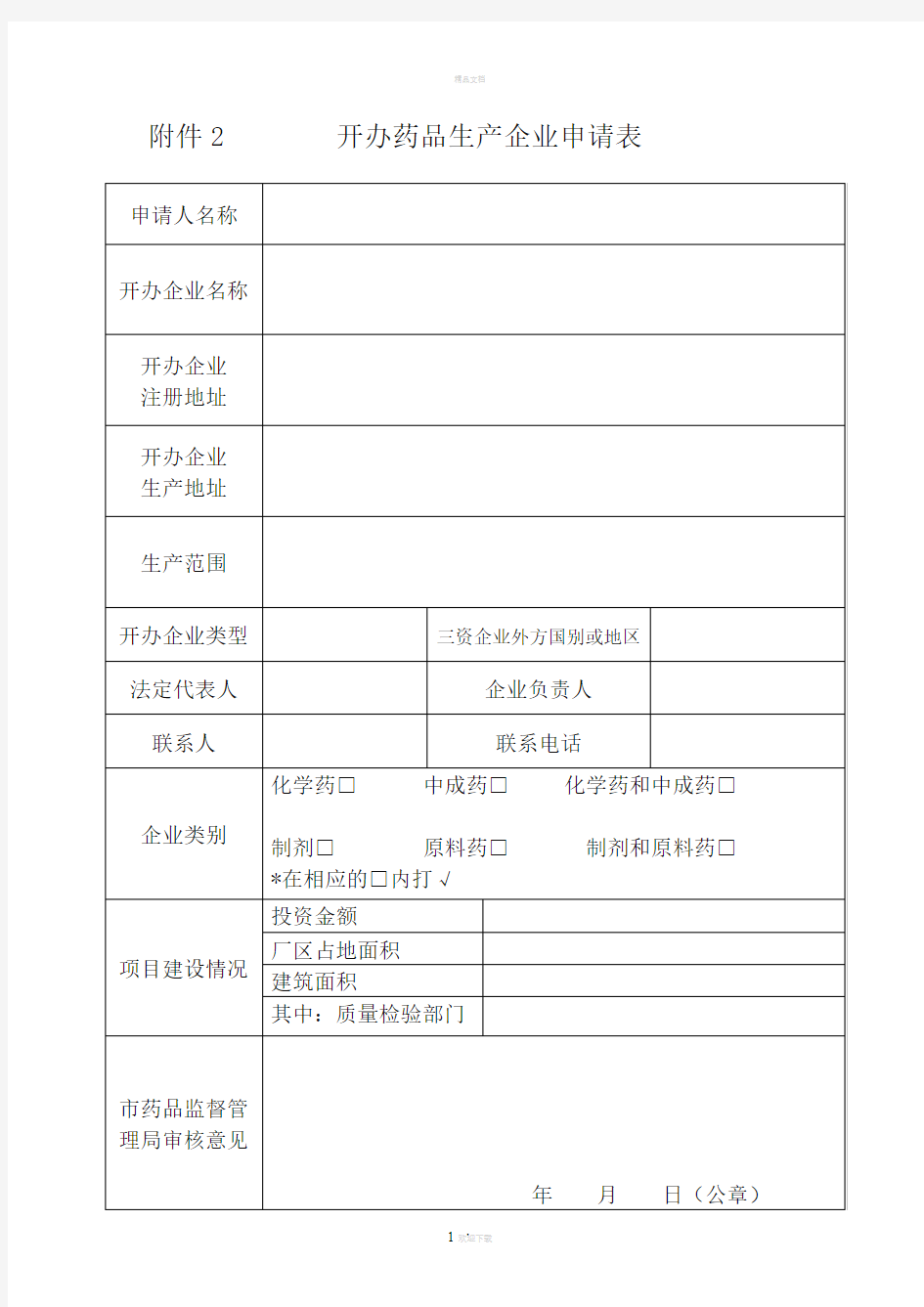

附件2 开办药品生产企业申请表
注:市局应在收到企业完整申报资料之日起的5个工作日内出具审核意见
欢迎您的下载,
资料仅供参考!
致力为企业和个人提供合同协议,策划案计划书,学习资料等等
打造全网一站式需求
药品管理法 一、开办药品生产企业,必须具备以下条件: (一)具有依法经过资格认定的药学技术人员、工程技术人员及相应的技术工人。 (二)具有与其药品生产相适应的厂房、设施和卫生环境; (三)具有能对所生产药品进行质量管理和质量检验的机构、人员以及必要的仪器设备; (四)具有保证药品质量的规章制度。 二、药品经营企业购销药品,必须有真实完整的购销记录。购销记录必须注明药品的通用名称、剂型、规格、批号、有效期、生产厂商、购(销)货单位、购(销)货数量、购销价格、购(销)货日期及国务院药品监督管理部门规定的其他内容。 有下列情形之一的,为假药: (一)药品所含成份与国家药品标准规定的成份不符的; (二)以非药品冒充药品或者以他种药品冒充此种药品的。 有下列情形之一的药品,按假药论处; (一)国务院药品监督管理部门规定禁止使用的; (二)依照本法必须批准而未经批准生产、进口,或者依照本法必须检验而未经检验即销售的。 (三)变质的; (四)被污染的; (五)使用依照本法必须取得批准文号而未取得批准文号的原料药生产
的; (六)所标明的适应症或者功能主治超出规定范围的。 三、有下列情形之一的药品,按劣药论处: (一)未标明有效期或者更改有效期的; (二)不注明或者更改生产批号的; (三)超过有效期的; (四)直接接触药品的包装材料和容器未经批准的; (五)擅自添加着色剂、防腐剂、香料、矫味剂及辅料的; (六)其他不符合药品标准规定的。 四、新开办药品批发企业和药品零售企业,应当自取得《药品经营许可证》之日起30日内,向发给其《药品经营许可证》的药品监督管理部门或者药品监督管理机构申请《药品经营质量管理规范》认证。 五、药品抽样必须由两名以上药品监督检查人员实施,并按照国务院药品监督管理部门的规定进行抽样;被抽检方应当提供抽检样品,不得拒绝,药品被抽检单位没有正当理由,国务院药品监督管理部门和被抽检单位所在地省、自治区、直辖市人民政府药品监督管理部门可以宣布停止该单位拒绝抽检的药品上市销售和使用。 六、药品生产企业、药品经营企业有下列情形之一的,由药品监督管理部门依照《药品管理法》第七十九条的规定给予处罚: (一)开办药品生产企业、药品生产企业新建药品生产车间、新增生产剂型,在国务院药品监督管理部门规定的时间内未通过《药品生产质量管理规范》认证,仍进行药品生产的;
《开办药品零售企业验收实施标准(试行)》 2007-01-31 第一章机构与人员 第一条企业应设置专门的质量管理机构或专职质量管理人员,与申请企业拟经营规模相适应。 第二条企业质量管理机构或专职质量管理人员应行使质量管理职能,在企业内部对药品质量具有裁决权。 第三条企业、企业法定代表人或企业负责人、质量负责人无《药品管理法》第76条、83条规定的情形。 第四条企业法定代表人、企业负责人应熟悉国家有关药品管理的法律、法规、规章和所经营药品的知识,无严重违反药品管理法律、法规行为记录。 第五条企业质量负责人,应具有药学(含相关专业,以下同)大学专科以上学历或者具有药师(含中药师,以下同)以上专业技术职称,并有一年以上(含一年)药品经营质量管理工作经验。 第六条企业应配备执业药师(含执业中药师、从业药师)。 经营乙类非处方药的药品零售企业,以及农村乡镇以下地区设立药品零售企业的,应当配备专职的具有高中以上文化程度,经所在地药品监督管理分局组织考核合格的人员。 第七条企业从事药品质量管理工作的人员,应具有药师以上专业技术职称或者具有大专以上药学学历。以上人员应经市药品监
督管理局考试合格,取得岗位合格证书后方可上岗。以上人员应在职在岗,不得为兼职人员。 第八条企业从事药品验收、养护工作的人员以及营业人员,应具有高中或者中专以上文化程度,如为初中文化程度,须具有5年以上从事药品经营工作的经历。以上人员经药品监督管理分局考试合格,取得岗位合格证书后方可上岗。 第九条企业处方审核人员,应是与其所经营范围相适应的执业药师或者药师以上依法经过资格认定的药学技术人员。 第十条企业在质量管理、药品验收、养护、保管等直接接触药品岗位工作的人员,应进行健康检查并建立档案。患有精神病、传染病等可能污染药品或导致药品发生差错疾病的患者,不得从事直接接触药品内包装的工作。 第十一条企业在国家有就业准入规定岗位工作的人员,需通过职业技能鉴定并取得职业资格证书后方可上岗。 第十二条企业应制定对各类人员进行药品法律、法规、规章和专业技术、药品知识、职业道德等教育培训计划。 第二章设施与设备 第十三条企业与最近药品零售企业之间应有350米以上的可行进距离。 商业中心区内可不受间隔距离限制。 在连锁超级市场内开办经营类别为乙类非处方药的药品零售企业,可不受间隔距离限制。 第十四条企业应有与经营规模相适应的营业场所和药品仓库,
2014年北京市药品生产企业名录267家
8北京御生堂制药有限 公司 李玉文 李玉 文 其他有限责任 公司 北京市房山区良乡工业 开发区金光南街3号 片剂、颗粒剂、硬胶囊剂、凝胶剂、膏药、橡 胶膏剂、丸剂(浓缩丸、微丸)、中药提取、 中药饮片(净制、切制、炒制、炙制、蒸制、 煮制、煅制)。 京20100007 HbZ bY 2011/8/24 2015/12/17 9北京市永康药业有限 公司 陈平 李艳 明 有限责任公司 北京市丰台区科学城中 核路8号(园区) 小容量注射剂、片剂、硬胶囊剂、颗粒剂。京20100008 Hb 2010/12/18 2015/12/17 10北京三联制药有限公 司 张海涛 卜绿 萍 其他有限责任 公司 北京市丰台区丰台路口 139号2幢617室(园区) 片剂、颗粒剂、丸剂(浓缩丸)、硬胶囊剂、 散剂;中药提取。 京20100009 HbZ b 2014/1/13 2015/12/17 11扬子江药业集团北京 海燕药业有限公司 徐镜人 徐镜 人 有限责任公司 北京市昌平区生命园路 16号 片剂、硬胶囊剂。京20100115 HbZ b 2011/2/24 2015/12/18 12北京太洋树康中药饮 片厂 崔国静 崔国 静 集体所有制 (股份合作) 北京市大兴区长子营镇 企融路1号 中药饮片(含直接服用、净制、切制、炒制、 炙制、蒸制、煅制、煮制)。 京20100122 Y 2010/12/19 2015/12/18 13北京康而福药业有限 责任公司 宋明选 王爱 荣 有限责任公司 北京市昌平区科技园区 中兴路10号二层 片剂、硬胶囊剂、软胶囊剂、颗粒剂、口服液、 滴丸剂、中药提取。 京20100124 Zb 2012/6/11 2015/12/19 14北京仟草中药饮片有 限公司 杨如意 杨如 意 有限责任公司 北京市大兴区西红门镇 大生庄工业区二条三号 中药饮片(含直接服用、净制、切制、炒制、煅 制、蒸制、煮制、燀制、炙制、煨制)。 京20100129 Y 2010/12/20 2015/12/19 15北京华邈中药工程技 术开发中心 商国懋 商国 懋 全民所有制 北京市顺义区顺通路西 侧 中药饮片(含毒性饮片、净制、切制、煮制、 蒸制、炒制、炙制、煅制)。 京20100037 Y 2010/12/18 2015/12/17 16北京市恒通制药有限 公司 袁社民 袁社 民 其他有限责任 公司 北京市通州区张家湾镇 柳营村 合剂、片剂、硬胶囊剂、颗粒剂、中药提取、 糖浆剂。 京20100039 Zb 2010/12/18 2015/12/17 17北京宏济药业有限公 司 苗洁苗洁 有限责任公司 (自然人投资 或控股) 北京市通州区于家务渠 头村北 中药饮片(含净制、切制、炒制、炙制、蒸制)。京20100046 Y 2010/12/18 2015/12/17 18北京赛而生物药业有 限公司 马骉马骉 其他有限责任 公司 北京市大兴工业开发区 科苑路35号 片剂(含头孢菌素类),胶囊剂(含头孢菌素类), 散剂,颗粒剂,中药前处理及提取,原料药(肝 素钠、盐酸精氨酸、胰酶、胃膜素、胃蛋白酶、 盐酸林可霉素、土霉素、四环素、麦白霉素、 乙酰螺旋霉素、猴头菌粉、二溴甘露醇、天麻 密环菌粉、单唾液酸四己糖神经节苷脂钠、帕 米膦酸 京20100048 Hab Zb 2014/1/24 2015/12/22
药品生产企业的开办条件与开办程序 一、药品生产企业的开办条件药品是用于防病、治病的特殊商品,为确保药品质量,国家依法对药品生产企业实行许可证制度,并对开办药品生产企业应具备的基本条件作了法律上的规定。开办药品生产企业必须符合《药品管理法》及《药品管理法实施办法》和相关文件的规定,必须具备以下条件: ⑴具有与所生产药品相适应的药师或者助理工程师以上技术人员及技术工人。中药饮片加工企业没有药师或者助理工程师以上技术人员的,配备熟悉药性并经县级以上药品监督管理主管部门审查登记的药工人员。 ⑵具有与所生产药品相适应的、能够保证药品质量的厂房、设施和卫生环境。 ⑶具有能对所生产药品进行质量检验的机构和人员,以及必要的仪器和设备。 ⑷具有国内未生产的二类以上(含二类)新药证书,中药生产企业具有国内未生产的二个以上(含二个)三类新药证书。生产生物工程产品还要符合有关特殊要求。 ⑸具备按照《药品生产质量管理规范》的要求进行设计、施工和安装的能力,且必须符合《药品生产质量管理规范》的要求。 二、申报材料
(一)办理企业预核准通知书(工商行政管理部门)。(二)根据规模大小进行立项(发展计划委员会)。 (三)开办药品生产企业向所在地药品监督管理部门提交开办资格申请报告时,除上述两份资料外还应提交: 1、开办单位的基本情况和法人资格证书。 2、拟开办企业的名称、地址。 3、拟开办企业的法人代表及其主要负责人简历。 4、拟开办企业的主要技术人员简历(包括姓名、年龄、性别、学历、原从事职业及年限、拟从事工作)。 5、拟开办企业的资金来源、构成及固定资产投资审批情况。 6、拟生产产品的品种、规模及质量标准。 7、拟生产品种与现有同类品种的比较及国内外市场预测。 8、拟采用的工艺介绍、优缺点及技术来源。 9、拟开办企业的燃料、动力、交通运输等条件说明。 10、拟开办企业对环境的影响及治理措施。 11、拟开办企业的职工人数及其学历结构和技术等级结构等。 12、主要生产设备目录。 13、主要检测仪器目录。 14、药品生产企业土建面积、总平面布置图、生产车间工艺流程图和工艺布局平面图及设备位置,并标明洁净级别。15、项目实施计划。
广东省开办药品零售企业验收实施标准(2017年修订) (征求意见稿) 1 / 6
2 / 6
3 / 6
4 / 6
(2)药品验收记录; (3)药品陈列检查记录 (4)药品养护记录; (5)药品销售记录; (6)中药饮片处方审核、调配核对记录; (7)中药饮片清斗装斗记录; (8)药品拆零销售记录; (9)温湿度监测记录; (10)药品质量投诉和质量事故处理记录; (11)药品不良反应报告记录; (12)不合格药品处理记录; (13)首营企业审核记录; (14)首营品种审核记录。 经营第二类精神药品、毒性中药品种和罂粟壳的,应设立特殊药品专用账册。 药品零售连锁企业连锁门店的质量管理记录格式由总部统一制定,按相关规定实施。 说明: 1.本标准所指珠三角地区包括广州、深圳、东莞、佛山、中山、珠海、惠州、江门、肇庆市。 2.《广东省开办药品零售企业验收实施标准(2017年修订)》共27项。现场验收时,应逐项进行检查,并逐项作出合格或不合格的评定。除合理缺项外,所有项目全部合格,评定结果为通过;否则为不通过。例如:企业仅申请经营非处方药的,经营处方药所需条件为合理缺项等情况。矚慫润厲钐瘗睞枥庑赖。 5 / 6
3.仅经营非处方药的药品零售企业以及在非珠三角地区乡镇以下(含乡镇)设立的药品零售企业的验收实施标准由各地级以上市药品监督管理部门按照《药品管理法实施条例》、《药品经营许可证管理办法》、《药品经营质量管理规范》相关要求参照本标准制定,并报省局备案。聞創沟燴鐺險爱氇谴净。 4.本实施标准自2017年月日起施行。《广东省开办药品零售企业验收实施标准(2013年修订)》同时废止。残骛楼諍锩瀨濟溆塹籟。 6 / 6
药品注册申请-填表说明 我们保证:本项内容是各申请机构对于本项申请符合法律、法规和规章的郑重保证,各申请机构应当一致同意。 药品上市许可持有人:符合《药品上市许可持有人制度试点方案》试点行政区域、试点品种范围和申请人条件,申请成为药品上市许可持有人的申请人,应根据申请人实际情况勾选“生产企业”或“研发机构”或“科研人员”选项,并填写第二页机构1(受托生产企业)和机构2(申请人)相关的内容。(注:《药品上市许可持有人制度试点方案》正式印发后,可以填写相关内容。) 其他特别申明事项:需要另行申明的事项。 1.本申请属于:系指如果属于申请国产注册品种选“国产药品注册”,如果属于申请进口注册选“进口药品注册”,如果属于申请港澳台注册选“港澳台医药产品注册”。本项为必选项目。 2.申请分类:按药品注册申请的分类填写,属新药的,选新药申请;属按新药管理的,选新药管理的申请;属申请仿制已有国家标准的,选仿制药申请。本项为必选项目。 3.申请事项:按照该申请实际申请事项填写。申请临床研究(包括附加申请免临床研究的),选临床试验;申请生产,选择生产;若仅申请新药证书的,选新药证书。本项为必选项目。当申请分类为新药申请或按新药管理的申请时,生产和新药证书为多选项;当为仿制药申请时,只能选临床或生产。 4.药品注册分类:…、15类)。如果是新药或按新药管理,则化药注册分类只能选择1-2,中药只能选择1-8,生物制品不限制;如果是仿制药,则化药注册分类只能选择3-4,中药只能选择9,生物制品不能选择。 5.附加申请事项:在申请分类和药品注册分类选定后,如同时申请非处方药,则选非处方药,此项不选,默认为申请处方药;如申请仿制的药品属于按非处方药管理的,则此项必须选择非处方药;同时申请减免临床研究,则选减或免临床研究;属于《药品注册管理办法》第四条规定的新药申请申请特殊审批的可选特殊审批程序如选择了特殊审批程序,须填写“药品注册特殊审批程序申请表”。属于上述申请以外的其他附加申请事项(如申请Ⅰ期临床等),可选择其他。选择“其他”的,应当简要填写申请事项。 6.药品通用名称:应当使用正式颁布的国家药品标准或者国家药典委员会《中国药品通用名称》或其增补本收载的药品通用名称。申报复方制剂或者中药制剂自拟药品名称的,应当预先进行药品名称查重工作。本项为必填项目。
开办药品生产企业审批优化准入服务措 施 为深入贯彻落实“证照分离”改革要求,加快营造稳定公平透明可预期的营商环境,就开办药品生产企业审批事项制定如下落实措施: 一、实施全程电子化办理 药品生产许可实行网上办理。申请人登陆新疆维吾尔自治区药品监督管理局网站进行网上申报,凭注册账号查询办理进度。 网上申报地址:https://www.doczj.com/doc/b914458627.html,/WS01/CL0429/ 二、压缩审批时限 审批时限由30个工作日压缩为20个工作日(现场检查不计入审批时限)。 三、精简审批材料 逐项梳理申请材料,与自治区数据共享平台加强数据对接和信息共享,推进完善审批系统,将营业执照、法定代表人或负责人、质量负责人身份证明等材料由申请人提交改为在线获取。 四、公开服务指南 根据法律法规规章制修订情况和改革要求,动态调整服务指南,及时更新行政受理中心窗口、部门网站相关内容,
公示审批流程、受理条件和办理标准。 公示网址:https://www.doczj.com/doc/b914458627.html,/WS01/CL0004/ 五、加强事中事后监管 (一)监管对象 全区药品生产企业 (二)监管内容 药品生产企业执行有关法律法规以及实施《药品生产质量管理规范》的情况 (三)监管措施 1.严格遵照审批标准实施行政审批事项。坚持“严”字当头,严格药品生产许可及药品GMP认证行政审批。 2.加强风险监测与防控,推行分类分级监管。一是督促药品生产企业主动开展风险隐患排查,重点从原料采购、生产过程、出厂检验等方面进行,使企业明确风险点源,积极主动整改,消除隐患;二是深入摸排、梳理药品生产企业各环节风险隐患和监管薄弱环节,对本辖区内的安全风险做到心中有数,将潜在风险纳入监管视野,对可能造成药品质量事件的风险要采取果断措施,将苗头性问题解决在萌芽状态,真正让监管“跑”在风险前面;三是根据企业生产活动
新开办药品生产企业检查评定标准 一、检查评定原则及方法 1、根据《药品生产监督管理办法》(国家食品药品监督管理局第14号令)、《药品生产质量管理规范》(1998年修订),制定本检查评定标准。 2、根据国家食品药品监督管理局的有关规定,新开办药品生产企业必须取得《药品生产许可证》,方可申请药品注册,取得药品注册证后,再进行药品GMP认证。鉴于新开办企业的申请周期较长,故在保证药品质量及安全的前提下,本检查评定标准以检查硬件设施为主。 3、本检查评定标准适用化学原料药及制剂、中成药、血液制品、生物制品、放射性药品、诊断试剂、药用辅料(空心胶囊除外)等药品生产企业的《药品生产许可证》(或增加生产范围)核发。 4、本标准共有检查项目111项。检查评定时,应根据检查范围对照本检查评定标准,确定相应的检查项目和内容。现场检查报告中应明确现场检查涉及检查项目项数。 5、现场检查时,应对所列项目及其涵盖内容进行全面检查;应逐项作出肯定或者否定的评定。凡属不完整、不齐全的项目,称为缺陷项目。 6、结果评定: 缺陷项目结果 ≤30% 通过检查 >30% 未通过检查 二、新开办药品生产企业检查评定标准 1、机构与人员(共6条) 0101企业应建立药品生产和质量管理机构,明确各级机构和人员的职责。 0102 应配备与药品生产相适应的管理人员和技术人员,并具有相应的专业知识。 0103主管生产和质量管理的企业负责人应具有医药或相关专业大专以上学历,并具有药品生产和质量管理经验。 0104中药制剂生产企业主管药品生产和质量管理的负责人应具有中药专业知识。 0105生产管理和质量管理的部门负责人应具有医药或相关专业大专以上学历,并具有药品生产和质量管理的实践经验。
中国药品生产企业排名前一百的名单 1 哈药集团有限公司 2 石家庄制药集团有限公司 3 上海医药集团有限公司 4 广州医药集团有限公司 5 天津医药集团有限公司 6 扬子江药业集团有限公司 7 华北制药集团有限责任公司 8 吉林修正药业集团股份有限公司 9 中国同仁堂(集团)有限责任公司10 北京医药集团有限责任公司11 西安杨森制药有限公司12 东北制药集团有限责任公司13 太极集团有限公司14 杭州华东医药集团有限公司15 拜耳先灵医药有限公司16 浙江海正药业股份有限公司17 步长制药集团18 珠海联邦制药股份有限公司19 齐鲁制药有限公司20 汇仁(集团)有限公司21 中国生物技术集团22 四川科伦实业集团有限公司(医药制造业部份)23 上海罗氏制药有限公司24 江西济民可信集团有限公司25 浙江医药股份有限公司26 诺和诺得(中国)制药有限公司27 山东新华医药集团有限责任公司28 阿斯利康制药有限公司29 北京诺华制药有限公司30 三九医药股份有限公司31 江苏恒瑞医药股份有限公司32 天津天士力集团有限公司(医药制造业部份)33 山东鲁抗医药集团有限公司34 辉瑞制药有限公司(中国·大连)35 丽珠医药集团股份有限公司36 上海复星医药(集团)股份有限公司(医药制造业部份)37 鲁南制药集团股份有限公司38 浙江新和成股份有限公司39 上海实业医药投资股份有限公司(医药制造业部份)40 先声药业有限公司41 利君制药42 中美上海施贵宝制药有限公司43 金陵药业股份有限公司44 康恩贝集团有限公司45 云南白药集团股份有限公司46 杭州赛诺菲安万特民生制药有限公司47 江苏康缘集团有限责任公司(医药制造业部份)48 辅仁药业集团有限公司49 河南省宛西制药股份有限公司50 菏泽睿鹰制药集团有限公司51 寿光富康制药有限公司52 广东康美药业股份有限公司53 黑龙江省珍宝岛制药有限公司54 中美天津史克制药有限公司55 成都地奥制药集团有限公司56 中国(杭州)青春宝集团有限公司57 福建省福抗
《药品生产许可证》核发及其项目变更须知 2011年03月08日发布 一、行政许可项目名称:《药品生产许可证》核发及其项目变更 二、行政许可内容:《药品生产许可证》核发及其项目变更 三、设定行政许可的法律依据 1、《中华人民共和国药品管理法》 2、《中华人民共和国药品管理法实施条例》 3、《药品生产监督管理办法》 四、行政许可数量:无数量限制。 五、行政许可条件: 1.具有依法经过资格认定的药学技术人员、工程技术人员及相应的技术工人; 2.具有与其药品生产相适应的厂房、设施和卫生环境; 3.具有能对所生产药品进行质量管理和质量检验的机构、人员以及必要的仪器设备; 4.具有保证药品质量的规章制度; 5.新增生产范围应符合国家制定的药品行业发展规划和产业政策; 6.药品生产企业新建、改建、扩建生产车间的必须验收合格。 六、申请材料目录: (一)《药品生产许可证》核发 资料编号1、企业提出核发《药品生产许可证》申请;
资料编号2、申请人的基本情况及其相关证明文件; 资料编号3、拟办企业的基本情况,包括拟办企业名称、生产品种、剂型、设备、工艺及生产能力;拟办企业的场地、周边环境、基础设施等条件说明以及投资规模等情况说明; 资料编号4、工商行政管理部门出具的拟办企业名称预先核准通知书或《企业法人营业执照》,生产地址及注册地址、企业类型、法定代表人或者企业负责人; 资料编号5、拟办企业的组织机构图(注明各部门的职责及相互关系、部门负责人); 资料编号6、拟办企业的法定代表人、企业负责人、部门负责人简历,学历和职称证书;依法经过资格认定的药学及相关专业技术人员、工程技术人员、技术工人登记表,并标明所在部门及岗位;高级、中级、初级技术人员的比例情况表; 资料编号7、拟办企业的周边环境图、总平面布置图、仓储平面布置图、质量检验场所平面布置图; 资料编号8、拟办企业生产工艺布局平面图(包括更衣室、盥洗间、人流和物流通道、气闸等,并标明人、 物流向和空气洁净度等级),空气净化系统的送风、回风、排风平面布置图,工艺设备平面布置图; 资料编号9、拟生产的范围、剂型、品种、质量标准及依据; 资料编号10、拟生产剂型及品种的工艺流程图,并注明主要质量控制点与项目; 资料编号11、空气净化系统、制水系统、主要设备验证概况;生产、检验仪器、仪表、衡器校验情况; 资料编号12、主要生产设备及检验仪器目录; 资料编号13、拟办企业生产管理、质量管理文件目录; 资料编号14、《药品生产许可证登记表》(一式二份)及电子文档。
开办药品零售企业,申办人应当向拟办企业所在地设区的市级药品监督管理机构或者省、自治区、直辖市人民政府药品监督管理部门直接设置的县级药品监督管理机构提出申请。受理申请的药品监督管理机构应当自收到申请之日起30个工作日内,依据国务院药品监督管理部门的规定,结合当地常住人口数量、地域、交通状况和实际需要进行审查,作出是否同意筹建的决定。申办人完成拟办企业筹建后,应当向原审批机构申请验收。原审批机构应当自收到申请之日起15个工作日内,依据《药品管理法》第十五条规定的开办条件组织验收;符合条件的,发给《药品经营许可证》。申办人凭《药品经营许可证》到工商行政管理部门依法办理登记注册。 省、自治区、直辖市人民政府药品监督管理部门负责组织药品经营企业的认证工作。药品经营企业应当按照国务院药品监督管理部门规定的实施办法和实施步骤,通过省、自治区、直辖市人民政府药品监督管理部门组织的《药品经营质量管理规范》的认证,取得认证证书。《药品经营质量管理规范》认证证书的格式由国务院药品监督管理部门统一规定。 新开办的药品零售企业,应当自取得《药品经营许可证》之日起30日内,向发给其《药品经营许可证》的药品监督管理部门或者药品监督管理机构申请《药品经营质量管理规范》认证。受理药品零售企业认证申请的药品监督管理机构应当自收到申请之日起7个工作日内,将申请移送负责组织药品经营企业认证工作的省、自治区、直辖市人民政府药品监督管理部门。省、自治区、直辖市人民政府药品监督管理部门应当自收到认证申请之日起3个月内,按照国务院药品监督管理部门的规定,组织对申请认证的药品零售企业是否符合《药品经营质量管理规范》进行认证;认证合格的,发给认证证书。 省、自治区、直辖市人民政府药品监督管理部门应当设立《药品经营质量管理规范》认证检查员库。《药品经营质量管理规范》认证检查员必须符合国务院药品监督管理部门规定的条件。进行《药品经营质量管理规范》认证,必须按照国务院药品监督管理部门的规定,从《药品经营质量管理规范》认证检查员库中随机抽取认证检查员组成认证检查组进行认证检查。 国家实行处方药和非处方药分类管理制度。国家根据非处方药品的安全性,将非处方药分为甲类非处方药和乙类非处方药。 经营处方药、甲类非处方药的药品零售企业,应当配备执业药师或者其他依法经资格认定的药学技术人员。经营乙类非处方药的药品零售企业,应当配备经设区的市级药品监督管理机构或者省、自治区、直辖市人民政府药品监督管理部门直接设置的县级药品监督管理机构组织考核合格的业务人员。 药品经营企业变更《药品经营许可证》许可事项的,应当在许可事项发生变更30日前,向原发证机关申请《药品经营许可证》变更登记;未经批准,不得变更许可事项。原发证机关应当自收到企业申请之日起15个工作日内作出决定。申请人凭变更后的《药品经营许可证》到工商行政管理部门依法办理变更登记手续。 《药品经营许可证》有效期为5年。有效期届满,需要继续经营药品的,持证企业应当在许可证有效期届满前6个月,按照国务院药品监督管理部门的规定申请换发《药品经营许可证》。 药品经营企业终止经营药品或者关闭的,《药品经营许可证》由原发证机关缴销。
药品生产许可证申请材料清单 (药品上市许可持有人自行生产的情形) 1.药品生产许可证申请表; 2.基本情况,包括企业名称、生产线、拟生产品种、剂型、工艺及生产能力(含储备产能); 3.企业的场地、周边环境、基础设施、设备等条件说明以及投资规模等情况说明; 4.营业执照(申请人不需要提交,监管部门自行查询); 5.组织机构图(注明各部门的职责及相互关系、部门负责人); 6.法定代表人、企业负责人、生产负责人、质量负责人、质量受权人及部门负责人简历、学历、职称证书和身份证(护照)复印件;依法经过资格认定的药学及相关专业技术人员、工程技术人员、技术工人登记表,并标明所在部门及岗位;高级、中级、初级技术人员的比例情况表; 7.周边环境图、总平面布置图、仓储平面布置图、质量检验场所平面布置图; 8.生产工艺布局平面图(包括更衣室、盥洗间、人流和物流通道、气闸等,并标明人、物流向和空气洁净度等级),空气净化系统的送风、回风、排风平面布置图,工艺设备平面布置图; —1 —
9.拟生产的范围、剂型、品种、质量标准及依据; 10.拟生产剂型及品种的工艺流程图,并注明主要质量控制点与项目、拟共线生产情况; 11.空气净化系统、制水系统、主要设备确认或验证概况;生产、检验用仪器、仪表、衡器校验情况; 12.主要生产设备及检验仪器目录; 13.生产管理、质量管理主要文件目录; 14.药品出厂、上市放行规程; 15.申请材料全部内容真实性承诺书; 16.凡申请企业申报材料时,申请人不是法定代表人或负责人本人,企业应当提交《授权委托书》; 17.按申请材料顺序制作目录。 中药饮片等参照自行生产的药品上市许可持有人申请要求提交相关资料。疫苗上市许可持有人还应当提交疫苗的储存、运输管理情况,并明确相关的单位及配送方式。 —2 —
烟台市药品零售(连锁)企业开办程序 一、申办范围 烟台市申请药品零售(连锁)企业的单位和个人。 二、开办企业申请 ㈠申办时应提报的资料 1、《药品经营许可证申请书》(附件1); 2、设立药品零售(连锁)企业有关情况说明(设立原因、可行性、企业名称及地址、仓库地址及周边环境、经营方式、经营范围、所属药店数量、名称、人员组成情况等); 3、企业名称预先核准通知书; 4、企业负责人员和质量管理人员情况表(包括企业法定代表人、质量负责人、质量部门负责人、质量管理员)和有关人员简历、资质(职称、学历)、离职证明、身份证复印件(附件2); 5、企业法定代表人、企业负责人、企业质量负责人和质量部门负责人(或人员)无《药品管理法》第7 6、83条规定的情形的证明(附件3); 6、拟建仓库平面图; 7、企业违法经营情况核查表(附件4); 8、药监部门认为需要提供的其他资料。
申报资料一式二份,一律使用A4纸,左侧装订成册。 ㈡申办程序 资格审查:拟开办企业登录山东省食品药品监督管理局网站办事大厅行政审批申报端申请筹建(填写申请表→上传附件-申报时应提供的资料→提交申请)。 企业可输入申办序号和访问密码查询业务办理进度,在收到“预受理”的通知后,将申请材料报驻地药监局受理、初审→烟台市行政审批中心食药监局窗口复审—审定—办理发放《开办药品零售(连锁)企业批件》,5个工作日内申请企业或申请人可在网上查询。 审查不合格或需补正材料,由驻地药监局通过行政审批受理端将意见反馈外网,企业5个工作日内可从网上查询,补正后重新提交申请。 三、开办企业验收申请 ㈠申请验收时应提报的资料 1、《药品经营许可证申请审查表》(附件5); 2、对照零售(连锁)验收实施标准的自查报告; 3、企业负责人员和质量管理人员情况表(包括企业法定代表人、质量负责人、质量部门负责人、质量管理员)和有关人员资质(职称、学历)复印件(附件2); 4、企业验收养护人员情况表(附件6)和资质证明复印件;
药品生产企业审批程序 一、开办条件 开办药品生产企业应当符合国家发布的药品行业发展规划和产业政策并具备以下条件: (一)具有依法经过资格认定的药学技术人员、工程技术人员及相应的技术工人; (二)具有与其药品生产相适应的厂房、设施和卫生环境; (三)具有能对所生产药品进行质量管理和质量检验的机构、人员以及必要的仪器设备; (四)具有保证药品质量的规章制度。 二、申请验收 (一)申办人完成筹建后,应当向省食品药品监督管理局申请验收,并提交以下资料: 1、工商行政管理部门出具的拟办企业名称预先核准通知书,生产及注册地址、企业类型、法定代表人; 2、拟办企业的组织结构图(注明各部门的职责及相互关系、部门负责人); 3、拟办企业的部门负责人、部门负责人简历、学历和职称证书;依法经过资格认定的药学及相关专业技术人员、工程技术人员、技术工人登记表,并标明所在部门及岗位;高、中、初级技术人员的比例情况表; 4、拟办企业的周边环境图、总平面布置图、仓储平面布置图、质量检验场所平面布置图;
5、拟办企业生产工艺布局平面图(包括更衣室、盥洗间、人流和物流通道、气闸等,并标明人、物流向和空气洁净度等级),空气净化系统的送风、回风、排风平面布置图,工艺设备平面布置图; 6、拟生产的围、剂型、品种、质量标准及依据; 7、拟生产剂型或品种的工艺流程图,并标明主要质量控制点与项目; 8、空气净化系统、制水系统、主要设备验证概况;生产、检验仪器、仪表、衡器校验情况; 9、主要生产设备及检验仪器目录; 10、拟办企业生产管理、质量管理文件目录。 (二)省食品药品监督管理局在收到申请验收的完整资料之日起15个工作日,组织现场检查验收。 三、核准许可 1、经现场检查验收合格的,省食品药品监督管理局应在5个工作日作出是否批准的决定,并向申办人核发《药品生产许可证》。验收不合格或不予批准的,应当书面通知申办人并说明理由。 2、申办人凭已取得的《药品生产许可证》到当地工商行政管理部门依法办理登记注册手续。
附件4 开办药品零售企业验收实施标准 (试行 第一章机构与人员 第一条企业应设置质量管理机构或专(兼职质量管理人员,具体负责企业质量管理工作 第二条企业、企业法定代表人或企业负责人、质量管理负责人无《药品管理法》第76条、83条规定的情形。 第三条企业质量管理负责人,省辖市城区应具有执业药师或药师(含中药师以上专业技术职称,县(市城区应具有药士(含中药士以上的技术职称,并有1年以上(含1年药品经营质量管理工作经验。经营乙类非处方药以及在农村乡镇以下地区设立的零售药店,质量管理负责人应具有高中以上文化程度。 第四条经营处方药的零售药店的处方审核人员,省辖市城区应具有执业药师或主管药师(含主管中药师以上技术职称,县(市城区应具有执业药师或药师(含中药师以上专业技术职称,乡镇及其以下应具有药士(含中药士或医士以上技术职称。 第五条经营处方药、甲类非处方药的企业,从事质量管理工作的人员:县及县以上城市应具有药师(含中药师以上的技术职称,乡镇及其以下应具有药士(含中药士或医士以上技术职称。 经营乙类非处方药以及在乡镇以下农村设立的零售药店,从事质量管理工作的人员应具有高中以上学历。 以上人员应在职在岗,不得在其他单位兼职。
第六条企业从事药品验收工作的人员以及营业员应具有高中(含以上文化程度。如为初中文化程度,须具有5年以上从事药品经营工作的经历。 第七条企业从事质量管理(含质量管理负责人和验收工作的人员以及营业员,应经专业或岗位培训,并经地市级(含以上药品监督管理部门考试合格,取得岗位合格证书后方可上岗。 第八条企业在质量管理、药品验收、养护、保管、营业员等直接接触药品岗位工作的人员,应进行健康检查并建立档案。患有精神病、传染病和其他可能污染药品或导致药品发生差错疾病的人员,不得从事直接接触药品及其包装的工作。 第二章设施与设备 第九条企业应有与经营药品规模相适应的营业场所和药品仓库,并配置调节温度、湿度的设备。地市城区药店营业场所面积不低于100平方米、仓库面积不低于40平方米;县(市城区药店营业场所面积不低于80平方米、仓库面积不低于30平方米;乡镇所在地药店营业场所面积不低于40平方米、仓库面积不低于20平方米;经营非处方药以及在乡镇以下农村设立的零售药店营业场所面积不低于20平方米。 企业变更经营地址按新开办标准验收。 第十条企业营业场所、仓库、办公生活等区域应分开,并做到环境整洁、无污染物。在超市等其它商业企业内设立的零售药店,必须具有独立的区域。 第十一条企业营业场所、营业用货架、柜台齐备,销售柜组标志醒目。 第十二条企业营业场所及库房内地面和墙壁平整、清洁。 第十三条企业应根据需要配置符合药品特性要求的冷藏存放设备。 第十四条企业应配置保持药品与地面之间有一定距离的设备。 第十五条企业应配置药品防尘、防潮、防污染和防虫、防鼠、防霉变等设备。
2014版四川省药品生产企业名录469家
34四川凯京制药有 限公司 刘楚 言 陈中 燕 有限责任公司 (台港澳与境 内合资) 四川省眉山市彭 山县城南经济开 发区 片剂、颗粒剂、硬胶囊剂、丸剂(糊丸、大蜜丸、浓缩 丸、水丸)(含中药前处理提取)、原料药(柠檬烯)、 中药饮片(净制、切制、炒制、煅制、蒸制、烫制、煮 制、燀制、酒制、醋制、盐制、姜汁炙、油炙、蜜炙) *片剂、颗粒剂、硬胶囊剂(含中药前处理提取)* 川 20100152 HabZ bY 2014/1/21 2015/12/31 35成都金江制药有 限公司 付常 清 付常 清 自然人出资有 限责任公司 成都市双流县黄 水镇杨公村 原料药(葛根素、胆酸钠、黄芩苷、猪去氧胆酸、胆酸) * 川 20100371 Ha 2011/1/1 2015/12/31 36四川辰龙制药有 限公司 张红 波 冷钊 莹 其他有限责任 公司 眉山市东坡区大 石桥 原料药(盐酸洛非西定)、片剂、硬胶囊剂、颗粒剂、 栓剂、散剂、酊剂、合剂、丸剂* 川 20100372 HabZ b 2012/1/4 2015/12/31 37四川子仁制药有 限公司 李昌 华 高传 敬 有限责任公司 广汉市深圳路西 三段 颗粒剂、片剂、丸剂、硬胶囊剂(含中药前处理提取)、 原料药(谷氨酸诺氟沙星、兰索拉唑、炎琥宁、埃索美 拉唑钠、盐酸度洛西丁、埃索美拉唑钠、盐酸度洛西丁) * 川 20100373 HabZ b 2011/1/1 2015/12/31 38四川省迪威药业 有限责任公司 张德 超 张德 超 有限责任公司 (自然人投资 或控股) 四川省资中县重 龙镇迪威路1号 酊剂(外用)(含中药前处理提取)、片剂、硬胶囊剂、 颗粒剂、糖浆剂、合剂、软膏剂、栓剂、搽剂* 川 20100255 Zb 2013/12/30 2015/12/31 39四川省营山县景 弘中药饮片厂 全春 平 全春 平 私有 营山县三星工业 经济区北干道南 侧 中药饮片 (净制、切制、炒制、烫制、煅制、制炭、蒸 制、煮制、炖制、燀制、酒制、醋制、盐制、姜汁炙、 蜜炙、煨制、油炙)* 川 20100036 Y 2011/1/1 2015/12/31 40四川康定金珠制 药有限责任公司 张燕 李永 光 有限责任公司康定县姑咱镇片剂、丸剂、煎膏剂(膏滋)* 川 20100037 Zb 2013/7/30 2015/12/31 41四川御鼎堂中药 饮片有限公司 王颖 群 王颖 群 有限责任(公 司) 四川省汉源县甘 溪坝工业园区 中药饮片(净制、切制、炒制、烫制、煅制、制炭、蒸 制、煮制、炖制、燀制、酒制、醋制、盐制、姜汁炙、 蜜炙、油炙、制霜、水飞、煨制)、毒性饮片(净制、 切制、炒制、烫制、蒸制、煮制、醋制、姜汁炙)* 川 20120424 Y 2012/2/23 2015/12/31 42四川峨边荣成气 体有限公司 杨荣 成 杨荣 成 有限责任公司 峨边县沙坪镇核 桃坪工业区 医用气体(液态氧)* 川 20110422 Q 2011/12/28 2015/12/31 43四川绵阳万利兴 企业有限公司 任伟 陈文 开 有限责任公司 (自然人投资 或控股) 绵阳市高新开发 区永兴工业区 中药饮片(净制、切制、蒸制)* 川 20100395 Y 2011/1/1 2015/12/31 44成都康弘生物科 技有限公司 柯尊 洪 陈粟 有限责任公司 (法人独资) 成都市金牛区蜀 西路36号 生物工程产品(重组人血管内皮生长因子受体-抗体融 合蛋白注射液、康柏西普眼用注射液)* 川 20110400 S 2014/3/12 2015/12/31
药品经营企业筹建申请表
说明:1、申请前应当阅读《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》、《药品经营许可证管理办法》,并确知申请人享有的权利和应履行的义务。 2、申请人应对其提交的文件、证件和所填写内容的真实性承担责任。 3、筹建申请完成审批后,由经办人制作《同意/不同意筹建药品经营企业通知书》,通知申请人。 4、本表一份,由所在地食品药品监督管理局留存。
药品经营许可证申请审查表 企业名称: 申请人: 填报日期:年月日保山市食品药品监督管理局制
填报说明 一、申办人完成企业筹建工作后,应填写《药品经营许可证申请审查表》一份,报所在地食品药品监督管理局。 二、内容填写应准确、完整,不得涂改。 三、申办人在报送《药品经营许可证申请审查表》时,必须随附以下申报材料: 1、营业场所、仓库平面布置图及房屋产权或使用权证明; 2、企业法定代表人、企业负责人、质量负责人、质量管理员和驻店药师身份证、学历证、资格证及健康证复印件;企业负责人、质量管理员和驻店药师1吋免冠彩色照片各1张; 3、依法经过资格认定的药学专业技术人员资格证书及聘书复印件; 4、企业质量管理文件目录; 5、主要设施设备发票复印件; 6、营业场所外观照片、布局照片各1张; 7、云南省药品经营许可证管理实施细则规定提供的其他材料。 申报资料应统一使用A4纸,标明目录及页码并装订成册。
企业基本情况
其他欺骗手段取得《药品生产许可证》、《药品经营许可证》、《医疗机构制剂许可证》或者药品批准证明文件的,吊销《药品生产许可证》、《药品经营许可证》、《医疗机构制剂许可证》或者撤销药品批准证明文件,五年内不受理其申请,并处一万元以上三万元以下的罚款。
关于重申新开办药品生产经营企业有关规定的通知 国药管办[2000]237号 各省、自治区、直辖市药品监督管理局或卫生厅(局)、医药管理部门: 药品是关系人民群众健康与生命安全的特殊商品。加强对药品的严格管理,确保药品质量,保障人民群众用药安全有效、方便及时,是维护人民身体健康,保持社会稳定,促进我国医药事业健康发展的一项重要工作。 为加强药品监督管理工作,国务院曾于1994年9月29日下发了《国务院关于进一步加强药品管理工作的紧急通知》(国发[1994]53号),国务院办公厅于1996年4月16日发出《国务院办公厅关于继续整顿和规范药品生产经营秩序加强药品管理工作的通知》(国办发[1996]14号),以上两个《通知》对加强药品监督管理,整顿和规范药品生产经营秩序提出了具体要求,对新开办药品生产经营企业作出了严格规定。 卫生部、原国家医药管理局、国家中医药管理局为认真贯彻国发[1994]53号和国办发[1996]14号文件精神,对新开办药品生产经营企业作出具体规定和严格要求。自1995 年12月1日起,新开办药品生产经营企业,须经国务院卫生行政部门、药品生产经营行业主管部门批准。特别是1998年国家药品监督管理局组建后,加大了药品监督管理工作的力度,于1999年1月5日印发了《开办药品生产企业暂行规定》(国药管安[1999]5号),规定了新开办药品生产企业的立项条件和审批程序。又于1999年1月21日发出了“关于暂缓换发《药品生产(经营)企业合格证》、《药品生产(经营)企业许可证》、《制剂许可证》有关问题的通知”(国药管市[1999]15号),明确规定暂停受理新开办药品经营企业和医疗单位制剂室的申请、审查及发证工作。 各级药品监督管理部门按照国务院及其有关部门的要求和我局的具体规定,严格对药品生产经营企业实施监督管理,对现有药品生产经营企业进行清理整顿,药品生产经营管理水平有了提高,药品生产经营秩序有了好转。对新开办药品生产经营企业按程序和条件进行审批和管理,遏制了乱开办、乱审批药品生产经营企业的势头,药品生产经营秩序有所好转,取得了一定成效。但目前在个别地区、个别部门仍然存在乱立项、乱审批药品生产经营企业的现象,不按规定的立项条件和程序进行审批,甚至弄虚作假、变更审批日期、越权审批新开办药品生产经营企业,造成盲目投资、低水平重复建设、产品技术含量和经营素质不高,浪费国家有限的财力和资源,不利于我国医药事业持续、稳定、健康发展。对此,我局对开办药品生产、经营企业的有关规定重申如下: 一、各级药品监督管理部门应认真领会江泽民总书记“三个代表”的论述,以国家整体利益为重,站在对人民群众的健康与生命安全负责的高度,充分认识加强药品监督管理工作,整顿规范药品生产经营秩