
第七单元生物的变异、语种和进化第24讲 基因突变和基因重组
[考纲要求] 1.基因重组及其意义(Ⅱ)。2.基因突变的特征和原因(Ⅱ)。
考点一 聚焦基因突变
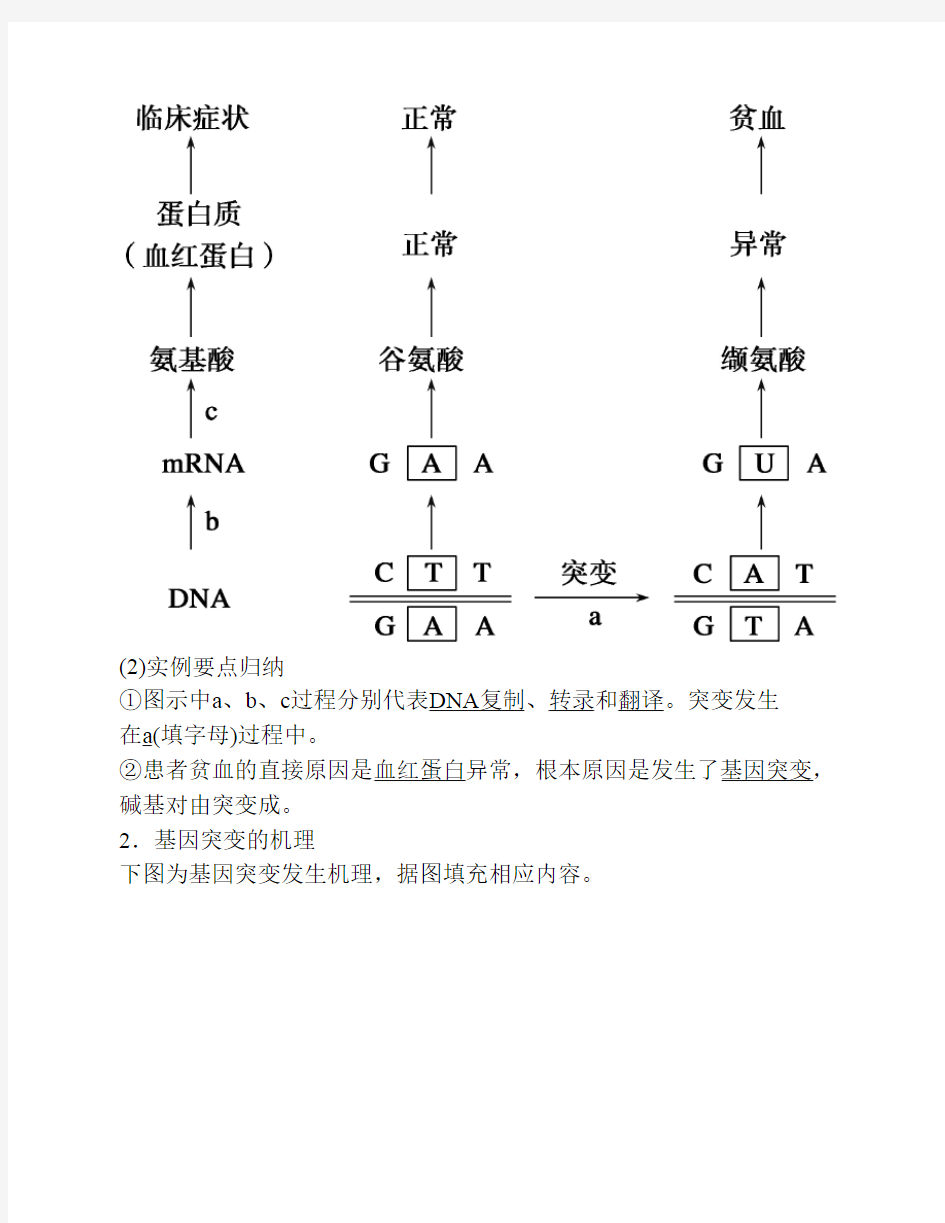
1.实例:镰刀型细胞贫血症
(1)病因图解如下:
(2)实例要点归纳
①图示中a、b、c过程分别代表DNA复制、转录和翻译。突变发生
在a(填字母)过程中。
②患者贫血的直接原因是血红蛋白异常,根本原因是发生了基因突变,碱基对由突变成。
2.基因突变的机理
下图为基因突变发生机理,据图填充相应内容。
注:④⑤⑥填写基因结构改变的类型。
3.基因突变的特点
(1)普遍性:一切生物都可以发生。
(2)随机性:生物个体发育的任何时期和部位。
(3)低频性:自然状态下,突变频率很低。
(4)不定向性:一个基因可以向不同的方向发生突变。
(5)多害少利性:有些基因突变,可使生物获得新性状,适应改变的环境。
4.基因突变的意义
(1)新基因产生的途径。
(2)生物变异的根本来源。
(3)生物进化的原始材料。
[思维诊断]
(1)某二倍植物染色体上的等位基因B 1突变为B 2可能是由于碱基对替换
或碱基对插入造成的(2013·海南,22A 改编)( √ )
(2)积聚在甲状腺细胞内的131I 可能直接诱发甲状腺滤泡上皮细胞基因突
变并遗传给下一代(2011·安徽,4D)( × )
(3)DNA 复制时发生碱基对的增添、缺失或改变,导致基因突变(2011·江
苏,22A)( √ )
(4)观察细胞有丝分裂中期染色体形态可判断基因突变发生的位置(2010·
江苏,6C)( ×
)
题组一 基因突变的实质分析
1.一种α链异常的血红蛋白叫作Hbwa ,其137位以后的氨基酸序列及对
应的密码子与正常血红蛋白(HbA)的差异如下:
血红
蛋白
部分α链血红蛋白的密码子及其氨基酸的顺序137
138139140141142143144145 HbA ACC 苏氨酸UCC 丝氨酸AAA 赖氨酸UAC 酪氨酸CGU 精氨酸
UAA 终止 Hbwa ACC 苏氨酸UCC 丝氨酸AAU 天冬酰胺ACC 苏氨酸GUU 缬氨酸AAG 赖氨酸CCU 脯氨酸CGU 精氨酸
UAG 终止下列相关叙述中正确的是( )
A .异常血红蛋白异常的根本原因是血红蛋白发生了突变
B.控制α链异常的血红蛋白(Hbwa)的基因中一个碱基对发生了替换C.控制α链异常的血红蛋白(Hbwa)的基因增添了一个碱基对
D.控制α链异常的血红蛋白(Hbwa)的基因缺失了一个碱基对
答案 D
2.如果一个基因的中部缺失了1个核苷酸对,不可能的后果是( ) A.没有蛋白质产物
B.翻译为蛋白质时在缺失位置终止
C.控制合成的蛋白质减少多个氨基酸
D.翻译的蛋白质中,缺失部位以后的氨基酸序列发生变化
答案 A
解析 对于基因中能编码蛋白质的脱氧核苷酸序列,若在其中部缺失一个核苷酸对,经转录后,在信使RNA上可能提前形成终止密码子,使翻译过程在基因缺失位置终止,使相应控制合成的蛋白质减少多个氨基酸。或者因基因的中部缺失1个核苷酸对,使相应信使RNA上从缺失部分开始向后的密码子都发生改变,从而使合成的蛋白质中,在缺失部位以后的氨基酸序列都发生变化。
思维辨析
基因突变与生物性状的关系
(1)基因突变引起生物性状的改变
碱基对影响范
围
对氨基酸序列的影响
替换小只改变1个氨基酸或不改变
增添大不影响插入位置前,但影响插入位置后的序列
缺失大不影响缺失位置前,但影响缺失位置后的序列
(2)基因突变未引起生物性状改变的原因
①突变部位:基因突变发生在基因的非编码区。
②密码子简并性:若基因突变发生后,引起了mRNA上的密码子改变,但由于一种氨基酸可对应多个密码子,若新产生的密码子与原密码子对应的是同一种氨基酸,此时突变基因控制的性状不改变。
③隐性突变:若基因突变为隐性突变,如AA中其中一个A→a,此时性状也不改变。
题组二 基因突变的特点分析
3.如图所示为结肠癌发病过程中细胞形态和部分染色体上基因的变化。下列表述正确的是( )
A.图示中与结肠癌有关的基因互为等位基因
B.结肠癌的发生是多个基因突变累积的结果
C.图中染色体上基因的变化说明基因突变是随机和定向的
D.上述基因突变一定可以传给子代个体
答案 B
解析 等位基因是指位于同源染色体的同一位置上,控制相对性状的基因,故图示中与结肠癌有关的基因不能称为等位基因;由图可知,结肠癌的发生是多个基因突变累积的结果;基因突变具有随机性和不定向性;图示中的基因突变发生在体细胞中,不可能传给下一代个体。4.DNA聚合酶是细胞复制DNA的重要作用酶,DNA聚合酶保证了复制的准确性,某些突变的DNA聚合酶(突变酶)比正常的DNA聚合酶精确
度更高,从而减少了基因突变的产生。下列有关叙述正确的是( ) A.这些突变酶大大提高了DNA复制的速度
B.翻译这些突变酶的mRNA序列不一定发生改变
C.这些突变酶作用的底物是四种核糖核苷酸
D.这些突变酶的产生不利于生物的进化
答案 D
解析 这些突变酶只是使DNA复制的精确度更高,并不能提高DNA复制的速度,故A项错误。既然发生了基因突变,故翻译突变酶的mRNA 序列必然会发生改变,故B项错误;突变酶催化的是DNA的复制,其作用的底物为4种脱氧核苷酸,故C项错误;突变酶减少了基因突变的发生,因此不利于生物的进化,故D项正确。
归纳提升
由基因突变可联系的知识
(1)联系细胞分裂:在细胞分裂间期,DNA复制时,DNA分子双链打开,脱氧核苷酸链极其不稳定,容易发生碱基对的变化。
(2)联系细胞癌变:癌细胞就是原癌基因和抑癌基因发生基因突变所致。
(3)联系生物育种:诱变育种就是利用基因突变的原理进行的。
(4)联系生物进化:基因突变为生物进化提供原始材料。
题组三 显性突变与隐性突变的判断
5.一只雌鼠的一条染色体上某基因发生了突变,使野生型(一般均为纯合子)变为突变型。让该雌鼠与野生型雄鼠杂交,F1的雌、雄鼠中均有野生型和突变型。由此可以推断,该雌鼠的突变为( )
A.显性突变
B.隐性突变
C.Y染色体上的基因突变
D.X染色体上的基因突变
答案 A
解析 由于这只野生型雄鼠为纯合子,而突变型雌鼠有一条染色体上的
基因发生突变,F1的雌、雄鼠中出现性状分离,所以该突变基因为显性基因,即该突变为显性突变,突变基因可能在常染色体上,也可能在X 染色体上。
6.(2010·江苏,6)育种专家在稻田中发现一株十分罕见的“一秆双穗”植株,经鉴定该变异性状是由基因突变引起的。下列叙述正确的是( ) A.这种现象是由显性基因突变成隐性基因引起的
B.该变异株自交可产生这种变异性状的纯合个体
C.观察细胞有丝分裂中期染色体形态可判断基因突变发生的位置D.将该株水稻的花粉离体培养后即可获得稳定遗传的高产品系
答案 B
解析 这种变异既可能是显性突变,也可能是隐性突变,A项错误;若是显性突变,则该个体是杂合子;若是隐性突变,则该个体是隐性纯合子,这两种情况下自交后代中均会产生这种变异性状的纯合个体,B项正确;观察细胞有丝分裂过程中染色体形态用光学显微镜,在光学显微镜下不可能观察到基因突变发生的位置,C项错误;假设突变是显性突变,则该杂合子的花粉离体培养后将形成显性单倍体和隐性单倍体两种单倍体,需经染色体加倍和筛选后才能得到稳定遗传的高产品系,D项错误。
技法提炼
显性突变和隐性突变的判断
(1)类型
(2)判定方法
①选取突变体与其他已知未突变纯合子杂交,据子代性状表现判断。
②让突变体自交,观察子代有无性状分离而判断。
题组四 突变基因具体位置的判断
7.已知a、b、c、d是某细菌DNA片段上的4个基因,右图中W表示野生型,①、②、③分别表示三种缺失不同基因的突变体,虚线表示所缺失的基因。若分别检测野生型和各种突变体中某种酶的活性,发现仅在野生型和突变体①中该酶有活性,则编码该酶的基因是( )
A.基因a B.基因b
C.基因c D基因d
答案 B
解析 从图中可以看出:突变体①缺失d基因;突变体②缺失b、c、d基因;突变体③缺失a、b基因。由题意可知,分别检测野生型和各种突变体中某种酶的活性,发现仅在野生型和突变体①中该酶有活性,说明决定该酶的基因在野生型和突变体①中都有,而在其他突变体中没有,因此编码该酶的是基因b。
8.某炭疽杆菌的A基因含有A1~A66个小段,某生物学家分离出此细菌A基因的2个缺失突变株K(缺失A2、A3)、L(缺失A3、A4、A5、A6)。将一未知的点突变株X与突变株L共同培养,可以得到转化出来的野生型细菌(即6个小段都不缺失);若将X与K共同培养,得到转化的细菌都为非野生型。由此可判断X的点突变最可能位于A基因的( )
A.A2小段 B.A3小段
C.A4小段 D.A5小段
答案 A
解析 从题干的信息可看出突变株L缺失A3、A4、A5、A6小段,但具有A1、A2小段,其与点突变株X共同培养后,可以得到转化出来的野生型细菌,那么点突变株X应具有A3、A4、A5、A6小段,所以未知的点突变可能位于A1、A2小段。突变株K缺失A2、A3小段,其与点突变株X共同培养后,得到转化的细菌都是非野生型,而只有当该点突变位于突变株K的缺失小段上时才能得到上述结果,因此点突变株X的点突变最可能位于A基因的A2小段。故选A。
技法提炼
突变基因具体位置的判断
(1)利用野生型的个体与缺失不同基因的突变体比较,根据有无特定酶的活性判断编码该酶的基因对应的位置。
(2)将一缺失未知基因片段的突变株与已知的缺失不同基因片段的突变株分别培养,根据是否转化为野生型个体判断未知个体的缺失基因对应的位置。
题组五 基因突变过程图解规范审答案例
考点二 基因重组与基因突变的比较
1.概念:基因重组是指在生物体进行有性生殖的过程中,控制不同性
状的基因的重新组合。
2.类型
(1)减数第一次分裂的后期,非同源染色体上的非等位基因自由组合。
(2)减数分裂形成四分体时期,位于同源染色体上的等位基因有时会随着
非姐妹染色单体的交换而发生交换,导致染色单体上的基因重组。
3.根据A 、B 图中的细胞分裂图来确定变异的类型
比较项
目
A图B图
分裂类型有丝分
裂
减数分裂
变异类型基因突
变
基因突变或基
因重组
4.基因突变和基因重组在变异、进化及生物多样性上的不同点
比较项目基因突变基因重组
生物变异生物变异的根本来
源
生物变异的重要来源
生物进化为生物进化提供原
始材料
为生物进化提供丰富的
材料
生物多样性形成生物多样性的
根本原因
形成生物多样性的重要
原因之一
[深度思考]
(1)雌雄配子随机结合属于基因重组吗?
提示 不属于,基因重组发生在减数分裂形成配子时。
(2)AaAA、Aa、aa属于基因重组吗?
提示 不属于,基因重组的实质是控制不同性状的基因重新组合。
题组一 基因重组的判断与分析
1.下列关于基因重组的说法,不正确的是( )
A.生物体进行有性生殖的过程中控制不同性状的基因的重新组合属于基因重组
B.减数分裂过程中,同源染色体的姐妹染色单体之间的局部交换,可导致基因重组
C.减数分裂过程中,非同源染色体上的非等位基因自由组合可导致基因重组
D.一般情况下,水稻雄蕊内可发生基因重组,而根尖中则不能
答案 B
解析 减数分裂四分体时期,同源染色体的非姐妹染色单体之间局部交换可导致基因重组,姐妹染色单体上含有相同基因不会导致基因重组。一般情况下,减数分裂过程中存在基因重组,而根尖细胞只能进行有丝分裂,所以不会发生基因重组。
2.下列育种或生理过程中,没有发生基因重组的是( )
普通棉花 离体花药 R型活菌 初级精母细胞
导入单倍+S型形成
抗虫体育种死菌
基因
抗虫棉花 纯合子植株 S型活菌 次级精母细胞
A B C D
答案 B
解析 B项中单倍体育种是将离体的花药通过植物组织培养形成单倍体幼苗,然后再用秋水仙素处理单倍体幼苗,使染色体加倍,整个过程中没有发生基因重组。
题组二 根据图示判断基因重组和基因突变
3.如图是某二倍体(AABb)动物的几个细胞分裂示意图。
据图判断不正确的是( )
A.甲图表明该动物发生了基因突变
B.乙图表明该动物在减数第一次分裂前的间期发生基因突变
C.丙图表明该动物在减数第一次分裂时发生交叉互换
D.甲、乙、丙所产生的变异均可遗传给后代
答案 D
解析 据题干中甲、乙、丙是同一个二倍体动物的几个细胞分裂图分析可知:甲图表示有丝分裂后期,染色体上基因A与a不同,是基因突变的结果;乙图表示减数第二次分裂后期,其染色体上基因A与a不同,基因a只能是基因突变的结果;丙细胞也属于减数第二次分裂后期图,基因B 与b所在的染色体颜色不一致,则染色体上基因B与b不同是交叉互换造成的。甲细胞分裂产生体细胞,产生的变异一般不遗传给后代。
4.
(2012·江苏,14)某植株的一条染色体发生缺失突变,获得该缺失染色体的花粉不育,缺失染色体上具有红色显性基因B,正常染色体上具有白色隐性基因b(见右图)。若以该植株为父本,测交后代中部分表现为红色性状。下列解释最合理的是( )
A.减数分裂时染色单体1或2上的基因b突变为B
B.减数第二次分裂时姐妹染色单体3与4自由分离
C.减数第二次分裂时非姐妹染色单体之间自由组合
D.减数第一次分裂时非姐妹染色单体之间交叉互换
答案 D
解析 由于“缺失染色体的花粉不育”,若以该植株为父本,测交后代理论上应该全部表现为白色。若出现部分红色性状,可能是图示染色单体1或2上的基因b突变为B,但这种可能性很小,故A项不是最合理的;减数第二次分裂时,即使姐妹染色单体3与4分离,由于其缺失突变,产生的花粉也不育,因而B项不合理;减数第二次分裂时姐妹染色单体分开成为染色体,分别移向细胞两极,不发生自由组合,因而C项也不合理;最可能的原因是减数第一次分裂的四分体时期,由于四分体中的非姐妹染色单体之间发生了交叉互换,基因B转移到染色单体1或2上,D 项最合理。
思维建模
基因突变和基因重组的判断
(1)根据概念判断:①如果是基因内部结构发生了变化(即基因内部发生了碱基对的增添、缺失或改变),产生了新基因,则为基因突变;②如
果是原有基因的重新组合(包括同源染色体上非姐妹染色单体之间交叉互换而引起的基因重组,非同源染色体上非等位基因的自由组合而引起的基因重组,基因工程中的基因重组,R型细菌转化为S型细菌中的基因重组等),则为基因重组。
(2)根据细胞分裂方式判断:①如果是有丝分裂过程中姐妹染色单体上的基因不同,则为基因突变的结果;②如果是减数分裂过程中姐妹染色单体上的基因不同,可能是基因突变或交叉互换(基因重组)的结果。(3)根据染色体图示判断:①如果是有丝分裂后期,图中两条子染色体上的两基因不同,则为基因突变的结果;②如果是减数第二次分裂后期,图中两条子染色体(颜色一致)上的两基因不同,则为基因突变的结果;
③如果是减数第二次分裂后期,图中两条子染色体(颜色不一致)上的两基因不同,则为交叉互换(基因重组)的结果。
网络构建
要语强记
1.基因突变、基因重组和染色体变异都是可遗传变异的来源,原因是三者细胞内遗传物质都发生了变化。
2.基因突变是由于DNA分子中发生碱基对的替换、增添和缺失,而引起的基因结构的改变。
3.基因突变是新基因产生的途径,是生物变异的根本来源,是生物进化的原始材料。
4.基因重组是指在生物体进行有性生殖的过程中,控制不同性状的基
因的重新组合。基因重组也是生物变异的来源之一,对生物的进化也具
有重要的意义。
5.基因重组来源于减数分裂形成配子时,非同源染色体上的非等位基因的自由组合及同源染色体上的非姐妹染色单体的交叉互换。
探究高考 明确考向
1.(2014·浙江,6)除草剂敏感型的大豆经辐射获得抗性突变体,且敏感基因与抗性基因是1对等位基因。下列叙述正确的是( )
A.突变体若为1条染色体的片段缺失所致,则该抗性基因一定为隐性基因
B.突变体若为1对同源染色体相同位置的片段缺失所致,则再经诱变可恢复为敏感型
C.突变体若为基因突变所致,则再经诱变不可能恢复为敏感型
D.抗性基因若为敏感基因中的单个碱基对替换所致,则该抗性基因一定不能编码肽链
答案 A
解析 A项,突变体若为1条染色体的片段缺失所致,缺失后表现为抗性突变体,则可推测出除草剂敏感型的大豆是杂合子,缺失片段中含有显性基因,缺失后即表现了隐性基因控制的性状;B项,突变体若为1对同源染色体相同位置的片段缺失所致,则会导致控制该性状的一对基因都丢失,经诱变后不可能使基因从无到有;C项,突变体若为基因突变所致,由于基因突变具有不定向性,所以经诱变仍可能恢复为敏感型;D项,抗性基因若为敏感基因中的单个碱基对替换所致,若该碱基对不在基因的前端(对应起始密码)就能编码肽链,肽链的长短变化需要根据突变后对应的密码子是否为终止密码子来判断。
2.(2013·海南,22)某二倍体植物染色体上的基因B2是由其等位基因B1突变而来的,如不考虑染色体变异,下列叙述错误的是( )
A.该突变可能是碱基对替换或碱基对插入造成的
B.基因B1和B2编码的蛋白质可以相同,也可以不同
C.基因B1和B2指导蛋白质合成时使用同一套遗传密码
D.基因B1和B2可同时存在于同一个体细胞中或同一个配子中
答案 D
解析 新基因的产生依靠基因突变,基因突变包括碱基对的缺失、增添或替换,A正确;B1、B2基因的碱基排列顺序不同,其转录的mRNA碱基序列也不同,但是mRNA可能出现不同的密码子决定同一种氨基酸的情况,所以能出现合成相同蛋白质的情况,而碱基排列顺序不同,也可能导致合成蛋白质不同的情况,B正确;生物指导蛋白质合成的过程中,都是使用同一套密码子,这也是证明生物共同起源的有力证据,C 正确;B1与B2为等位基因,在同一个体细胞中时,存在于同源染色体上,故而可以存在于同一个体细胞中,但是二倍体生物的配子遗传物质减半,不考虑染色体变异的情况下,配子中只含有一个染色体组,不可能含有两个等位基因,故而不可以存在于同一个配子中,D错误。3.(2010·福建,5)下图为人WNK4基因部分碱基序列及其编码蛋白质的部分氨基酸序列示意图。已知WNK4基因发生了一种突变,导致1 169位的赖氨酸变为谷氨酸。该基因发生的突变是( )
A.①处插入碱基对G-C
B.②处碱基对A-T替换为G-C
C.③处缺失碱基对A-T
D.④处碱基对G-C替换为A-T
答案 B
解析 根据图中1 168位的甘氨酸的密码子GGG可知,WNK4基因是以其DNA分子下方的一条脱氧核苷酸链为模板转录形成mRNA的,那么1
第5讲氧化还原反应的计算及方程式的配平 [考纲要求] 1.掌握常见氧化还原反应的配平和相关计算。2.能利用得失电子守恒原理进行相关计算。 考点一氧化还原反应方程式的配平方法 氧化还原反应的实质是反应过程中发生了电子转移,而氧化剂得电子总数(或元素化合价降低总数)必然等于还原剂失电子总数(或元素化合价升高总数),根据这一原则可以对氧化还原反应的化学方程式进行配平。 配平的步骤: (1)标好价:正确标出反应前后化合价有变化的元素的化合价。 (2)列变化:列出元素化合价升高和降低的数值。 (3)求总数:求元素化合价升高和降低的总数,确定氧化剂、还原剂、氧化产物、还原产物的化学计量数。 (4)配系数:用观察法配平其他各物质的化学计量数。 (5)细检查:利用“守恒”三原则(即质量守恒、得失电子守恒、电荷守恒),逐项检查配平的方程式是否正确。 [典例]根据FeS2+O2―→Fe2O3+SO2,回答下列问题: (1)氧化剂________,还原剂________,氧化产物________,还原产物________。 (2)元素化合价升高的元素为________,元素化合价降低的元素为________。 (3)1“分子”还原剂化合价升高总数为________,1“分子”氧化剂化合价降低总数为________。 (4)配平后各物质的系数依次为____________________。 答案(1)O2FeS2Fe2O3、SO2Fe2O3、SO2 (2)Fe、S O(3)114 (4)4、11、2、8 失误防范配平氧化还原反应方程式的关键是正确标出化合价,找准1“分子”氧化剂化合价降低总数,1“分子”还原剂化合价升高总数,在计算时,往往容易忽略氧化剂、还原剂中的粒子个数。 题组一正向配平类
§2.9 函数的应用 2014高考会这样考 1.综合考查函数的性质;2.考查一次函数、二次函数、分段函数及基本初等函数的建模问题;3.考查函数的最值. 复习备考要这样做 1.讨论函数的性质一定要先考虑定义域;2.充分搜集、应用题目信息,正确建立函数模型;3.注重函数与不等式、数列、导数等知识的综合. 1. 几类函数模型及其增长差异 (1)几类函数模型 函数模型 函数解析式 一次函数模型 f (x )=ax +b (a 、b 为常数,a ≠0) 反比例函数模型 f (x )=k x +b (k ,b 为常数且k ≠0) 二次函数模型 f (x )=ax 2+bx +c (a ,b ,c 为常数,a ≠0) 指数函数模型 f (x )=ba x +c (a ,b ,c 为常数,b ≠0,a >0且a ≠1) 对数函数模型 f (x )=b log a x +c (a ,b ,c 为常数,b ≠0,a >0且a ≠1) 幂函数模型 f (x )=ax n +b (a ,b 为常数,a ≠0) 函数 性质 y =a x (a >1) y =log a x (a >1) y =x n (n >0) 在(0,+∞)上的 增减性 单调递增 单调递增 单调递增 增长速度 越来越快 越来越慢 相对平稳 图像的变化 随x 的增大逐渐表现为 与y 轴平行 随x 的增大逐渐表现为 与x 轴平行 随n 值变化而各有不同 值的比较 存在一个x 0,当x >x 0时,有log a x (1)审题:弄清题意,分清条件和结论,理顺数量关系,初步选择数学模型; (2)建模:将自然语言转化为数学语言,将文字语言转化为符号语言,利用数学知识,建 立相应的数学模型; (3)解模:求解数学模型,得出数学结论; (4)还原:将数学问题还原为实际问题的意义. 以上过程用框图表示如下: [难点正本疑点清源] 1.要注意实际问题的自变量的取值范围,合理确定函数的定义域. 2.解决函数应用问题重点解决以下问题 (1)阅读理解、整理数据:通过分析、画图、列表、归类等方法,快速弄清数据之间的关 系,数据的单位等等; (2)建立函数模型:关键是正确选择自变量将问题的目标表示为这个变量的函数,建立函 数的模型的过程主要是抓住某些量之间的相等关系列出函数式,注意不要忘记考察函数的定义域; (3)求解函数模型:主要是研究函数的单调性,求函数的值域、最大(小)值,计算函数的 特殊值等,注意发挥函数图像的作用; (4)回答实际问题结果:将函数问题的结论还原成实际问题,结果明确表述出来. 1.某物体一天中的温度T(单位:℃)是时间t(单位:h)的函数:T(t)=t3-3t+60,t=0表示中午12∶00,其后t取正值,则下午3时的温度为________. 答案78℃ 解析T(3)=33-3×3+60=78(℃). 2.某工厂生产某种产品固定成本为2 000万元,并且每生产一单位产品,成本增加10万元.又 知总收入K是单位产品数Q的函数,K(Q)=40Q-1 20 Q2,则总利润L(Q)的最大值是________万元. 答案 2 500 解析L(Q)=40Q-1 20 Q2-10Q-2 000 选修4-5不等式选讲 1.两个实数大小关系的基本事实 a>b?________;a=b?________;a 5.基本不等式 (1)定理:如果a ,b ∈R ,那么a 2+b 2≥2ab ,当且仅当a =b 时,等号成立. (2)定理(基本不等式):如果a ,b >0,那么a +b 2________ab ,当且仅当________时,等号成 立.也可以表述为:两个________的算术平均________________它们的几何平均. (3)利用基本不等式求最值 对两个正实数x ,y , ①如果它们的和S 是定值,则当且仅当________时,它们的积P 取得最________值; ②如果它们的积P 是定值,则当且仅当________时,它们的和S 取得最________值. 6.三个正数的算术—几何平均不等式 (1)定理 如果a ,b ,c 均为正数,那么a +b +c 3________3 abc ,当且仅当________时,等号 成立. 即三个正数的算术平均____________它们的几何平均. (2)基本不等式的推广 对于n 个正数a 1,a 2,…,a n ,它们的算术平均__________它们的几何平均,即 a 1+a 2+…+a n n ________n a 1a 2…a n , 当且仅当________________时,等号成立. 7.柯西不等式 (1)设a ,b ,c ,d 均为实数,则(a 2+b 2)(c 2+d 2)≥(ac +bd )2,当且仅当ad =bc 时等号成立. (2)设a 1,a 2,a 3,…,a n ,b 1,b 2,b 3,…,b n 是实数,则(a 21+a 22+…+a 2n )(b 21+b 22+…+b 2 n )≥(a 1b 1 +a 2b 2+…+a n b n )2,当且仅当b i =0(i =1,2,…,n )或存在一个数k ,使得a i =kb i (i =1,2,…,n )时,等号成立. (3)柯西不等式的向量形式:设α,β是两个向量,则|α·β|≤|α||β|,当且仅当β是零向量,或存在实数k ,使α=k β时,等号成立. 8.证明不等式的方法 (1)比较法 ①求差比较法 知道a >b ?a -b >0,a b ,只要证明________即可,这种方法称为求差比较法. ②求商比较法 由a >b >0?a b >1且a >0,b >0,因此当a >0,b >0时要证明a >b ,只要证明________即可,这 种方法称为求商比较法. 第1讲探究型实验题 热点一未知产物及物质性质的探究 1.对未知产物的探究 通过化学反应原理猜测可能生成哪些物质,对这些物质逐一进行检验来确定究竟含有哪些物质。正确解答此类试题的关键:(1)猜测要全面;(2)熟记常见物质的检验方法。 4 (2)在烧杯中加入热水(或对烧杯加热)c (3)取少量溶液于试管中,加入KSCN溶液,溶液变成血红色,则有Fe3+取少量溶液滴入适 量酸性高锰酸钾溶液中,高锰酸钾溶液褪色,则有Fe2+a(4)b 11m-4n 14n 2.物质性质的探究 无机物、有机物性质的探究,必须在牢牢掌握元素化合物知识的基础上,大胆猜想,细心论证。 对物质性质探究的基本思路如下: 题组一 未知产物的探究 1.实验室中需要22.4 L(标准状况)SO 2气体。化学小组同学依据化学方程式Zn +2H 2SO 4(浓)=====△ZnSO 4+SO 2↑+2H 2O 计算后,取65.0 g 锌粒与98%的浓H 2SO 4(ρ=1.84 g·cm -3)110 mL 充分反应,锌全部溶解,对于制得的气体,有同学认为可能混有杂质。 (1)化学小组所制得的气体中混有的主要杂质气体可能是______(填分子式)。产生这种结果的主要原因是________(用化学方程式和必要的文字加以说明)。 (2)为证实相关分析,化学小组的同学设计了实验,组装了如下装置,对所制取的气体进行探究。 ①装置B中加入的试剂为________,作用是________。 ②装置D加入的试剂为________________,装置F加入的试剂为________________。 ③可证实一定量的锌粒和一定量的浓硫酸反应后生成的气体中混有某杂质气体的实验现象是________。 ④U形管G的作用为________。 答案(1)H2随着反应的进行,硫酸浓度降低,致使锌与稀硫酸反应生成H2:Zn+H2SO4===ZnSO4+H2↑ (2)①NaOH溶液(或酸性KMnO4溶液,其他合理答案也可) 除去混合气体中的SO2②浓硫酸无水硫酸铜 ③装置E玻璃管中黑色CuO粉末变红色,干燥管F中无水硫酸铜变蓝色 ④防止空气中的H2O进入干燥管F而影响杂质气体的检验 解析(1)从物质的量关系来看,发生反应Zn+2H2SO4(浓)===ZnSO4+SO2↑+2H2O,H2SO4略过量,但是实际上随着反应的进行,硫酸的浓度降低;当硫酸的浓度降到一定程度,反应变为Zn+H2SO4===ZnSO4+H2↑。(2)该实验的目的是为了通过加热还原CuO验证H2的存在,通过F装置进一步确认有H2O生成;具体的实验装置及作用是A—产生待研究的气体,B—除去气体中的SO2(可以利用SO2的性质选取NaOH溶液或酸性高锰酸钾溶液),C—验证SO2已除尽,D—干燥气体,E—若有H2,则加热E玻璃管,CuO固体由黑色变为红色,F—利用无水硫酸铜吸水变蓝进一步确定气体中H2的存在,G—防止空气中的水蒸气进入F装置而干扰实验。 选修4-4 坐标系与参数方程 1.极坐标系 (1)极坐标系的建立:在平面上取一个定点O ,叫做________,从O 点引一条射线Ox ,叫做________,再选定一个长度单位、一个角度单位(通常取弧度)及其正方向(通常取逆时针方向),这样就确定了一个极坐标系. 设M 是平面内一点,极点O 与点M 的距离OM 叫做点M 的________,记为ρ,以极轴Ox 为始边,射线OM 为终边的角叫做点M 的极角,记为θ.有序数对(ρ,θ)叫做点M 的极坐标,记作M (ρ,θ). (2)极坐标与直角坐标的关系:把直角坐标系的原点作为极点,x 轴的正半轴作为极轴,并在两种坐标系中取相同的长度单位,设M 是平面内任意一点,它的直角坐标是(x ,y ),极坐标为(ρ,θ),则它们之间的关系为x =______,y =________. 另一种关系为ρ2=________,tan θ=________. 2.简单曲线的极坐标方程 (1)直线的极坐标方程 θ=α (ρ∈R )表示过极点且与极轴成α角的直线; ρcos θ=a 表示过(a,0)且垂直于极轴的直线; ρsin θ=b 表示过??? ?b ,π 2且平行于极轴的直线; ρsin(α-θ)=ρ1sin(α-θ1)表示过(ρ1,θ1)且与极轴成α角的直线方程. (2)圆的极坐标方程 ρ=2r cos θ表示圆心在(r,0),半径为|r |的圆; ρ=2r sin θ表示圆心在????r ,π 2,半径为|r |的圆; ρ=r 表示圆心在极点,半径为|r |的圆. 3.曲线的参数方程 在平面直角坐标系xOy 中,如果曲线上任意一点的坐标x ,y 都是某个变量t 的函数? ???? x =f (t ), y =g (t ). 并且对于t 的每一个允许值上式所确定的点M (x ,y )都在这条曲线上,则称上式为该曲线的________________,其中变量t 称为________. 4.一些常见曲线的参数方程 (1)过点P 0(x 0,y 0),且倾斜角为α的直线的参数方程为________________(t 为参数). (2)圆的方程(x -a )2+(y -b )2=r 2的参数方程为________________________(θ为参数). (3)椭圆方程x 2a 2+y 2 b 2=1(a >b >0)的参数方程为________________(θ为参数). (4)抛物线方程y 2=2px (p >0)的参数方程为________________(t 为参数). 1.在极坐标系中,直线ρsin(θ+π 4 )=2被圆ρ=4截得的弦长为________. 2.极坐标方程ρ=sin θ+2cos θ能表示的曲线的直角坐标方程为____________________. 3.已知点P (3,m )在以点F 为焦点的抛物线? ???? x =4t 2 , y =4t (t 为参数)上,则PF =________. 4.直线? ???? x =-1+t sin 40° ,y =3+t cos 40°(t 为参数)的倾斜角为________. 5.已知曲线C 的参数方程是? ???? x =3t , y =2t 2 +1(t 为参数).则点M 1(0,1),M 2(5,4)在曲线C 上的是________. 题型一 极坐标与直角坐标的互化 例1 在直角坐标系xOy 中,以O 为极点,x 轴正半轴为极轴建立极坐标系.曲线C 的极坐标方程为ρcos(θ-π 3)=1,M ,N 分别为C 与x 轴、y 轴的交点. (1)写出C 的直角坐标方程,并求M 、N 的极坐标; 第1讲 化学实验基础知识和技能 [考纲要求] 1.了解化学实验室常用仪器的主要用途和使用方法。2.掌握化学实验的基本操作,能识别药品安全使用标志。3.了解实验室一般事故的预防和处理方法。 考点一 常用化学仪器的识别与使用 1.可加热的仪器 (1)仪器①的名称为试管,加热液体时,液体体积不能超过其容积的13 ,加热固体时,试管口应略向下倾斜。 (2)仪器②的名称为蒸发皿。使用方法:蒸发浓缩时要用玻璃棒搅拌。 (3)仪器③的名称为坩埚。使用方法:用于固体物质灼烧,把坩埚放在三脚架上的泥三角上加热,取放坩埚必须使用坩埚钳,加热完的坩埚应放在石棉网上冷却。 (4)仪器④的名称为圆底烧瓶。使用方法:a.常用于组装有液体参与反应的反应器;b.加热液 体时,不能超过其容积的12 。 (5)仪器⑤的名称为锥形瓶。使用方法:a.可用于组装气体发生器;b.用于滴定操作;c.作蒸馏装置的接收器。 收集:樱满唯 (6)仪器⑥的名称为烧杯。使用方法:a.可用于物质的溶解与稀释;b.用于称量具有腐蚀性的固体药品;c.组装水浴加热装置。 2.常用的计量仪器 完成下列空白 (1)仪器A的名称:量筒;用途:量取一定体积的液体;精确度:0.1 mL。 特别提醒①无“0”刻度;②不可加热,不可作反应容器,不可用于溶液的稀释;③选取量筒的规则是“大而近”,例如量取5.6 mL NaOH溶液应选取10 mL量筒,而不能选5 mL 或50 mL 量筒。 (2)仪器B的名称:容量瓶;用途:配制一定物质的量浓度的溶液;该仪器能长时间贮存溶液吗?不能。 (3)仪器C的名称:酸式滴定管。 ①使用前需“查漏”;②“0”刻度在上方;③不可盛装碱性溶液;④精确度:0.01 mL。 (4)仪器D的名称:碱式滴定管。 用于盛装碱性溶液,不可盛装酸性和强氧化性液体(如KMnO4溶液)。 (5)仪器E的名称:托盘天平。 ①称量前先调零点;②腐蚀性药品应放于烧杯内称量;③左盘放被称物,右盘放砝码,即“左物右码”;④精确度:0.1 g。 (6)仪器F的名称:温度计。 ①测反应混合液的温度时,温度计的水银球应插入混合液中但不能接触容器内壁;②测蒸汽的温度时,水银球应在液面以上;测馏分温度时,水银球应放在蒸馏烧瓶支管口处。3.常用的分离、提纯仪器 第十二章 推理证明、算法初步、复数 第1讲 归纳与类比一、选择题 1.观察下列事实:|x |+|y |=1的不同整数解(x ,y )的个数为4,|x |+|y |=2的不同整数解(x ,y )的个数为8,|x |+|y |=3的不同整数解(x ,y )的个数为12,…,则|x |+|y |=20的不同整数解(x ,y )的个数为 ( ). A .76 B .80 C .86 D .92解析 由|x |+|y |=1的不同整数解的个数为4,|x |+|y |=2的不同整数解的个数为8,|x |+|y |=3的不同整数解的个数为12,归纳推理得|x |+|y |=n 的不同整数解的个数为4n ,故|x |+|y |=20的不同整数解的个数为80.故选B.答案 B 2.古希腊人常用小石子在沙滩上摆成各种形状来研究数.比如:他们研究过图1中的1,3,6,10,…,由于这些数能够表示成三角形,将其称为三角形数;类似地,称图2中的1,4,9,16,…,这样的数为正方形数.下列数中既是三角形数又是正方形数的是 ( ).A .289 B .1 024C .1 225 D .1 378解析 观察三角形数:1,3,6,10,…,记该数列为{a n },则a 1=1,a 2=a 1+2,a 3=a 2+3,…,a n =a n -1+n .∴a 1+a 2+…+a n =(a 1+a 2+…、管路敷设技术通过管线敷设技术,不仅可以解决吊顶层配置不规范问题,而且可保障各类管路习题到位。在管路敷设过程中,要加强看护关于管路高中资料试卷连接管口处理高中资料试卷弯扁度固定盒位置保护层防腐跨接地线弯曲半径标高等,要求技术交底。管线敷设技术中包含线槽、管架等多项方式,为解决高中语文电气课件中管壁薄、接口不严等问题,合理利用管线敷设技术。线缆敷设原则:在分线盒处,当不同电压回路交叉时,应采用金属隔板进行隔开处理;同一线槽内,强电回路须同时切断习题电源,线缆敷设完毕,要进行检查和检测处理。、电气课件中调试对全部高中资料试卷电气设备,在安装过程中以及安装结束后进行高中资料试卷调整试验;通电检查所有设备高中资料试卷相互作用与相互关系,根据生产工艺高中资料试卷要求,对电气设备进行空载与带负荷下高中资料试卷调控试验;对设备进行调整使其在正常工况下与过度工作下都可以正常工作;对于继电保护进行整核对定值,审核与校对图纸,编写复杂设备与装置高中资料试卷调试方案,编写重要设备高中资料试卷试验方案以及系统启动方案;对整套启动过程中高中资料试卷电气设备进行调试工作并且进行过关运行高中资料试卷技术指导。对于调试过程中高中资料试卷技术问题,作为调试人员,需要在事前掌握图纸资料、设备制造厂家出具高中资料试卷试验报告与相关技术资料,并且了解现场设备高中资料试卷布置情况与有关高中资料试卷电气系统接线等情况,然后根据规范与规程规定,制定设备调试高中资料试卷方案。 、电气设备调试高中资料试卷技术电力保护装置调试技术,电力保护高中资料试卷配置技术是指机组在进行继电保护高中资料试卷总体配置时,需要在最大限度内来确保机组高中资料试卷安全,并且尽可能地缩小故障高中资料试卷破坏范围,或者对某些异常高中资料试卷工况进行自动处理,尤其要避免错误高中资料试卷保护装置动作,并且拒绝动作,来避免不必要高中资料试卷突然停机。因此,电力高中资料试卷保护装置调试技术,要求电力保护装置做到准确灵活。对于差动保护装置高中资料试卷调试技术是指发电机一变压器组在发生内部故障时,需要进行外部电源高中资料试卷切除从而采用高中资料试卷主要保护装置。 考点一物质分离、提纯的常用方法及装置 1.物质分离、提纯的区别 (1)物质的分离 将混合物的各组分分离开来,获得几种纯净物的过程。 (2)物质的提纯 将混合物中的杂质除去而得到纯净物的过程,又叫物质的净化或除杂。 2.物质分离、提纯的常用方法及装置 (1)常规实验装置 ①过滤:适用条件:不溶性固体和液体的分离。说明:操作中a.一贴:滤纸紧贴漏斗内壁;二低:滤纸上边缘低于漏斗边缘,液面低于滤纸边缘;三靠:烧杯紧靠玻璃棒,玻璃棒轻靠三层滤纸处,漏斗下端尖口处紧靠烧杯内壁;b.若滤液浑浊,需更换滤纸,重新过滤。浑浊 的原因可能是滤纸破损、滤液超过滤纸边缘。 ②蒸发:适用条件:分离易溶性固体的溶质和溶剂。说明:蒸发结晶适用于溶解度随温度变化不大的物质;而对溶解度受温度变化影响较大的固态溶质,采用降温结晶的方法。 在蒸发结晶中应注意:a.玻璃棒的作用:搅拌,防止液体局部过热而飞溅;b.当有大量晶体析出时,停止加热,利用余热蒸干而不能直接蒸干。 ③蒸馏:适用条件:分离沸点相差较大的互溶液体混合物。说明:a.温度计的水银球放在蒸馏烧瓶的支管口处;b.蒸馏烧瓶内要加沸石;c.冷凝管水流方向应为“逆流”。 ④萃取和分液:适用条件:分离互不相溶的两种液体。说明:a.溶质在萃取剂中的溶解度大; b.两种液体互不相溶; c.溶质和萃取剂不反应; d.分液时下层液体从下口流出,上层液体从上口倒出。 ⑤升华(如下左图):适用条件:除去不挥发性杂质或分离不同挥发程度的固体混合物。说明:利用物质升华的性质进行分离,属于物理变化。 ⑥洗气(如上右图):适用条件:除去气体中的杂质气体。说明:长管进气短管出气。 (2)创新实验装置 ①过滤装置的创新——抽滤 由于水流的作用,使图1装置a、b中气体的压强减小,故使过滤速率加快。 §5.4复数 1.复数的有关概念 (1)定义:我们把集合C ={a +b i|a ,b ∈R }中的数,即形如a +b i(a ,b ∈R )的数叫做复数,其中a 叫做复数z 的实部,b 叫做复数z 的虚部(i 为虚数单位). (2)分类: (3)复数相等:a +b i =c +d i ?a =c 且b =d (a ,b ,c ,d ∈R ). (4)共轭复数:a +b i 与c +d i 共轭?a =c ,b =-d (a ,b ,c ,d ∈R ). (5)模:向量OZ → 的模叫做复数z =a +b i 的模,记作|a +b i|或|z |,即|z |=|a +b i|=a 2+b 2(a ,b ∈R ). 2.复数的几何意义 复数z =a +b i 与复平面内的点Z (a ,b )及平面向量OZ → =(a ,b )(a ,b ∈R )是一一对应关系. 3.复数的运算 (1)运算法则:设z 1=a +b i ,z 2=c +d i ,a ,b ,c ,d ∈R . (2)几何意义:复数加减法可按向量的平行四边形或三角形法则进行. 如图给出的平行四边形OZ 1ZZ 2可以直观地反映出复数加减法的几何意义,即OZ →=OZ 1→+OZ 2→ ,Z 1Z 2→=OZ 2→-OZ 1→. 概念方法微思考 1.复数a+b i的实部为a,虚部为b吗? 提示不一定.只有当a,b∈R时,a才是实部,b才是虚部. 2.如何理解复数的加法、减法的几何意义? 提示复数的加法、减法的几何意义就是向量加法、减法的平行四边形法则. 题组一 思考辨析 1.判断下列结论是否正确(请在括号中打“√”或“×”) (1)复数z =a +b i(a ,b ∈R )中,虚部为b i.( × ) (2)复数中有相等复数的概念,因此复数可以比较大小.( × ) (3)复平面中原点是实轴与虚轴的交点.( √ ) (4)复数的模实质上就是复平面内复数对应的点到原点的距离,也就是复数对应的向量的模.( √ ) 题组二 教材改编 2.若复数z =(x 2-1)+(x -1)i 为纯虚数,则实数x 的值为( ) A .-1 B .0 C .1 D .-1或1 答案 A 解析 ∵z 为纯虚数,∴????? x 2-1=0, x -1≠0, ∴x =-1. 3.在复平面内,向量AB →对应的复数是2+i ,向量CB →对应的复数是-1-3i ,则向量CA → 对应的复数是( ) A .1-2i B .-1+2i C .3+4i D .-3-4i 答案 D 解析 CA →=CB →+BA → =-1-3i +(-2-i)=-3-4i. 4.若复数z 满足()3+4i z =1-i(i 是虚数单位),则复数z 的共轭复数z 等于( ) A .-15-75 i B .-15+75 i 第3讲 硫及其化合物 [考纲要求] 1.了解硫及其重要化合物的主要化学性质及应用。2.了解硫的氧化物对大气的污染与防治。 考点一 硫及其氧化物的性质 1.硫单质的性质及应用 (1)硫元素的存在形态 形态— —游离态—火山喷口附近或地壳的岩层里—化合态—主要以硫化物和硫酸盐的形式存在 (2)硫单质的物理性质 硫单质俗称硫黄,是一种淡黄色固体;不溶于水,微溶于酒精,易溶于CS 2;有多种同素异形体,如单斜硫、斜方硫等。 (3)从化合价的角度认识硫单质的化学性质 S -2 ――→ 氧化性 S 0 ――→ 还原性 S + 4 O 2 2.二氧化硫(SO2) (1)物理性质 二氧化硫是无色,有刺激性气味的有毒气体,是大气污染物之一;易溶于水,通常状况下,1体积水溶解约40体积SO2。 (2)化学性质 按要求完成下列方程式: SO 2 ??????? ?? 酸性氧化物的通性???? ? 与H 2O 反应:SO 2+H 2O H 2SO 3与NaOH (足量)反应: 2NaOH +SO 2===Na 2SO 3+H 2O 氧化性 (如与H 2 S 溶液反应): SO 2 +2H 2 S===3S ↓+2H 2 O 还原性??? ?? O 2:2SO 2+O 2催化剂△ 2SO 3 Cl 2+H 2O :Cl 2+SO 2+2H 2O===2HCl +H 2SO 4 漂白性:可使品红溶液等有机色质褪色生成不稳定 的化合物 3.三氧化硫(SO 3) SO 3在标准状况下为无色、针状晶体,能与水反应:SO 3+H 2O===H 2SO 4,放出大量的热,SO 3是酸性氧化物,它跟碱性氧化物或碱都能反应生成硫酸盐。 4.硫的氧化物的污染与治理 (1)来源:含硫化石燃料的燃烧及金属矿物的冶炼等。 (2)危害:危害人体健康,形成酸雨(pH 小于5.6)。 (3)治理:燃煤脱硫,改进燃烧技术。 (4)硫酸型酸雨的形成途径有两个: 途径1:空气中飘尘的催化作用,使2SO 2+O 2催化剂 2SO 3、SO 3+H 2O===H 2SO 4。 途径2:SO 2+H 2O H 2SO 3、2H 2SO 3+O 2===2H 2SO 4。 深度 思考 1 第1章第1讲 考点一 物质的量 摩尔质量 题组一 有关分子(或特定组合)中微粒数的计算 1.答案 ①>⑥>⑤>③>②>④ 2.(1)答案 1.2 < 解析 n (SO 2 - 4)=3n [Al 2(SO 4)3]=3×0.4 mol =1.2 mol ,0.4 mol Al 2(SO 4)3中含有0.8 mol Al 3+ ,由于在 溶液中Al 3+ 水解,故Al 3+的物质的量小于0.8 mol 。 (2答案 小于 小于 题组二 通过n =m M =N N A ,突破质量与微粒数目之 间的换算 3.答案 C 解析 ③中摩尔质量的单位错误;由于该氯原子的质量是a g ,故a g 该氯原子所含的电子数为17,④错。 4.答案 0.33N A 0.26 解析 晶体的摩尔质量约为122 g·mol - 1,n = 12.2 g 122 g·mol -1=0.1 mol ,故氧原子数目=0.1×(2+ 1.3)N A =0.33N A ,n (H)=0.1 mol ×1.3×2=0.26 mol 。 考点二 气体摩尔体积 阿伏加德罗定律 深度思考 2.答案 ③ 解析 ①、②中,1摩尔水或水蒸气的质量都为m 水 N A ;③中,水蒸气分子间间距比分子直径大的多, 仅由题给条件不能确定1摩尔水蒸气的体积。 题组一 有关“n =V V m =m M =N N A ”的应用 1.答案 D 解析 解法一 公式法: a g 双原子分子的物质的量=p N A mol , 双原子分子的摩尔质量= a g p N A mol = aN A p g·mol - 1, 所以b g 气体在标准状况下的体积为 b g aN A p g·mol - 1×22.4 L·mol - 1= 22.4pb aN A L 。 解法二 比例法: 同种气体其分子数与质量成正比,设b g 气体的分子数为N a g ~ p b g ~ N 则:N = bp a ,双原子分子的物质的量为pb aN A ,所以b g 该气体在标准状况下的体积为22.4pb aN A L 。 2.答案 B 解析 X 除以N A 为该气体的物质的量;然后乘以M 表示其质量;最后除以V 为1 L 该气体的质量。 题组二 阿伏加德罗定律及推论的应用 3.答案 C 解析 等质量的气体,其摩尔质量与物质的量(或分子数)成反比,若M (甲) 2015年高中数学步步高大一轮复习讲义(文科)第3讲平面向量 的数量积 第3讲平面向量的数量积 一、选择题 1.设x∈R,向量a=(x,1),b=(1,-2),且a⊥b,则|a+b|=() A.5 B.10 C.2 5 D.10 解析∵a⊥b,∴x-2=0,∴x=2.∴|a+b|=a2+b2+2a·b=a2+b2=4+1+1+4=10.故选B. 答案 B 2.设向量a=(1,cos θ)与b=(-1,2cos θ)垂直,则cos 2θ等于() A. 2 2 B. 1 2 C.0 D.-1 解析∵a⊥b,∴1×(-1)+cos θ·2cos θ=0,即2cos2θ-1=0.又cos 2θ=2cos2θ-1. 答案 C 3.若向量a,b,c满足a∥b,且a⊥c,则c·(a+2b)= ().A.4 B.3 C.2 D.0 解析由a∥b及a⊥c,得b⊥c,则c·(a+2b)=c·a+2c·b=0. 答案 D 4.已知非零向量a,b,c满足a+b+c=0.向量a,b的夹角为60°,且|b|=|a|,则向量a与c的夹角为() A.60°B.30° C.120°D.150°解析由a+b+c=0得c=-a-b, ∴|c|2=|a+b|2=|a|2+|b|2+2|a||b|cos 60°=3|a|2, ∴|c|=3|a|, 又a ·c =a ·(-a -b )=-|a |2-a ·b =-|a |2-|a ||b |cos 60°=-32|a |2. 设a 与c 的夹角为θ, 则cos θ=a ·c |a ||c |= -32|a |2 |a |·3|a |=-32, ∵0°≤θ≤180°,∴θ=150°. 答案 D 5.在平面直角坐标系中,O 为坐标原点,已知向量OA →=(2,2),OB →=(4,1),在x 轴上取一点P ,使AP →·BP →有最小值,则P 点的坐标是 ( ). A .(-3,0) B .(2,0) C .(3,0) D .(4,0) 解析 设P 点坐标为(x,0), 则AP →=(x -2,-2),BP →=(x -4,-1). AP →·BP →=(x -2)(x -4)+(-2)×(-1) =x 2-6x +10=(x -3)2+1. 当x =3时,AP →·BP →有最小值1. ∴此时点P 坐标为(3,0),故选C. 答案 C 6.对任意两个非零的平面向量α和β,定义αβ=α·ββ· β.若平面向量a ,b 满足 |a |≥|b |>0,a 与b 的夹角θ∈? ????0,π4,且a b 和b a 都在集合???? ??n 2| n ∈Z 中,则a b = ( ). A.12 B .1 C.3 2 D.52 解析 由定义αβ=α·ββ2可得b a =a ·b a 2=|a |·|b |cos θ|a |2=|b |cos θ |a |,由|a |≥|b |>0,及 [考纲要求] 1.应用离子反应发生的条件,正确判断常见离子在溶液中能否大量共存。2.利用离子的特征反应,能鉴别常见离子以及进行综合推断。 考点一离子共存 1.离子共存问题是离子反应条件和本质的最直接应用 所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。 2.熟记常考离子的性质 注意“两性离子”指既能与酸反应又能与碱反应的离子,一般为多元弱酸的酸式酸根离子。3.常见溶液酸、碱性的判断 酸性溶液:pH<7(常温);能使pH试纸呈红色的溶液;能使甲基橙呈红色或橙色的溶液;能使石蕊溶液呈红色的溶液。 碱性溶液:pH>7(常温);能使pH试纸呈蓝色的溶液;能使石蕊溶液呈蓝色的溶液;能使酚酞溶液呈红色的溶液。 呈酸性或碱性的溶液:和Al反应放出H2的溶液(HNO3除外);能使甲基橙呈黄色的溶液;c(H +)水或c(OH-)水等于10-a mol·L-1(a>7)的溶液。 深度思考 (1)OH-不能和________________________________________________________大量共存(填具体离子,下同)。 答案H+、NH+4、Fe2+、Fe3+、Cu2+、Zn2+、Mg2+、Al3+、Cr3+、HCO-3、HS-、HSO-3、H2PO-4、HPO2-4 (2)H+不能和____________________________________________________大量共存。 答案OH-、CO2-3(HCO-3)、S2-(HS-)、SO2-3(HSO-3)、PO3-4(H2PO-4,HPO2-4)、SiO2-3、AlO-2、ClO-、F-、CH3COO-、NO-2 (3)CO2-3不能和________________________________________________大量共存。 答案H+、Mg2+、Ba2+、Ca2+、Fe3+、Al3+、Fe2+、Cu2+ (4)SO2-3不能和__________________________________________大量共存。 2015年高中数学步步高大一轮复习讲义(文科)第三章 3.1 §3.1导数的概念及运算 1.函数y=f(x)从x0到x1的平均变化率 Δy Δx=f(x1)-f(x0) x1-x0 = f(x0+Δx)-f(x0) Δx. 2.函数y=f(x)在x=x0处的导数 (1)定义 当x1趋于x0,即Δx趋于0时,如果平均变化率趋于一个固定的值,那么这个值就是函数y=f(x)在x0点的瞬时变化率.在数学中,称瞬时变化率为函数y=f(x)在x0点的导 数,通常用符号f′(x0)表示,记作f′(x0)=lim x1→x0f(x1)-f(x0) x1-x0 =lim Δx→0 f(x0+Δx)-f(x0) Δx. (2)几何意义 函数f(x)在点x0处的导数f′(x0)的几何意义是曲线y=f(x)在点(x0,f(x0))处的切线的斜率.相应地,切线方程为y-f(x0)=f′(x0)(x-x0). 3.函数f(x)的导函数 如果一个函数f(x)在区间(a,b)上的每一点x处都有导数,导数值记为f′(x):f′(x)= lim Δx→0f(x+Δx)-f(x) Δx,则f′(x)是关于x的函数,称f′(x)为f(x)的导函数,通常也简称为 导数. 4.基本初等函数的导数公式 5. (1)[f(x)±g(x)]′=f′(x)±g′(x); (2)[f(x)·g(x)]′=f′(x)g(x)+f(x)g′(x); (3)?? ??f (x )g (x )′=f ′(x )g (x )-f (x )g ′(x ) [g (x )]2 (g (x )≠0). 1. 判断下面结论是否正确(请在括号中打“√”或“×”) (1)f ′(x 0)与(f (x 0))′表示的意义相同. ( × ) (2)求f ′(x 0)时,可先求f (x 0)再求f ′(x 0). ( × ) (3)曲线的切线不一定与曲线只有一个公共点. ( √ ) (4)与曲线只有一个公共点的直线一定是曲线的切线. ( × ) (5)若f (x )=a 3+2ax -x 2,则f ′(x )=3a 2+2x . ( × ) (6)函数f (x )=x 2ln x 的导函数为f ′(x )=2x ·1x =2. ( × ) 2. (2013·江西)设函数f (x )在(0,+∞)内可导,且f (e x )=x +e x ,则f ′(1)=________. 答案 2 解析 设e x =t ,则x =ln t (t >0),∴f (t )=ln t +t ∴f ′(t )=1 t +1,∴f ′(1)=2. 3. 已知曲线y =x 3在点(a ,b )处的切线与直线x +3y +1=0垂直,则a 的值是 ( ) A .-1 B .±1 C .1 D .±3 答案 B 第三章常见的金属及其化合物钠及其氧化物钠的其他常见化合物 碱金属元素 一、选择题(本题包括12个小题,每小题5分,共60分) 1.下列有关NaHCO3和Na2CO3性质的比较中,正确的是 ( ) A.热稳定性:Na2CO3高中数学步步高大一轮复习讲义(文科)选修45 不等式选讲
第十章第1讲【2016化学大一轮步步高答案】
2015年高中数学步步高大一轮复习讲义(文科)选修4-4 坐标系与参数方程
第一章--第1讲-【2016化学大一轮步步高标准答案】
【免费下载】高中数学步步高大一轮复习讲义文科第1讲 归纳与类比
化学步步高大一轮复习全书第一章第2讲
2021届步步高数学大一轮复习讲义(文科)第五章 5.4复数
第四章第3讲【2016化学大一轮步步高答案】
最新版2017教师用书步步高大一轮复习讲义习题详细答案第一章第一讲
最新2015年高中数学步步高大一轮复习讲义(文科)第3讲平面向量的数量积
第二章第3讲【2016化学大一轮步步高答案】
最新高中数学步步高大一轮复习讲义(文科)第三章 3.1汇总
【步步高】2020年高考化学大一轮总复习 第三章第一讲至二讲同步训练