
抗肿瘤药物5-氟尿嘧啶对肿瘤细胞迁移的影响
(细胞划痕法)
实验导读
瘤组织的增殖失控、瘤细胞的分化异常、瘤细胞具有侵袭和转移的能力是恶性肿瘤最基本的生物学特征,而侵袭和转移又是恶性肿瘤威胁患者健康乃至生命的主要原因。因此研究肿瘤侵袭和转移的规律及其发生机制,对恶性肿瘤的防治有重要意义。
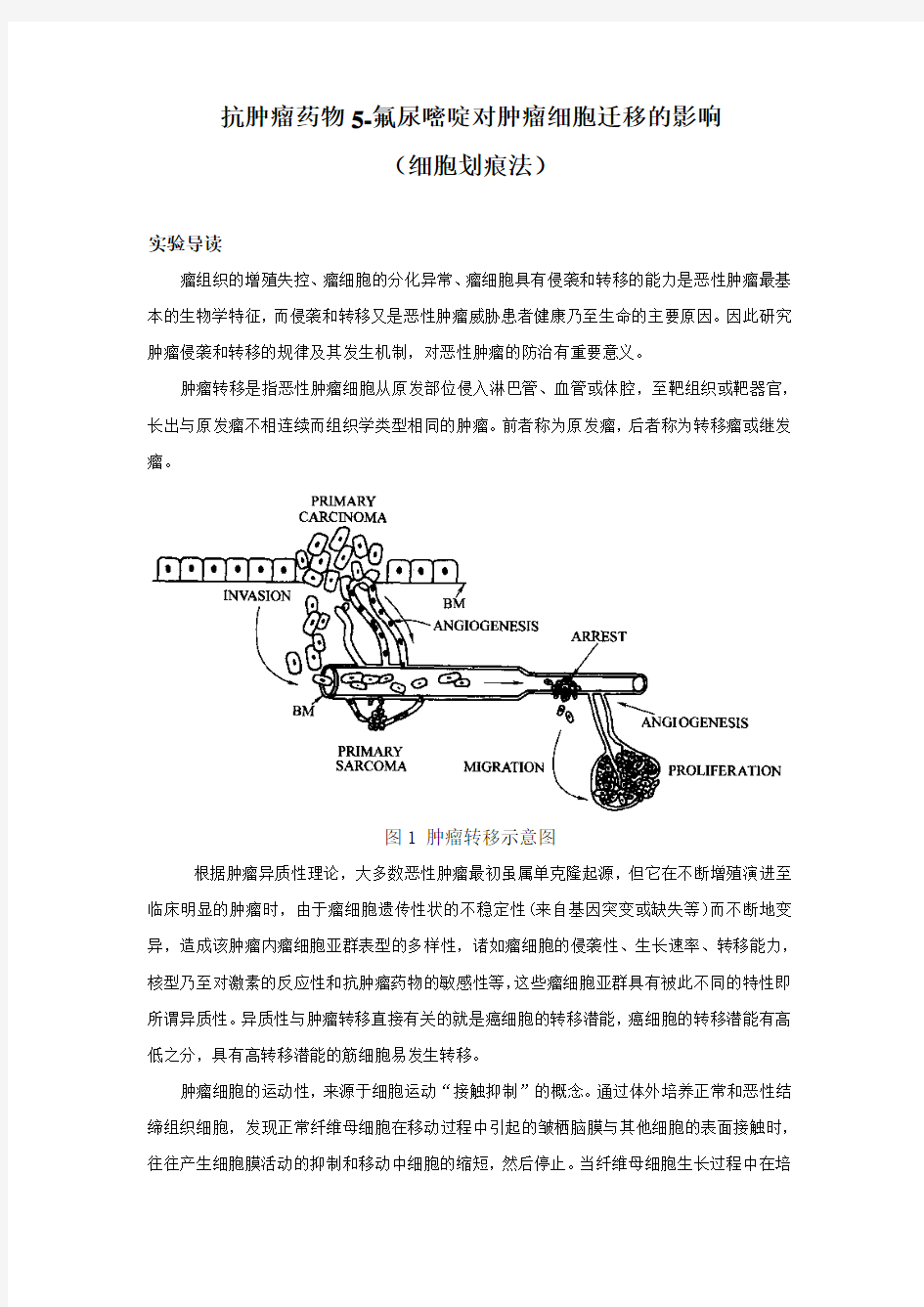
肿瘤转移是指恶性肿瘤细胞从原发部位侵入淋巴管、血管或体腔,至靶组织或靶器官,长出与原发瘤不相连续而组织学类型相同的肿瘤。前者称为原发瘤,后者称为转移瘤或继发瘤。
图1 肿瘤转移示意图
根据肿瘤异质性理论,大多数恶性肿瘤最初虽属单克隆起源,但它在不断增殖演进至临床明显的肿瘤时,由于瘤细胞遗传性状的不稳定性(来自基因突变或缺失等)而不断地变异,造成该肿瘤内瘤细胞亚群表型的多样性,诸如瘤细胞的侵袭性、生长速率、转移能力,核型乃至对激素的反应性和抗肿瘤药物的敏感性等,这些瘤细胞亚群具有被此不同的特性即所谓异质性。异质性与肿瘤转移直接有关的就是癌细胞的转移潜能,癌细胞的转移潜能有高低之分,具有高转移潜能的筋细胞易发生转移。
肿瘤细胞的运动性,来源于细胞运动“接触抑制”的概念。通过体外培养正常和恶性结缔组织细胞,发现正常纤维母细胞在移动过程中引起的皱栖脑膜与其他细胞的表面接触时,往往产生细胞膜活动的抑制和移动中细胞的缩短,然后停止。当纤维母细胞生长过程中在培
养皿上融合形成一单层时,细胞运动即显著受到抑制。间变的肉瘤细胞则缺乏接触抑制,瘤细胞的运动不会被正常纤维母细胞所抑制。
针对肿瘤转移这一复杂的过程,人们研制了各种抗转移药物,如血小板凝集抑制剂、血管生成抑制因子、内皮稳定因子、干扰素-α以及其他化学药物。
细胞划痕法是测定了肿瘤细胞的运动特性的方法之一。其借鉴体外细胞致伤愈合实验模型,在体外培养的单层细胞上,划痕致伤,然后加入药物观察其抑制肿瘤细胞迁移的能力。下图即为划痕实验的示意图,图中可见,在细胞层上出现一道空痕(A),当加入药物后,由于药物的作用使细胞迁移受到抑制(B),而未加入药物的细胞保持了原有的迁移能力,在一段时间后通过迁移将划痕掩盖(C)。
A B
C
图2实验结果(A表示在单层细胞上划出的一道痕;B表示加入抑制剂,为阳性对照组;C
表示未加入抑制剂,为阴性对照组)
一、实验目的
1.了解肿瘤细胞转移的基本原理
2.了解测定细胞运动特性的方法――细胞划痕法
二、实验原理
肿瘤细胞在体外仍具有迁移的能力,本实验借鉴体外细胞致伤愈合实验模型,利用细胞划痕法测定了肿瘤细胞的运动特性。
三、仪器和试剂
1)细胞系及其培养:肝肿瘤细胞HepG2
2)24孔板,移液器,倒置显微镜,
3)主要试剂:PBS,DMEM培养液,0.25%胰酶,胎牛血清,5-氟尿嘧啶溶液(1ug/ml)
四、实验步骤
1. 5-氟尿嘧啶溶液的配制
精密称取10mg用灭菌蒸馏水溶解,定容于100ml容量瓶,精密移取1ml溶液,稀释至100ml,即得1ug/ml 5-氟尿嘧啶溶液。
2.制备单层细胞
将细胞密度为5~10×105个/mL的Hep G2细胞铺于24孔板(每孔500 uL)上,加入含10%胎牛血清的RMPI.1640 培养液,培养16~24 h,使形成单层细胞。
3.划痕
以五氟尿嘧啶(5-Fu)为例,首先配制1 μg/μL的母液,取45 μL该母液用PBS稀释至1.1 mL,得到浓度为40 μg/ML的5-Fu溶液。
用10 uL移液枪枪头(或者无菌牙签)在单层细胞上呈“一”字划痕,用PBS清洗3次,然后加入上面配好的5-Fu溶液,平行两个样本,孵育24 h后换成含10%胎牛血清的RMPI.1640 培养液,孵育24 h。
4.观察并拍照
吸去培养液,用PBS清洗3次后,在倒置荧光显微镜下观察并拍照。
五、注意事项:
1.实验时应注意细胞生长状况,选择适当的细胞接种浓度。对不同的细胞要观察细胞的贴壁率等,确定实验时细胞的接种数量和培养时间,保证培养终止时密度适当。
2.在用PBS缓冲液冲洗时,注意贴壁慢慢加入,以免冲散单层贴壁细胞,影响实验拍照结果。
3.在药物的筛选过程中,其对细胞迁移能力的影响也是重要的一方面。实验设计过程中需要选择适当的阳性对照组和阴性对照组。
生物实验高清视频,细胞、分子生物学、蛋白检测技术实验高清视频教程
点击进入微信店铺点击进入淘宝店铺
生物实验高清视频,细胞、分子生物学、蛋白检测技术实验高清视频教程,约7G大小,22个实验项目。适用于教学和学习!
本套实验视频制作耗资上百万,由专业的影视和后期制作团队拍摄+生物、医学领域的教授专家指导+Thermo、Roche等著名企业参与共同制作完成。
分子生物学实验技术共6个视频,包括:DNA甲基化检测、分子克隆技术、高分辨溶解曲线分析技术(HRM)、逆转录聚合酶链式反应(RT-PCR)、荧光定量PCR(real time QPCR)、原位杂交(ISH)。
蛋白检测技术共6个视频,包括:TUNEL法检测细胞凋亡、酶联接免疫吸附测定(ELISA)、免疫印迹法(Western blotting)、免疫组化(IHC)、凝胶迁移实验(EMSA)、染色质免疫沉淀技术(ChIP)。
细胞检测技术共10个视频,包括:siRNA转染、大鼠骨骼肌细胞培养、全骨髓法分离培养大鼠骨髓间充质干细胞、细胞传代、细胞冻存、细胞复苏、细胞划痕、细胞侵染、质粒DNA 转染、组织块贴壁法培养大鼠平滑肌细胞。
每个实验视频内容包括详细的实验操作流程,原理讲解,结果分析及疑难解答,并配有相应的详实的文字文档和参考文献!
直尺20微升枪头(灭菌)无血清培养基PBS 准备: 所有能灭菌的器械都要灭菌,直尺和marker笔在操作前紫外照射30min(超净台内) 流程: 1。先用marker笔在6孔板背后,用直尺比着,均匀得划横线,大约每隔0.5~1cm一道,横穿过孔。每孔至少穿过5条线。 2。在空中加入约5X105个细胞,具体数量因细胞不同而不同,掌握为过夜能铺满。 3。第二天用枪头比着直尺,尽量垂至于背后的横线划痕,枪头要垂直,不能倾斜。 4。用PBS洗细胞3次,去处划下的细胞,加入无血清培养基。 5。放入37度5%co2培养箱,培养。按0,6,12,24小时取样,拍照。 NOTE 6空板可以保证有相当距离的平直划痕,我觉得挺不错的。而且因为有5条定位线,与划痕相交,这样就有10个可固定监测点,不作重复,误差也很小。 如果你连续监测24小时,你需要考虑到划痕缩小是细胞迁移和细胞繁殖共同作用的结果,而不是单纯的细胞迁移。如果你要单纯的考虑细胞迁移,你可以先用丝裂霉素(1ug/ml)处理一小时,抑制细胞的分裂,这样你的结果就是细胞迁移的作用了。 照片拍完之后,可以用image J 来测量划痕区域的像素定量比较细胞迁移的速度。 无血清的话,应该一个细胞周期内,增殖可以忽略吧。而且我定点监测的话,差不多可以对应到每个细胞。好像没有看见很明显的增殖现象。丝裂霉素貌似很贵的说。。。如果用这个还不如直接用transwell呢。 另,image J 哪里有下载么?谢谢。 ImageJ 下载网址:https://www.doczj.com/doc/9b4123352.html,/ij/download.html 无血清培养,确实细胞增殖可以忽略了,不过由于细胞内信号传导系统整体性的下调节,细胞迁移的速度也会慢很多。不知道是不是大多数文献都用无血清培养状态下作划痕实验呢?目前最好的方法还是transwell法 一般做划痕实验,都是无血清或者低血清(《2%)否则细胞增殖就不能忽略。一般认为细胞周期是24小时,但对于一些特殊的细胞系来说,生长可能会快一点。因此好像还没看见用带血清培养,短时间检测的。不过我会去试试看。可能是个好方法。 划痕法的意义在于,价格低廉,操作简单。还有很重要的一点在于细胞外围环境简单单纯,容易控制。(比如做加药的,可能会和血清的组分有反映,而且受血清批次的影响,造成误差。如果是铺了ECM物质的,组分就更复杂了。) 划痕法的不足也很明显,适用的细胞系很窄,一般只能用于上皮,纤维样细胞系。因为1。这些细胞本身有迁移能力,且较强。 2。细胞有极性,方便测量,观察。 3。细胞对无血清有较强的忍受力(至少24小时),因此很多肿瘤细胞系是不适合做划痕的,很多肿瘤细胞系在无血清培养下,12小时细胞凋亡就超过50%。这也就是transwell发展的最大要求。而一些上皮样细胞系甚至可以忍受高达72小时的无血清实验。足以弥合划痕。
实验室细胞划痕实验简介 细胞划痕实验是一种操作简单,经济实惠的研究细胞迁移/肿瘤侵袭的体外试验方法。这种方法的原理是,当细胞长到融合成单层状态时,在融合的单层细胞上人为制造一个空白区域,称为“划痕”。划痕边缘的细胞会逐渐进入空白区域使“划痕”愈合。 基本的步骤包括“划痕”的制造,细胞迁移期间图像的获得以及后期数据的处理。特点: 1,在一定程度上模拟了体内细胞迁移的过程。 2, 非常适合研究细胞与胞外基质(ECM),细胞与细胞之间相互作用引起的细胞迁移。 3,与包括活细胞成像在内的显微镜系统兼容,可用于分析细胞间的相互作用。4,研究细胞迁移的体外实验中最简单的方法。 传统实验方法 实验步骤: 1,培养板接种细胞之前先用marker笔在12孔板背面画横线标记(方便拍照时定位同一个视野)。 2,细胞消化后接入12孔板,数量以贴壁后铺满板底为宜(数量少时可培养一段时间至铺满板底)。 3, 细胞铺满板底后,用1ml枪头垂直于孔板制造细胞划痕,尽量保证各个划痕宽度一致。(人工枪头制造划痕难以保证划痕宽度的一致性,影响实验结果,这也是该方法最大的缺陷。) 4,吸去细胞培养液,用PBS冲洗孔板三次,洗去划痕产生的细胞碎片。 5,加入无血清培养基,拍照记录。 6,将培养板放入培养箱培养,每隔4-6小时取出拍照 7,根据收集图片数据分析实验结果。 德国IBIDI(易必迪)公司Culture Insert方法 1,准备细胞,培养液,culture Insert。 2,如图,将细胞接种于Dish中间的Insert,细胞长满Insert 区域后用镊子移除Insert即可产生500μm宽度的划痕。 3,每隔4-6小时拍照记录。 4,根据收集图片数据分析实验结果。
划痕攻略之如何使用Image-Pro Plus分析划痕实验划痕实验大家做了不少,但是如何能快速地将实验结果量化呢?今天给大家介绍如何用Image-Pro Plus分析划痕实验。 我们先回顾一下划痕实验的实验原理和步骤 实验原理:细胞划痕法是测定肿瘤细胞的运动特性的方法之一,是在体外培养的单层细胞上划痕致伤,观察肿瘤细胞的迁移情况。 实验步骤:1、培养板接种细胞之前先用marker笔在6孔板背面画横线标记(方便拍照时定位同一个视野)。 2、细胞消化后接入6孔板,数量以贴壁后铺满板底为宜(数量少时 可培养一段时间至铺满板底)。 3、细胞铺满板底后,用10μL枪头垂直于孔板制造细胞划痕,尽量 保证各个划痕宽度一致。 4、吸去细胞培养液,用PBS冲洗孔板三次,洗去划痕产生的细胞碎 片。 5、加入含有4μg/m L丝裂霉素(防止细胞增殖过快)的完全/基础培 养基,拍照记录。 6、将培养板放入培养箱培养,不同时间点取出拍照。 7、Image-Pro Plus分析实验结果。 划痕实验的结果是以照片的形式呈现的,那么如何将这一大批的图片进行量化呢?下面我给大家介绍一下运用Image-Pro Plus来分析划划痕实验结果。 我用的是Image-Pro Plus 6.0版本(需要的小伙伴可以私信拿安装包) 1.首先打开Image-Pro Plus,在File菜单栏下的open那里选择你要分析的图片或者把你要分析的图片直接拖入软件中(fig.1)。
Fig.1 2.选择工具栏里的计算和测量工具即红色箭头所指(Fig.2) Fig.2 3.在count/Size小窗口里选择measure下拉栏里的select measurements 选择我们要分析的面积(Area)和宽度(Box width)(Fig.3)
细胞迁移实验技术 —划痕实验 一、基本原理 细胞划痕(修复)法是简捷测定细胞迁移运动与修复能力的方法,类似体外伤口愈合模型,在体外培养皿或平板培养的单层贴壁细胞上,用微量枪头或其它硬物在细胞生长的中央区域划线,去除中央部分的细胞,然后继续培养细胞至实验设定的时间(例如72h),取出细胞培养板,观察周边细胞是否生长(修复)至中央划痕区,以此判断细胞的生长迁移能力,实验通常需设定正常对照组和实验组,实验组是加了某种处理因素或药物、外源性基因等的组别,通过不同分组之间的细胞对于划痕区的修复能力,可以判断各组细胞的迁移与修复能力。 二、操作步骤 1.先用marker笔在6孔板背后,用直尺比着,均匀的划横线,大约每隔0.5~1cm一道,横穿过孔。每孔至少穿过5条线。 2.在孔中加入约5×105个细胞,具体数量因细胞种类不同而不同,接种原则为过夜后融合率达到100%。 3.第二天用枪头比着直尺,尽量垂至于背后的横线划痕,枪头要垂直,不能倾斜(不同孔之间最好使用同一只枪头)。 4.PBS洗细胞3次,去处划下的细胞,加入无血清培养基。 5.放入37℃5%CO2培养箱,培养。可按0,6,12,24h时间点取样,拍照(具体时间依实验需要而定)。 6.统计方法:使用ImageJ软件打开图片后,随机划取6至8条水平线,计算细胞间距离的均值。
三、注意事项: 1.在用PBS 缓冲液冲洗时,注意贴壁慢慢加入,以免冲散单层贴壁细胞,影响实验拍照结果。 2.一般做划痕实验,都是无血清或者低血清(<2%)否则细胞增殖就不能忽略。 3.按照6孔板背后画线的垂直方向划痕,可以形成若干交叉点,作为固定的检测点,以解决了前后观察时位置不固定的问题。
抗肿瘤药物5氟尿嘧啶对肿瘤细胞 迁移的影响 欧阳学文 (细胞划痕法) 实验导读 瘤组织的增殖失控、瘤细胞的分化异常、瘤细胞具有侵袭和转移的能力是恶性肿瘤最基本的生物学特征,而侵袭和转移又是恶性肿瘤威胁患者健康乃至生命的主要原因。因此研究肿瘤侵袭和转移的规律及其发生机制,对恶性肿瘤的防治有重要意义。 肿瘤转移是指恶性肿瘤细胞从原发部位侵入淋巴管、血管或体腔,至靶组织或靶器官,长出与原发瘤不相连续而组织学类型相同的肿瘤。前者称为原发瘤,后者称为转移瘤或继发瘤。 图1 肿瘤转移示意图 根据肿瘤异质性理论,大多数恶性肿瘤最初虽属单克隆起源,但它在不断增殖演进至临床明显的肿瘤时,由于瘤细
胞遗传性状的不稳定性(来自基因突变或缺失等)而不断地变异,造成该肿瘤内瘤细胞亚群表型的多样性,诸如瘤细胞的侵袭性、生长速率、转移能力,核型乃至对激素的反应性和抗肿瘤药物的敏感性等,这些瘤细胞亚群具有被此不同的特性即所谓异质性。异质性与肿瘤转移直接有关的就是癌细胞的转移潜能,癌细胞的转移潜能有高低之分,具有高转移潜能的筋细胞易发生转移。 肿瘤细胞的运动性,来源于细胞运动“接触抑制”的概念。通过体外培养正常和恶性结缔组织细胞,发现正常纤维母细胞在移动过程中引起的皱栖脑膜与其他细胞的表面接触时,往往产生细胞膜活动的抑制和移动中细胞的缩短,然后停止。当纤维母细胞生长过程中在培养皿上融合形成一单层时,细胞运动即显著受到抑制。间变的肉瘤细胞则缺乏接触抑制,瘤细胞的运动不会被正常纤维母细胞所抑制。 针对肿瘤转移这一复杂的过程,人们研制了各种抗转移药物,如血小板凝集抑制剂、血管生成抑制因子、内皮稳定因子、干扰素-α以及其他化学药物。
五、Matrigel体外侵袭实验所需: 1、Transwell 小室 2、上层培养液:含10g/L BSA的无血清培养液 3、细胞:实验细胞 4、基质胶:Matrigel基质胶为了方便运输和保存,一般是在-20℃(至少保存3个月),呈固体状态。使用前要将Matrigel提前放入4℃冰箱冰上过夜(12h),Matrigel即融化为液体状态备用,避免反复冻融。在冰冻和解冻过程中可能会发生颜色变化属正常现象,一旦解冻,晃动瓶子使其分散均匀。Matrigel冰上维持液态,22~35℃可迅速凝结成胶,使用前接触Matrigel的试管、移液吸头等均须4℃预冷。 5、下层培养液:含FBS或趋化因子的培养液 6、细胞培养板:12孔板,24孔板等 十二、Matrigel 体外侵袭实验 1.实验前的准备 (1)使用前要将Matrigel提前放入4℃冰箱过夜,溶胶。 (2)接触Matrigel的试管、移液吸头等均须4℃预冷。 2.包被基底膜(冰上进行) (1)冻融后,用预冷的移液枪头混匀Matrigel基质成匀浆状。 (2)根据使用需要,用无血清的冷细胞培养基稀释Matrigel胶(稀释比例根据不同细胞系,比例约为1:6~1:3)。 (3)将稀释胶包被于所需的Transwell上室中,包被量至少覆盖整个生长表面,例120μl稀释胶加到12孔transwell上室中。 (4)37℃孵育1小时。 (5)去除未结合的Matrigel,用无血清培养基轻轻冲洗。 3.水化基底膜 吸出培养板中残余液体,每孔加入50μl含10g/L BSA的无血清培养液,37℃,30min。 4.制备细胞悬液 (1) 制备细胞悬液前可先让细胞撤血清饥饿12~24h,进一步去除血清的影响。 (2)常规消化细胞,终止消化后离心收集细胞沉淀,PBS洗1~2遍,用含10g/L BSA 的无血清培养基重悬。调整细胞密度至1~10×105个/ml(一般不超过5×105个/ml)。 5.接种细胞 (1)取细胞悬液加入transwell小室。不同公司不、同大小的transwell小室对细胞悬液量有不同要求,请参考说明书。24孔板小室一般200μl,12孔板加400μl。
细胞划痕实验 细胞划痕实验是一种简单易行的检测细胞运动的方法,实验成本低,可以用来检测贴壁生长肿瘤细胞的侵袭转移能力。 实验材料:细胞样品 仪器、耗材:6孔板marker笔直尺枪头 试剂、试剂盒:无血清培养基、PBS 抗体:Hamster igG 3、λ抗体 实验步骤: 一.准备: 所有能灭菌的器械都要灭菌,直尺和marker笔在操作前紫外照射30min(超净台内) 二.流程: 1.先用marker笔在6孔板背后,用直尺比着,均匀得划横线,大约每隔0.5~1cm一道,横穿过孔。每孔至少穿过5条线。 2.在空中加入约5X105个细胞,具体数量因细胞不同而不同,掌握为过夜能铺满。 3.第二天用枪头比着直尺,尽量垂至于背后的横线划痕,枪头要垂直,不能倾斜。 4.用PBS洗细胞3次,去处划下的细胞,加入无血清培养基。 5.放入37度5%CO2培养箱,培养。按0,6,12,24小时取样,拍照。 注意的几个问题: 1、划痕前是不倒培养基的,划痕后再倒掉培养基加PBS清洗后加无血清培养基; 细胞长到融合成单层状态时,在融合的单层细胞上人为制造一个空白区域,称为“划痕”。划痕边缘的细胞会逐渐进入空白区域使“划痕”愈合。因此是整个培养皿都加培养基的,观察部位是划痕而已。 2、通过算每个视野的划痕面积,可以通过image J 软件计算。 3、划痕法的意义在于,价格低廉,操作简单。还有很重要的一点在于细胞外围环境简单单纯,容易控制。(比如做加药的,可能会和血清的组分有反映,而且受血清批次的影响,造成误差。如果是铺了ECM物质的,组分就更复杂了。) 划痕法的不足也很明显,适用的细胞系很窄,一般只能用于上皮,纤维样细胞系。因为 a.这些细胞本身有迁移能力,且较强。 b.细胞有极性,方便测量,观察。 c.细胞对无血清有较强的忍受力(至少24小时),因此很多肿瘤细胞系是不适合做划痕的,很多肿瘤细胞系在无血清培养下,12小时细胞凋亡就超过50%。这也就是transwell发展的最大要求。而一些上皮样细胞系甚至可以忍受高达72小时的无血清实验。足以弥合划痕。 4、其实在伤口弥合中,fibroblast的向创口处迁移就是典型的侧向爬行。但是其实癌细胞的迁移倒不是侧向爬行那么简单,我觉得应该是综合效应,而且要看是什么类型的肿瘤。因为对于远端病灶的转移,显然是通过血液运输的。这是一个细胞去黏附和再黏附的过程。其实transwell也不能很好的模仿这个过程。只是transwell+matrigel可以模仿肿瘤细胞融解基质,侵入到正常组织的这个过程。也就是侵袭。所以对于做cancer的来说,可能transwell会更好些。但我觉得并不能就简单否定scar assay。细胞的迁移作为细胞的一个正常生理活动,是表征细胞生理变化的一个重要指标。这点是很主要的意义。
细胞划痕 细胞划痕实验是指将细胞培养在培养皿或平板上,待细胞融合后用枪头或其他硬物在中央区域画一条线,这条线内的细胞被机械力去除掉了,然后将细胞继续培养,观察细胞向无细胞的划痕区域迁移的情况,来判断细胞的迁移能力。其意义在于:价格低廉,操作简单,还有很重要的一点在于细胞外围环境简单、单纯,容易控制,是肿瘤细胞最基本的研究方法。 一、实验前准备 实验开始前,将离心管、吸管筒、移液枪、枪头,直尺等放入无菌超净工作台,以紫外线照射30min。然后,采用通风机通风3min。 取出无菌6孔板,用黑色记号笔在6孔板底部,用直尺比着,均匀的划横线,大约每隔0.5~1cm一道,横穿过孔,每孔至少穿过3条线。每条黑线的上下缘与划痕交叉点作为观察点,这样一方面便于观察另一方面可以一次取多个观察点,最终可以获得多个数据。 画好横线后,在板上分别做好标记。 取下试剂瓶和离心管上的封口膜,且将每个试剂瓶和离心管拧松,方便后续试验的操作。 二、细胞准备 取出处于对数生长期的健康细胞,吸掉原来的培养液,用无菌PBS清洗细胞。加入1ml 胰酶消化液消化细胞,显微镜下观察所有细胞完全皱缩变圆后加入完全培养基终止消化。收集细胞悬液于15ml离心管中,800rpm/min室温离心5min。用罗氏CASY快速细胞计数及活率分析仪进行细胞计数,弃去上清,加入培养基重悬细胞。,以每孔1~4×105细胞的密度接种到6孔培养板上,在含10%胎牛血清的DMEM培养基中培养一天。具体数量因细胞种类不同而不同,掌握为过夜能铺满。 三、直线划痕 取出铺满六孔板的细胞,用200ul枪头垂直于细胞表面,由孔一端划向另一端。尽量垂直于背面的横线划痕,枪头要垂直,不能倾斜。此时可在培养皿的表面清晰看到细胞表面呈#字形划痕。
细胞划痕实验的详细步骤及说明细胞迁移(cell migration):也称为细胞移动、细胞爬行或细胞运动,是指细胞在接收到迁移信号或感受到某些物质的梯度后而产生的移动。 它参与到很多生理和病理的活动中,如下: 免疫:如淋巴细胞的定向迁移是其分化成熟和发挥功能的关键之一; 炎症:炎症反应最重要的功能是将白细胞送到炎症灶,白细胞迁移到炎症部位并发挥其吞噬和组织损伤作用; 肿瘤转移:肿瘤转移是肿瘤恶化后最常见的活动,如侵入淋巴管、血管后随脉管系统实现远处转移; 损伤修复:当机体发生损伤时,免疫细胞和血小板会迁移到损伤部位,参与消炎和凝血; 胚胎发育:胚胎期不同类型祖细胞迁移至特异靶位以保证各组织、器官的正常发育。 细胞划痕实验的基本原理: 在融合的单层细胞上人为制造一个空白区域,称为“划痕/伤口”,边缘的细胞会逐渐进入空白区域使“划痕/伤口”愈合。因其类似体外伤口愈合过程,又名伤口愈合实验(Wound-Healing Assay),广泛用于可以观察药物、基因等外源因素对细胞迁移和修复的影响。
细胞划痕实验过程: 在体外培养皿或平板培养的单层贴壁细胞上,用微量枪头或其它硬物在细胞生长的中央区域划线,去除中央部分的细胞,然后再继续培养细胞至实验设定的时间(可有不同时间点),取出细胞培养板,显微镜下观察周边细胞是否迁至中央划痕区,并拍照。 具体实验步骤: 1. 培养板划线标记 用marker笔在6孔板背后画横线(用直尺比着),每孔至少穿过5条线,每条线均匀且平行。 2. 细胞铺板 在孔内接种约5-10*105个细胞(可根据细胞的生长快慢调整接种数量),原则为过夜后细胞能够长满,切记一定要铺匀(细胞铺板均匀技巧可参考往期内容)。 3. 细胞划线 第二天用20uL枪头(灭菌)或牙签,垂直孔板背后的黑线划痕,使划痕与标记线相交。 Tips:
抗肿瘤药物5-氟尿嘧啶对肿瘤细胞迁移的影响 (细胞划痕法) 实验导读 瘤组织的增殖失控、瘤细胞的分化异常、瘤细胞具有侵袭和转移的能力是恶性肿瘤最基 本的生物学特征,而侵袭和转移又是恶性肿瘤威胁患者健康乃至生命的主要原因。 因此研究 肿瘤侵袭和转移的规律及其发生机制,对恶性肿瘤的防治有重要意义。 肿瘤转移是指恶性肿瘤细胞从原发部位侵入淋巴管、血管或体腔,至靶组织或靶器官, 长出与原发瘤不相连续而组织学类型相同的肿瘤。 前者称为原发瘤,后者称为转移瘤或继发 瘤。 图1肿瘤转移示意图 根据肿瘤异质性理论, 大多数恶性肿瘤最初虽属单克隆起源, 临床明显的肿瘤时,由于瘤细胞遗传性状的不稳定性 (来自基因突变或缺失等)而不断地变 异,造成该肿瘤内瘤细胞亚群表型的多样性,诸如瘤细胞的侵袭性、生长速率、转移能力, 核型乃至对激素的反应性和抗肿瘤药物的敏感性等, 这些瘤细胞亚群具有被此不同的特性即 所谓异质性。异质性与肿瘤转移直接有关的就是癌细胞的转移潜能, 癌细胞的转移潜能有高 低之 分,具有高转移潜能的筋细胞易发生转移。 肿瘤细胞的运动性,来源于细胞运动“接触抑制”的概念。 通过体外培养正常和恶性结 缔组织细胞,发现正常纤维母细胞在移动过程中引起的皱栖脑膜与其他细胞的表面接触时, 往往产生 细胞膜活动的抑制和移动中细胞的缩短, 然后停止。当纤维母细胞生长过程中在培 INVASION 但它在不断增殖演进至 Am BM BM ANGIOGENESIS MIGRATION PROLIFERAHON PRIMARY SARCOMA PRIMARY CARCINOMA ANGIOGENESIS ARKtSF
—划痕实验 一、基本原理 细胞划痕(修复)法是简捷测定细胞迁移运动与修复能力的方法,类似体外伤口愈合模型,在体外培养皿或平板培养的单层贴壁细胞上,用微量枪头或其它硬物在细胞生长的中央区域划线,去除中央部分的细胞,然后继续培养细胞至实验设定的时间(例如72h),取出细胞培养板,观察周边细胞是否生长(修复)至中央划痕区,以此判断细胞的生长迁移能力,实验通常需设定正常对照组和实验组,实验组是加了某种处理因素或药物、外源性基因等的组别,通过不同分组之间的细胞对于划痕区的修复能力,可以判断各组细胞的迁移与修复能力。 二、操作步骤 1.先用marker笔在6孔板背后,用直尺比着,均匀的划横线,大约每隔~1cm一道,横穿过孔。每孔至少穿过5条线。 2.在孔中加入约5×105个细胞,具体数量因细胞种类不同而不同,接种原则为过夜后融合率达到100%。 3.第二天用枪头比着直尺,尽量垂至于背后的横线划痕,枪头要垂直,不能倾斜(不同孔之间最好使用同一只枪头)。 4.PBS洗细胞3次,去处划下的细胞,加入无血清培养基。 5.放入37℃ 5% CO2培养箱,培养。可按0,6,12,24h时间点取样,拍照(具体时间依实验需要而定)。 6.统计方法:使用Image J软件打开图片后,随机划取6至8条水平线,计算细胞间距离的均值。 三、注意事项: 1.在用PBS缓冲液冲洗时,注意贴壁慢慢加入,以免冲散单层贴壁细胞,影响实验拍照结果。 2.一般做划痕实验,都是无血清或者低血清(<2%)否则细胞增殖就不能忽略。 3.按照6孔板背后画线的垂直方向划痕,可以形成若干交叉点,作为固定的检测点,以解决了前后观察时位置不固定的问题。
划痕(修复)实验服务 实验服务目的 细胞划痕法检测细胞的迁移能力 材料:6孔板(其他的也可以,但感觉6孔比较好,大小适中)marker笔,直尺20,微升枪头(灭菌),无血清培养基,PBS 准备: 所有能灭菌的器械都要灭菌,直尺和marker笔在操作前紫外照射30min(超净台内) 流程: 1.先用marker笔在6孔板背后,用直尺比着,均匀得划横线,大约每隔0.5~1cm一道,横穿过孔。每孔至少穿过5条线。 2.在空中加入约5X105个细胞,具体数量因细胞不同而不同,掌握为过夜能铺满。 3.第二天用枪头比着直尺,尽量垂至于背后的横线划痕,枪头要垂直,不能倾斜。 4.用PBS洗细胞3次,去处划下的细胞,加入无血清培养基。 5.放入37度5%CO2培养箱,培养。按0,6,12,24小时取样,拍照。【晶莱生物】 细胞划痕实验服务原理 将细胞培养,观察细胞向无细胞的划痕区域迁移情况,来判断细胞的迁移能力 细胞划痕实验服务材料 实验仪器:超净工作台、CO2培养箱、生物倒置显微镜 细胞划痕实验服务内容与方法 1、使用marker笔在6孔板背后,均匀得划横线,大约每隔0.5-1cm一道,横穿过孔。每孔至少穿过5条线。 2、在孔中加入约5×105个细胞,具体数量因细胞不同而不同,掌握为过夜能铺满。 3、第二天用枪头比着直尺,尽量垂至于背后的横线划痕,枪头要垂直,不能倾斜。 4、用PBS洗细胞3次,去除划下的细胞,加入无血清培养基。 5、放入37度5%co2培养箱,培养。按0,6,12,24小时取样,拍照。[晶莱生物] 细胞划痕实验服务信息(客户提供) 1、生长状况良好的细胞株,一并提供细胞特性,培养条件及相关注意事项。 2、受试样品及相关信息 细胞划痕服务服务周期 2周 细胞划痕实验结果提交
细胞培养实验指导 陈轶霞刘俊林 实验报告书写要求: 1、学生实验后应按时完成并提交实验报告。报告要求结构完整、内容充实、图表齐全、书面整洁、分析讨论认真合理等。 2、严禁互相抄袭实验报告,发现雷同实验报告一律视为不及格。 3、切忌全班同学统一打印相同的实验结果图(以前曾发生过全班同学共用一张错误的图的情况) 实验一细胞培养实验室介绍及使用卫生要求 【目的与要求】 1.了解细胞培养实验室的基本设施和布局 2. 掌握细胞培养实验室的使用卫生要求 【基本原理】 细胞培养必须无菌操作,要求工作环境和条件必须保证无微生物污染和不受其它有害因素影响,应建立专门的实验室并划分不同功能区。理想的细胞培养实验室可分为准备室、更衣室、缓冲室、培养室等。 【内容与方法】 1.通过教师讲解并参观了解开展本课程教学的细胞培养实验室的布局、设施与仪器设备的摆放情况 2.使用卫生要求。 (1)实验室的消毒 实验室日常采用紫外灯消毒;按实验室的卫生管理要求对实验室洁净区按周期进行熏蒸消毒;在培养期间发生严重污染时要进行熏蒸消毒。 (2)培养工作开始操作前将所有培养用的物品经专用物流通道通过传递窗放进培养室,开紫外灯消毒30min,关紫外灯后方进入操作。配有空气净化系统的洁净室在风机开启至少30min后才能达到相应的洁净度级别。 (3)操作者进入培养室时要遵守的程序 a: 用肥皂洗手,在干手器上吹掉手臂上的水滴。 b: 换穿无菌室专用鞋,进入更衣室,外衣挂到指定的衣柜里,用0.1%新洁尔灭溶液对手及前臂进行消毒,戴帽子(不露头发)、口罩(应包住胡须),穿已消毒的洁净服,进入缓冲室。再用0.1%新洁尔灭溶液对手及前臂消毒,在其滞留3min后进入培养室。 (4)开超净工作台10min,期间用0.1%新洁尔灭溶液的擦拭操作台面后可开始具体的操作,同时点燃酒精灯用于临时性的火焰消毒。 (5)实验完毕,关闭超净工作台,及时清理实验用品,废物从通往物流通道的传递窗中传出。工作台面用0.1%新洁尔灭溶液的擦拭消毒后方可出培养室。 (6)出培养室时,将工作服放在更衣室指定的位置以便清洗和消毒,鞋放到隔离鞋柜里,跨过隔离鞋柜,将用过的一次性帽子、口罩、鞋套等放到指定的废物桶,出实验室前用肥皂洗手,关闭空气净化
划痕实验: 1.细胞接种到六孔板中,每孔接约5×105 个细胞(SMMC7721,不同细胞 具体接种数量掌握为24 h能铺满板),放入37℃ 5%CO2培养箱培养,20~ 24 h观察是否铺满板。待铺满后开始划痕实验。 2.用灭过菌的200uL黄色枪头在每个孔中间划一条痕(枪头垂直划线,每 次力度均一,划线要直,一次性划到底,可用板盖当尺子),PBS洗2遍,去除划下的细胞,显微镜拍照(放大倍数为100倍)。 3.换含不同药物的无血清培养液继续培养(空白组用PBS代替药物,每组 设3个平行)。 4.24h或48h后拍照(放大倍数为100倍)固定点测量划痕距离是否改变。 5.用Photoshop中的直方图测量间距大小,表示不同组细胞发生迁移的距 离。将对照组迁移距离大小设为100%,实验组迁移比例为:(对照组迁 移距离-实验组迁移距离)/对照组迁移距离*100%。 6.数据分析后作图。 如图例:
Transwell实验: 1、收取处于对数生长期的细胞。终止消化后离心弃去培养液,用PBS洗1-2遍, 再用无血清培养基重悬,彻底去除血清干扰,调整细胞密度1~5×105个。2、Transwell小室(孔径大小有不同规格,一般肿瘤细胞选8 μm;迁移实验用 普通Transwell小室,侵袭实验用含有基质胶的Transwell小室)里加入制备好的细胞悬液(1×105个),小室内液体总体积为200 μL。 3、24孔板中加入500 μL含10% 胎牛血清的完全培养基。将Transwell小室放 入24孔板中。 特别注意:下层培养液和小室间常会有气泡产生,一旦产生气泡,下层培养液的趋化作用就减弱甚至消失了,因此在种板和培养过程中要特别留心,一旦出现气泡,要将小室提起,去除气泡,再将小室放进培养板。 4、将带有小室的24孔板置于37℃ 5% CO2培养箱中培养,18-48 h后(时间依 不同实验不同细胞而定)取出,非贴壁细胞直接计数下层细胞数,贴壁细胞拍照计数小室底部膜上细胞(步骤如下)。 5、轻轻吸出小室内的培养基,用37℃预热的PBS轻轻洗一遍,每孔加入4℃预 冷的4%多聚甲醛(或甲醇)固定液500uL,于室温固定细胞20min,PBS轻轻洗3次。 6、用湿棉签轻轻刮出小室中上层细胞,重复3次。 7、PBS轻轻洗3次,吸干残余PBS。 8、每孔加入结晶紫染色液400~500uL(没过小室底部)于37℃中孵育30min。 9、用枪吸出结晶紫并用双蒸水轻洗3次,室温倒置风干。 10、显微镜拍照(200倍镜下每小室的一个横轴或纵轴拍五张图,计算平均细胞数)。数据分析后作图,比较不同药物对细胞迁移或侵袭速率的影响。 33%醋酸洗脱细胞,洗脱液570nm 下测OD值
直尺20微升枪头(灭菌)无血清培养基PBS 准备:所有能灭菌的器械都要灭菌,直尺和marker笔在操作前紫外照射30min(超净台内) 流程:1。先用marker笔在6孔板背后,用直尺比着,均匀得划横线,大约每隔0.5~1cm一道,横穿过孔。每孔至少穿过5条线。2。在空中加入约5X105个细胞,具体数量因细胞不同而不同,掌握为过夜能铺满。3。第二天用枪头比着直尺,尽量垂至于背后的横线划痕,枪头要垂直,不能倾斜。4。用PBS洗细胞3次,去处划下的细胞,加入无血清培养基。5。放入37度5%co2培养箱,培养。按0,6,12,24小时取样,拍照。 NOTE 6空板可以保证有相当距离的平直划痕,我觉得挺不错的。而且因为有5条定位线,与划痕相交,这样就有10个可固定监测点,不作重复,误差也很小。 如果你连续监测24小时,你需要考虑到划痕缩小是细胞迁移和细胞繁殖共同作用的结果,而不是单纯的细胞迁移。如果你要单纯的考虑细胞迁移,你可以先用丝裂霉素(1ug/ml)处理一小时,抑制细胞的分裂,这样你的结果就是细胞迁移的作用了。 照片拍完之后,可以用image J 来测量划痕区域的像素定量比较细胞迁移的速度。 无血清的话,应该一个细胞周期内,增殖可以忽略吧。而且我定点监测的话,差不多可以对应到每个细胞。好像没有看见很明显的增殖现象。丝裂霉素貌似很贵的说。。。如果用这个还不如直接用transwell呢。另,image J 哪里有下载么?谢谢。ImageJ 下载网址: 无血清培养,确实细胞增殖可以忽略了,不过由于细胞内信号传导系统整体性的下调节,细胞迁移的速度也会慢很多。不知道是不是大多数文献都用无血清培养状态下作划痕实验呢?目前最好的方法还是transwell法 一般做划痕实验,都是无血清或者低血清(《2%)否则细胞增殖就不能忽略。一般认为细胞周期是24小时,但对于一些特殊的细胞系来说,生长可能会快一点。因此好像还没看见用带血清培养,短时间检测的。不过我会去试试看。可能是个好方法。划痕法的意义在于,价格低廉,操作简单。还有很重要的一点在于细胞外围环境简单单纯,容易控制。(比如做加药的,可能会和血清的组分有反映,而且受血清批次的影响,造成误差。如果是铺了ECM物质的,组分就更复杂了。)划痕法的不足也很明显,适用的细胞系很窄,一般只能用于上皮,纤维样细胞系。因为1。这些细胞本身有迁移能力,且较强。2。细胞有极性,方便测量,观察。3。细胞对无血清有较强的忍受力(至少24小时),因此很多肿瘤细胞系是不适合做划痕的,很多肿瘤细胞系在无血清培养下,12小时细胞凋亡就超过50%。这也就是transwell 发展的最大要求。而一些上皮样细胞系甚至可以忍受高达72小时的无血清实验。足以弥合划痕。
ibidi 伤口愈合与细胞迁移实验 细胞划痕实验是一种操作简单,经济实惠的研究细胞迁移/肿瘤侵袭的体外试验方法。这种方法的原理是,当细胞长到融合成单层状态时,在融合的单层细胞上人为制造一个空白区域,称为“划痕”。划痕边缘的细胞会逐渐进入空白区域使“划痕”愈合。 基本步骤:“划痕”的制造,细胞迁移期间图像的获得以及后期数据的处理。 特点: 1.在一定程度上模拟了体内细胞迁移的过程。 2.非常适合研究细胞与胞外基质(ECM),细胞与细胞之间相互作用引起的细胞迁移。 3.与包括活细胞成像在内的显微镜系统兼容,可用于分析细胞间的相互作 4.研究细胞迁移的体外实验中最简单的方法。 传统实验方法:细胞融合后,用枪头在细胞层表面制造划痕实验方法缺陷:人工制造的“划痕”很难保证一致性,重复性差。 ibidi Culture-Insert 生物相容性硅胶制成的插件,可产生确定的500μm “划痕”区域。适合于伤口愈合实验,细胞迁移实验,2D侵袭和共培养。 技术参数:
材料:生物相容硅胶材料 规格:两孔(70μl/孔) 尺寸(长x宽x高):8.4 mm x 8.4 mm x 5 mm 底部:可黏附底部 每孔生长面积:0.22 cm2 产生“划痕”宽度:500 μm 操作步骤: 其他应用:
ibidi Culture Insert与传统划痕实验比较: Ibidi Culture Insert提供重复性更好的实验结果 实验结果分析: Data Acquisition/数据采集: 显微镜用于评估伤口愈合的过程。根据你的关注点和兴趣,不仅可以视频显微镜,还可以进行定点的成像观察。ibidi加热与孵育系统可以直接在培养的条件下进行活细胞成像,不用将样品反复的从孵育室移至显微镜上。 Wound Healing Image Analysis/伤口成像分析– WimScratch 是一个伤口愈合和细胞迁移实验的成像分析软件 1. 全面解决伤口愈合实验-从样品准备到成像分析只需要几步 2. 客观的和可再生分析 3. 简单并且快速的数据处理-几分钟出结果 4. 不需要额外的硬件或者软件 WimScratch 自动分析实验结果 WimScratch是基于网站的自动化分析平台,无需任何软件和硬件,只要将图片上传到数据分析平台,几分钟之后结果就可以发送到注册邮箱。