
抗肿瘤药物5-氟尿嘧啶对肿瘤细胞迁移的影响
(细胞划痕法)
实验导读
瘤组织的增殖失控、瘤细胞的分化异常、瘤细胞具有侵袭和转移的能力是恶性肿瘤最基本的生物学特征,而侵袭和转移又是恶性肿瘤威胁患者健康乃至生命的主要原因。因此研究肿瘤侵袭和转移的规律及其发生机制,对恶性肿瘤的防治有重要意义。
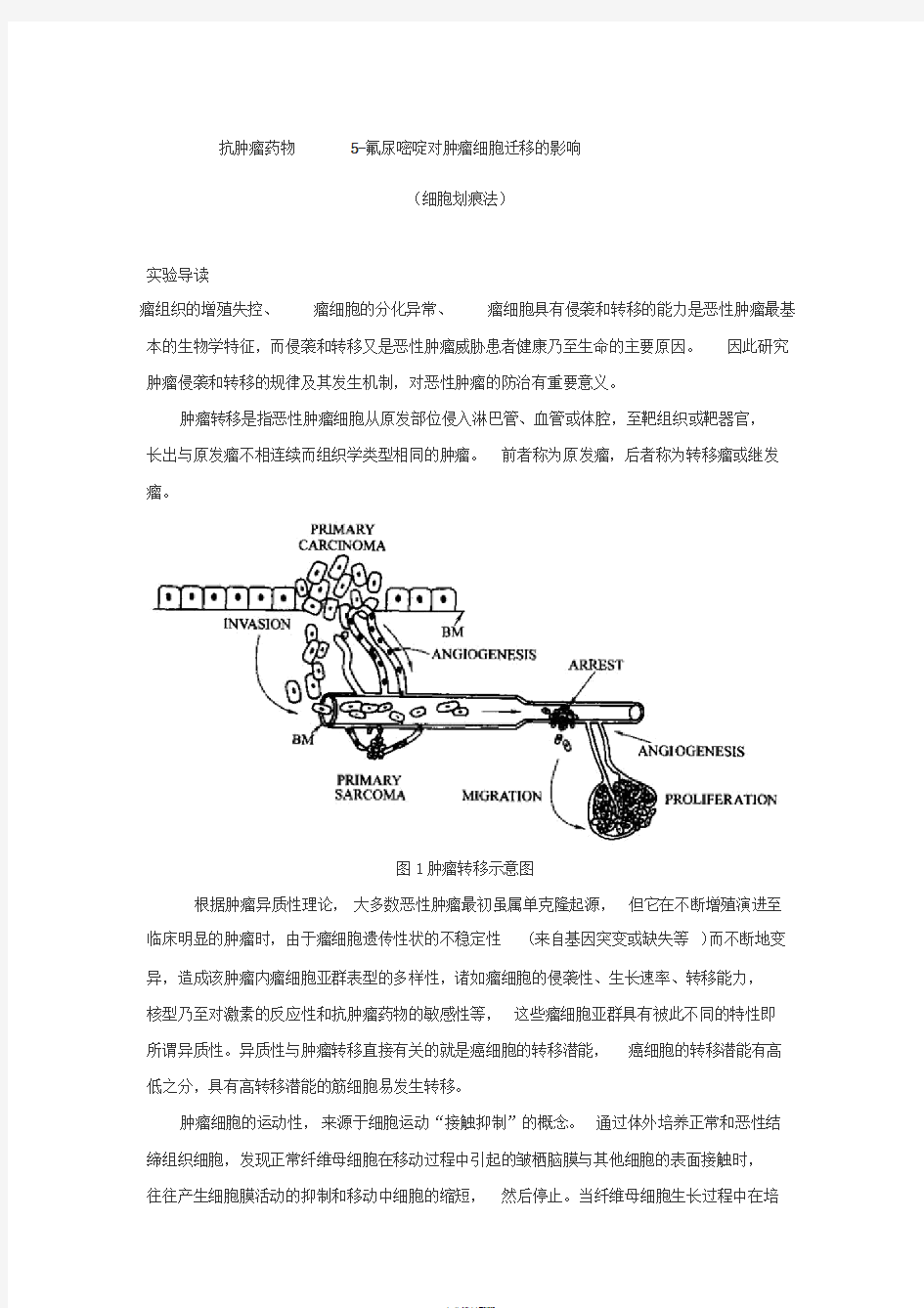
肿瘤转移是指恶性肿瘤细胞从原发部位侵入淋巴管、血管或体腔,至靶组织或靶器官,
长出与原发瘤不相连续而组织学类型相同的肿瘤。前者称为原发瘤,后者称为转移瘤或继发瘤。
图1肿瘤转移示意图
根据肿瘤异质性理论,大多数恶性肿瘤最初虽属单克隆起源,但它在不断增殖演进至临床明显的肿瘤时,由于瘤细胞遗传性状的不稳定性(来自基因突变或缺失等)而不断地变异,造成该肿瘤内瘤细胞亚群表型的多样性,诸如瘤细胞的侵袭性、生长速率、转移能力,
核型乃至对激素的反应性和抗肿瘤药物的敏感性等,这些瘤细胞亚群具有被此不同的特性即
所谓异质性。异质性与肿瘤转移直接有关的就是癌细胞的转移潜能,癌细胞的转移潜能有高低之分,具有高转移潜能的筋细胞易发生转移。
肿瘤细胞的运动性,来源于细胞运动“接触抑制”的概念。通过体外培养正常和恶性结缔组织细胞,发现正常纤维母细胞在移动过程中引起的皱栖脑膜与其他细胞的表面接触时,
往往产生细胞膜活动的抑制和移动中细胞的缩短,然后停止。当纤维母细胞生长过程中在培
养皿上融合形成一单层时,细胞运动即显著受到抑制。间变的肉瘤细胞则缺乏接触抑制,瘤细胞的运动不会被正常纤维母细胞所抑制。
针对肿瘤转移这一复杂的过程,人们研制了各种抗转移药物,如血小板凝集抑制剂、血管生成抑制因子、内皮稳定因子、干扰素-α以及其他化学药物。
细胞划痕法是测定了肿瘤细胞的运动特性的方法之一。其借鉴体外细胞致伤愈合实验模型,在体外培养的单层细胞上,划痕致伤,然后加入药物观察其抑制肿瘤细胞迁移的能力。
下图即为划痕实验的示意图,图中可见,在细胞层上出现一道空痕(A),当加入药物后,
由于药物的作用使细胞迁移受到抑制(B),而未加入药物的细胞保持了原有的迁移能力,在
一段时间后通过迁移将划痕掩盖(C)。
A B
C
图2实验结果(A表示在单层细胞上划出的一道痕;B表示加入抑制剂,为阳性对照组; C
表示未加入抑制剂,为阴性对照组)
一、实验目的
1.了解肿瘤细胞转移的基本原理
2.了解测定细胞运动特性的方法――细胞划痕法
二、实验原理
肿瘤细胞在体外仍具有迁移的能力,本实验借鉴体外细胞致伤愈合实验模型,利用细胞
划痕法测定了肿瘤细胞的运动特性。
三、仪器和试剂
1)细胞系及其培养:肝肿瘤细胞HepG2
2)24孔板,移液器,倒置显微镜,
3)主要试剂:PBS,DMEM培养液,0.25%胰酶,胎牛血清,5-氟尿嘧啶溶液(1ug/ml)
四、实验步骤
1.5-氟尿嘧啶溶液的配制
精密称取10mg用灭菌蒸馏水溶解,定容于100ml容量瓶,精密移取1ml溶液,稀释至
100ml,即得1ug/ml5-氟尿嘧啶溶液。
2.制备单层细胞
将细胞密度为 5~10×105个/mL的HepG2细胞铺于24孔板(每孔500uL)上,加入
含10%胎牛血清的RMPI.1640 培养液,培养16~24h,使形成单层细胞。
3.划痕
以五氟尿嘧啶(5-Fu)为例,首先配制1μg/μL的母液,取45μL该母液用PBS稀释
至1.1mL,得到浓度为40μg/ML的5-Fu溶液。
用10uL移液枪枪头(或者无菌牙签)在单层细胞上呈“一”字划痕,用PBS清洗 3
次,然后加入上面配好的5-Fu 溶液,平行两个样本,孵
育
24h 后换成
含
10%胎牛血清的
RMPI.1640 培养液,孵
育
24h。
4.观察并拍照
吸去培养液,用 PBS清洗3次后,在倒置荧光显微镜下观察并拍照。
五、注意事项:
1.实验时应注意细胞生长状况,选择适当的细胞接种浓度。对不同的细胞要观察细胞的贴壁率等,确定实验时细胞的接种数量和培养时间,保证培养终止时密度适当。
2.在用PBS缓冲液冲洗时,注意贴壁慢慢加入,以免冲散单层贴壁细胞,影响实验拍照结果。
3.在药物的筛选过程中,其对细胞迁移能力的影响也是重要的一方面。实验设计过程中需要选择适当的阳性对照组和阴性对照组。
六、思考题
1.如何用实验验证化学物质能恢复或者增强细胞的迁移能力?
2.如何避免化学物质浓度过高造成的细胞毒性对实验的影响?
七、参考文献:
1版1.司徒镇强,吴军正;《细胞培养》;兴界图书出版公司;2004年3月
第
2.MaryBirch,StephenMitchell,andIanR.Hart.IsolationandCharacterizationofHumanMelano maCellVariantsExpressingHighandLowLevelsofCD44.CANCERRESEARCH
1991;51:6660-6667.
3.何贤峰,杨述华等.唑来膦酸对骨肉瘤细胞生物学行为的影响.肿瘤防治研究2008;35(2):77-80.
4.罗庚求,文继舫,李景和等.Twist对胃癌细胞系MKN28迁移和侵袭能力的影响.中南大学学报(医学版)2008;33(2):174-178.
(赵丹军汤谷平)
实验介绍 细胞迁移与侵袭实验将Transwell小室放入培养板中,小室内称上室,培养板内称下室,上下层培养液以聚碳酸酯膜相隔,将研究的细胞种在上室内,由于聚碳酸酯膜有通透性,下层培养液中的成分可以影响到上室内的细胞,应用不同孔径和经过不同处理的聚碳酸酯膜,就可以进行共培养、细胞趋化、细胞迁移、细胞侵袭等多种方面的研究。 实验步骤: 1材料准备: 可拍照显微镜,Transwell小室,孔径8μm,没包被胶的(Coster和Corning公司的也较常用),Transwell迁移实验的细胞培养板24孔板。细胞培养板应当与购买的Transwell小室相配套,BD公司的Matrigel,无血清DMEM,(1%胎牛血清)DMEM和1640培养基,DMEM完全培养基,1640完全培养基(也可加到20%血清),无菌PBS,棉签,胰酶,4%多聚甲醛固定液或者甲醇,结晶紫染液(%(g/ml)PBS结晶紫) 2步骤和流程 基质胶铺板: 用BD公司的Matrigel 1:8(根据细胞产生mmp的量来决定)稀释,包被Transwell小室底部膜的上室面,置37℃30min使Matrigel聚合成凝胶。使用前进行基底膜水化。 制备细胞悬液 ①制备细胞悬液前可先让细胞撤血清饥饿12-24h,进一步去除血清的影响。但这一步并不是必须的。 ②消化细胞,终止消化后离心弃去培养液,(用PBS洗1-2遍),用含BSA的无血清培养基重悬。调整细胞密度至5×105/ml。 接种细胞 ①取细胞悬液100μl加入Transwell小室。 ②24孔板下室一般加入600μl含20%FBS的培养基,特别注意的是,下层培养液和小室间常会有气泡产生,一旦产生气泡,下层培养液的趋化作用就减弱甚至消失了,在种板的时候要特别留心,一旦出现气泡,要将小室提起,去除气泡,再将小室放进培养板。 ③培养细胞:常规培养12-48h(主要依癌细胞侵袭能力而定)。24h较常见,时间点的选择除了要考虑到细胞细胞侵袭力外,处理因素对细胞数目的影响也不可忽视。 结果统计 直接计数法,“贴壁”细胞计数,这里所谓的“贴壁”是指细胞穿过膜后,可以附着在膜的
直尺20微升枪头(灭菌)无血清培养基PBS 准备: 所有能灭菌的器械都要灭菌,直尺和marker笔在操作前紫外照射30min(超净台内) 流程: 1。先用marker笔在6孔板背后,用直尺比着,均匀得划横线,大约每隔0.5~1cm一道,横穿过孔。每孔至少穿过5条线。 2。在空中加入约5X105个细胞,具体数量因细胞不同而不同,掌握为过夜能铺满。 3。第二天用枪头比着直尺,尽量垂至于背后的横线划痕,枪头要垂直,不能倾斜。 4。用PBS洗细胞3次,去处划下的细胞,加入无血清培养基。 5。放入37度5%co2培养箱,培养。按0,6,12,24小时取样,拍照。 NOTE 6空板可以保证有相当距离的平直划痕,我觉得挺不错的。而且因为有5条定位线,与划痕相交,这样就有10个可固定监测点,不作重复,误差也很小。 如果你连续监测24小时,你需要考虑到划痕缩小是细胞迁移和细胞繁殖共同作用的结果,而不是单纯的细胞迁移。如果你要单纯的考虑细胞迁移,你可以先用丝裂霉素(1ug/ml)处理一小时,抑制细胞的分裂,这样你的结果就是细胞迁移的作用了。 照片拍完之后,可以用image J 来测量划痕区域的像素定量比较细胞迁移的速度。 无血清的话,应该一个细胞周期内,增殖可以忽略吧。而且我定点监测的话,差不多可以对应到每个细胞。好像没有看见很明显的增殖现象。丝裂霉素貌似很贵的说。。。如果用这个还不如直接用transwell呢。 另,image J 哪里有下载么?谢谢。 ImageJ 下载网址:https://www.doczj.com/doc/8c15108801.html,/ij/download.html 无血清培养,确实细胞增殖可以忽略了,不过由于细胞内信号传导系统整体性的下调节,细胞迁移的速度也会慢很多。不知道是不是大多数文献都用无血清培养状态下作划痕实验呢?目前最好的方法还是transwell法 一般做划痕实验,都是无血清或者低血清(《2%)否则细胞增殖就不能忽略。一般认为细胞周期是24小时,但对于一些特殊的细胞系来说,生长可能会快一点。因此好像还没看见用带血清培养,短时间检测的。不过我会去试试看。可能是个好方法。 划痕法的意义在于,价格低廉,操作简单。还有很重要的一点在于细胞外围环境简单单纯,容易控制。(比如做加药的,可能会和血清的组分有反映,而且受血清批次的影响,造成误差。如果是铺了ECM物质的,组分就更复杂了。) 划痕法的不足也很明显,适用的细胞系很窄,一般只能用于上皮,纤维样细胞系。因为1。这些细胞本身有迁移能力,且较强。 2。细胞有极性,方便测量,观察。 3。细胞对无血清有较强的忍受力(至少24小时),因此很多肿瘤细胞系是不适合做划痕的,很多肿瘤细胞系在无血清培养下,12小时细胞凋亡就超过50%。这也就是transwell发展的最大要求。而一些上皮样细胞系甚至可以忍受高达72小时的无血清实验。足以弥合划痕。
于侵袭、迁移等试验的细胞计数及铺板 [实验步骤] 1、准备工作用 75% 的酒精擦拭双手,同时用酒精棉球擦拭超净台。2)将培养液、实验所需材料也放入超净台进行灭菌(血清、培养基除外)3)倒置显微镜下,观察细胞的状态,是否已经长满培养瓶,需要进行分瓶。 2、弃去培养基,用枪尽量去培养基。贴壁加入5mlPBS液清洗一遍,四个方向晃动倒掉。 3、将0.25%胰酶600ul加入培养皿内,拍皿,上下左右铺匀,37°消化30分钟左右,随时观察,见到细胞泥沙状留下时,即消化完全. 4、加入4ml的含5%血清的新鲜培养基,反复吹打消化好的细胞使其脱壁并分散,制成细胞悬液,然后装到15ml离心管中。1000rpm,3min. 5、弃上清。用PBS 3ml 洗细胞,吹打或涡旋混匀,洗2次,离心1000rpm,3min.弃上清。 6、配细胞稀释液(BSA 终浓度为0.1%)每种细胞需3ml稀释液,共6个样品,所以配20ml稀释液(无血培20ml+10%BSA 200ul.) 7、细胞沉淀中加3ml细胞稀释液,吹打混匀,即得稀释过的细胞悬液。 8、细胞计数板每孔加15ul悬液。每个样品计数2次,算均值。(8个大格总数/8=数值*104) 9、根据铺板密度,计算稀释过的细胞悬液用量,剩余体积用细胞稀释液补。 普通的细胞计数及铺板(免疫荧光,WB等不需定量) [实验步骤] 1、准备工作用75% 的酒精擦拭双手,同时用酒精棉球擦拭超净台。2)将 培养液、实验所需材料也放入超净台进行灭菌(血清、培养基除外)3)倒置显 微镜下,观察细胞的状态,是否已经长满培养瓶,需要进行分瓶。 2、弃去培养基,用枪尽量去培养基。贴壁加入5mlPBS液清洗一遍,四个方向晃动倒掉。 3、将0.25%胰酶600ul加入培养皿内,拍皿,上下左右铺匀,37°消化30分钟左右,随时观察,见到细胞泥沙状留下时,即消化完全. 4、加入4ml的含血清的新鲜培养基,反复吹打消化好的细胞使其脱壁并分散,制成细胞悬液,然后装到15ml离心管中。1000rpm,3min.若细胞较多,则需稀释。 5、取上述1ml细胞悬液,在加1ml含血清的新鲜培养基,混匀。 6、细胞计数板每孔加15ul悬液。每个样品对角线计数2次,算均值。 7 、根据铺板密度,计算稀释过的细胞悬液用量,剩余体积用含血清的新鲜 培养基补。
细胞迁移和侵袭实验 实验准备: 细胞,24孔板,transwell小室(8μm,24孔板专用),ECM Gel,10%FBS+培养基,无血清培养基,10 μ、200 μL、1000 μL移液器及配套枪头,1.5 mL EP 管,冰盒 实验设计: 实验分组一般分为阴性组(上下层均没有趋化因素),实验组(按照实验需要,上层或者下层加入趋化因素),对照组(趋化因素与实验组中的相反)。如果有特别需要,可以再加上阳性组(上下层都有趋化因素)。 实验操作(请细读注意事项): 一、细胞侵袭实验 1.ECM Gel原液提前1 h放在4 ℃冰箱中解冻,实验前转移到冰盒中。 2.将1.5 mL EP、枪头盒、transwell放在24孔板里面后,置于冰上预冷。 3.根据自己的使用量,按照ECM Gel : 无血清培养基=1 : 7.5在冰上稀释成使 用液。 4.把枪头剪去一小段(约3 μm)后在冰上吸取40 μL/孔ECM Gel使用液轻轻 加入transwell上室中,加入时慢慢移动枪头,保证液体平铺在底部。 5.放在37 ℃孵箱15 min,让胶凝固。 6.消化、离心、计数细胞后,按照2.5x104 / mL用无血清培养基稀释细胞, 制成细胞悬液(如果细胞很多,这一步可以提前,在4、5之前做)。 7.按照每孔200 μL,将细胞悬液加入transwell上室,同时在transwell下室加 入10%FBS+培养基500 μL,放入37 ℃孵箱培养。 8.若干小时后取出,吸去transwell上室多余液体,用PBS清洗两次,用棉棒 在上室中轻轻转动,吸干水分并擦去膜内侧的细胞。 9.在上室中加入结晶紫染液,染色5 min,回收染液,用流水缓缓冲去染液, 再次用棉棒在上室中轻轻转动,吸干水分。 10.在正置显微镜上放置一块载玻片,将transwell小孔倒置放在上面,拍照。 11.在100倍视野下,对膜的上下左右及中间计数,做平均数。
实验室细胞划痕实验简介 细胞划痕实验是一种操作简单,经济实惠的研究细胞迁移/肿瘤侵袭的体外试验方法。这种方法的原理是,当细胞长到融合成单层状态时,在融合的单层细胞上人为制造一个空白区域,称为“划痕”。划痕边缘的细胞会逐渐进入空白区域使“划痕”愈合。 基本的步骤包括“划痕”的制造,细胞迁移期间图像的获得以及后期数据的处理。特点: 1,在一定程度上模拟了体内细胞迁移的过程。 2, 非常适合研究细胞与胞外基质(ECM),细胞与细胞之间相互作用引起的细胞迁移。 3,与包括活细胞成像在内的显微镜系统兼容,可用于分析细胞间的相互作用。4,研究细胞迁移的体外实验中最简单的方法。 传统实验方法 实验步骤: 1,培养板接种细胞之前先用marker笔在12孔板背面画横线标记(方便拍照时定位同一个视野)。 2,细胞消化后接入12孔板,数量以贴壁后铺满板底为宜(数量少时可培养一段时间至铺满板底)。 3, 细胞铺满板底后,用1ml枪头垂直于孔板制造细胞划痕,尽量保证各个划痕宽度一致。(人工枪头制造划痕难以保证划痕宽度的一致性,影响实验结果,这也是该方法最大的缺陷。) 4,吸去细胞培养液,用PBS冲洗孔板三次,洗去划痕产生的细胞碎片。 5,加入无血清培养基,拍照记录。 6,将培养板放入培养箱培养,每隔4-6小时取出拍照 7,根据收集图片数据分析实验结果。 德国IBIDI(易必迪)公司Culture Insert方法 1,准备细胞,培养液,culture Insert。 2,如图,将细胞接种于Dish中间的Insert,细胞长满Insert 区域后用镊子移除Insert即可产生500μm宽度的划痕。 3,每隔4-6小时拍照记录。 4,根据收集图片数据分析实验结果。
Transwell侵袭实验全面总结 第一节概念 这里想明确两个概念,一个是Transwell,另一个是肿瘤细胞侵袭模型。 1.Transwell trans-这个词根有转移、转运、穿过等意思,well有小室的意思,可以从字面上理解,这是一类有通透性的杯状的装置,根据Corning公司的Transwell说明书中的介绍,可以认为这是一种膜滤器(Membrane filters),也可认为是一种有通透性的支架(permeable support s)。更准确地说,Transwell应该是一种实验技术,这项技术的主要材料是Transwell小室(T ranswell chamber,Transwell insert),其外形为一个可放置在孔板里的小杯子,不同厂家对Transwell会有不同的命名,而不同型号也可有不同形状,不同大小,根据实验需要,可有不同选择。 但无论是何种外形,其关键部分都是一致的,那就是杯子底层的一张有通透性的膜,而杯子其余部分的材料与普通的孔板是一样。这层膜带有微孔,孔径大小有-μm,根据不同需要
可用不同材料,一般常用的是聚碳酸酯膜(polycarbonate membrane)。下图是一个Trans well装置的纵切面 将Transwell小室放入培养板中,小室内称上室,培养板内称下室,上室内盛装上层培养液,下室内盛装下层培养液,上下层培养液以聚碳酸酯膜相隔。我们将细胞种在上室内,由于聚碳酸酯膜有通透性,下层培养液中的成分可以影响到上室内的细胞,从而可以研究下层培养 液中的成分对细胞生长、运动等的影响。 应用不同孔径和经过不同处理的聚碳酸酯膜,就可以进行共培养、细胞趋化、细胞迁移、细胞侵袭等多种方面的研究。当然不同细胞其体积不同,具体选择时要考虑到细胞大小。这里主要谈几种大家常用的实验: (1)共培养体系: 小于孔径条件下,细胞不会迁徙通过,因此,若研究不涉及细胞运动能力,不需要细胞穿过聚碳酸酯膜,则应选择μm以下孔径。常用、μm。我们实验室用的是μm。将细胞A种于上室,细胞B种于下室,可以研究细胞B分泌或代谢产生的物质对细胞A的影响。
划痕攻略之如何使用Image-Pro Plus分析划痕实验划痕实验大家做了不少,但是如何能快速地将实验结果量化呢?今天给大家介绍如何用Image-Pro Plus分析划痕实验。 我们先回顾一下划痕实验的实验原理和步骤 实验原理:细胞划痕法是测定肿瘤细胞的运动特性的方法之一,是在体外培养的单层细胞上划痕致伤,观察肿瘤细胞的迁移情况。 实验步骤:1、培养板接种细胞之前先用marker笔在6孔板背面画横线标记(方便拍照时定位同一个视野)。 2、细胞消化后接入6孔板,数量以贴壁后铺满板底为宜(数量少时 可培养一段时间至铺满板底)。 3、细胞铺满板底后,用10μL枪头垂直于孔板制造细胞划痕,尽量 保证各个划痕宽度一致。 4、吸去细胞培养液,用PBS冲洗孔板三次,洗去划痕产生的细胞碎 片。 5、加入含有4μg/m L丝裂霉素(防止细胞增殖过快)的完全/基础培 养基,拍照记录。 6、将培养板放入培养箱培养,不同时间点取出拍照。 7、Image-Pro Plus分析实验结果。 划痕实验的结果是以照片的形式呈现的,那么如何将这一大批的图片进行量化呢?下面我给大家介绍一下运用Image-Pro Plus来分析划划痕实验结果。 我用的是Image-Pro Plus 6.0版本(需要的小伙伴可以私信拿安装包) 1.首先打开Image-Pro Plus,在File菜单栏下的open那里选择你要分析的图片或者把你要分析的图片直接拖入软件中(fig.1)。
Fig.1 2.选择工具栏里的计算和测量工具即红色箭头所指(Fig.2) Fig.2 3.在count/Size小窗口里选择measure下拉栏里的select measurements 选择我们要分析的面积(Area)和宽度(Box width)(Fig.3)
迁移实验(cell migration assay) 实验介绍 细胞迁移与侵袭实验将Transwell小室放入培养板中,小室内称上室,培养板内称下室,上下层培养液以聚碳酸酯膜相隔,将研究的细胞种在上室内,由于聚碳酸酯膜有通透性,下层培养液中的成分可以影响到上室内的细胞,应用不同孔径和经过不同处理的聚碳酸酯膜,就可以进行共培养、细胞趋化、细胞迁移、细胞侵袭等多种方面的研究。 实验步骤: 1材料准备: 可拍照显微镜,Transwell小室,孔径8μm,没包被胶的(Coster和Corning公司的也较常用),Transwell迁移实验的细胞培养板24孔板。细胞培养板应当与购买的Transwell小室相配套,BD公司的Matrigel,无血清DMEM,(1%胎牛血清)DMEM和1640培养基,DMEM 完全培养基,1640完全培养基(也可加到20%血清),无菌PBS,棉签,胰酶,4%多聚甲醛固定液或者甲醇,结晶紫染液(0.1%(g/ml)PBS结晶紫) 2步骤和流程 2.1基质胶铺板: 用BD公司的Matrigel 1:8(根据细胞产生mmp的量来决定)稀释,包被Transwell小室底部膜的上室面,置37℃30min使Matrigel聚合成凝胶。使用前进行基底膜水化。 2.2制备细胞悬液 ①制备细胞悬液前可先让细胞撤血清饥饿12-24h,进一步去除血清的影响。但这一步并不是必须的。 ②消化细胞,终止消化后离心弃去培养液,(用PBS洗1-2遍),用含BSA的无血清培养基重悬。调整细胞密度至5×105/ml。 2.3接种细胞 ①取细胞悬液100μl加入Transwell小室。 ②24孔板下室一般加入600μl含20%FBS的培养基,特别注意的是,下层培养液和小室间常会有气泡产生,一旦产生气泡,下层培养液的趋化作用就减弱甚至消失了,在种板的时候要特别留心,一旦出现气泡,要将小室提起,去除气泡,再将小室放进培养板。 ③培养细胞:常规培养12-48h(主要依癌细胞侵袭能力而定)。24h较常见,时间点的选择除了要考虑到细胞细胞侵袭力外,处理因素对细胞数目的影响也不可忽视。 2.4结果统计 直接计数法,“贴壁”细胞计数,这里所谓的“贴壁”是指细胞穿过膜后,可以附着在膜的下室侧而不会掉到下室里面去,通过给细胞染色,可在镜下计数细胞。 取出Transwell小室,弃去孔中培养液,用无钙的PBS洗2遍,甲醇固定30分钟,将小室适当风干。 0.1%结晶紫染色20 min,用棉签轻轻擦掉上层未迁移细胞,用PBS洗3遍。 400倍显微镜下随即五个视野观察细胞,记数。 实验材料
细胞迁移实验技术 —划痕实验 一、基本原理 细胞划痕(修复)法是简捷测定细胞迁移运动与修复能力的方法,类似体外伤口愈合模型,在体外培养皿或平板培养的单层贴壁细胞上,用微量枪头或其它硬物在细胞生长的中央区域划线,去除中央部分的细胞,然后继续培养细胞至实验设定的时间(例如72h),取出细胞培养板,观察周边细胞是否生长(修复)至中央划痕区,以此判断细胞的生长迁移能力,实验通常需设定正常对照组和实验组,实验组是加了某种处理因素或药物、外源性基因等的组别,通过不同分组之间的细胞对于划痕区的修复能力,可以判断各组细胞的迁移与修复能力。 二、操作步骤 1.先用marker笔在6孔板背后,用直尺比着,均匀的划横线,大约每隔0.5~1cm一道,横穿过孔。每孔至少穿过5条线。 2.在孔中加入约5×105个细胞,具体数量因细胞种类不同而不同,接种原则为过夜后融合率达到100%。 3.第二天用枪头比着直尺,尽量垂至于背后的横线划痕,枪头要垂直,不能倾斜(不同孔之间最好使用同一只枪头)。 4.PBS洗细胞3次,去处划下的细胞,加入无血清培养基。 5.放入37℃5%CO2培养箱,培养。可按0,6,12,24h时间点取样,拍照(具体时间依实验需要而定)。 6.统计方法:使用ImageJ软件打开图片后,随机划取6至8条水平线,计算细胞间距离的均值。
三、注意事项: 1.在用PBS 缓冲液冲洗时,注意贴壁慢慢加入,以免冲散单层贴壁细胞,影响实验拍照结果。 2.一般做划痕实验,都是无血清或者低血清(<2%)否则细胞增殖就不能忽略。 3.按照6孔板背后画线的垂直方向划痕,可以形成若干交叉点,作为固定的检测点,以解决了前后观察时位置不固定的问题。
抗肿瘤药物5氟尿嘧啶对肿瘤细胞 迁移的影响 欧阳学文 (细胞划痕法) 实验导读 瘤组织的增殖失控、瘤细胞的分化异常、瘤细胞具有侵袭和转移的能力是恶性肿瘤最基本的生物学特征,而侵袭和转移又是恶性肿瘤威胁患者健康乃至生命的主要原因。因此研究肿瘤侵袭和转移的规律及其发生机制,对恶性肿瘤的防治有重要意义。 肿瘤转移是指恶性肿瘤细胞从原发部位侵入淋巴管、血管或体腔,至靶组织或靶器官,长出与原发瘤不相连续而组织学类型相同的肿瘤。前者称为原发瘤,后者称为转移瘤或继发瘤。 图1 肿瘤转移示意图 根据肿瘤异质性理论,大多数恶性肿瘤最初虽属单克隆起源,但它在不断增殖演进至临床明显的肿瘤时,由于瘤细
胞遗传性状的不稳定性(来自基因突变或缺失等)而不断地变异,造成该肿瘤内瘤细胞亚群表型的多样性,诸如瘤细胞的侵袭性、生长速率、转移能力,核型乃至对激素的反应性和抗肿瘤药物的敏感性等,这些瘤细胞亚群具有被此不同的特性即所谓异质性。异质性与肿瘤转移直接有关的就是癌细胞的转移潜能,癌细胞的转移潜能有高低之分,具有高转移潜能的筋细胞易发生转移。 肿瘤细胞的运动性,来源于细胞运动“接触抑制”的概念。通过体外培养正常和恶性结缔组织细胞,发现正常纤维母细胞在移动过程中引起的皱栖脑膜与其他细胞的表面接触时,往往产生细胞膜活动的抑制和移动中细胞的缩短,然后停止。当纤维母细胞生长过程中在培养皿上融合形成一单层时,细胞运动即显著受到抑制。间变的肉瘤细胞则缺乏接触抑制,瘤细胞的运动不会被正常纤维母细胞所抑制。 针对肿瘤转移这一复杂的过程,人们研制了各种抗转移药物,如血小板凝集抑制剂、血管生成抑制因子、内皮稳定因子、干扰素-α以及其他化学药物。
五、Matrigel体外侵袭实验所需: 1、Transwell 小室 2、上层培养液:含10g/L BSA的无血清培养液 3、细胞:实验细胞 4、基质胶:Matrigel基质胶为了方便运输和保存,一般是在-20℃(至少保存3个月),呈固体状态。使用前要将Matrigel提前放入4℃冰箱冰上过夜(12h),Matrigel即融化为液体状态备用,避免反复冻融。在冰冻和解冻过程中可能会发生颜色变化属正常现象,一旦解冻,晃动瓶子使其分散均匀。Matrigel冰上维持液态,22~35℃可迅速凝结成胶,使用前接触Matrigel的试管、移液吸头等均须4℃预冷。 5、下层培养液:含FBS或趋化因子的培养液 6、细胞培养板:12孔板,24孔板等 十二、Matrigel 体外侵袭实验 1.实验前的准备 (1)使用前要将Matrigel提前放入4℃冰箱过夜,溶胶。 (2)接触Matrigel的试管、移液吸头等均须4℃预冷。 2.包被基底膜(冰上进行) (1)冻融后,用预冷的移液枪头混匀Matrigel基质成匀浆状。 (2)根据使用需要,用无血清的冷细胞培养基稀释Matrigel胶(稀释比例根据不同细胞系,比例约为1:6~1:3)。 (3)将稀释胶包被于所需的Transwell上室中,包被量至少覆盖整个生长表面,例120μl稀释胶加到12孔transwell上室中。 (4)37℃孵育1小时。 (5)去除未结合的Matrigel,用无血清培养基轻轻冲洗。 3.水化基底膜 吸出培养板中残余液体,每孔加入50μl含10g/L BSA的无血清培养液,37℃,30min。 4.制备细胞悬液 (1) 制备细胞悬液前可先让细胞撤血清饥饿12~24h,进一步去除血清的影响。 (2)常规消化细胞,终止消化后离心收集细胞沉淀,PBS洗1~2遍,用含10g/L BSA 的无血清培养基重悬。调整细胞密度至1~10×105个/ml(一般不超过5×105个/ml)。 5.接种细胞 (1)取细胞悬液加入transwell小室。不同公司不、同大小的transwell小室对细胞悬液量有不同要求,请参考说明书。24孔板小室一般200μl,12孔板加400μl。
Transwell侵袭实验总结 第一节概念 这里想明确两个概念,一个是Transwell,另一个是肿瘤细胞侵袭模型。 1.Transwell 关于Transwell这个词该如何解释,查了很多资料也未见准确的注解,我觉得可以这么理解吧,trans-这个词根有转移、转运、穿过等意思,well有小室的意思,可以从字面上理解,这是一类有通透性的杯状的装置,根据Corning公司的Transwell说明书中的介绍,可以认为这是一种膜滤器(Membrane filters),也可认为是一种有通透性的支架(permeable supports)。 更准确地说,Transwell应该是一种实验技术,这项技术的主要材料是Transwell小室(Transwell chamber,Transwell insert),其外形为一个可放置在孔板里的小杯子,不同厂家对Transwell会有不同的命名,而不同型号也可有不同形状,不同大小,根据实验需要,可有不同选择。 但无论是何种外形,其关键部分都是一致的,那就是杯子底层的一张有通透性的膜,而杯子其余部分的材料与普通的孔板是一样。这层膜带有微孔,孔径大小有0.1-12.0μm,根据不同需要可用不同材料,一般常用的是聚碳酸酯膜(polycarbonate membrane)。 下图是一个Transwell装置的纵切面
将Transwell小室放入培养板中,小室内称上室,培养板内称下室,上室内盛装上层培养液,下室内盛装下层培养液,上下层培养液以聚碳酸酯膜相隔。 我们将细胞种在上室内,由于聚碳酸酯膜有通透性,下层培养液中的成分可以影响到上室内的细胞,从而可以研究下层培养液中的成分对细胞生长、运动等的影响。 应用不同孔径和经过不同处理的聚碳酸酯膜,就可以进行共培养、细胞趋化、细胞迁移、细胞侵袭等多种方面的研究。 下面参考guxuefeng战友和cosmosci战友的帖子具体来谈谈孔径的选择,当然不同细胞其体积不同,具体选择时要考虑到细胞大小。这里主要谈几种大家常用的实验: (1)共培养体系: 小于3.0um孔径条件下,细胞不会迁徙通过,因此,若研究不涉及细胞运动能力,不需要细胞穿过聚碳酸酯膜,则应选择3.0μm以下孔径。常用0.4、3.0μm。我们实验室用的是0.4μm。
细胞划痕实验 细胞划痕实验是一种简单易行的检测细胞运动的方法,实验成本低,可以用来检测贴壁生长肿瘤细胞的侵袭转移能力。 实验材料:细胞样品 仪器、耗材:6孔板marker笔直尺枪头 试剂、试剂盒:无血清培养基、PBS 抗体:Hamster igG 3、λ抗体 实验步骤: 一.准备: 所有能灭菌的器械都要灭菌,直尺和marker笔在操作前紫外照射30min(超净台内) 二.流程: 1.先用marker笔在6孔板背后,用直尺比着,均匀得划横线,大约每隔0.5~1cm一道,横穿过孔。每孔至少穿过5条线。 2.在空中加入约5X105个细胞,具体数量因细胞不同而不同,掌握为过夜能铺满。 3.第二天用枪头比着直尺,尽量垂至于背后的横线划痕,枪头要垂直,不能倾斜。 4.用PBS洗细胞3次,去处划下的细胞,加入无血清培养基。 5.放入37度5%CO2培养箱,培养。按0,6,12,24小时取样,拍照。 注意的几个问题: 1、划痕前是不倒培养基的,划痕后再倒掉培养基加PBS清洗后加无血清培养基; 细胞长到融合成单层状态时,在融合的单层细胞上人为制造一个空白区域,称为“划痕”。划痕边缘的细胞会逐渐进入空白区域使“划痕”愈合。因此是整个培养皿都加培养基的,观察部位是划痕而已。 2、通过算每个视野的划痕面积,可以通过image J 软件计算。 3、划痕法的意义在于,价格低廉,操作简单。还有很重要的一点在于细胞外围环境简单单纯,容易控制。(比如做加药的,可能会和血清的组分有反映,而且受血清批次的影响,造成误差。如果是铺了ECM物质的,组分就更复杂了。) 划痕法的不足也很明显,适用的细胞系很窄,一般只能用于上皮,纤维样细胞系。因为 a.这些细胞本身有迁移能力,且较强。 b.细胞有极性,方便测量,观察。 c.细胞对无血清有较强的忍受力(至少24小时),因此很多肿瘤细胞系是不适合做划痕的,很多肿瘤细胞系在无血清培养下,12小时细胞凋亡就超过50%。这也就是transwell发展的最大要求。而一些上皮样细胞系甚至可以忍受高达72小时的无血清实验。足以弥合划痕。 4、其实在伤口弥合中,fibroblast的向创口处迁移就是典型的侧向爬行。但是其实癌细胞的迁移倒不是侧向爬行那么简单,我觉得应该是综合效应,而且要看是什么类型的肿瘤。因为对于远端病灶的转移,显然是通过血液运输的。这是一个细胞去黏附和再黏附的过程。其实transwell也不能很好的模仿这个过程。只是transwell+matrigel可以模仿肿瘤细胞融解基质,侵入到正常组织的这个过程。也就是侵袭。所以对于做cancer的来说,可能transwell会更好些。但我觉得并不能就简单否定scar assay。细胞的迁移作为细胞的一个正常生理活动,是表征细胞生理变化的一个重要指标。这点是很主要的意义。
细胞运动及迁移检测方法的比较与选择关键词:细胞仪器分析仪试剂标准物质北京标准物质网 一.transwell试验 transwell技术是检测细胞运动能力的经典方法,由于其原理简单、操作相对简便,该法目前已被广泛用于检测不同类型细胞的运动能力。内室底部的薄膜是整个实验装置的核心部分,待测细胞的直径决定了薄膜孔径的选择。通常情况下,薄膜的孔径应略小于细胞的直径以防止细胞直接漏入到外室。transwell试验对细胞运动和迁移能力的评价主要依赖于对转移至底膜外侧细胞的染色和计数。甲紫是transwell试验中常用的细胞染料,在染色前需要使用棉签将底膜内侧的细胞拭去以免残余的细胞着色后影响最终的细胞计数和统计。然而,通常使用棉签很难将膜内侧的细胞全部拭去,因此这是制约本试验精确度的主要因素之一。同时,甲紫染色后的细胞计数常由操作者在显微镜下完成,导致实验的最终结果缺乏稳定性和准确度。此外,该方法只适宜于终点检测法,难以实时检测细胞的运动变化。 目前已有改良的方法或实验装置可弥补以上几点不足。如在对发生迁移的细胞进行定量分析时,可以荧光染料将细胞着色,而后将底膜外侧的细胞经处理(如胰酶等)转移至计数板内,使用电子计数器对细胞总数进行定量分析。又如Roche 和AceaBio公司联合开发的xcELLigenee系统,将经典的transwell实验装置与微电子阻抗感应系统整合,实现了对细胞运动的实时监测。微电子阻抗系统所检测到的微电阻与细胞的数量,伸展状态,贴壁紧密程度等多项生理指标密切相
关,将其整合于内室底部微孔膜的下表面上,当细胞迁移至微孔膜底面时,则可引起细胞微电阻的升高,通过记录微电阻的变化可精确的反映细胞的运动状态。该系统提高了传统transwell的精确度,同时可以获取细胞运动的实时动态数据。然而,由于该系统需要借助于特殊的仪器设备,且成本相对较高,因此常应用于大规模及高通量的筛选工作。 二、二维平面内细胞运动的检测方法 1.划痕试验原理简单,操作便捷,不需要借助特殊的实验仪器,适用于任何具有贴壁特性的细胞,因此在细胞运动的检测中应用广泛。本方法中,细胞运动的能力反映为划痕宽度的变化,通常情况下划痕由实验操作者以移液器的吸管端划出,导致划痕的宽度并不均一,因此在一定程度上影响了划痕愈合度的评估。同时,有观点认为超过24小时的检测并不能排除细胞增殖对划痕愈合的影响,尽管在实验过程中通过降低培养基的血清浓度可在一定程度上削弱细胞增殖的影响,但划痕试验中观察时间点的设置仍宜控制在24小时以内。此外,在人为制造划痕时可对周围细胞产生一定的机械损伤,可能会影响划痕边界周围细胞的活性和运动潜能。同时,脱落的部分细胞可能在培养板静置后重新在无细胞区域定植和迁移,从而制造划痕愈合的假象。 目前,Applied BioPhysics公司推出了基于微电阻感应系统的划痕试验装置。借助于整合在细胞培养板l的电极,通过电流的脉冲刺激可产生宽度恒定均一的无细胞区域。同时通过检测无细胞区域的微电阻的增加,可以判断细胞向内迁移的数量。这种改良后的装置实现了实验条件的标准化和实验结果统计的精准化,但其对设备器材的要求和成本均相对较高。
细胞划痕 细胞划痕实验是指将细胞培养在培养皿或平板上,待细胞融合后用枪头或其他硬物在中央区域画一条线,这条线内的细胞被机械力去除掉了,然后将细胞继续培养,观察细胞向无细胞的划痕区域迁移的情况,来判断细胞的迁移能力。其意义在于:价格低廉,操作简单,还有很重要的一点在于细胞外围环境简单、单纯,容易控制,是肿瘤细胞最基本的研究方法。 一、实验前准备 实验开始前,将离心管、吸管筒、移液枪、枪头,直尺等放入无菌超净工作台,以紫外线照射30min。然后,采用通风机通风3min。 取出无菌6孔板,用黑色记号笔在6孔板底部,用直尺比着,均匀的划横线,大约每隔0.5~1cm一道,横穿过孔,每孔至少穿过3条线。每条黑线的上下缘与划痕交叉点作为观察点,这样一方面便于观察另一方面可以一次取多个观察点,最终可以获得多个数据。 画好横线后,在板上分别做好标记。 取下试剂瓶和离心管上的封口膜,且将每个试剂瓶和离心管拧松,方便后续试验的操作。 二、细胞准备 取出处于对数生长期的健康细胞,吸掉原来的培养液,用无菌PBS清洗细胞。加入1ml 胰酶消化液消化细胞,显微镜下观察所有细胞完全皱缩变圆后加入完全培养基终止消化。收集细胞悬液于15ml离心管中,800rpm/min室温离心5min。用罗氏CASY快速细胞计数及活率分析仪进行细胞计数,弃去上清,加入培养基重悬细胞。,以每孔1~4×105细胞的密度接种到6孔培养板上,在含10%胎牛血清的DMEM培养基中培养一天。具体数量因细胞种类不同而不同,掌握为过夜能铺满。 三、直线划痕 取出铺满六孔板的细胞,用200ul枪头垂直于细胞表面,由孔一端划向另一端。尽量垂直于背面的横线划痕,枪头要垂直,不能倾斜。此时可在培养皿的表面清晰看到细胞表面呈#字形划痕。
Transwell实验原理与操作步骤 Trans-这个词根有转移、转运、穿过等意思,well有小室的意思,可以从字面上理解,这是一类有通透性的杯状的装置,根据Corning公司的Transwell说明书中的介绍,可以认为这是一种膜滤器(Membrane filters),也可认为是一种有通透性的支架(permeable supports)。更准确地说,Transwell应该是一种实验技术,这项技术的主要材料是Transwell 小室(Transwell chamber,Transwell insert),其外形为一个可放置在孔板里的小杯子,不同厂家对Transwell会有不同的命名,而不同型号也可有不同形状,不同大小,根据实验需要,可有不同选择。但无论是何种外形,其关键部分都是一致的,那就是杯子底层的一张有通透性的膜,而杯子其余部分的材料与普通的孔板是一样。这层膜带有微孔,孔径大小有0.1-12.0μm,根据不同需要可用不同材料,一般常用的是聚碳酸酯膜(polycarbonate membrane)。 将Transwell小室放入培养板中,小室内称上室,培养板内称下室,上室内盛装上层培养液,下室内盛装下层培养液,上下层培养液以聚碳酸酯膜相隔。我们将细胞种在上室内,由于聚碳酸酯膜有通透性,下层培养液中的成分可以影响到上室内的细胞,从而可以研究下层培养液中的成分对细胞生长、运动等的影响。 应用不同孔径和经过不同处理的聚碳酸酯膜,就可以进行共培养、细胞趋化、细胞迁移、细胞侵袭等多种方面的研究。当然不同细胞其体积不同,具体选择时要考虑到细胞大小。这里主要谈几种大家常用的实验: (1)共培养体系: 小于3.0um孔径条件下,细胞不会迁徙通过,因此,若研究不涉及细胞运动能力,不需要细胞穿过聚碳酸酯膜,则应选择3.0μm以下孔径。常用0.4、3.0μm。我们实验室用的是0.4μm。将细胞A种于上室,细胞B种于下室,可以研究细胞B分泌或代谢产生的物质对细胞A的影响。 (2)趋化性实验: 可用5.0、8.0、12.0μm膜,上室细胞可穿过聚碳酸酯膜进入下室,计数进入下室的细胞量可反映下室成分对上室细胞的趋化能力。 ①细胞B对细胞A的趋化作用:将细胞A种于上室,细胞B种于下室,可以研究细胞B分泌或代谢产生的物质对细胞A的趋化作用。 ②趋化因子对细胞的趋化作用:将细胞种于上室,下室加入某种趋化因子,可研究该趋化因子对细胞的趋化作用。 (3)肿瘤细胞迁移实验: 常用8.0、12.0μm膜,上室种肿瘤细胞,下室加入FBS或某些特定的趋化因子,肿瘤细胞会向营养成分高的下室跑,计数进入下室的细胞量可反映肿瘤细胞的迁移能力。
细胞划痕实验的详细步骤及说明细胞迁移(cell migration):也称为细胞移动、细胞爬行或细胞运动,是指细胞在接收到迁移信号或感受到某些物质的梯度后而产生的移动。 它参与到很多生理和病理的活动中,如下: 免疫:如淋巴细胞的定向迁移是其分化成熟和发挥功能的关键之一; 炎症:炎症反应最重要的功能是将白细胞送到炎症灶,白细胞迁移到炎症部位并发挥其吞噬和组织损伤作用; 肿瘤转移:肿瘤转移是肿瘤恶化后最常见的活动,如侵入淋巴管、血管后随脉管系统实现远处转移; 损伤修复:当机体发生损伤时,免疫细胞和血小板会迁移到损伤部位,参与消炎和凝血; 胚胎发育:胚胎期不同类型祖细胞迁移至特异靶位以保证各组织、器官的正常发育。 细胞划痕实验的基本原理: 在融合的单层细胞上人为制造一个空白区域,称为“划痕/伤口”,边缘的细胞会逐渐进入空白区域使“划痕/伤口”愈合。因其类似体外伤口愈合过程,又名伤口愈合实验(Wound-Healing Assay),广泛用于可以观察药物、基因等外源因素对细胞迁移和修复的影响。
细胞划痕实验过程: 在体外培养皿或平板培养的单层贴壁细胞上,用微量枪头或其它硬物在细胞生长的中央区域划线,去除中央部分的细胞,然后再继续培养细胞至实验设定的时间(可有不同时间点),取出细胞培养板,显微镜下观察周边细胞是否迁至中央划痕区,并拍照。 具体实验步骤: 1. 培养板划线标记 用marker笔在6孔板背后画横线(用直尺比着),每孔至少穿过5条线,每条线均匀且平行。 2. 细胞铺板 在孔内接种约5-10*105个细胞(可根据细胞的生长快慢调整接种数量),原则为过夜后细胞能够长满,切记一定要铺匀(细胞铺板均匀技巧可参考往期内容)。 3. 细胞划线 第二天用20uL枪头(灭菌)或牙签,垂直孔板背后的黑线划痕,使划痕与标记线相交。 Tips:
抗肿瘤药物5-氟尿嘧啶对肿瘤细胞迁移的影响 (细胞划痕法) 实验导读 瘤组织的增殖失控、瘤细胞的分化异常、瘤细胞具有侵袭和转移的能力是恶性肿瘤最基 本的生物学特征,而侵袭和转移又是恶性肿瘤威胁患者健康乃至生命的主要原因。 因此研究 肿瘤侵袭和转移的规律及其发生机制,对恶性肿瘤的防治有重要意义。 肿瘤转移是指恶性肿瘤细胞从原发部位侵入淋巴管、血管或体腔,至靶组织或靶器官, 长出与原发瘤不相连续而组织学类型相同的肿瘤。 前者称为原发瘤,后者称为转移瘤或继发 瘤。 图1肿瘤转移示意图 根据肿瘤异质性理论, 大多数恶性肿瘤最初虽属单克隆起源, 临床明显的肿瘤时,由于瘤细胞遗传性状的不稳定性 (来自基因突变或缺失等)而不断地变 异,造成该肿瘤内瘤细胞亚群表型的多样性,诸如瘤细胞的侵袭性、生长速率、转移能力, 核型乃至对激素的反应性和抗肿瘤药物的敏感性等, 这些瘤细胞亚群具有被此不同的特性即 所谓异质性。异质性与肿瘤转移直接有关的就是癌细胞的转移潜能, 癌细胞的转移潜能有高 低之 分,具有高转移潜能的筋细胞易发生转移。 肿瘤细胞的运动性,来源于细胞运动“接触抑制”的概念。 通过体外培养正常和恶性结 缔组织细胞,发现正常纤维母细胞在移动过程中引起的皱栖脑膜与其他细胞的表面接触时, 往往产生 细胞膜活动的抑制和移动中细胞的缩短, 然后停止。当纤维母细胞生长过程中在培 INVASION 但它在不断增殖演进至 Am BM BM ANGIOGENESIS MIGRATION PROLIFERAHON PRIMARY SARCOMA PRIMARY CARCINOMA ANGIOGENESIS ARKtSF
迁移实验(cell migration assay) 实验介绍 细胞迁移与侵袭实验将Transwell小室放入培养板中,小室内称上室,培养板内称下室,上下层培养液以聚碳酸酯膜相隔,将研究的细胞种在上室内,由于聚碳酸酯膜有通透性,下层培养液中的成分可以影响到上室内的细胞,应用不同孔径与经过不同处理的聚碳酸酯膜,就可以进行共培养、细胞趋化、细胞迁移、细胞侵袭等多种方面的研究。 实验步骤: 1材料准备: 可拍照显微镜,Transwell小室,孔径8μm,没包被胶的(Coster与Corning公司的也较常用),Transwell迁移实验的细胞培养板24孔板。细胞培养板应当与购买的Transwell小室相配套,BD公司的Matrigel,无血清DMEM,(1%胎牛血清)DMEM与1640培养基,DMEM完全培养基,1640完全培养基(也可加到20%血清),无菌PBS,棉签,胰酶,4%多聚甲醛固定液或者甲醇,结晶紫染液(0、1%(g/ml)PBS结晶紫) 2步骤与流程 2、1基质胶铺板: 用BD公司的Matrigel 1:8(根据细胞产生mmp的量来决定)稀释,包被Transwell小室底部膜的上室面,置37℃30min使Matrigel聚合成凝胶。使用前进行基底膜水化。 2、2制备细胞悬液 ①制备细胞悬液前可先让细胞撤血清饥饿12-24h,进一步去除血清的影响。但这一步并不就是必须的。 ②消化细胞,终止消化后离心弃去培养液,(用PBS洗1-2遍),用含BSA的无血清培养基重悬。调整细胞密度至5×105/ml。 2、3接种细胞 ①取细胞悬液100μl加入Transwell小室。 ②24孔板下室一般加入600μl含20%FBS的培养基,特别注意的就是,下层培养液与小室间常会有气泡产生,一旦产生气泡,下层培养液的趋化作用就减弱甚至消失了,在种板的时候要特别留心,一旦出现气泡,要将小室提起,去除气泡,再将小室放进培养板。 ③培养细胞:常规培养12-48h(主要依癌细胞侵袭能力而定)。24h较常见,时间点的选择除了要考虑到细胞细胞侵袭力外,处理因素对细胞数目的影响也不可忽视。 2、4结果统计 直接计数法,“贴壁”细胞计数,这里所谓的“贴壁”就是指细胞穿过膜后,可以附着在膜的下室侧而不会掉到下室里面去,通过给细胞染色,可在镜下计数细胞。 取出Transwell小室,弃去孔中培养液,用无钙的PBS洗2遍,甲醇固定30分钟,将小室适当风干。 0、1%结晶紫染色20 min,用棉签轻轻擦掉上层未迁移细胞,用PBS洗3遍。 400倍显微镜下随即五个视野观察细胞,记数。 实验材料 (1)Transwell chamber: 24-well, 8、0-μm pore membranes (Corning) (2)细胞培养相关试剂:无血清培养基,10%血清培养基,PBS,0、02%EDTA
迁移实验(cell migration assay ) 实验介绍 细胞迁移与侵袭实验将Transwell 小室放入培养板中,小室内称上室,培养板内称下室,上下层培养 液以聚碳酸酯膜相隔,将研究的细胞种在上室内,由于聚碳酸酯膜有通透性,下层培养液中的 成分可以影响到上室内的细胞,应用不同孔径和经过不同处理的聚碳酸酯膜,就可以进行共培养、 细胞趋化、细胞迁移、细胞侵袭等多种方面的研究。 实验步骤: 1 材料准备: 可拍照显微镜,Tran swell小室,孔径8 ^m ,没包被胶的(Coster和Corni ng公司的也较常用),Transwell 迁移实验的细胞培养板24 孔板。细胞培养板应当与购买的Transwell 小室相配套,BD 公司的Matrigel ,无血清DMEM ,(1% 胎牛血清)DMEM 和1640 培养基,DMEM 完全培养 基,1640 完全培养基(也可加到20%血清),无菌PBS ,棉签,胰酶,4%多聚甲醛固定液或者 甲醇,结晶紫染液(0.1%(g/ml)PBS 结晶紫) 2 步骤和流程 2.1 基质胶铺板: 用BD 公司的Matrigel 1 :8 (根据细胞产生mmp 的量来决定)稀释,包被Transwell 小室底部 膜的上室面,置37 °C 30min使Matrigel聚合成凝胶。使用前进行基底膜水化。 2.2 制备细胞悬液 ①制备细胞悬液前可先让细胞撤血清饥饿12 -24h ,进一步去除血清的影响。但这一步并不 是必须的。 ②消化细胞,终止消化后离心弃去培养液,(用PBS洗1 —2遍),用含BSA的无血清培养 基重悬。调整细胞密度至5X105/ml。 2.3 接种细胞 ①取细胞悬液100卩1加入Tran swell小室。 ②24孔板下室一般加入600 ^l含20%FBS的培养基,特别注意的是,下层培养液和小室间常会有 气泡产生,一旦产生气泡,下层培养液的趋化作用就减弱甚至消失了,在种板的时候要特别留 心,一旦出现气泡,要将小室提起,去除气泡,再将小室放进培养板。 ③培养细胞:常规培养12 —48h (主要依癌细胞侵袭能力而定)。24h较常见,时间点的选择除 了要考虑到细胞细胞侵袭力外,处理因素对细胞数目的影响也不可忽视。 2.4 结果统计 直接计数法,“贴壁”细胞计数,这里所谓的“贴壁”是指细胞穿过膜后,可以附着在膜的下室侧 而不会掉到下室里面去,通过给细胞染色,可在镜下计数细胞。 取出Transwell 小室,弃去孔中培养液,用无钙的PBS 洗 2 遍,甲醇固定30 分钟,将小室适当风 干。 0.1% 结晶紫染色20 min ,用棉签轻轻擦掉上层未迁移细胞,用PBS 洗3 遍。 400 倍显微镜下随即五个视野观察细胞,记数。 实验材料 (1)Tran swell chamber: 24-well, 8.0- 卩m pore membra nes (Corni ng) (2)细胞培养相关试剂:无血清培养基,10%血清培养基,PBS,0.02 %EDTA