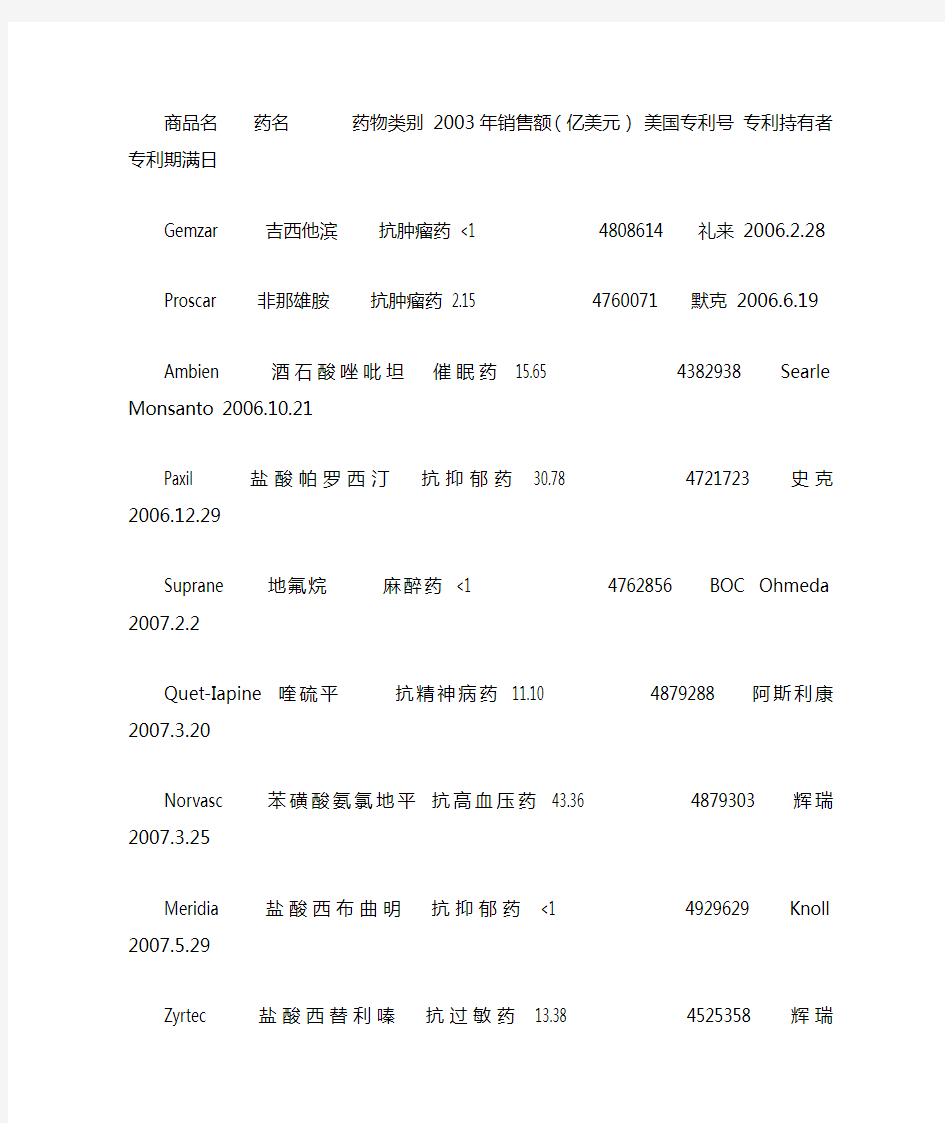

商品名药名药物类别 2003年销售额(亿美元)美国专利号专利持有者专利期满日
Gemzar 吉西他滨抗肿瘤药 <1 4808614 礼来 2006.2.28
Proscar 非那雄胺抗肿瘤药 2.15 4760071 默克 2006.6.19
Ambien 酒石酸唑吡坦催眠药
15.65 4382938 Searle Monsanto 2006.10.21
Paxil 盐酸帕罗西汀抗抑郁药 30.78 4721723 史克 2006.12.29
Suprane 地氟烷麻醉药 <1 4762856 BOC Ohmeda 2007.2.2
Quet-Iapine 喹硫平抗精神病药 11.10 4879288 阿斯利康 2007.3.20
Norvasc 苯磺酸氨氯地平抗高血压药 43.36 4879303 辉瑞 2007.3.25
Meridia 盐酸西布曲明抗抑郁药
<1 4929629 Knoll 2007.5.29
Zyrtec 盐酸西替利嗪抗过敏药 13.38 4525358 辉瑞 2007.6.25
Fosamax 阿仑膦酸钠钙调节药 26.77 5849726 默克 2007.8.6
Camptosar 盐酸伊立替康抗肿瘤药 <1 4604463 法玛西亚 2007.8.27
Propulsid 西沙必利-水物镇吐药 <1 4962115 强
生制药 2007.10.9
Kytril 格拉司琼镇吐药 <1 4886808 史克 2007.12.29
Risperdal 利培酮抗精神病药 25.12 5158952 强生制药 2007.12.29
Serevent 羟萘酸沙美特罗支气管扩张药 1.73 4922474 5380992 Allen Hanburys 2008.2.12
Zemuron 罗库溴铵神经肌阻断药
<1 4894369 Akzo-Organ 2008.4.13
Zerit 司他夫定抗感染药 <1 4978655 BMS 2008.6.25
Lamictal 拉莫三嗪抗惊厥药
<1 4602017 Cerenex 2008.7.22
Epivir 拉米夫定抗病毒药 2.26 5047407 葛兰素 2009.2.8
Prevacid 兰索拉唑抗溃疡药
35.69 4628098 Tapp Pharm 2009.5.10
Cozaar 氯沙坦钾抗高血压药 5.36 5153197 默克 2009.10.6
Rispedal 利培酮抗精神病药 25.12 5158952 强生 2009.10.27
Neurotin 加巴喷丁抗焦虑药 27.02 5084479 派克戴维斯 2010.1.2
Famvir 泛昔洛韦抗病毒药 1.88 5246937 史克 2010.9.21
Inverase 甲磺酸沙奎那韦抗病毒药 <1 5196438 罗氏 2010.11.19
Ariceot 多奈哌齐阿尔茨海默氏病治疗药 4.86 4895841 辉瑞 2010.11.25
Sigular 孟鲁斯特钠抗变态反应药 16.25 5565473 默克 2010.11.30
浅析药品专利权的知识产权保护 (一)药品专利权的沿革 ]1[最早的专利制度起源于中世纪的欧洲,是商品经济的发展促进了技术的日益商品化,使得人们意识到谁拥有先进的技术,谁就可以在市场竞争中占有优势,从而导致了专利制度的产生。1474年,世界上第一部专利法在威尼斯城邦共和国诞生,该法奠定了现代专利法的基础。1624年,英国颁布《垄断法》,人们通常称之为第一部具有现代意义的专利法。 美国是世界上较早建立专利制度的国家之一,美国于1790年颁布了第一部专利法,对美洲及东南亚国家影响很大,例如加拿大、阿根廷、墨西哥等国家都基本上采用类似于美国的专利制度。美国专利不仅保护药品制备工艺与技术路线,而且对药品品种给予保护。德国是自1968年开始对药物化合物给予专利保护的,但是只能以产品和制备方法两种方式请求专利保护,而不能以应用方式请求保护。1977年,联邦法院对物质第一次药品应用的专利性给以了肯定;1982年,法院又肯定了药物或药品第二适应症应用发明的专利性,使对药品发明的专利保护日趋完善;它对挪威、瑞典、奥地利、瑞士等国家的专利制度建设产生了巨大的影响,特别对日本现行的药品专利有较大影响。]2[药品的知识产权保护被纳入专利法领域是从近代开始的,迄今已有90多个国 家和地区实行了药品专利保护。 (二)药品专利的国际保护 知识产权国际保护不是指国际条约取代或覆盖国内法,也不是使知识产权的“地域性”消失,而是在一定程度上使得“地域性”削弱了而已。药品专利作为知识产权的一种,它的国际保护途径主要是国际公约和区域公约,下面主要通过分析国际公约和区域公约了解药品专利的国际保护。]3[关于药品专利的国际保护是伴随着知识产权的国际保护产生和发展的,知识产权的国际保护是指一国缔结或参加多边公约或双边条约,以内国法在不违反国际公约所规定最低限度的情况下保护 他国的知识产权。 贵州大学本科毕业论文(设计)第 5 页 1、《建立世界知识产权组织公约》 1967年7月14日,“国际保护工业产权联盟”(巴黎联盟)和“国际保护文学艺术作品联盟”(伯尔尼联盟)的51个成员在瑞典首都斯德哥尔摩共同建立了世界知识产权组织(WIPO),旨在通过国家之间的合作并在适当情况下与其他国际组织配合,促进世界范围内的知识产权保护和各联盟之间的行政合作,鼓励创造性活动而加强世界范围内的知识产权保护。 2、《保护工业产权的巴黎公约》 《保护工业产权巴黎公约》简称《巴黎公约》,是1883年3月20日在法国巴黎缔结的保护工业产权的国际公约,曾经过6次修改。是世界知识产权组织管理下的条约之一。《巴黎公约》的保护对象很广泛,不仅仅包括发明创造专利、商标、服务标志和工业品外观设计,还包括实用新型、厂商名称、产地标记、原产地名称以及制止不正当竞争。它还规定了工业产权方面各成员
08/03/99P 盐酸倍他洛尔 betaxolol hydrochloride,Kerlone eq Alcon Lab 0.25% base 08/03/99P 盐酸倍他洛尔 betaxolol hydrochloride,Kerlone eq Alcon Lab 0.5% base 08/03/99P 盐酸倍他洛尔 betaxolol hydrochloride,Kerlone eq Alcon Lab 10mg base 08/03/99P 盐酸倍他洛尔 betaxolol hydrochloride,Kerlone eq Alcon Lab 20mg base 08/31/99P 盐酸安非他酮 bupropion hydrochloride,Wellbutin Burroughs Wellcome 100mg 08/31/99P 盐酸安非他酮 bupropion hydrochloride,Wellbutin Burroughs Wellcome 50mg 08/31/99P 盐酸安非他酮 bupropion hydrochloride,Wellbutin Burroughs Wellcome
75mg 09/14/99P 碘[131I]化钠 sodium iodide I-131,Iodotope 150MCi E.R.Squibb 09/14/99P 碘[131I]化钠 sodium iodide I-131,Iodotope 7.106MCi E.R.Squibb 09/14/99P 碘[131I]化钠 sodium iodide I-131,Iodotope 8.100MCi E.R.Squibb 10/13/99P 更昔洛韦钠 ganciclovir sodium,Cytovene 10/28/99P 甲磺酸麦角碱 ergoloid mesylates,Hyderginelc 10/29/99P 更昔洛韦钠 ganciclovir sodium eq 500mg base/vial Syntex 10/29/99P 二丙酸倍氯米松 beclomethasone dipropionate,Vancenase Schering 0.042mg/inh 11/04/99P 洛伐他汀 Mevacor,lovastatin 20mg Merck Sharp & Dohme 11/04/99P 洛伐他汀 Mevacor,lovastatin 40mg Merck Sharp & Dohme 11/18/99P 醋酸那法瑞林 nafarelin acetate,Synaral 12/02/99P 美司钠 mesna,Mesnex 100mg/ml Astra Pharm
编号:_______________本资料为word版本,可以直接编辑和打印,感谢您的下载 药品专利转让协议范本 甲方:___________________ 乙方:___________________ 日期:___________________ 说明:本合同资料适用于约定双方经过谈判、协商而共同承认、共同遵守的责任与 义务,同时阐述确定的时间内达成约定的承诺结果。文档可直接下载或修改,使用 时请详细阅读内容。
合同编号:___________ 项目名称:___________ 受让方(甲方): 住所: __________ 法定代表人:____________ 项目联系人:____________ 联系方式:___________ 通讯地址:___________ 电话: __________ 传真: __________ 电子信箱:___________ 让与方(乙方): __________ 住所: __________ 法定代表人:____________ 项目联系人: __________
联系方式: _________ 通讯地址: _________ 电话: _________ 传真: _________ 电子信箱: _________ 开户银行: _________ 地址: _________ 账号: _________ 本合同乙方拥有 __________ 的技术发明创造,甲方受让该项技术发明的专利申请权并支付相应的转让价款。双方就此项专利申请权转让事项,经过平等协商,在真实、充分地表达各自意愿的基础上,根据《中华人民共和国合同法》的规定,达成如下协议,并由双方共同恪守。 第一条本项发明创造的专利申请权: 1. 属于__________ (发明、实用新型、外观设计)申请。 2. 发明人/设计人:__________ 。
以专利的申请日为基准,美国专利到期日计算有两种方式。如果申请日早于1995年6月8日,其到期日为申请日加二十年或专利授权日加十七年,取两者较晚的日期为该专利的到期日。若专利的申请日晚于1995年6月8日,其到期日为申请日加二十年。上述是基本原则,实际计算时要注意如下要点。 1. 大部分的美国专利文件,在文件的第一页有明显的申请日(Filing Date)和授权日(Issue date),若申请日和授权日不明显,可找到INID码22相应的日期为申请日,INID码45相应的日期为授权日,即可按上述方法计算。 2. 如果该专利属于一个大的专利族群,而该专利本身不是在该专利族群中最早递交申请的专利,计算时其所用的申请日则要以最早的相关专利申请日来计算,最早的相关专利申请日可用INID码62 或63栏目中相应的日期。 3. 如果该专利曾通过一个有临时专利(provisional patent)发展而成的,计算时其所用的申请日则无须考虑该临时专利申请日(INID码60)来计算。 4. 对于重发的专利(Reissued patent) 计算时其所用的申请日或授权日要以原来专利申请日(INID码60)或授权日来计算。 5. 美国专利局还对在审核过程中官方或的延误时间给予补偿,反映为专利期调整(patent term adjustment)。因而,最终的专利到期日要加上相应的调整期。专利调整期的资料可在专利的首页或美国专利局的数据库PAIR上找到。
6. 世贸乌拉圭回合协定之后,药品专利可获得延期,相应的到期日计算要加上相应的延期时间。美国的专利在三种情况下可得到延期:a. 根据美国专利法第156条规定的延期,该延期旨在补偿专利权人在开发和正常药物审批程序中耽搁的专利期,该延期最高可达五年;b:儿科延期,如果药物开发商按照官方的要求,将该药物的临床研究扩展到儿科病例,相关的药品专利可以有六个月的延期;c:临时性延期,当该专利牵涉到行政或法律纠纷,并且会影响到该专利的期限,专利权人可申请临时性延期,最多可申请三次,每次最长一年。 7. 专利权终止声明(Terminal disclaimer) 在某些情况下,专利权人申请了第一个专利,接着又申请了相关的第二个专利,第一个专利的某些权利要求在第二个专利里重复了,显然,这些重复的权利要求会丧失其新颖性而无效。美国专利局会要求申请人会发表一个专利权终止声明,以防那些重复的权利要求在第一个专利过期之后仍然有效。当一个专利有一个终止声明,其到期日的计算就相当复杂了,要查看其终止声明的详情。1995年6月8日之前的专利,其终止声明相应的日期可在第一页找到,但1995年6月8日以后的专利登载的日期有可能出错。当该专利还得到延期,情况就更复杂了。
药物研发专利类型 药品专利类型根据《专利法》的有关规定,专利包括发明专利、实用新型专利和外观设计专利三类。 (1)发明专利发明是指对产品、方法或其改进所提出的新的技术方案。药品发明专利包括产品发明专利和方法发明专利两类。 药品产品发明专利:产品发明指人工制造的各种有形物品的发明。药品产品发明包括:①新物质(即化合物专利),指具有一定化学结构式或物理、化学性能的单一物质,包括有一定医疗用途的新化合物;新基因工程产品;新生物制品;用于制药的新原料、新辅料、新中间体、新代谢物和新药物前体;新异构体;新的有效晶型;新分离或提取得到的天然物质等。②药物组合物,指两种或两种以上元素或化合物按一定比例组成具有一定性质和用途的混合物。包括中药新复方制剂;中药的有效部位;药物的新剂型等。③生物制品、微生物及其代谢产物,可授予专利权的微生物及其代谢产物必须是经过分离成为纯培养物,并且具有特定工业用途的。 方法发明专利:方法发明是指为制造产品或解决某个技术课题而研究开发出来的操作方法、制造方法以及工艺流程。关于药品的方法发明包括:①制备和生产方法,如化合物的制备方法、组合物的制备方法、提取分离方法、纯化方法等(即工艺专利);②用途发明,如化学物质的新的医药用途、药物的新的适应症等(即用途专利)。 (2)实用新型专利实用新型是指对产品的形状、构造或者其结合所提出的适于实用的新的技术方案。实用新型专利在创造性上较发明专利低,因此,常被人称之为“小发明”。 实用新型必须具备两个特征:其一,它必须是一种产品,该产品应该是工业方法制造的、占据一定空间的、具有实用型的物品,而不是方法;其二,它必须是具有一定形状和构造的产品,没有固定形状的物质以及气体、液体、粉末物等不能被授予实用新型专利。药品的实用新型专利包括:①某些与功能相关的药物剂型、形状、结构的改变(如剂型专利、晶形专利),如通过改变药品的外层结构达到延长药品疗效的技术方案;②诊断用药的试剂盒与功能有关的形状、结构的创新;③生产药品的专用设备的改进;④某些与药品功能有关的包装容器的形状、结构和开关技巧等。 (3)外观设计专利外观设计是指对产品的形状、图案、色彩或者其结合所作出的富有美感并适于工业上应用的新设计。外观设计的特征是:①必须是产品形状、图案、色彩或其结合的新设计;②必须与产品结合,并能在工业上应用。药品的外观设计包括:药品的外观,如便于给儿童服用的制成小动物形状的药片;药品包装的外观,如药品的包装盒;富有美感和特色的说明书等。药化方面: 1. 化合物专利(通常是具有相似结构的一类化合物共同保护,是仿制的硬伤) 2. 工艺专利(合成一个或一类化合物的最优工艺路线,以前在中国没用,大家都写假工艺 绕开该路线进行申报,实际生产的时候大多数还是用这个。但以后要求申报工艺和生产工艺必须一致,不知道会怎样) 天然药化方面: 天然产物中的有效成分及其衍生物、有效部位(一般要结合提取纯化工艺、药效、适应症、衍生物合成路线一起保护) 药剂方面: 1.处方专利(最常见也是最实用的,包括组合物专利) 2.工艺专利(类似于药化的工艺专利,价值不大) 3.剂型专利(很难,除非你能作出与现有剂型完全不同,全新的剂型,否则基本上不太可能 授权) 药理方面:
经由FDA审批的药品全部收入FDA注册药品大全“橙皮书”(Orange Book), 即《经过治疗等同性评价批准的药品》(Approved Drug Products with Therape- utic Equivalence Evaluations)一书,详细完整地列出了在《食品、药品和化妆 品法》指导下历年来根据药品的安全性和有效性批准的所有药品,其中最重要的 是明确列出新药所涉及的所有专利以及市场专营保护信息。 ■药品专利 药品专利是法律授予的产权保护,其不在FDA管辖范围内,而是由专利持有 者直接到美国专利商标局(PatentTrade鄄markOffice)注册,专利商标局将保护 专利持有者的发明创造在专利期内不被他人制造、使用和销售。药品专利的申请 没有固定时间要求,在药品研发甚至上市后都可以申请。因此,有的药品专利可 能在药品被批准上市前就已经过了有效期,也可能在药品上市后才申报获得。 在1995年6月8日生效的《乌拉圭回合协议法》(Uruguay Rounds Agreements Act)中,美国专利法规定专利的有效期如下:1995年6月8日前注册的专利有效期 为17年,从专利获准日算起;1995年6月8后注册的专利有效期为20年,从专利申报日算起。对未过期的、在1995年6月8日以前注册的专利,按旧法或新法规定中专利期较长的算法生效。但实际上,由于药品研发和审批的漫长过程,药品专利 在批准上市后的有效保护期往往少于20年。为鼓励新药的研发,补偿专利持有者 在药品研发和等候审批过程所失去的时间,美国国会通过的《药品价格竞争和专 利期恢复法》(Drug Price Competition and Patent Term Restoration Act), 允许人用药品专利期可获得5 年的延长,但药品批准延长的总专利期不得超过14年。要获得专利期延长, 专利持有者必须在FDA批准药品上市后的60天内,向专利商标局递交申请。FDA在药品专利延长事务上的主要任务则是协助专利商标局确定该药品是否具有专利延 长的资格,并为专利商标局提供其所需信息。 ■市场专营保护期 市场专营保护期是在新药批准时,FDA根据《食品、药品和化妆品法》和《联 邦管理法》的相关条款授予新药申请者一定的保护期,属于行政保护,与当时该 药品是否具有专利无关。市场专营保护的宗旨在于补偿药品在研发和审批过程中 失去的专利保护时间,鼓励创新药的研制发展,让新药产品在限定时间内不受市 场竞争的影响。具体授予多长期限,由FDA根据新药审批时间和新药临床研究时间长短而定。一般来说,市场专营保护期主要有以下几种: 一、新化学实体(NCE)创新药保护期——5年。FDA在批准这类药时,给予申报者5年的行政保护期。即无论其是否有专利存在,至少在5年之内FDA不受理其仿制药的申请。但一般来说获得五年保护期的创新药均具有NCE专利,其专利期比市场专营保护期更长。 二、临床试验保护期——3年。如果制药企业通过新的临床试验(生物等效性 试验不在此列)证明已上市的药品又有新的适应症、新剂型或新用药途径等,FDA 在批准时就会在原来保护期的基础上加补3年市场专营保护期。 三、罕见病药品保护期——7年。由于罕见病的患者数量不多,其药品的研发 对企业来说无多大经济利益。因此,为鼓励企业研发罕见病药品,国会于1983年 通过了《罕见病药品法》(The Orphan Dru gAct)。该法对罕见病药品研制的主办 者提供50%的税收减免、补助金以及7年市场专营权等优惠政策。 四、儿科临床研究保护期——6个月。为鼓励制药商进行儿科的临床研究,1997年的《食品和药品现代化管理法》规定,给予儿科临床研究6个月的市场专
药品专利链接制度 我国药品注册过程中,也会遇到专利问题,专利制度与药品注册审批制度的存在着一定的关系。随着我国医药产业发展,专利链接制度也越来越多地被业内的专家提到,那么什么是专利链接制度呢?通过对美国药品专利链接制度的研究,可以为我国建立药品注册中的专利链接制度提供一些参考。 “专利链接”制度最早是由美国设立的,1984 年美国国会通过的《药品价格竞争与专利期补偿法》(简称 Hatch-Waxman 法案,以下同)中首次对药品注册审批过程中的专利权问题作了细致的规定,法案中的专利链接是指仿制药品上市批准,与专利药品专利期满相“链接”,即仿制药品在注册申请时应考虑已经上市药品的专利情况,避免可能发生的侵权。 一、美国药品专利链接制度的介绍 随着药品注册对于安全性和有效性的要求越来越高,药厂与公众的利益冲突矛盾不断升级,进行新药研究需要投入到临床研究的费用越来越高,时间越来越长。美国药品监管当局面临如何建立一个有效的法规管理体系的问题,在鼓励创新的同时,鼓励仿制药尽快上市,降低药品价格。因此在 1984年,美国国会通过了 Hatch-Waxman 法案,这部法案正式确立了专利链接制度,充分兼顾了创新和仿制的相互利益,不仅提升了仿制药公司的竞争能力,也使得药品价格大幅度降低,同时保障了创新药企业的利益。这部法案开创性地设计了药品专利链接制度,在保护和促进公众健康的同时,极大地促进了创新药
和仿制药的协调发展。在Hatch-Waxman法案中,专利链接制度具体包括橙皮书、药品专利期限延长、Bolar 例外、第四段申明、45天诉讼期、30个月遏制期和180天市场独占期。对于仿制药企业上市申请,执行简化新药申请(ANDA)途径,即无需提交证明药品安全性和有效性的数据,只要参照新药的标准进行生物等效性研究。 二、美国专利链接制度主要内容 2.1 药品专利期限延长 医药公司在进行研发时,一般只要完成新药的单体筛选,就去申请专利保护,而由于药品的特殊性,在上市前还需要大量时间进行一系列的试验来获得相关的安全性和有效性的试验数据。因此大多专利药在获准上市时,已经过去了专利期限的一半时间,剩余的时间远不足让研发企业收回成本。美国国会为了调动药品研发企业的积极性,在Hatch-Waxman 法案中规定了药品专利期延长的制度。Hatch-Waxman 法案规定,权利人可以就产品专利、用法专利或者制造方法专利中选择其中一种来延长保护期限,但是延长专利期的药品必须满足以下条件:产品专利尚未到期;专利没有经过延期;产品必须是经过 FDA 审批并取得上市许可的。药品专利期限延长的目的是为了弥补临床试验和上市审批中漫长的监管审查期而耽误的专利时间,延长时间一般为 5 年,从上市之日起,最多不超过 14 年。但如果是由于申请人未尽到应有的注意义务而导致专利期耽搁的,该期间将不计入延长期内,且同一药物只能申请一次专利期间延长。药品专利期延长的申请必须在 FDA 批准上市后 60 天内向美国专利和商标局
1.新药保护期,它是99年药监局成立之初发布的《新药审批办法》中制定的一种行政干预,目的其实是为了鼓励国内企业的创新,但是,以当时的行业水平想研发真正的“新药”是不现实的,所以当时的新药定义还是遵循着1985年实施的《药品管理法》的新药定义,即“没有在中国境内生产过的药”就是“新”药,这就是说,只要是能首家仿制国外品种的中国企业,就能够获得新药保护期,保护期内不受理其他国内企业的注册申请,能够让首仿企业在相当长的时间内独家的占领市场。 这是一个很大的政策优惠,但是由于新药定义的缺陷,导致了不可避免的逻辑矛盾:有些品种明明已经进口多年,然而国内首家仿制的企业照样能拿到“新”药保护期,如果用这个保护期去限制国外的公司,明显是不合理的——毕竟人家才是真正的原研者。为了解决这个逻辑矛盾,我们的新药保护期只禁止国产而不限制进口。 在如今看,这种光限制自家人的规定,实属汉奸条款。但在当时,却是有益的,如果不给予极大的政策优惠,如何激励企业家和社会资金的投入?如何改善当时缺医少药的局面?可是,在如今已经不缺医少药,而且进口逐渐蚕食国内市场的境况下,这个新药保护期却显得如此的不合时宜。 还好,2002年9月15日《药品注册管理办法(试行)》颁布并废止了99年的《新药审批办法》以后,就已经没有新药保护期了。另外,对于在《新药审批办法》颁布后申报,但在《药品注册管理办法(试行)》颁布时还在做临床而没有完成审评的品种,出于历史沿革的考虑仍然给予新药保护期的待遇,这就是所谓的“过渡期”,与新药保护期一样,过渡期只限制国产不限制进口。 无论新药保护期,还是过渡期,都已经是历史名词了,会逐渐湮没。 2.行政保护期,这是对我国早期专利法的妥协。中国85~93年间的《专利法》不保护药品的知识产权,这和“No patent, no drug”的国际新药开发认知是相悖的,于是在国际社会(其实就是那某个强国)的强烈抗议下,中国作出了一个行政干预的补救措施,就是但凡某外企的品种在85-93间在国外享有知识产权或独占权且未过期者,可以提出申请,获得7.5年的行政保护,只要得到该保护,则在保护期内既不再允许批准国产,也不允许批准其他的进口。详见《药品行政保护条例》。 按道理来说,通产药品的专利也就20年,所以03年就应该不再存在可以获得行政保护的品种,但是,某些时候,其品种在国外的专利可以按法规(例如美国的《药品价格竞争和专利期恢复法》(Drug Price Competition and Patent Term Restoration Act))得以延长,所以,现在还陆陆续续有行政保护的申请,但在过几年估计就差不多没有了,那时,行政保护自然湮灭。 行政保护是专利的补偿,所以和专利保护期一样,其他企业的同品种仿制可以在行政保护到期前2年申报,但行政保护到期后方能批准仿制。而且,其在本国的独占权过期的话,哪怕行政保护期尚未满7.5年,也同时无效。
2017-2029年专利到期药物汇总 通用名靶点主要适应症原研厂家化合物专利专利期限国内仿制药申报 加雷沙星喹诺酮类抗菌药细菌感染 Astellas Pharma/Taisho Toyama WO1997029102/CN1100053 2017 天津汉康 头孢托罗头孢类抗生素细菌感染 Johnson & Johnson EP0849269/CN1104436 2017 无 福司氟康唑氟康唑水溶性前药真菌感染 Pfizer WO1997028169/CN1085213 2017 正大天晴 帕瑞昔布 COX-2抑制剂术后疼痛 Pfizer WO1997038986/CN1098256 2017 湖南科伦等 贝他斯汀组胺H1受体拮抗剂过敏 Tanabe Seiyaku/ISTA Pharma WO1998029409/CN1098262 2017 重庆华邦等 他氟前列素前列腺素FP受体激动剂青光眼、眼高压 Merck US5985920/CN1108289 2017 四川科伦 deferasirox 铁螯合剂慢性铁过载 Novartis WO1997049395/CN1146415 2017 无 tasimelteon 褪黑素受体激动剂盲人非24小时睡眠觉醒障碍 Vanda Pharma WO1998025606/CN1152679 2017 无 安妥沙星喹诺酮类抗菌药细菌感染安徽环球 CN1181381 2017 无 博舒替尼 Bcr-Abl抑制剂慢性粒细胞白血病 Pfizer US6002008(无中国专利?) NA 天津汉康等 非布索坦黄嘌呤氧化酶抑制剂高尿酸血症/慢性痛风 Takeda Pharma US5614520(无中国专利?) NA 万全阳光等 达比加群酯凝血因子IIa抑制剂预防卒中 Boehringer Ingelheim WO1998037075/CN1088702 2018 豪森药业等 伐地那非 PDE5抑制剂勃起功能障碍 Bayer WO1999024433/CN1123573 2018 无 米拉贝隆肾上腺素β3受体激动剂膀胱过动症 Astellas Pharma WO1999020607/CN1136193 2018 无 lumiracoxib COX-2抑制剂骨关节炎、术后疼痛 Novartis WO1999011605/CN1140500 2018 无 头孢洛林头孢类抗生素细菌感染 Takeda Pharma/Forest Laboratories WO1999032497/CN1194980 2018 无 瑞他莫林青霉类抗生素细菌感染 GlaxoSmithKline WO1999021855/CN1205211 2018 重庆华邦 地加瑞克促性腺素释放激素受体拮抗剂晚期前列腺癌 Ferring Pharma WO1998046634/CN1230442(弃权) 2018 豪森药业 伊沙匹隆埃坡霉素B衍生物乳腺癌 Bristol-Myers Squibb WO1999002514/CN1270589 2018 无 fosamprenavir HIV蛋白酶抑制剂 HIV-1感染 Vertex Pharma WO1999033815/CN1284071 2018 无 varenicline 烟碱α4β2受体激动剂尼古丁成瘾 Pfizer WO1999035131/CN1285821 2018 无 替格瑞洛 P2Y12受体拮抗剂预防血栓 AstraZeneca WO2000034283/CN1128801 2019 恒瑞医药等 拉帕替尼 HER2/EGFR抑制剂乳腺癌 GlaxoSmithKline WO1998002434; WO1999035146/CN1134438 2019 四川科伦等udenafil PDE5抑制剂勃起功能障碍 Dong-A Pharma WO2000027848/CN1136219 2019 无 维格列汀 DPP-4抑制剂 II型糖尿病 Novartis WO2000034241/CN1160330 2019 豪森药业等 利奥西呱可溶性鸟苷酸环化酶激活剂肺动脉高压Bayer WO2000006569/CN1165536; WO2003095451/CN133**** ****/2023 无 fesoterodine 胆碱受体拮抗剂膀胱过度活动症 Pfizer WO1999058478/CN1207268 2019 无 雷美替胺褪黑素受体激动剂失眠 Takeda Pharma WO1997032871/CN1212691 2019 南京华威等 依曲韦林 HIV逆转录酶抑制剂 HIV-1感染 Johnson & Johnson WO2000027825/CN1214013 2019 无 艾日布林软海绵素B衍生物转移性乳腺癌 Eisai Inc WO1999065894/CN1216051 2019 无 替比夫定核苷类抗病毒药物 HBV感染 Novartis WO2000009531/CN1257912 2019 无 马拉韦罗 CCR5拮抗剂 HIV-1感染 Pfizer WO2000038680/CN133**** **** 无 阿哌沙班凝血因子Xa抑制剂全身性栓塞、卒中 Bristol-Myers Squibb/Pfizer WO2000039131/CN139**** **** 南京润诺等 双环铂铂类抗癌药肿瘤北京兴大 WO2001064696/CN1121380 2020 无 艾瑞昔布 COX-2抑制剂骨关节炎恒瑞医药 CN1134413 2020 无 阿昔替尼 VEGFR抑制剂肾细胞癌 Pfizer WO2001002369/CN1137884 2020 四川科伦等 茚达特罗肾上腺素β2受体激动剂慢性阻塞性肺病 Novartis WO2000075114/CN1156451 2020 无 regadenoson 腺苷A2A受体激动剂心肌灌注显像 Astellas Pharma WO2000078779/CN1167709 2020 无
专利的种类在不同的国家有不同的规定,在我国专利法中规定有:发明专利、实用新型专利和外观设计专利。 专利保护期限是以提交专利的申请日开始计算的,其中: 发明专利保护期限为20年 实用新型专利和外观设计专利保护期限均是10年; 保护期限过了怎么办? 一、我国关于专利保护过期怎么处理的规定 我国专利基本上没有续期,专利的保护日期不能延长专利保护期限到期后,等于该专利已经公开成为公众社会都可以使用的专利,将专利贡献给整个社会。这样的做法似乎更有利于社会的发展,科学的进步,因此在我国专利法中,并没有具体关于专利过期的处理规定。 二、专利保护期过期怎么处理的看法 专利作为一种核心的竞争力,对企业发展或个人发展都是非常重要的,建立专利制度可以通过保护和使用发明来鼓励发明创造,它必须谋求发明人的利益和公众利益平衡。因此自申请专利起,有关十年二十年的保护已经非常不错,只要我们在这段时间内,最大可能的发挥专利的使用价值,就已收获良多了。所以总的来说,专利续期没有想像中的那么重要。 专利保护不是长期存在的,专利权人不能对自己的专利过分处于安心状态,专利保护过期怎么处理也是大众较为关心的一个问题。任何专利在其被保护期间能充分发挥专利权人对其的支配权已经足够了,在专利保护期后贡献社会也是一种不错的选择。 汉唐知识产权代理有限公司(以下简称“汉唐”)是经国家知识产权局及国家工商总局商标局批准设立,具有商标和专利代理资质的综合型知识产权代理机构(专利代理机构代码:44399)。公司成立15年,总部位于深圳,截止到 目前已在广州、无锡、泉州、厦门、成都、西安、银川、佛山、内蒙古等地设立了分公司,营销和服务网络遍布全国,公司聚集多位商标、专利、版权、项目申报方面的顶级专家和外籍顾问,并拥有一支由百余名高级顾问、律师,以及商标和专利代理人为中坚力量的专业团队。合作伙伴遍布欧洲、美洲、亚洲 等多个国家和地区。以“专业创造可能,沟通成就品质”为宗旨的知识产权综合 法律服务体系。能够为客户提供更加快捷、专业的服务,助力客户利用知识产权工具获得更大的商业成功。公司主营业务:商标注册、专利申请、版权登记、专利开发 我们提供一站式一对一专利申请服务
关于所谓延长专利保护期限的问题的看法 -刘增光 根据我国专利法第42条的规定,发明专利权的期限为20年,实用新型专利权的期限为10年,均自申请日起计算。 我们知道专利权是一种排他权,本身就是与非专利权人的一种冲突,如果保护时间超过规定时间,则损害了非专利权人的利益。 然而,现如今,在中国专利界存在这样一种情况,在某些情况下似乎可以延长规定的保护期限,现提出来与大家讨论: 我国对实用新型专利申请实行初步审查,对发明专利申请实行早期公开延迟审查,而发明专利申请的实质审查需要较长的时间,在这种情况下,有些申请人既希望获得较长的保护时间,又想较快地获得保护,就常常采取就同一发明创造同时或先后申请一项发明专利和一项实用新型专利的作法。考虑到我国的国情和申请人的客观情况,我国审查部门针对这种情况规定了一种较为特殊的作法,即在发明专利申请的审查中发现一项发明专利申请符合被授予专利权的条件,但该申请人已经就同样的发明创造获得了一项实用新型专利权时,不采取直接将该发明专利驳回的作法,而是通知申请人择其一。我们暂且不讨论此种作法的合法性和合理性,现看一看会出现什么样的后果和问题。
当申请人先后申请发明和实用新型专利申请的情况下,例子如下: 在如上的情况下,根据专利法62条2款的规定,发明专利申请公布后至专利权授予前使用该发明的当事人应该适当支付使用费用。 我们用图表表示如下: 如果申请人按照以上时间顺序来申请发明创造,则该2001.1.1 2002.7.1 2001.1.2 2001.3.1 专利期限20年 新型10年
申请人在没有获得发明专利权的情况下可以用已经授权的实用新型来获得保护,在获得专利权以后,该专利权人根据审查员的指示一般放弃实用新型专利权而要求发明专利权,此时又多获得了2001.1.1-2001.1.2的时间。 而且,本来如果不存在实用新型,则所谓侵权人只需要适当支付2002.7.1至授权后之间的使用费,现在由于实用新型的存在,则变得侵权或将支付更多的使用费,此外,2001.1.2-2002.7.1期间受到实用新型专利权的保护,这对该当事人造成了很大的损害,这是不公平的,变形地增强了保护范围,也可以说延长了有效的保护期限。 针对以上情况,我认为专利局的作法不妥: 第一,这就真的避免了重复授权吗?我表示怀疑,这分明是对同一发明创造授予了两次专利权,只不过是先后存在的两个专利权而已。 第二,当申请人放弃实用新型专利权以后,就意味着该内容已经成为任何人都可以使用的技术,如果再次授权,对非专利权人不公平,而且我们知道主动放弃的专利权是不可以恢复的。 如果专利局允许这种情况,则本国优先权制度似乎没有太大作用了。这是因为本国优先权无非是在优先权日到申请日之间可以排除掉其它相同专利的申请,而并不可以受到法
2009-2014年专利到期情况探究 许关煜 前不久在网络上见到《2009-2014年专利到期化学原料药》一文(以下简称“资料”),该资料将29个药物品种按适应症排列,并注有美国专利到期时间: 和国内生产(经营)单位数。此类信息对于从事非专利药物开发、生产的企业而言自然非常有用,笔者在拜读之余,作了一番校核,并提出一些补充见解,与同行切磋。资料所介绍的品种可供开发选题参考。 为了避免侵犯他人知识产权,明确专利到期时间无疑是个关键,这首先得找到具体品种的基础专利,然后查找其法律状况以求确认其失效日期。同一项目在不同国家地区获得授权的专利法律状况如授权与否及时间、权利转让、缴费记录、保护期是否获得延长等会有所差异。对最初的基础专利进行剖析可以得到大致结果。 既然讨论的是化学原料药,本文所涉及的均为特定化合物的基础(发明)专利。 经查核,所列品种专利保护期届满时间有些出入。有多个品种专利保护证书早几年已经失效,甚或是其合成方法早年就有报道,具体可见文中说明。 有一些机构专门从事药品专利保护期的预测,从相关数据库可以检索此类信息。然而即使是权威数据库中预期的时间并非一定准确,有时专利保护期获得延长,会使人“始料不及”。譬如依发韦仑基础专利EP的法律状况记录中,曾经预期于 2013年11月19日保护期届满,但最近( 2008年7月28日)该专利获得补充保护证书,有效期延长至 2018年8月3日。因此,获得初步信息后,还得进行验证和跟踪。 欧洲专利保护期延长在各成员国情况不同,时间也有差异,文中所列为最终时间。
资料所列国内生产(经营)单位数,也不尽正确。笔者对某个化学原料药的中国供应商作过调查,从不下7个数据库获得不同结果,也就是说这些数据库信息都不够完整。由于多年以来的所谓“抢仿”,大多数近年即将专利到期的药品生产都已经“名花有主”了,这里不作重复和补充。无论参与者多寡,能否介入后在竞争中取胜,成为“后起之秀”,关键在于扎实的工作。 “资料”所列应该说只是2009~2014年这个时间段专利到期品种的一部分,笔者曾经在以往的信息发布会提供过相关信息,本文结尾补充了数个这一时间段专利到期品种。 还有一个需要重视的问题是: 并非这些品种都有开发价值,譬如氟喹诺酮类抗菌剂甲磺酸阿拉曲伐沙星,曾经受到青睐,但现已撤出市场。因此必须检索资料,分析具体品种的市场前景和生命力。 1、抗xx ▲拉米夫定(Lamivudine) xx专利到期时间: 2009年11月。 获准适应症: 与其他抗逆转录酶病毒药物联用治疗HIV-I感染。 创制单位: 加拿大Shire BioChem(IAF?鄄BIOCHEM INT) 专利期复核: EP,专利优先日 1992年12月21日(xx)。
药品专利保护VS药品试验数据保护 —不同国家药品专利保护与药品试验数据保护届满期的计算 诸葛明 据统计:2001年我国医药外贸总额仅95亿美元,2010年已达602亿美元。其中出口额从54亿美元增长至400亿美元,年复合增长率达25%。由此可见,目前全球医药市场增长迅速,而仿制药市场持续升温,这对我国自主创新能力较弱的制药企业无疑是一个契机。我国制药企业在保持原料药的基础上扩大制剂的出口,尤其是扩张对美国、欧洲、日本等世界主流医药市场的销售。然而,药品是一种特殊的产品,医药行业特殊。要想让中国药品“走出国门”,除制药企业具有国际注册和生产质量体系国际认证的经验外,更重要的是要求制药企业确保对他人知识产权不侵犯的前提下筛选出具有优势的产品。 鉴于各个国家有关知识产权的立法情况不一,因此有必要对一些主流国家的有关药品的立法情况进行梳理,为制药企业筛选品种时提供立题依据。与药品相关的知识产权主要有专利、药品试验数据保护。专利对于大多数企业而言已经不再陌生。由于各国专利立法不一,因此专利保护期也不同。譬如,有些国家设有专利延长制度,有些国家则没有;大多数国家的专利保护期以申请日计算,而有些国家的专利保护期曾以授权日或颁证日开始计算。 药品试验数据保护(Data Exclusivity,Pharmaceutical Data Protection)则是指原研药公司为获得新药批准上市而向药品管理机构提交能证明该药品有效性和安全性的一系列“试验数据”。由于仿制药仅需验证其生物等效性与品牌药一致,无需进行大量的临床前试验和临床试验,因此其投资成本和风险大大降低。药品试验数据保护制度的设立就是为了杜绝仿制药公司“搭便车”,借用原研药公司的数据进行注册申报。因此,在数据保护期内不仅仿制药公司无权使用原研公司的试验数据,连药品管理机构也无权参考原研公司的试验数据对仿制药进行审批。 实际上,药品专利保护和药品试验数据保护是两种独立的保护系统,二者之间无直接联系。要判断一个产品对他人知识产权不侵犯,除需确认对他人专利不侵权外,还要确保对他人的药品试验数据也不侵权。
2009-2014年专利到期化学原料药 1、抗艾药 拉米夫定( Lamivudine)美国专利到期时间2009.11 国内生产(经营)单位21家 阿巴卡韦( Abacavir )美国专利到期时间2009.6国内生产(经营)单位2家 奈韦拉平(Nevirapine)美国专利到期时间2011.11国内生产(经营)单位22家 依发韦仑( Efavirenz)美国专利到期时间2013.5国内生产(经营)单位9家 茚地那韦(Indinavir)美国专利到期时间2011.11 国内生产(经营)单位4家 奈非那韦( Nelfinavir)美国专利到期时间2013.10国内生产(经营)单位5家 氨普那韦(Amprenavir )美国专利到期时间2013.11国内生产(经营)单位2家 阿扎那韦(Atazanavir )美国专利到期时间2014.1国内生产(经营)单位2家 2、调血脂药 阿托伐他汀(Atorvastatin)美国专利到期时间2015.6欧洲专利到期时间2011.6国内生产(经营)单位7家 3、消化系统药 埃索美拉唑(Esomeprazole)美国专利到期时间2014.1国内生产(经营)单位3家 4、心血管 氯吡格雷(Clopidogrel)美国专利到期时间2011.1国内生产(经营)单位25家 5、高血压 盐酸地尔硫卓(Diltiazem hydrochloride)美国专利到期时间2011.5国内生产(经营)单位13家 6、抗高眼压及青光眼 拉坦前列腺素(Latanopros)美国专利到期时间2011.3国内生产单位11家 贝美前列素(Bimatoprost)美国专利到期时间2012.9国内生产(经营)单位0家 布林佐胺(Brinzolamide)美国专利到期时间2010.8国内生产(经营)单位0家 7、帕金森病 盐酸普拉克索(Pramipexole dihydrochloride)美国专利到期时间2011.3国内生产单位7家 8、哮喘病 扎鲁司特(Zafirlukast)美国专利到期时间2010.5国内生产(经营)单位9家 9、抗痤疮 阿达帕林(Adapalene)美国专利到期时间2010.5国内生产(经营)单位36家 10、抗感染 甲磺酸阿拉曲伐沙星(Alatrofloxacin Mesylate) 美国专利到期时间2009.11国内生产(经营)单位0家 11、止吐 盐酸阿洛司琼(Alosetron hydrochloride)美国专利到期时间2010.10 国内生产(经营)单位8家 12、抗癌 氨磷汀(Amifostine)美国专利到期时间2012.7 国内生产(经营)单位13家 阿那曲唑(Anastrozole)美国专利到期时间 2009.12国内生产(经营)单位60家 13、抗变态 盐酸氮卓斯汀(Azelastine hydrochloride)美国专利到期时间2011.10 国内生产(经营)
新药保护期、过渡期、行政保护期、专利保护期、监测期、 试行期,一次说清楚 这个问题看来一直困扰着大家,我试着回答一下,希望这个回答能从根本上讲清楚,并且 终结此话题的讨论。1分限制,纯属激励新手。 1.新药保护期,它是99年药监局成立之初发布的《新药审批办法》中制定的一种 行政干预,目的其实是为了鼓励国内企业的创新,但是,以当时的行业水平想研发真正的“新药”是不现实的,所以当时的新药定义还是遵循着1985年实施的《药品管理法》的新 药定义,即“没有在中国境内生产过的药”就是“新”药,这就是说,只要是能首家仿制国外 品种的中国企业,就能够获得新药保护期,保护期内不受理其他国内企业的注册申请,能 够让首仿企业在相当长的时间内独家的占领市场。 这是一个很大的政策优惠,但是由于新药定义的缺陷,导致了不可避免的逻辑矛盾: 有些品种明明已经进口多年,然而国内首家仿制的企业照样能拿到“新”药保护期,如果用 这个保护期去限制国外的公司,明显是不合理的——毕竟人家才是真正的原研者。为了解 决这个逻辑矛盾,我们的新药保护期只禁止国产而不限制进口。 在如今看,这种光限制自家人的规定,实属汉奸条款。但在当时,却是有益的,如果 不给予极大的政策优惠,如何激励企业家和社会资金的投入?如何改善当时缺医少药的局面?可是,在如今已经不缺医少药,而且进口逐渐蚕食国内市场的境况下,这个新药保护 期却显得如此的不合时宜。 还好,2002年9月15日《药品注册管理办法(试行)》颁布并废止了99年的《新 药审批办法》以后,就已经没有新药保护期了。另外,对于在《新药审批办法》颁布后申报,但在《药品注册管理办法(试行)》颁布时还在做临床而没有完成审评的品种,出于 历史沿革的考虑仍然给予新药保护期的待遇,这就是所谓的“过渡期”,与新药保护期一样,过渡期只限制国产不限制进口。 无论新药保护期,还是过渡期,都已经是历史名词了,会逐渐湮没。