
编号:25
第1节认识晶体
(第1课时)
2010年4月19日
班级__________ 姓名__________
【学习目标】
1、晶胞的概念。
2、知道晶胞是晶体的最小结构重复单元,能用切割法计算一个晶胞种实际拥有的微粒数。
【学习重难点】
重点:计算一个晶胞种实际拥有的微粒数
难点:计算一个晶胞种实际拥有的微粒数
【当堂检测】
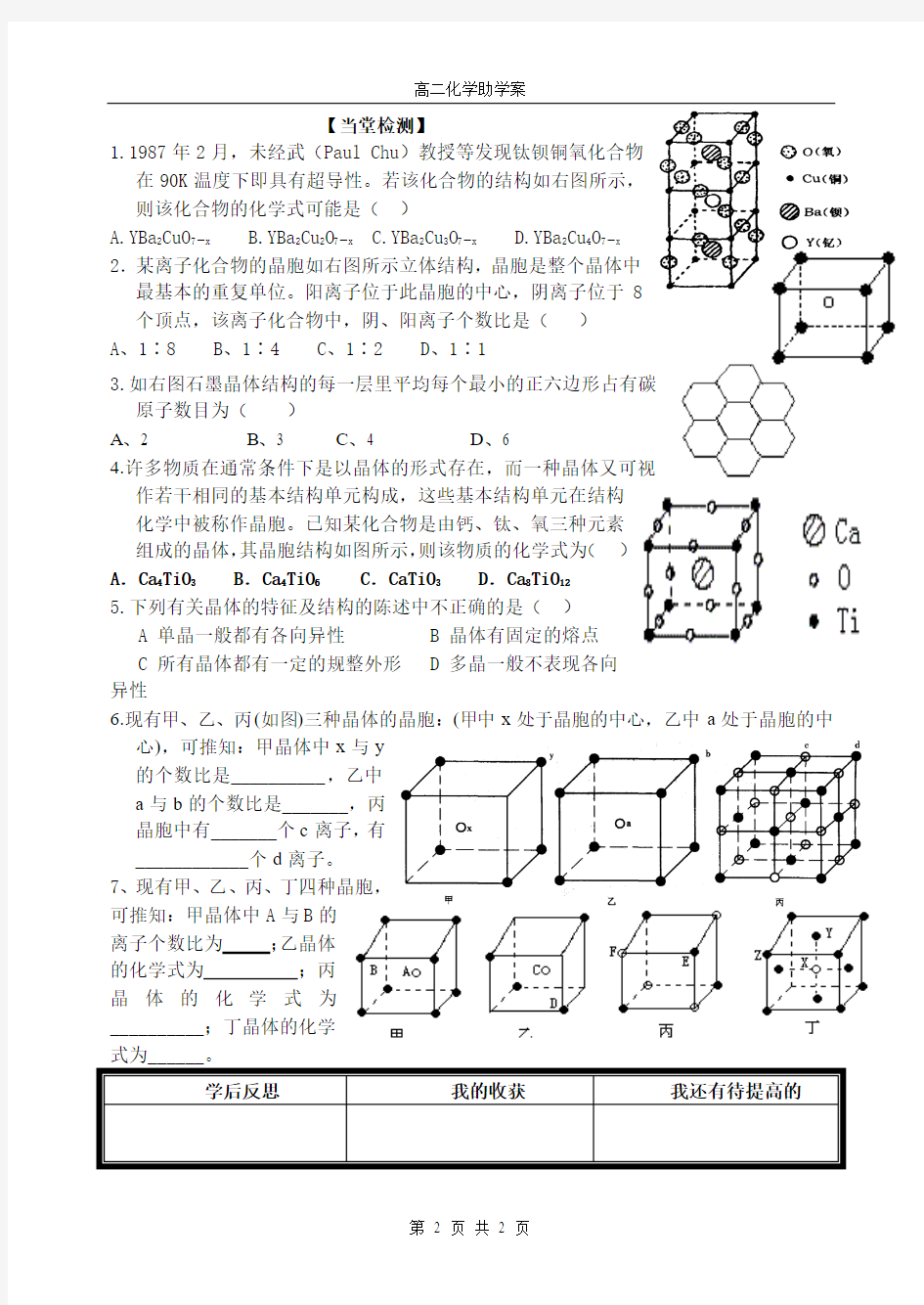
1.1987年2月,未经武(Paul Chu )教授等发现钛钡铜氧化合物在90K 温度下即具有超导性。若该化合物的结构如右图所示,则该化合物的化学式可能是( )
A.YBa 2CuO 7-x
B.YBa 2Cu 2O 7-x
C.YBa 2Cu 3O 7-x
D.YBa 2Cu 4O 7-x
2.某离子化合物的晶胞如右图所示立体结构,晶胞是整个晶体中最基本的重复单位。阳离子位于此晶胞的中心,阴离子位于8个顶点,该离子化合物中,阴、阳离子个数比是( ) A 、1∶8 B 、1∶4 C 、1∶2 D 、1∶1
3.如右图石墨晶体结构的每一层里平均每个最小的正六边形占有碳原子数目为( ) A 、2 B 、3 C 、4 D 、6
4.许多物质在通常条件下是以晶体的形式存在,而一种晶体又可视作若干相同的基本结构单元构成,这些基本结构单元在结构
化学中被称作晶胞。已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为( ) A .Ca 4TiO 3 B .Ca 4TiO 6 C .CaTiO 3 D .Ca 8TiO 12 5.下列有关晶体的特征及结构的陈述中不正确的是( )
A 单晶一般都有各向异性
B 晶体有固定的熔点
C 所有晶体都有一定的规整外形
D 多晶一般不表现各向异性
6.现有甲、乙、丙(如图)三种晶体的晶胞:(甲中x 处于晶胞的中心,乙中a 处于晶胞的中心),可推知:甲晶体中x 与y
的个数比是__________,乙中a 与b 的个数比是_______,丙晶胞中有_______个c 离子,有____________个d 离子。
7、现有甲、乙、丙、丁四种晶胞,可推知:甲晶体中A 与B 的
离子个数比为 ;乙晶体的化学式为 ;丙晶体的化学式为__________;丁晶体的化学式为______。
化学人教版选修三第三章第三节金属晶体测试题(实验班)学校:___________姓名:___________班级:___________考号:___________ 一、单选题(每题3分,共48分) 1.下列说法正确的是 A.分子晶体中一定存在分子间作用力,不一定存在共价键 B.分子中含两个氢原子的酸一定是二元酸 C.含有金属阳离子的晶体一定是离子晶体 D.元素的非金属性越强,其单质的活泼性一定越强 2.下列叙述不正确的是 ①热稳定性:H2O>HF>H2S ②熔点:Al>Na>K ③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布 ④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 ⑤沸点:NH3<PH3<AsH3 ⑥已知2H2(g)+O2(g)=2H2O(l)△H=﹣571kJ·mol﹣1,则氢气的燃烧热为285.5kJ·mol ﹣1 ⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N.A.②④⑥B.①③⑤⑦C.②④⑥⑦D.⑤⑥⑦ 3.下列有关说法不正确的是( ) A.水合铜离子的模型如图,1个水合铜离子中有4个配位键 B.CaF2晶体的晶胞如图所示,每个CaF2晶胞平均占有4个Ca2+C.H原子的电子云图如图所示,H原子核外电子在原子核附近运动D.金属Cu中Cu原子堆积模型如图,为最密堆积,每个Cu原子的配位数 均为12 4.下列各项比较中前者高于(或大于或强于)后者的是
A.金属Mg和金属Cu的空间利用率 B.BF3和CH4中心原子的价层电子对数 C.邻羟基苯甲醛()和对羟基苯甲醛()的沸点 D.C-O和Si-O的键能 5.下列说法正确的是 1s2s2p3s3p A.2S 电子排布式22624 B.在金属晶体中,自由电子与金属离子或金属原子的碰撞有能量传递,可以用此来解释的金属的物理性质是导热性 C.金属键可以看做是许多原子共用许多电子所形成的强烈相互作用,所以和共价键类似,也有饱和性和方向性 D.某物质的晶体中含A、B、C三种元素,其排列方式如图所示,晶胞中A、B、C的原子个数比为1:2:2. 6.Mn和Bi形成的晶体薄膜是一种金属间化合物(晶胞结构如图),有关说法正确的() A.锰价电子排布为70 3d4s B.Bi是d区金属 C.该合金堆积方式是简单立方 D.该晶体的化学式为MnBi 7.关于金属性质和原因的描述不正确的是 A.金属具有金属光泽是因为金属中的自由电子吸收了可见光,又把各种波长的光大部分反射出来 B.金属具有良好的导电性,是因为金属晶体中共享了金属原子的价电子,形成了“电子气”,在外电场的作用下自由电子定向移动形成电流 C.金属具有良好的导热性能,是因为自由电子在受热后,加快了运动速率,自由电子
光子晶体的应用及其发展前景 摘要:光子晶体是一种介电常数不同的,是人工设计的由两种或两种以上介质材料排列的一维·二维或三维周期结构的晶体。一维光子晶体已得到实际应用,三维光子晶体仍处于实验室实验阶段。由于光子晶体有带隙和慢光等优良特性,所以具有广泛的应用前景。 关键字:光子晶体物理基础材料制备应用 1、物理基础 (1)1987年,E.Y allonovitch 和S.John在研究抑制自发辐射和光子局域时提出光子这概念。概念提出后,其研究经历了一个从一维、二维到三维的过程,并将带隙不断向短波方向推进。微波波段的逞隙常称为电磁带隙(ElectromagneticBand-Gap,简称为EBG),光子晶体的引入为微波领域提供了新的研究方向。光子晶体完全依靠自身结构就可实现带阻滤波,且结构比较简单,在微波电路、微波天线等方面均具有广阔的应用前景。国外在这一方面的研究已经取得了很多成果,而国内的研究才刚刚起步,所以从事光子晶体的研究具有重要的意义。光子晶体是指具有光子带隙(Photonic Band-Gap,简称为PBG)特性的人造周期性电介质结构,有时也称为PBG结构。所谓的光子带隙是指某一频率范围的波不能在此周期性结构中传播,即这种结构本身存在“禁带”。这一概念最初是在光学领域提出的,现在它的研究范围已扩展到微波与声波波段。由于这种结构的周期尺寸与“禁带”的中心频率对应的波长可比拟,所以这种结构在微波波段比在光波波段更容易实现。相比一维二维光子晶体只能产生方向禁带,三维光子晶体能产生全方向的禁带,具有更普遍的实用性。 2、光子晶体的原理 (1)什么是光子晶体 光子晶体是指具有光子带隙的周期性介电结构材料,所谓光子带隙是由于介电常数不同的材料在空间周期性排列导致介电常数的空间周期性,使得光折射率产生周期性分布,光在其中传播时产生能带结构,在带隙中的光子频率被禁止传播,因此称光子禁带,具有光子禁带特征的材料称光子晶体。 (2)光子晶体的特性 根据固体物理的理论知识,在电子晶体中,由原子排布的晶格结构产生的周期性势场会对其中的运动电子形成调制。类似于电子晶体的一些特性,光子晶体中由于介电常数的空间周期分布带来的调制作用,所以也会形成光波的的带状分布,出现不连续的光子能带,能带的间隙称为光子禁带。禁带中对应频率的光波不能被传播。 光子禁带是光子晶体的两个重要特征之一,它的另一重要特征是光子局域。按照形成光子晶体结构的介电材料的空间周期性,可将其分为一维、二维和三维光子晶体。对于一维的光子晶体来说,由于介电材料只在一个空间方向上周期排列,所以只能在这一方向上产生光子禁带。对于二维光子晶体来说,由于介电常数在两个空间方向上均具有周期分布,所以产生的光子禁带位于这两个方向或这两个波矢交面上。三维光子晶体具有全方位的周期结构,可在所有方向上产生光子禁带。产生的光子禁带又分完全带隙和不完全带隙。在具有完全带隙的光子晶体中,落在光子禁带中的光在任何方向都不能传播,而在具有不完全带隙的光子晶体中,光波只是在某些方向上被禁止。
第三章晶体结构与性质 第一节晶体常识 第一课时 教学目标: 1、通过实验探究理解晶体与非晶体的差异。 2、学会分析、理解、归纳和总结的逻辑思维方法,提高发现问题、分析问题和解决问题的能力。 3、了解区别晶体与非晶体的方法,认识化学的实用价值,增强学习化学的兴趣。 教学重难点: 1、晶体与非晶体的区别 2、晶体的特征 教学方法建议:探究法 教学过程设计: [新课引入]:前面我们讨论过原子结构、分子结构,对于化学键的形成也有了初步的了解,同时也知道组成千万种物质的质点可以是离子、原子或分子。又根据物质在不同温度和压强 下,物质主要分为三态:气态、液态和固态,下面我们观察一些固态物质的图片。 [投影]:1、蜡状白磷;2、黄色的硫磺;3、紫黑色的碘;4、高锰酸钾 [讲述]:像上面这一类固体,有着自己有序的排列,我们把它们称为晶体;而像玻璃这一类 固体,本身原子排列杂乱无章,称它为非晶体,今天我们的课题就是一起来探究晶体与非晶体的有关知识。[板书]:—、晶体与非晶体 [板书]:1、晶体与非晶体的本质差异 [提问]:在初中化学中,大家已学过晶体与非晶体,你知道它们之间有没有差异? [回答]:学生:晶体有固定熔点,而非晶体无固定熔点。 [讲解]:晶体有固定熔点,而非晶体无固定熔点,这只是晶体与非晶体的表观现象,那么他 们在本质上有哪些差异呢? [投影]晶体与非晶体的本质差异 [板书]:自范性:晶体能自发性地呈现多面体外形的性质。 [解释]:所谓自范性即“自发”进行,但这里得注意,“自发”过程的实现仍需一定的条件。例如:水能自发地从高处流向低处,但不打开拦截水流的闸门,水库里的水不能下泻。 [板书]:注意:自范性需要一定的条件,其中最重要的条件是晶体的生长速率适当。 [投影]:通过影片播放出,同样是熔融态的二氧化硅,快速的冷却得到玛瑙,而缓慢冷却得到水晶过程。[设问]:那么得到晶体的途径,除了用上述的冷却的方法,还有没有其它途径呢?你能列举 哪些? [板书]:2、晶体形成的一段途径: (1)熔融态物质凝固; (2)气态物质冷却不经液态直接凝固(凝华); (3)溶质从溶液中析出。
第1节认识晶体 发展目标体系构建 1.通过生活中常见晶体和非晶体的实例,了解晶体 的特征,认识晶体与非晶体的区别。 2.了解晶体中微粒的空间排布存在周期性,认识简 单的晶胞,会用切割法确定晶胞微粒数目及晶体化 学式。 一、晶体的特性 1.晶体的概念 (1)晶体:内部微粒(原子、离子或分子)在空间按一定规律做周期性重复排列构成的固体物质。 (2)非晶体:内部微粒无周期性重复排列的固体物质。 2.晶体的特性 (1)晶体的自范性:在适宜的条件下,晶体能够自发地呈现封闭的、规则的多面体外形。 (2)晶体的各向异性:晶体在不同方向上表现出不同的物理性质。 (3)晶体有特定的对称性:晶体具有规则的几何外形。 3.晶体的分类 (1)分类标准:根据晶体内部微粒的种类和微粒间相互作用的不同。 (2)分类 晶体类型构成微粒微粒间的相互作用实例 离子晶体阴、阳离子离子键NaCl 金属晶体金属阳离子、自由电子金属键铜共价晶体(原子晶体) 原子共价键金刚石分子晶体分子分子间作用力冰 二、晶体结构的基本重复单元——晶胞 概念晶体结构中基本的重复单元 形状大小、形状完全相同的平行六面体 晶体中晶 无隙并置 胞的排列方式
“切割法”计算某晶胞中的微粒,如果被n个晶胞所共有,则微粒的1/n 属于该晶胞 微点拨:晶胞的形状大多数是平行六面体,但也有其他形状,如三棱柱、八面体等。 1.判断正误(正确的打“√”,错误的打“×”) (1)晶体一定是固体,固体不一定是晶体(√) (2)晶胞都是平行六面体(×) (3)区分晶体与非晶体最可靠的方法是确定有没有固定的熔点(×) (4)粉末状固体也可能是晶体(√) (5)由晶胞组成的晶体,其化学式表示一个分子中原子的数目(×) 2.下列不属于晶体特性的是( ) A.具有规则的几何外形 B.具有各向异性 C.具有对称性 D.没有固定的熔点 D [晶体具有规则的几何外形、各向异性、自范性、对称性等特征,且晶体有固定的熔点。] 3.下列有关晶胞的叙述,不正确的是( ) A.晶胞是晶体最小的结构重复单元 B.不同的晶体中晶胞的大小和形状都相同 C.晶胞中的微粒可能不完全属于该晶胞 D.已知晶胞的组成就可推知晶体的组成 B [描述晶体结构的基本单元(最小重复单元)叫晶胞,A正确;相同晶体中晶胞的大小和形状完全相同,不同晶体中晶胞的大小和形状不一定相同,B错误;晶胞中有的微粒被若干个晶胞所共用,而不专属于某个晶胞,C正确;根据晶胞的组成,可以利用“均摊法”推知晶体的组成,D正确。] 晶体与非晶体的区别 (素养养成——宏观辨识与微观探析) 1.我们吃的食盐是粉末状的没有固定形状的颗粒,是不是说明食盐不是晶体? 提示:食盐是晶体,晶胞的规则几何外形用肉眼是看不到的。 2.能不能只通过外观就能区分晶体和非晶体?
第三章物质的聚集状态与物质性质 第一节认识晶体第三课时 【教学目标】 1.知道晶胞是晶体的最小结构重复单元。 2.能用切割法计算一个晶胞中实际拥有的微粒数 【教学重难点】 能用切割法计算一个晶胞中实际拥有的微粒数 【教学方法】探究法 【教学过程】 【新课引入】 【联想质疑】 通过前面的学习你已经知道,晶体可以看成是微粒按照一定的规律无限堆积而得到的,整个晶体里排列着无数个微粒。那么,如何研究晶体内部微粒的排列规律呢? 【板书】 三.晶体结构的基本单元 1.晶胞定义:晶胞是晶体中最小的结构重复单元。晶胞都是从晶体结构中截取下来的大小、形状完全相同的平行六面体。 【多媒体展示】各种类型的晶胞 【问题讨论】晶胞必须符合两个条件?我们又如何去划分晶胞呢? 【总结】 晶胞必须符合两个条件:一是代表晶体的化学组成二是代表晶体的对称性。 划分晶胞要遵循2个原则:一是尽可能反映晶体内结构的对称性;二是尽可能小 【陈述】由A3密堆积中可以划分出六方晶胞,从A1密堆积中可以划分出立方面心晶胞。
整块晶体可以看作是数量巨大的晶胞无隙并置而成,所谓无隙是指相邻晶胞之间没有任何间隙,所谓并置是指所有晶胞都是平行排列的,取向相同。晶胞是具有代表性的体积最小的平行六面体。 【交流研讨】既然晶体是由无数个晶胞堆积形成的,晶胞内威力的组成就能反映整个晶体的组成。那么?应如何来分析一个晶胞中的微粒数呢? 【板书】2.晶胞中原子个数的计算方法:(分割法) 分割法是一种计算一个晶胞中实际拥有微粒数目的一种方法。 分割法的根本原则是:晶胞任意位置上的一个原子如被X个晶胞所共有,那么每个晶胞对这个原子分享1/X。如对于立方晶胞 (1)每个顶点上的原子被8个晶胞共有,所以晶胞对顶点的每个原子占有1/8。 (2)每条棱上的原子被4个晶胞共有,所以晶胞对棱上的每个原子只占有1/4。 (3)每个面上的原子被2个晶胞共有,所以晶胞对面上的每个原子只占有1/2。 (4)晶胞内部的原子属于晶胞自己,不与其它晶胞分享。 【思考】你能用这种方法分析一下NaCl、CsCL晶体吗?(多媒体展示) 【计算】NaCl晶胞、CsCl晶胞中含有的阴、阳离子数目分别是多少? NaCl晶胞:钠离子:1+12×1/4=4氯离子:8 ×1/8+6×1/2=4 CsCl晶胞:铯离子:1氯离子:8 ×1/8=1 【迁移应用】计算物质的化学式 【例题】如图所示的晶体结构是一种具有优良的压电、铁电、光电等功能的晶体材料的晶胞。晶体内与每个“Ti”紧邻的氧原子数和这种晶体材料的化学式分别是(各元素所带的电荷均已略去)
课后达标检测 一、单项选择题 1.下列有关金属晶体的说法中不正确的是() A.金属晶体是一种“巨分子” B.“电子气”为所有原子所共用 C.简单立方堆积的空间利用率最低 D.体心立方堆积的空间利用率最高 解析:选D。根据金属晶体的“电子气理论”,选项A、B都是正确的。金属晶体的堆积方式中空间利用率分别是简单立方堆积52%,体心立方堆积68%,面心立方最密堆积和六方最密堆积均为74%。因此简单立方堆积的空间利用率最低,六方最密堆积和面心立方最密堆积的空间利用率最高,选项C正确,选项D错误。 2.金属键的强弱与金属价电子数多少有关,价电子数越多金属键越强,与金属阳离子的半径大小也有关,半径越大,金属键越弱。据此判断下列金属熔点逐渐升高的是() A.Na K Rb B.Na Mg Al C.Li Be Mg D.Li Na Mg 解析:选B。金属熔点的高低与金属阳离子半径大小及金属价电子数有关,价电子数越多,阳离子半径越小,金属键越强。B项中三种金属在同一周期,价电子数分别为1、2、3,且半径由大到小,故熔点由高到低的顺序是Al>Mg>Na。 3.下列对各组物质性质的比较中,正确的是() A.熔点:Li<Na<K B.导电性:Ag>Cu>Al>Fe C.密度:Na>Mg>Al D.空间利用率:体心立方堆积<六方最密堆积<面心立方最密堆积 解析:选B。同主族的金属单质,原子序数越大,熔点越低,这是因为它们的价电子数相同,随着原子半径的增大,金属键逐渐减弱,A项错误;Na、Mg、Al是同周期的金属单质,密度逐渐增大,C项错误;不同堆积方式的金属晶体空间利用率分别是简单立方堆积
晶体学基础与晶体结构习题与答案 1. 由标准的(001)极射赤面投影图指出在立方晶体中属于[110]晶带轴的晶带,除了已在图2-1中标出晶面外,在下列晶面中哪些属于[110]晶带?(1-12),(0-12),(-113),(1-32),(-221)。 图2-1 2. 试证明四方晶系中只有简单立方和体心立方两种点阵类型。 3. 为什么密排六方结构不能称作为一种空间点阵? 4. 标出面心立方晶胞中(111)面上各点的坐标。 5. 标出具有下列密勒指数的晶面和晶向:a)立方晶系(421),(-123),(130),[2-1-1],[311];b)六方晶系(2-1-11),(1-101),(3-2-12),[2-1-11],[1-213]。 6. 在体心立方晶系中画出{111}晶面族的所有晶面。 7. 在立方晶系中画出以[001]为晶带轴的所有晶面。 8. 已知纯钛有两种同素异构体,密排六方结构的低温稳定的α-Ti和体心立方结构的高温稳定的β-Ti,其同素异构转变温度为882.5℃,使计算纯钛在室温(20℃)和900℃时晶体中(112)和(001)的晶面间距(已知aα20℃=0.29506nm,cα20℃=0.46788nm,aα900℃=0.33065nm)。 9. 试计算面心立方晶体的(100),(110),(111),等晶面的面间距和面致密度,并指出面间距最大的面。 10.平面A在极射赤平面投影图中为通过NS及核电0°N,20°E的大圆,平面B的极点在30°N,50°W处,a)求极射投影图上两极点A、B间的夹角;b)求出A绕B顺时针转过40°的位置。 11. a)说明在fcc的(001)标准极射赤面投影图的外圆上,赤道线上和0°经线上的极点的指数各有何特点,b)在上述极图上标出(-110),(011),(112)极点。 12. 图2-2为α-Fe的x射线衍射谱,所用x光波长λ=0.1542nm,试计算每个峰线所对应晶面间距,并确定其晶格常数。 图2-2 13. 采用Cu kα(λ=0.15418nm)测得Cr的x射线衍射谱为首的三条2θ=44.4°,64.6°和81.8°,若(bcc)Cr的晶格常数a=0.28845nm,试求对应这些谱线的密勒指数。
第3章物质的聚集状态与物质性质 第1节认识晶体 【自学目标】 1.能区分晶体与非晶体,知道晶体的重要特征。 2.了解A1、A3 型密堆积。 3.知道晶胞是晶体的最小结构重复单元,能用切割法计算一个晶胞种实际拥有的微粒数。【自学助手】 1.晶体的特性是。 2.的晶体称为离子晶体;的晶体称为金属晶体; 的晶体称为原子晶体;的晶体称为分子晶体。 3.因为金属键、离子键、分子间的相互作用没有,所以组成金属晶体、离子晶体、分子晶体的微粒服从原理。 4.金属晶体的结构形式可归结为等径圆球的密堆积。其中,每一层都是最紧密堆积,也就是每个等径球与周围相接触。而层与层之间的堆积时有多种方式: 一种是“…ABAB…”重复方式,叫型的最密堆积,一种是“…ABCABC…”重复方式,叫型的最密堆积。 5.晶胞是晶体结构中最小的,是从晶体结构中截取下来的大小、形状完全相同的。 6.在晶胞中,平行六面体的顶点上的微粒为个晶胞共有;在面心上的微粒为个晶胞共有;在棱的中心上的微粒为个晶胞共有。 【思维点拨】 【例题1】关于晶体的下列说法正确的是 A.在晶体中只要有阴离子就一定有阳离子B.在晶体中只要有阳离子就一定有阴离子 C.离子晶体的熔点一定比金属晶体的高D.分子晶体的熔点一定比金属晶体的低 【解答】A正确。B不正确,在金属晶体中含金属阳离子而不含阴离子。C不正确,金属钨的熔点比所有的离子晶体高。D不正确,单质汞在常温下为液态,而分子晶体碘、硫在常温下为固态。 【答案】A 【例题2】某离子晶体晶胞结构如图所示,X位于立方体的顶点,Y位于立方体的中心。试分析: (1)在一个晶胞中有个X,个Y,所以该晶体的化学式为_____ _____。 (2)晶体中距离最近的2个X与一个Y所形成的夹角∠XYX角度为________(填角的度数)【解答】(1)Y的个数为1,X的个数为4×1/8=1/2,所以X︰Y=1︰2,化学式是XY2 (2)X与Y之间的连线构成了正四面体,类似甲烷(CH 4) 的结构,所求的∠XYX等于甲烷中的键角,即109.5°。 【答案】(1)1;1/2;(2)109.5° 【自我检测】 1.下列各对物质中,化学键类型和晶体类型完全相同的是() A.NaCl和NaOH B.Br2和H2O.CCl4和FeCl3 D.CO2和SiO2 2.某单质晶体一定不是() A.离子晶体B.分子晶体C.原子晶体D.金属晶体 3.下列叙述正确的是() A.任何晶体中,若含有阳离子也一定含有阴离子 B.离子晶体中可能含有共价键 C.离子晶体中只含有离子键不含有共价键 D.分子晶体中只存在分子作用力,不含有其他化学键 4.下列有关金属元素特征的叙述中正确的是() A.金属元素的原子只有还原性,离子只有氧化性 B.金属元素在化合物中一定显正价 C.金属元素在不同化合物中的化合价均不同 D.金属单质在常温下都是固体 5.含有离子的晶体()
金属晶体练习 [基础训练] 1下列有关金属元素的特征叙述正确的是() A .金属元素的原子具有还原性,离子只有氧化性 D ?金属元素的化合价一定显正价 C.金属元素在不同化合物中的化合价均不相同 D ?金属元素的单质在常温下均为金属晶体 2?下列有关金属元素特征的叙述中正确的是() A.金属元素的原子只有还原性,离子只有氧化性 B.金属元素在化合物中一定显正价 C.金属元素在不同化合物中的化合价均不同 D.金属单质在常温下都是金属晶体 3.金属的下列性质中,不能用金属的电子气理论加以解释的是() A易导电B .易导热C.有延展性D .易锈蚀 4.下列晶体中由原子直接构成的单质有 () A.白磷B .氦C.金刚石D .金属镁 5.金属具有延展性的原因是 () A .金属原子半径都较大,价电子较少 B.金属受外力作用变形时,金属阳离子与自由电子间仍保持较强烈作用 C.金属中大量自由电子受外力作用时,运动速度加快 D.自由电子受外力作用时能迅速传递能量 6.下列说法不正确的是() A.金属单质的熔点一定比非金属单质高 B.离子晶体中不一定含有金属元素 C.在含有阳离子的晶体中,一定含有阴离子 D.含有金属元素的离子不一定是阳离子 7.金属晶体的形成是因为晶体中存在
() A.金属离子间的相互作用 B .金属原子间产生相互作用 C.金属离子与自由电子间的相互作用 D .金属原子与自由电子间的相互作用 & 关于金属元素的特征,下列叙述正确的是 ①金属元素的原子只有还原性,离子只有氧化性②金属元素在化合物中一般显正价 ③金属性越强的元素相应的离子氧化性越弱④金属元素只有金属性,没有非金属性 ⑤价电子越多的金属原子的金属性越强 A .①②③B.②③ C .①⑤ D .全部 9.金属的下列性质中,与自由电子无关的是() A.密度大小 B.容易导电 C ?延展性好 D ?易导热 10.下列有关金属的叙述正确的是() A .金属元素的原子具有还原性,其离子只有氧化性 B ?金属元素的化合价一般表现为正价 C.熔化状态能导电的物质一定是金属的化合物 D ?金属元素的单质在常温下均为金属晶体 11.下列叙述正确的是() A .原子晶体中可能存在离子键 B .分子晶体中不可能存在氢键 C.在晶体中可能只存在阳离子不存在阴离子 D .金属晶体导电是金属离子所致 12.金属能导电的原因是() A.金属晶体中金属阳离子与自由电子间的相互作用较弱 B.金属晶体中的自由电子在外加电场作用下可发生定向移动 C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动 D.金属晶体在外加电场作用下可失去电子 13.下列叙述正确的是() A.任何晶体中,若含有阳离子也一定含有阴离子 B.原子晶体中只含有共价键 C.离子晶体中只含有离子键,不含有共价键
深圳大学研究生课程论文题目光子晶体及其器件的研究进展成绩 专业 课程名称、代码 年级姓名 学号时间2016年12月 任课教师
子晶体及其器件的研究进展 摘要:光子晶体是一种具有光子带隙的新型材料,通过设计可以人为调控经典波的传输。由 于光子晶体具有很多新颖的特性,使其成为微纳光子学和量子光学的重要研究领域。随着微加工技术的进步和理论的深入研究,光子晶体在信息光学以及多功能传感器等多个学科中也得到了广泛应用。本文介绍了光子晶体及其特征,概述了光子晶体器件的设计方法和加工制作流程,论述现阶段发展的几种光子晶体器件,并对光子晶体器件的发展趋势做了展望。 关键词:光子晶体;光子晶体的应用;发展趋势 Research progress of photonic crystals and devices Abstract:Photonic crystal is a new material with photonic band gap, which can regulate the transmission of classical wave artificially. Because it has many novel properties of photonic crystal, which is becoming an important research field of micro nano Photonics and quantum optics. With the progress of micro machining technology and theoretical research, photonic crystals have been widely used in many fields such as information optics and multifunction sensors. This paper introduces the photonic crystals and its characteristics, summarizes the design method and process of the photonic crystal devices in the production process, discusses several kinds of photonic crystal devices at this stage of development, and the development trend of photonic crystal devices is prospected. Key words:Photonic crystal; application of photonic crystal; development trend 1引言 在过去的半个世纪里,随着人们对电子在物质尤其是半导体中运动规律的研究,使得对电子控制能力的增加,从而产生了各种微电子器件以及大规模的集成电路,推动了电子工业和现代信息产业的迅猛发展,半导体技术在人们生活中扮演着越来越重要的角色。目前半导体技术正向着高速化和高集成化方向的发展,不可避免地引发了一系列问题。当信息处理的频率和信号带宽越来越高时,通过金属线传输电子会带来难以克服的发热问题和带宽限制;而线宽减小到深纳米尺度时,相邻导线的量子隧穿效应成为电子器件发展的重要瓶颈。这迫使人们越来越关注光信息处理技术,并尝试用光器件来替代部分传统电子器件,以突破上述瓶颈限制。实现这一目标的关键在于如何将光子器件尺寸降低至微纳米量级,并能与微电子电路集成在同一芯片上。 目前比较有效的方法有三种:纳米线波导,表面等离子体和光子晶体。其中,光子晶体具有体积小、损耗低和功能丰富等多种优点,被认为是最有前途的光子集成材料,称为光子半导体[1],它是1987年才提出的新概念和新材料。这种材料有一个显著的特点是它可以如人所愿地控制光子的运动。由于其独特的特性,光子晶体可以制作全新原理或以前所不能制作的高性能光学器件,在光通讯上也有重要的用途,如用光子晶体器件来替代传统的电子器件,信息通讯的速度快得
高考化学第1节认识晶体专题1 2020.03 1,有A、B、C、D四种元素,A元素的气态氢化物分子式为RH4,其中R的质量分数为75%,该元素核内有6个中子,能与B形成AB2型化合物,B在它的氢化物中含量为88.9%,核内质子数和中子数相等,C、D为同周期元素,D的最高价氧化物的水化物为酸性最强的酸,C的氧化物为两性氧化物。 (1)A元素的一种无色透明的单质,名称叫______,其晶体类型是______。 (2)B的氢化物的电子式为______,属______分子。(极性或非极性) (3)A和B形成化合物的分子空间构型为______,属______分子(极性或非极性),其晶体类型是______。俗名______。 (4)C元素位于周期表中第______周期______族,A、C、D三元素的最高价氧化物的水化物按酸性由强到弱的顺序排列(用分子式表示)_______________________。 (5)C和D的化合物溶于水后滴入过量KOH,现象是_______________________________,离子方程式_______________________________。 2,下列关于胶体的叙述不正确的是 ( ) A.布朗运动是胶体微粒特有的运动方式,可以据此把胶体和溶液、悬浊液区别开来 B.光线透过胶体时,胶体发生丁达尔现象 C.用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过
D.胶体微粒具有较大的表面积,能吸附阳离子或阴离子,故在电场作用下会产生电泳现象 3,有甲、乙、丙、丁四种液体,它们分别为Fe(OH)3胶体、硅酸溶胶、As2S3胶体、NaOH溶液。现将有关实验现象记录如下:(1)电泳:甲液体的阳极周围颜色变浅,阴极周围颜色变深;(2)将一束光通过乙液体,无丁达尔现象;(3)将乙慢慢加入到丙中,先出现浑浊,后液体变清。则甲为,乙为,丙为,丁为 4,二氧化硅晶体是立体的网状结构,其晶体模型如右图所示。认真观察晶体模型并回答下列问题: (1)二氧化硅晶体中最小的环为元环。 (2)每个硅原子为个最小环共有。 (3)每个最小环平均拥有 5,下列过程需要通电后才可以进行的是 ( ) ①电离②电解③电镀④电泳⑤电化腐蚀 A.①②③ B.②③④ C.②④⑤ D.全部 6,下列与胶体无关的事实是 ( ) A.明矾用于净水 B.澄清石灰水在空气中放置后变浑浊 C.用FeCl3止血 D.用石膏点豆腐
光子晶体的最新研究进展 (学号:SA12231016 姓名:陈飞虎) 摘要:光子晶体(Photonic Crystal)是在1987年由S.john[1]和E.Yablonovitch[2]分别独立提出,是由不同折射率的介质周期性排列而成的人工微结构。在这二十多年的发展当中,光子晶体已在光通信技术、材料科学和激光与光电子学等方面都取得了相应的进展。本文阐述了光子晶体在各方面所取得的相应进展,并探讨光子晶体在各个领域的最新研究状况。 关键词:光子晶体研究进展 1 引言 自光子晶体这一概念提出以来,它就成为各个学科领域的科学家们关注的热点。光子晶体(Photonic crystals)材料又称为光子带隙(Photonic band gap,PBG)材料,指介电常数(折射率)周期性变化的材料。电子在固态晶体的周期性势垒下能形成电子带隙,光子晶体的周期性晶格对光的布拉格散射可以形成光子带隙, 频率处在光子带隙中的光被禁止进入光子晶体。若光子晶体中某个地方不满足周期性,即引入了缺陷,禁带中就会出现缺陷态,缺陷态具有很高的光子态密度。采用各种材料,设计不同的光子晶体结构和引入不同的缺陷类型以及缺陷组合,可以制作出功能和特性各异的微纳光子器件。因光子晶体具有光子带隙和光子局域两大优越特点,所以它在发光二极管、多功能传感器、光通讯、光开关、光子晶体激光器等现代高新技术领
域[3-4]有着广泛应用。当前所制备的光子晶体大多不可调,但对于可调制光子晶体的带隙可以调控,电介质的折射率和光子晶体的晶格常数决定了光子带隙的宽度和位置,故改变外部环境,如加电场、磁场、压力或温度等,均能对光子禁带进行调制。因此可调控的光子晶体成为各个应用领域的研究热点和方向。 2 光通信技术方向的研究进展 传统波导利用的是全内反射原理,当波导弯曲较大时,电磁波在其中的传播不再符合全反射原理,以至于弯曲损耗较大。而光子晶体波导采用的是不同方向缺陷模共振匹配原理,因而光子晶体波导不受转角限制,有着极小的弯曲损耗。理论上,当波导弯曲 90°时,传统波导会有 30%的损失,而光子晶体波导的损耗只有 2%[5]。另外,光子晶体波导的尺度可以做得很小,达到波长量级;因此,光子晶体波导不仅在光通信中有着十分重要的应用,在未来大规模光电集成、光子集成中也将具有极其重要的地位。 光子晶体光纤(PCF) 由于它的包层中二维光子晶体结构能够以从前没有的特殊方式控制纤芯中的光波,使其具有诸多优异的光学特性,如无截止单模传输特性、可调节的色散特性、高双折射特性、大模面积和高非线性特性等,因此PCF的研究一直是光通信和光电子领域科学家们关注的热点。目前,世界各国对PCF的研究如火如荼,在PCF的色散、带隙、非线性特性及应用方面均有了长足进展。PCF的
第3章物质的聚集状态与物质性质 第1节认识晶体 第1课时晶体的特征 【教学目标】 1.能区分晶体与非晶体。 2.认识晶体的重要特征。 【教学重难点】 晶体的特征 【教学方法】探究法 【教学过程】 【新课引入】 【投影】几种常见的晶体图片 【联想·质疑】 1.食盐、冰、金属、宝石、水晶、大部分矿石等都是晶体,那么什么样的物质才能称为晶体? 2.晶体与玻璃、橡胶等非晶体有什么不同? 3.为什么晶体具有明显不同于非晶体的特性? 【讲述】 像上面这一类固体,有着自己有序的排列,我们把它们称为晶体;而像玻璃这一类固体,本身原子排列杂乱无章,称它为非晶体,今天我们的课题就是一起来探究晶体与非晶体的有关知识。 【板书】 一、晶体的特征 【板书】 1.晶体与非晶体的本质差异
【提问】 在初中化学中,大家已学过晶体与非晶体,你知道它们之间有没有差异? 【回答】 学生:晶体有固定熔点,而非晶体无固定熔点。 【讲解】 晶体有固定熔点,而非晶体无固定熔点,这只是晶体与非晶体的表观现象,那么他们在本质上有哪些差异呢? [投影] 晶体与非晶体的本质差异 【讲述】 通过前面对晶体与非晶体的讨论,现在我们来总结一下,晶体有哪些特点: 【板书】 2.晶体的特点: 【阅读思考】 晶体具有何种特性 (1)在适宜条件下,晶体能自发呈现封闭的、规则的多面体外形———自范性; (2)在不同的方向上表现不同的物理性质(如导电)————向异性 (3)具有特定的对称性———对称性 【过渡】 通过以上的学习如何给晶体下一定义?晶体又有何分类?分类的依据又是什么? 【板书】
3.晶体的分类 (1)晶体:内部微粒在空间按一定的俄规律做周期性重复排列构成的固体物质 (2)依据:根据晶体内部微粒的种类和微粒间相互作用 (3)分类:离子晶体、金属晶体、原子晶体和分子晶体 【思考】各类晶体有何区别? 【学生归纳】 【问题】晶体有何用途呢? 【板书】 4.晶体的用途(学生阅读教材) 【练习】 1.从我们熟悉的食盐、金属、冰到贵重的钻石等都是晶体,而同样透明的玻璃却是非晶体。下列关于晶体和非晶体的本质区别的叙述中,正确的是() A.是否具有规则的几何外形的固体 B.是否具有固定组成的物质 C.是否具有美观对称的外形 D.内部基本构成微粒是否按一定规律做周期性重复排列 2.下列物质中属于晶体的是() A.橡胶B.玻璃C.食盐D.水晶 3.关于晶体的自范性,下列叙述正确的是() A.破损的晶体能够在固态时自动变成规则的多面体 B.缺角的氯化钠晶体在饱和的NaCl溶液中慢慢变为完美的立方块 C.圆形容器中结出的冰是圆形的 D.由玻璃制成的圆形的玻璃球
较石墨和金刚石的晶体结构、结合键和性能。 答:金刚石晶体结构为带四面体间隙的FCC,碳原子位于FCC点阵的结合点和四个不 相邻的四面体间隙位置,碳原子之间都由共价键结合,因此金刚石硬度高,结构致密。石墨晶体结构为简单六方点阵,碳原子位于点阵结点上,同层之间由共价键结合,邻层之间由范德华力结合,因此石墨组织稀松,有一定的导电性,常用作润滑剂。 1. 单晶体:如果一个物体就是一个完整的晶体,这样的晶体~单晶体. 水晶、雪花、食盐小颗粒、单晶硅、晶须 2 多晶体:如果整个物体是由许多杂乱无章地排列着的小晶体组成的,这样的物体~多晶体,其中的小晶体叫做晶粒,其边界称为晶界,多晶体有一定的熔点。各向同性 金属及合金等. 3 非晶体:没有规则的几何形状,原子在三维空间内不规则排列。长程无序,各向同性。常见的非晶体有:玻璃、蜂蜡、松香、沥青、橡胶等. 扩散定理 单位时间内通过垂直于扩散方向的单位截面积的物质量(扩散通量)与该物质在该面积处的浓度梯度成正比。 为扩散通量,表示扩散物质通过单位截面的流量,dC/dx为沿x方向的浓度梯度;D为原子的扩散系数。负号表示扩散由高浓度向低浓度方向进行。 层错能 金属结构在堆垛时,没有严格的按照堆垛顺序,形成堆垛层错。层错是一种晶格缺陷,它破坏了晶体的周期完整性,引起能量升高,通常把单位面积层错所增加的能量称为层错能。 层错能出现时仅表现在改变了原子的次近邻关系,几乎不产生点阵畸变。所以,层错能相对于晶界能而言是比较小的。层错能越小的金属,则层错出现的几率越大。
在层错能较高的金属如铝及铝合金、纯铁、铁素体钢(bcc)等热加工时,易发生动态回复,因为这些金属中易发生位错的交滑移及攀移。而奥氏体钢(fcc)、镁及其合金等由于层错能低,不发生位错的交滑移,所以动态再结晶成为动态软化的主要方式。 面心立方的密排面 晶体中原子的堆垛方面心立方晶格的金属: 铝(Al)、铜(Cu)、镍(Ni)、金(Au)、银(Ag)、γ- 铁( γ-Fe, 912℃~1394℃) 式n面心立方:密排面为{111} A BCABCABC…… 点阵常数与原子半径R的关系 晶胞棱边的长度称为点阵常数或晶格常数。对立方晶系,a=b=c,点阵常数用a表示即可; 对六方晶系,a1=a2=a3?c,需要用a和c两个点阵常数来表示晶胞的大小。 1.面心立方: –最密排方向<110> –即面对角线方向原子半径为
反蛋白石光子晶体的研究进展 韩国志1 孙立国2 (1南京工业大学应用化学系 南京 210009; 2黑龙江大学化学化工与材料学院 哈尔滨 150080) 2008-07-02收稿,2008-09-24接受摘 要 反蛋白石晶体是一类重要的光子晶体,由于其制备材料的广泛性以及容易实现对光子禁带的 多重调制而受到广泛关注。本文介绍了目前反蛋白石晶体结构的主要制备技术和方法,详细阐述了反蛋白石 晶体结构的最新研究进展。 关键词 反蛋白石 光子晶体 胶体晶体 应用 Advance in Inverse Opal Photonic Structure Han Guozhi 1 Sun Liguo 2(1Department of Applied Chemistry ,Nanjing Universit y of Technology ,Nanjing 210009;2School of Chemistry and Materials ,Heilongjian g Univers ity ,Harbin 150080) A bstract Inverse opal crystals are an important structure for photonic crystal .Comparing with opal crystals ,it is advantageous in universality of materials for fabricating and easy to realize multi -tunablity of stop -band and structure function .In this paper ,current preparation and advance in application of inverse opal structures are reviewed . Keywords Inverse opal ,Photon ic crystal ,Colloidal crystal ,Application 图1 反蛋白石晶体的结构Fig .1 SEM image of invers e opal 蛋白石(opal )是一种存在于自然界中的、在数百nm 尺度 上有规整排列的含水非晶质二氧化硅。它拥有色彩缤纷的外 观,电子显微镜下观察表明,结晶蛋白石具有周期排列的六方 晶格,为面心立方结构。广义而言,蛋白石是一种三维光子晶 体,具备选择性布拉格反射,所以在不同的角度,显示不同的 颜色[1~4]。目前人工蛋白石主要采用胶体晶体自组装方法制 备。将表面带同种电荷的胶体颗粒(如非晶二氧化硅微球、聚 苯乙烯微球等)按一定的浓度分散于溶剂中,由于颗粒表面之 间的电荷相互作用,随着溶剂的蒸发,胶体粒子自动排列成六 方密堆积的胶体晶体,当胶体晶体中微球的直径与光波长相 当时,该晶体即可产生带隙,具有与蛋白石相似的光学特性。 反蛋白石晶体就是在蛋白石晶体的空隙中填充某种介 质,然后通过焙烧、溶解或化学腐蚀等方法除去蛋白石晶体的原材料后所形成的多孔结构,即空气小球以面心立方的形式分布于介质中,每个空气小球在之前胶体粒子接触点以小的圆柱形通道连接(图1)。如果介质折射率与空气不同,就产生布拉格反射,反射波长可由下式计算: λ=2(2 3)1 2d (n 2a -sin 2θ)1 2其中,λ表示反射波长,d 表示晶面间距,n a 表示材料平均折射率,θ表示入射光线与晶面的夹角。这种结构只要填充材料的折射率跟周边的介质(空气)的比值达到一定的数值(>2.8)时,就会出现完全光子带隙。 与蛋白石晶体相比,反蛋白石晶体最大的优势在于制备材料的选择性广泛、材料折射率的差异容易
金刚石的消光规律--晶体结构题目例
(4)金刚石的消光规律计算举例: 金刚石结构中C 的原子坐标: (000)(1/2 1/2 0)(1/2 0 1/2)(0 1/2 1/2) (1/4 1/4 1/4) (3/4 3/4 1/4) (3/4 1/4 3/4) (1/4 3/4 3/4) F hkl =∑f j e 2πi(hxj+kyj+lzj) =fe 2πi(0)+fe 2πi(h/2+k/2)+fe 2πi(h/2+l/2)+fe 2πi(k/2+l/2) +fe 2πi(h/4+k/4+l/4) +fe 2πi(3h/4+3k/4+l/4) +fe 2πi(3h/4+k/4+3l/4) +fe 2π i(h/4+3k/4+3l/4) 前四项为面心格子的结构因子,用F F 表示,后四项可提出公因子e πi/2(h+k+l) 。得: F hkl =F F +fe πi/2(h+k+l) (1+e πi (h+k) +e πi (h+l) +e πi (k+l) ) = F F +F F e πi/2(h+k+l) =F F (1+ e πi/2(h+k+l) ) (1) 由面心格子可知,h 、k 、l 奇偶混杂时,F F =0,F=0; (2) h 、k 、l 全为奇数,且h+k+l=2n+1时, 1+ e πi/2(h+k+l) =1+cosπ/2(h+k+l)+i sinπ/2(h+k+l)
=1+cosπ/2(2n+1)+i sinπ/2(2n+1) =1+(-1)n i F=4f(1±i) F 2 =16f 2 (1+1)=32f (3) h 、k 、l 全为偶数,且h+k+l=4n 时 F=4f(1+e 2niπ) = 4f(1+1) = 8f (4) h 、k 、l 全为偶数,且h+k+l≠4n,即h+k+l=2(2n+1)时 F=4f(1+e (2n+1)iπ )=4f(1-1)=0 对于金刚石 各原子的分数坐标为 )(,0,00,)(,021,21,),(,21,021, ),,(,2 1210 )(41,41,41,)(41,43,43,)(43,43,41, )(4 3 ,41,43 由结构因子得 ) ()()(0[F l k i l h i k h i hkl e e e e f ++++++=πππ