
Z n
C u ×
课题:第一节 原电池
班级 姓名
【学习目标】 体验化学能与电能相互转化的过程
【学习重点】 初步认识原电池概念、原理、组成及应用。
【学习难点】 通过对原电池实验的研究,从电子转移角度理解化学能向电能转化的本
质,以及这种转化的综合利用价值。
【温习旧知】 1、原电池是______________________的装置。原电池反应的本质是_______________反应。
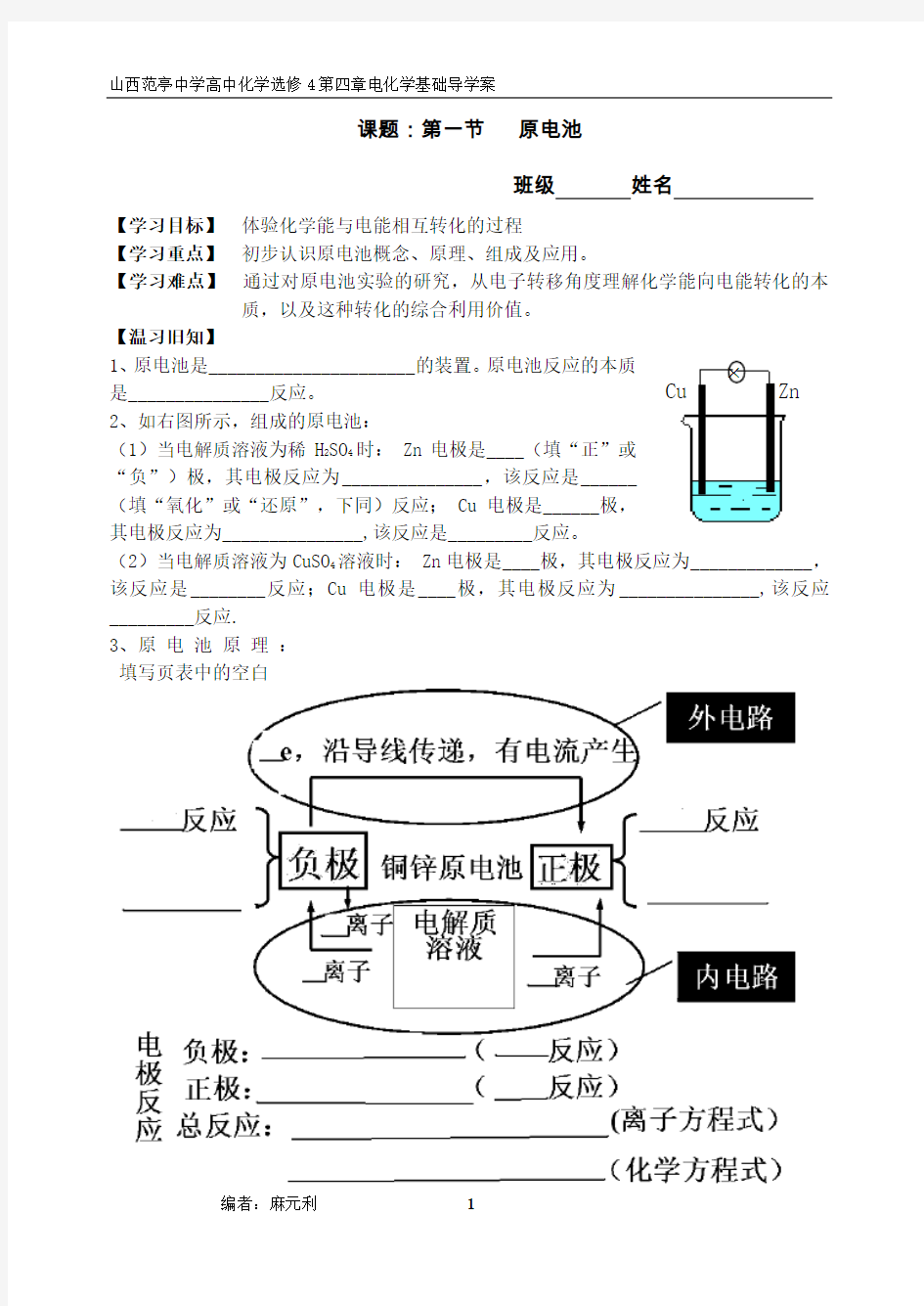
2、如右图所示,组成的原电池:
(1)当电解质溶液为稀H 2SO 4时: Zn 电极是____(填“正”或“负”)极,其电极反应为_______________,该反应是______(填“氧化”或“还原”,下同)反应; Cu 电极是______极,其电极反应为_______________,该反应是_________反应。
(2)当电解质溶液为CuSO 4溶液时: Zn 电极是____极,其电极反应为_____________,该反应是________反应;Cu 电极是____极,其电极反应为_______________,该反应_________反应.
3、原 电 池 原 理 : 填写页表中的空白
【学习新知】
一、对锌铜原电池工作原理的进一步探究
【思考与交流】上图是我们在必修2中学习过的将锌片和铜片置于稀硫酸的原电池,如果用它做电源,不但效率低,而且时间稍长电流就很快减弱,因此不适合实际应用。这是什么原因造成的呢?有没有什么改进措施?
原因:
改进措施:
【自学指导一】观察实验4-1,说出实验现象。
【思考与交流】改进后的装置为什么能够持续、稳定的产生电流?盐桥在此的作用是什么?[附:盐桥制法:1)将热的琼胶溶液倒入U形管中(注意不要产生裂隙),将冷却后的U形管浸泡在KCl或NH4NO3的饱和溶液中即可。2)将KCl或NH4NO3的饱和溶液装入U 形管,用棉花都住管口即可]
产生持续、稳定的电流的原因
盐桥的作用
二、由两个半电池组成原电池的工作原理
(1)把氧化反应和还原反应分开在不同区域进行,再以适当方式连接,可以获得电流。
①在这类电池中,用较强的物质作为负极,负极向外电路提供电子;用较弱的物质作为正极,正极从外电路得到电子。
②在原电池的内部,两极浸在电解质溶液中,并通过阴阳离子的定向运动而形成内电路。(2)组成原电池的条件
a 。
b 。
c 。
d内部条件:。
(3)原电池的正负极的判断方法
微观判断(根据电子流动方向)
宏观判断:
①根据电极材料:
②根据原电池电极发生的反应:
③根据电极增重还是减重:
④根据电极有气泡冒出:
(4)电解质溶液和电极材料的选择
电解质溶液一般要能够与负极发生反应。但若是两个半反应分别在两个烧杯中进行,则左右两个烧杯中的电解质溶液应与电极材料具有相同的阳离子。
①活泼性不同的两种金属。如锌铜原电池,锌作负极,铜作正极
②金属和非金属。如锌锰干电池,锌作负极,石墨棒作正极
③金属和化合物。如铅蓄电池,铅版作负极,PbO2作正极
④惰性电极。如氢氧燃料电池中,两根电极均可用Pt
[学生练习]
1、锌铜原电池产生电流时,阳离子()
A 移向Zn 极,阴离子移向Cu 极
B 移向Cu 极,阴离子移向Zn 极
C 和阴离子都移向Zn极
D 和阴离子都移向Cu 极
2.下列哪几个装置能形成原电池?()
3.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu, 该反应的的原电池正确组合是()
A
B
C
D
正极 Zn Cu Cu Fe
负极 Cu Zn Zn Zn
电解质溶液 CuCl 2
H 2SO 4
CuSO 4
HCl
4、某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg
B.Fe
C.Al
D.Cu
5、由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 pH( )
A.不变 B 先变大后变小 C 逐渐变大 D.逐渐变小
6、把a 、b 、c 、d 四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a 、b 相连时,a 为负极;c 、d 相连时,电流由d 到c ;a 、c 相连时,c 极上产生大量气泡,b 、d 相连时,b 上有大量气泡产生,则四种金属的活动性顺序由强到弱的为 ( )
A .a > b > c > d
B .a > c > d > b
C .c > a > b .> d
D .b > d > c > a
7、如图所示,在铁圈和银圈的焊接处,用一根棉线将其悬在盛水的烧杯中,使之平衡;小心的向烧杯中央滴入CuSO 4溶液,片刻后可观察到的现象是( ) A. 铁圈和银圈左右摇摆不定 B. 保持平衡状态
C. 铁圈向下倾斜,银圈向上倾斜
D. 银圈向下倾斜,铁圈向上倾斜
8、请根据氧化还原反应 :Cu +2 Fe 3+ = Cu 2+
+ 2Fe
2+ 设计成原电池。你有哪些可行方案? 负极: 正极:
电解质溶液:
若是采用烧杯和盐桥装置图,采用的电解质溶液又是什么?试画出原电池的装置简图。
三、原电池的主要应用:
1.利用原电池原理设计新型化学电池;
2.改变化学反应速率,如实验室用粗锌与硫酸反应制取氢气;
3.进行金属活动性强弱比较;
4.电化学保护法,即将金属作为原电池的正极而受到保护。如在铁器表面镀锌。
5.解释某些化学现象
原电池原理应用:
(1)比较金属活动性强弱。
练习9:下列叙述中,可以说明金属甲比乙活泼性强的是
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2气放出;
B.在氧化–还原反应中,甲比乙失去的电子多;
C.将甲乙作电极组成原电池时甲是负极;
D.同价态的阳离子,甲比乙的氧化性强;
(2)比较反应速率
练习10:下列制氢气的反应速率最快的是
A纯锌和1mol/L 硫酸;
B纯锌和18 mol/L 硫酸;
C粗锌和 1mol/L 盐酸;
D粗锌和1mol/L 硫酸的反应中加入几滴CuSO4溶液。
(3)比较金属腐蚀的快慢
练习11:下列各情况,在其中Fe片腐蚀由快到慢的顺序是
练习12:下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是
(4)判断溶液pH值变化
练习13:在Cu-Zn原电池中,200mLH2SO4 溶液的浓度为0.125mol/L , 若工作一段时间
后,从装置中共收集到 0.168L升气体,则流过导线的电子为———— mol,溶液的pH 值变_________?(溶液体积变化忽略不计)
(5)原电池原理的综合应用
练习14:市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等。“热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈存在。
1)“热敷袋”是利用放出热量。
2)炭粉的主要作用是。
3)加入氯化钠的主要作用是。
4)木屑的作用是
【学习反馈或反思】:
第小组,组长
课题:第二节化学电源
班级姓名
[学习目标]了解常见的化学电源的种类及其工作原理,知道它们在生产、生活和国防中的实际应用。
[学习重点、难点]常见化学电源的工作原理
[学习过程]
【自学指导一】阅读教材74-78 页,思考下列问题并把答案填写在下面的知识总结中。[问题]
①目前化学电池主要分为哪几个大类?在性能等方面它们各有什么特点?产生电能
的基本原理是什么?
②化学电池与其他能源相比有哪些优点?
③判断电池的优劣标准主要是什么?
【知识总结】化学电池
1)概念:
2)分类:
3)优点:
4)电池优劣的判断标准:
5)各类电池
【练习】将铂丝插入KOH溶液作电极,然后向两个电极上分别通入甲烷和氧气,可以形成原电池,由于发生的反应类似于甲烷的燃烧,所以称作燃料电池,根据两极上反应的实质判断,通入甲烷的一极为____,这一极的电极反应为_______;通入氧气的一极为______,电极反应为_ ,总反应为__________。
【小结】书写电极反应式应注意以下几点:
1.电极反应是一种离子反应,遵循书写离子反应的所有规则(如“拆”、“平”);2.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;
3.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在);
【学习反馈或反思】:
第小组,组长
课题:第三节电解池第一课时
班级姓名
【学习目标】了解电解池的工作原理,知道电解在氯碱工业、电镀、电冶金方面的应用。【学习重点、难点】电解池的工作原理
【温习旧知】
1、电解质是指在__________ _ __能够导电的化合物。
2、电离是指电解质在_____________或__________状态下离解成____________的过程。
3、原电池是_______ ______的装置。
4、写出下列物质的电离方程式
CuCl2 H2O NaHSO4 CH3COONH4
【学习新知】
一、电解原理
【自学指导一】观察实验4-8,回答实验现象得出实验结论。
实验现象:
实验结论:电解质通电前在水溶液中自由移动的阴、阳离子作______________运动;在外电源的作用下(直流电),改作_________移动而导电。在导电的同时,在阳、阴两极发生氧化—还原反应,即被电解,电离是__________的前题。
【知识总结】
1、电解氯化铜原理
2、电解原理
在外加的作用下,电解质的在阴阳发生的过程,叫电解。明确:(1)电流是发生氧化—还原反应的根源、动力。
⑵阴阳离子在做定向运动导电的同时,也就在两极发生了氧化还原反应,生成
了新物质;而金属导电是由自由电子的定向运动形成,无反应发生,无新物质生成,两者有本质区别。
3、构成电解池的条件:
①直流电源;
4.电解池电极反应规律(阳氧阴还)
(1)阴极:电子,反应
①电极本身不参加反应
②一定是电解质溶液中阳离子“争”得电子
(2)阳极:电子,反应
①若为金属(非惰性)电极,电极失电子
②若为惰性电极,电解质溶液中阴离子“争”失电子
(3)离子放电顺序
阴离子失去电子而阳离子得到电子的过程叫放电。
阳极:
①活性材料作电极时:金属在阳极失电子被氧化成阳离子进人溶液,阴离子不容易在电
极上放电。
②用惰性电极(Pt、Au、石墨、钛等)时:溶液中阴离子的放电顺序(由难到易)是:
Fe、Cu、Ag等,做阴极本身反应,做阳极,本身溶解。
C、Pt、Au等,不论做阴极、阳极,本身都不反应。
活泼电极:
与外电源正极相连的电极,电子,反应。
与外电源负极相连的电极,电子,反应。
定义:把转化为的装置。
组成:两个电极、电解质溶液、直流电源
电
极
极:
极:
电
解
池
惰性电极:
电极
材料
与电源负极相连的电极为极
与电源正极相连的电极为极
②电极
S2->SO32->I->Br ->Cl ->OH ->NO3 ->SO42-(等含氧酸根离子)>F-
阴极:
无论是惰性电极还是活性电极都不参与电极反应,发生反应的是溶液中的阳离子。阳离子在阴极上放电顺序是:
Ag+>Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>(H+)> Al3+>Mg2+>Na+>Ca2+>K+
注:当离子浓度相差较大时,放电顺序要发生变化,相同时按H+,不同时按(H+)【思考与交流】
若以铜为阳极,铁为阴极,电解氯化铜溶液,情况又如何?
【小结】
分析电解反应的一般思路:
根据阳极氧化,阴极还原分析得出产物
5、电极反应式、电解方程式的书写:
写出用石墨做电极电解CuSO4溶液的电极反应式及总的电解方程式,
①、首先分析、比较出阴阳极的放电离子:
CuSO4=作极:H+Cu2+
H2O = 作极:OH-SO42-
②、然后写电极反应式:
阴极:
阳极:
③、最后使得失数相等,两极半反应相加得总方程式;
(电解离子方程式)
(电解化学方程式)
练习:完成下列溶液的电极反应。
(以石墨为电极电解)
硫酸溶液:
盐酸:
NaOH溶液:
CuBr2溶液:
KCl溶液:
CuSO4溶液:
Na2SO4溶液:
【自学指导二】根据上面的分析总结出用惰性电极电解电解质溶液的类型,并填入下表。
电解质溶液用惰性电极电解的示例
【学生反馈与反思】
第小组,组长
课题:第三节电解池第二课时
班级姓名
【学习目标】知道电解在氯碱工业、电镀、电冶金方面的应用
【学习重点、难点】电解池的工作原理的应用
二、电解原理的应用
1.电解食盐水
【思考】
(1)通电前,饱和食盐水中存在哪些离子?这些离子的运动情况怎样?
(2)在电解装置中可否选用铜作阴、阳极的电极材料,为什么?
(3)通电后,溶液中的离子运动发生了什么变化?
(4)通电后,溶液中的在阴、阳放电的是什么离子?
(5)电解后,在阴极区和阳极区分别得到的产物是什么?怎样初步检验两极产物的生成?
【知识总结】电解食盐水
阳极:
阴极:
总式:
电解饱和食盐水可以制造。
2.铜的电解精炼
一般火法冶炼得到的粗铜中含有多种杂质(如锌、铁、镍、银、金等),这种粗铜的导电性远不能满足电气工业的要求,如果用以制电线,就会大大降低电线的导电能力。因此必须利用电解的方法精炼粗铜。
粗铜含杂质( 等)
阳极:Zn
Fe
Ni
Cu
Ag
Au
阴极:
思考:电解完后,CuSO4溶液的浓度有何变化?
3. 电镀
原理:电镀是利用原理在某些金属表面镀
上一薄层其他金属或合金的过程,它是电解原
理的又一重要应用。电镀可以使金属更加美观
耐用,增强防锈抗腐能力。例如,钢铁是人们
最常用的金属,但钢铁有个致命的缺点,就是
它们易被腐蚀。防止钢铁发生腐蚀的一种最常
用方法就是在其表面镀上其他金属,如锌、铜、
铬、镍等。
①电极:
铁片铜片极极
第一节 原电池 一、教材提炼 电化学:研究化学能与电能相互转换的装置、过程和效率的科学。 电化学反应过程(及其装置)可以分为两类(从反应产物和电流的关系): 产生电流的反应(发生在化学电池中,是自发的,向外界输送能量); 借助电流而发生的反应(发生在电解池中,由外界输入的能量推动)。 电化学相关工业:电解、电镀、电冶金、电池制造 氧化还原反应的本质是反应物之间电子的转移,但通常的的氧化还原反应中不能获得电流。(相当于短路,反应时,有热量放出来) 二、考点解读 要点一、原电池 1、概念:将 转化为 的装置叫原电池。(是电的源头) 2 、原电池的构成条件 ① (材料可以是金属或导电的非金属),分别发生氧化和还原反应。 负极:活泼性 ,失去电子发生 反应。(负阳氧失) 正极:活泼性 ,溶液中阳离子得到电子发生还原反应。(正阴还得) ② ,电解质中阴离子(带负电)向负极方向移动,阳离子(带正电)向正极方向移动,阴阳离子定向移动形成内电路。(正正负负) ③导线将两电极连接, 。 ④有能 反应。 要点诠释:a .原电池中,电极材料可能与电解质反应,也可能与电解质不反应。如图: b .形成闭合回路的方式有多种,可以是用导线连接两个电极,也可以是两电极直接接触。如图: ZnSO 4 CuSO 4 Z n Cu C CH 3CH 2OH CuSO 4 Zn CuSO 4
要点二、原电池工作原理的实验探究 1、实验设计 ①按照图示装置进行实验。请观察两个金属片插入溶液后电流表指针位置的变化、金属电极表面的变化以及溶液温度的变化,分析是否有电流产生。 极Zn片: 极Cu片: 同时在Zn片上,Zn可直接与CuSO4溶液反应,生成Cu与ZnSO4,因此该 装置中既有化学能转化为电能,同时也有化学能转化为热能。 指针发生,但是 标注出电子流向 ②按照下图组装实验装置,注意最后将盐桥插入两种电解质溶液中。请观察反应过程中电流表指针位置的 变化,判断是否有电流产生,并观察电极表面以及溶液温度的变化情况。 锌片:极,( 反应) 铜片:极,( 反应) 总化学方程式: 指针发生,且 标注出电子流向 要点诠释:盐桥的作用及优点 a.组成:将热的饱和KCl或NH4NO3琼胶溶液倒入U形管中(不能产生裂隙),即可得到盐桥。将冷却 后的U形管浸泡在KCl饱和溶液或NH4NO3饱和溶液中备用。 b.作用:使两个半电池中的溶液连成一个路。 c.优点:使原电池中的氧化剂和还原剂近乎完全隔离,并在不同区域之间实现了电子的定向移动, 使原电池能、地产生电流。 电流产生情况电极表面变化情况温度变化情况能量变化情况(Ⅰ) 有电流产生,指针偏 转,但不稳定 锌片质量,铜片上有色 物质析出,铜片质量 溶液温度化学能转化为能、 能(Ⅱ) 有电流产生,指针较 稳定偏转, 锌片质量,铜片上有色 物质析出,铜片质量 溶液温度化学能转化为能1mol/L的CuSO4溶液 Cu Zn 1mol/L ZnSO4 1mol/L CuSO4 Z n Cu
3.6乘法估算导学案
第六课时 乘法估算 姓名:_________ 1、 学习课本60页例5,用红笔勾画出疑惑点;独立思考完成自主学习和合作探究任务,并总结规律方法。 怎样学习 1、通过学习我要掌握乘法估算的基本方法,会进行乘法估算。 2、我要养成认真审题的良好学习习惯,应用所学知识灵活解决实际问题的能力。 一、知识链接: 1、《新编小学生字典》有592页,大约是( )页。 2、小明每分钟打字108个,大约是( )个。 3、本校有688人,大约是( )人。 4、李平大叔今年收橘子1328千克,大约是( )千克。 二、自主学习 认真自学课本60页例2,我一定能完成自学任务! 四年级同学去旅游。每套车票和门票49元,一共需要104套票。应该准备多少钱买票? 列式:49×104≈ (元) 第一种方法: 49≈_____ 104≈_____ , 50×100=5000 应该准备5000元。 第二种方法: 49≈______ 104≈_______, 50×110=5500 应该准备5500元。 你认为第 种方法好一些。 因为 . 体验学习 学习什么 我能边读边做好笔
我要提醒大家在进行估算时应该考虑实际情况。一般在算有关钱的问题是都要估算的()一些。 三、合作探究、归纳展示估算乘法的方法: 1、要接近____________(符合实际); 2、要计算方便(将两个因数看成______、______或________的数)。 四、当堂检测 1、估算:223×18≈ (1)把223看作,把18看作,× = 所以 223×18 ≈ (2)把223看作,把18看作,× = 所以223×18≈ (3)把223看作,把18看作,× = 所以223×18≈ 2、估算:340×12≈(包) (1)把340看作,把12看作,×=所以 340×12≈(包) (2)把340看作,把12看作,×=所以340×12≈(包) (3)把340看作,把12看作,×=所以 340×12≈(包) 3、选择正确答案填空: (估小了估大了) 两个因数都变大,就把原来的结果() 两个因数都变小,就把原来的结果() 一个因数变小,另一个因数不变,就把原来的结果() 一个因数变大,另一个因数不变,就把原来的结果() 4、电影院有1000个座位,学校有19个班,平均每班61人,这些同学如果都去看电影,电影院能坐下吗?为什么?
第四章电化学基础 第一节原电池 教学目标:知识与技能: 1、了解原电池原理; 2、掌握原电池正、负极的判断及构成原电池的条件; 3、理解铜锌原电池的原理与结构,初步学会制作水果电池。 过程与方法: 1、培养学生的探究精神和依据实验事实得出结论的科学方法; 2、培养学生的观察能力; 3、培养学生的实验设计能力。 教学重点:原电池原理 教学难点:原电池设计 基础知识预备: 1、原电池是将转化为的装置。其本质是原理的应用。 2、判断下列装置为原电池的是: 镁铜 稀H2SO4 稀H2SO4 稀H2SO4 稀H2SO4 稀H2SO4 稀H2SO4 NaOH溶液 E F G 小结:构成原电池的4个条件是: ⑴________________________________________________________________________ ⑵ ________________________________________________________________________ ⑶ _______________________________________________________________________ ⑷___________________________________________________________________________ 3、写出上图中原电池的电极反应式和总反应式: ______________________________________________________________________ ______________________________________________________________________ 〈〉 找规律,小结:①负极产生阳离子或消耗阴离子, 正极〈〉产生阴离子或消耗阳离子 ②注意溶液的酸碱性,适当在电极反应式两边添加___________、________、或 ___________,以遵循电荷守恒和质量守恒。 [自主学习]:一、盐桥在原电池工作中的应用
专题七电化学 【考纲要求】 1.了解原电池的工作原理,能写出电极反应和电池反应方程式。 2.了解常见的化学电源的种类及其工作原理。 3.了解电解池的工作原理,能写出电极反应和电池反应方程式。 4.理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。 【主干知识梳理】 考点一原电池 1.概念:把转化为的装置。 2.工作原理:(以铜—锌原电池为例) (1)两个____________的电极。 (2)将电极插入______________中。 (3)用导线连接电极构成____________。 (4)能自发进行的____________________。考点二常见的化学电源 1.一次电池(以碱性锌锰电池为例) 总反应为Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。 负极:________________________________________
正极:2MnO2+2H2O+2e-===2MnOOH+2OH- 2.二次电池 铅蓄电池是最常见的二次电池,总反应为 Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l) 负极:__________________________________________ 正极:__________________________________________ 阳极:__________________________________________ 3.燃料电池 (1)氢氧燃料电池是目前最成熟的燃料电池,可分酸性和碱性两种。 (2)CH442232 负极:__________________________________________ 正极:__________________________________________ 考点三:电解原理 1.电解、电解池 (1)电解:使________通过电解质溶液(或熔融的电解质)而在__________引起 ____________________的过程。 (2)电解池(也叫电解槽):把____能转化为________能的装置。 (3)电极名称与电极反应: 与电源正极相连的为________,发生_____反应;与电源负极相连的为_______,发生______反应。2.电解池的组成和工作原理(电解CuCl2溶液)
2017/2 化学能转化为电能 【学考要求】 1、通过实验探究认识化学能可以转化为电能; 2、从电子转移的角度理解化学能向电能转化的本质及原电池的构成条件; 3、会书写简单的原电池的电极反应式及电池总反应方程式(离子方程式)。 【典型例题】 1.(2015年10月浙江,T16)如图所示进行实验,下列说法不正确的是 A .装置甲的锌片上和装置乙的铜片上均可观察到有气泡产生 B .甲、乙装置中的能量变化均为化学能转化为电能 C .装置乙中的锌、铜之间用导线连接电流计,可观察到电流计 指针发生偏转 D .装置乙中负极的电极反应式:Zn -2eˉ=Zn 2+ 2.现有如下两个反应:(A)Na 2CO 3+2HCl===2NaCl +CO 2+H 2O (B)Zn +CuSO 4===ZnSO 4+Cu (1)根据两反应本质,判断能否设计成原电池_____________________________________。 (2)如果不能,说明其原因 。 (3)如果可以,则写出正、负极材料及其电极反应式、电解质溶液名称: 负极:______,___________________;正极:______,___________________。电解质溶液:__________。 【限时训练】 1.(2015年4月浙江,T12)右图是铜锌原电池示意图。当该原电池工作时, 下列描述不正确... 的是 A .溶液逐渐变蓝 B .锌片逐渐溶解 C .铜片上有气泡产生 D .电流计指针发生偏转 2. 某实验兴趣小组用如图所示装置做完实验后,在读书卡片上记下 了如下6条记录,其中正确的是 A .①②③ B .③④⑤ C .④⑤⑥ D .②③④ 3.(2016年4月浙江,T17)Mg-H 2O 2电池是一种化学电源,以Mg 和石墨为电极,海水为电解质溶液,示意图如下。下列说法不正确的是 A .石墨电极是该电池的正极 B .石墨电极上发生还原反应 C .Mg 电极的电极反应式:Mg-2e -=Mg 2+ D .电池工作时,电子从Mg 电极经导线流向石墨电极,再出石墨电 极经电解质溶液流向Mg 电极 G Cu Zn 稀硫酸
精品文档 精品文档清平乐·村居① 【宋】辛弃疾 茅檐②低小,溪上青青草。醉里吴音③相媚好④,白发谁家翁媪⑤? 大儿锄豆⑥溪东,中儿正织⑦鸡笼。最喜小儿⑧亡赖,溪头卧⑨剥莲蓬。 注释:①清平乐村居:清平乐,词牌名。村居,这首词的题目,意为乡村生活。“乐”在此处读yuè。 ②茅檐:茅屋,茅屋的屋檐。 ③吴音:作者当时住在江西东部的上饶,这一带古时是吴国的领土,所以称这一带的方言为 吴音,也被成为吴侬软语。 ④相媚好:这里指互相逗趣,取乐。互相夸赞对方 ⑤翁(wēng)媪(ǎo):老年夫妇,老翁老妇。 ⑥锄豆:锄掉豆田里的草。 ⑦织:编织,文中指编织鸡笼。 ⑧亡赖:这里指顽皮、淘气。“亡”在此与“无”同音。应读作“wú” ⑨卧:趴、躺。 作品译文:一所低小的茅草房屋,紧靠着一条流水淙淙,清澈照人的小溪。溪边长满了碧绿的小 草。一对满头白发的老夫妻,刚刚饮罢酒,带着醉意,亲热地在一起悠闲自得地聊天。大儿子在溪东豆地锄草,二儿子在家门口编织鸡笼。最有趣的是三儿子,他是那么调皮地玩耍,俯卧在溪边剥莲蓬吃。 创作背景:辛弃疾出生于被金人侵占的北方,亲眼目睹了汉人家破人亡、妻离子散。他十分渴望百姓能过上安居乐业的生活,一直为抗金而不懈努力,但却屡遭奸臣排挤与打击,被贬到远离战火的江西农村,一住就是18之久。这首词就是辛弃疾描写农村田园生活的词中最为人称道的一首。描绘了一个农村家庭普通而又富有情趣的生活场景,天伦之乐,其乐融融,具有浓郁的农村生活气息,表达出诗人对美好生活的渴望与向往。 一、思考:读着这首词,你的眼前看见了一副怎样的画面? 二、1、小练笔:读着“醉里吴音相媚好”我仿佛听到了翁夸媪(或者媪对翁说): “。” 2、请同学们自由选择扮演翁或者媪,来选择三个儿子中的一个来夸一夸 “”
第六章第2讲电化学基础 【复习重点】 1.掌握原电池和电解池的工作原理,能写出电极反应和电池反应方程式。 2.了解常见化学电源的种类及其工作原理。 3.理解金属发生电化学腐蚀的原因,掌握一般防护方法,能区别化学腐蚀与电化学腐蚀。4.掌握铜的电解精炼、电镀铜、氯碱工业等反应原理。 【知识梳理】 一、原电池 1.定义:___________________________________________________。 2.组成原电池的条件:_________________;______________;___________________。 3.原电池的工作原理: (1)以Zn---Cu(H2SO4)设计的不带盐桥的原电池 负极:作负极,负极发生反应 电极反应式: 正极:作正极,正极发生反应 电极反应式: 总反应式: 电子流向:外电路中电子由到 溶液中离子移动方向: (2)依据氧化还原反应:2Ag+(aq) +Cu(s)=Cu2+(aq) +2Ag(s)设计的带盐桥的原电池 负极:作负极,负极发生 电极反应式: 正极电解质溶液为:,正极发生 电极反应式: 电子流向:外电路中电子由到 盐桥中离子移动方向: 4.原电池正负极判断方法; (1) 根据电极材料判断: (2)根据电子的流向判断: (3)根据发生的反应类型判断: (4)根据反应现象判断:
(5)根据给出的方程式判断: (6) 根据溶液中阴、阳离子的定向移动判断: 5.电极反应式的书写: (1)先确定原电池的正负极,列出正负极上的反应物质,并标出相同数目电子的得失。(2)注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存。若不共存,则该电解质溶液中的阴离子应写入负极反应式。 (3)若正极上的反应物质是O2,且电解质溶液为中性或碱性,电极反应式中不能出现H+,且水必须写入正极反应式中,与O2结合生成OH-,若电解质溶液为酸性,电极反应式中不能出现OH-,且H+必须写入正极反应式中,与O2结合生成水。 (4)正负极反应式相加(电子守恒)得到电池反应的总反应式。若已知电池反应的总反应式,可先写出较易书写的电极反应式,然后在电子守恒的基础上,总反应式减去较易写出的电极反应式,即得到较难写出的电极反应式 (5)对于可逆电池反应,需要看清楚―充电、放电‖的方向,放电过程是体现原电池原理, 充电过程是体现电解池原理。 【练习】 1)如下图所示,用Mg和Al组成一个原电池. (1)当电解质溶液为稀硫酸时: ① Mg电极是____极,其电极反应式为,该反应是_____反应; ②Al电极是____极,其电极反应式为,该反应是_____反应. (2)当电解质溶液为NaOH溶液时: ①Mg电极是_____极,其电极反应式为,该反应是_____反应. ②Al电极是_____极,其电极反应式为,该反应是_____反应. 2)氢氧燃料电池一般是以惰性金属铂(Pt)或石墨做电极材料,负极通入H2,正极通入O2,总反应为:2H2 + O2 === 2H2O (1)电解质是KOH溶液(碱性电解质) 负极:正极: (2)电解质是H2SO4溶液(酸性电解质) 负极:正极:
导学案教学基本步骤 一、自主学习阶段 1.安排学生按照导学案要求进行课前自主学习(有困难的可将自主学习安排在课堂),作业用铅笔完成。教师下组指导。 2.利用课余时间,对学科组长进行导学案学习内容的培训,重在思路讲解,不直接给答案(这是导学案教学成功的关键环节)。 3.合作交流课前,检查批改学科组长的导学案作业(如果学科组长没完成作业,意味着上一阶段的培训没有消化,势必影响下阶段自己对组长的培训)。 二、合作交流阶段 由学科组长对组员进行导学案学习内容的培训,并开展合作交流活动。《小组之成员导学案学习活动评价量表》从第一堂课开始,由学科组长公开随堂使用;《班级之小组导学案学习活动评价量表》从第一堂课开始,由科代表公开随堂使用(若前有自主学习课,都移前课开始使用)。教师下组指导。 三、展示讨论阶段 1.科代表针对导学案的学习内容安排各组展示内容和顺序,展示讨论课即将开始前才告知各组(防止有的小组不重视非自己展示的学习内容)。 2.展示讨论课由学生主持。教师观察把控课堂,以备作课堂总结。 3.展示讨论课毕,收集各小组对本课存在的其他问题(记录到小组“积极质疑”的分数中去),准备个别或全班解答。 4.授课完毕,可将导学案重要题目的答案发送各组,以便学生修正。学生用黑色或蓝色水笔修正和完成导学案所有作业。 5.学科组长检查组员的导学案全部作业(包括拓展提升作业和自主反思)。若没有问题,每道题都用红笔打勾;若有错,退回修正,再打勾。 四、达标测评阶段 完成本课“达标测评”后,学科组长将组员成绩记录在其导学案讲义的相应处。 五、结题阶段 1.学科组长完成本组的《小组之成员导学案学习活动评价量表》,公示后,将此表与本组导学案讲义一起提交科代表。 2.科代表完成《班级之小组导学案学习活动评价量表》,公示后,将此表与各组评价表及本班导学案讲义一起提交学科教师。 3.学科教师检查学生提交的导学案讲义和评价表,完成导学案讲义中的“自主反思”。
Zn Cu × 专题二电化学基础强化 第一节原电池 一、学习目标体验化学能与电能相互转化的过程 二、学习重点初步认识原电池概念、原理、组成及应用。 三、学习难点 通过对原电池实验的研究,从电子转移角度理解化学能向电能转化的本质,以及这种转化的综合利用价值。 四、学习过程【温习旧知】 1、原电池是______________________的装置。原电池反应的本质是_______________ 反应。 2、如右图所示,组成的原电池: (1)当电解质溶液为稀H2S O4时:Z n电极是____(填“正”或“负”)极,其电极 反应为_______________,该反应是______(填“氧化”或“还原”,下同)反应;C u 电极是______极,其电极反应为_______________,该反应是_________反应。 (2)当电解质溶液为C u S O4溶液时:Z n电极是____极,其电极反应为_____________, 该反应是________反应;C u电极是____极,其电极反应为_______________,该反应_________反应. 3、原电池原理: 填写页表中的空白 【学习新知】 一、对锌铜原电池工作原理的进一步探究 【思考与交流】上图是我们在必修2中学习过的将锌片和铜片置于稀硫酸的原电池,如果用它做电源,不但效率低,而且时间稍长电流就很快减弱,因此不适合实际应用。这是什么原因造成的呢?有没有什么改进措施?原因: 改进措施: 【自学指导一】观察实验4-1,说出实验现象。 【思考与交流】改进后的装置为什么能够持续、稳定的产生电流?盐桥在此的作用是什么?[附:盐桥制法:1)将热的琼胶溶液倒入U形管中(注意不要产生裂隙),将冷却后的U形管浸泡在K C l或N H4N O3的饱和溶液中即可。2)将K C l或N H4N O3的饱和溶液装入U形管,用棉花都住管口即可] 产生持续、稳定的电流的原因
高中化学电化学基础化学电源学案新人教版选 修 Coca-cola standardization office【ZZ5AB-ZZSYT-ZZ2C-ZZ682T-ZZT18】
第二节 化学电源 [目标要求] 1.了解依据原电池原理开发的技术产品——化学电池。2.了解一次电池、二次电池、燃料电池的基本构造、工作原理、性能和适用范围。3.正确书写原电池的电极反应式和电池反应方程式。 一、化学电池 化学电池是利用原电池原理,将化学能转化为电能的装置。 二、常用电池 碱性锌锰电池锌银电池 电池结构 负极:Zn 正极:MnO2 电解质溶液:KOH溶液 负极:Zn 正极:Ag2O 电解质溶液:KOH溶液 电极反应 正极 2MnO2+2e-+2H2O===2MnOOH+2OH - Ag2O+2e-+H2O===2Ag+2OH-负极Zn-2e-+2OH-===Zn(OH)2Zn+2OH--2e-===Zn(OH)2 总反应式 Zn+2MnO2+2H2O===2MnOOH+ Zn(OH)2 Zn+Ag2O+H2O===Zn(OH)2+2Ag 铅蓄电池氢氧燃料电池 电池结构 负极:Pb 正极:PbO2 电解质溶液:H2SO4溶液 负极:H2 正极:O2 电解质:酸性电解质 电极反应 正极 PbO2(s)+SO2-4(aq)+4H+(aq)+ 2e-===PbSO4(s)+2H2O(l) O2+4H++4e-===2H2O 负极 Pb(s)+SO2-4(aq)-2e- ===PbSO4(s) 2H2-4e-===4H+ 总反应式 Pb(s)+PbO2(s)+ 2H2SO4(aq)===2PbSO4(s)+2H2O(l) 2H2+O2===2H2O 知识点一化学电池 1.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。碱性锌锰电池以氢氧化钾溶液为电解液,电池总反应式为Zn+MnO2+H2O===ZnO+Mn(OH)2 下列说法中,错误的是( ) A.电池工作时,锌失去电子 B.电池正极的电极反应式为 MnO2+2H2O+2e-===Mn(OH)2+2OH- C.电池工作时,电子由正极通过外电路流向负极 D.外电路中每通过 mol电子,锌的质量理论上减少 g 答案 C 解析本题要求利用原电池的原理,分析碱性锌锰电池:锌为负极,在反应中失去电子,故A正确;电池工作时,电流由正极通过外电路流向负极,而电子定向移动方向与电流方向相反,故C错误;由电子守恒知D项正确;由该电池反应的总反应式和原电池的原理写
汾阳二中高三一轮复习化学导学练 专题:电化学命题人:高春建审核人:高三化学组 一、高考基本要求 1.理解原电池和电解池的工作原理,能写出常见的简单电极反应和电池反应方程式。 2.解常见的化学电源,认识化学能与电能相互转化的实际意义及其重要应用。 3.认识金属腐蚀的危害,理解金属发生电化学腐蚀的原因,能运用恰当的措施防止铁、铝 等金属腐蚀。 4.了解提高燃料的燃烧效率、开发高能清洁燃料和研制新型化学电源的重要性。认识化学 在解决能源危机中的重要作用。 二、知识点梳理 原电池电解池电镀池 定义将化学能转变成电能的装 置 将电能转变成化学能的装 置 应用电解原理在某些金 属表面镀上一层其它金 属的装置。一种特殊的电 解池 装置举例 形成条件①活动性不同的两电极(连 接) ②电解质溶液(电极插入其 中并与电极自发反应) ③形成闭合回路 ①两电极接直流电源 ②两电极插人电解质溶液 ③形成闭合回路 ①镀层金属接电源正极, 待镀金属接电源负极 ②电镀液必须含有镀层 金属的离子 电极名称负极:较活泼金属; 正极:较不活泼金属(或能 导电的非金属等) 阳极:电源正极相连的电 极 阴极:电源负极相连的电 极 阳极:镀层金属; 阴极:镀件 电子 流向负极正极 电源负极阴极 电源正极阳极 电源负极阴极 电源正极阳极 电极反应负极(氧化反应):金属原 子失电子; 正极(还原反应):溶液中 的阳离子得电子 阳极(氧化反应):溶液中 的阴离子失电子,或金属 电极本身失电子; 阴极(还原反应):溶液中 的阳离子得电子 阳极(氧化反应):金属 电极失电子; 阴极(还原反应):电镀 液中阳离子得电子
离 子 流 向 阳离子:负极→正极(溶液 中) 阴离子:负极←正极(溶液 中) 阳离子→阴极(溶液中) 阴离子→阳极(溶液中) 阳离子→阴极(溶液中) 阴离子→阳极(溶液中) (1)判断装置的名称:A池为________,B池为________。 (2)锌极为____极,Cu2+在溶液中向________(填“Zn”或“Cu”)极运动。 (3)电极反应式 正极________________________________________________________________________,负极________________________________________________________________________。 (4)若溶液X为滴有酚酞的KCl溶液 ①石墨棒C1的电极反应式为______________________,石墨棒C2附近发生的实验现象为__________________________,溶液中的K+向__________(填“C1”或“C2”)电极移动; ②当C2极析出224 mL 气体(标准状况时),锌的质量变化________(填“增加”或“减少”)________g,此时B中的溶液的体积为200 mL,则pH为________。 (5)若溶液X为CuSO4溶液(足量) ①B池中总反应的离子方程式为______________________________________________; ②反应一段时间后,A池中Cu电极增重3.2 g,要使B池溶液恢复到起始状态,向溶液中加入适量的________,其质量为________g。 要点二原电池、电解池工作原理及其应用 1、原电池、电解池的判定 先分析有无外接电源:有外接电源者为,无外接电源者可能为;然后依据原电池、电解池的形成条件、工作原理分析判定。 2、原电池正、负极的判定 ①、由两极的相对活泼性确定:在原电池中,相对活泼性较强的金属为原电池的极, 相对活泼性 较差的金属或导电的非金属作原电池的极。 ②、由电子流向、反应类型、电极现象确定:通常情况下,在原电池中某一电极若不断溶 解或质量不 断减少,该电极发生氧化反应,此为原电池的极;若原电池中某一电极上有气体生成、电 极的质量不断增加或电极质量不变,该电极发生还原反应,此为原电池的极。练习2、某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他均为Cu,则()
培优数学教材三年级全册已整理 目录 第一讲找规律填数(一) ...................................................................................................................................... - 3 - 第二讲找规律填数(二) ...................................................................................................................................... - 5 - 第三讲找规律填数(三) ...................................................................................................................................... - 8 - 第四讲从数表中找规律........................................................... - 10 -第五讲数线段................................................................... - 13 -第六讲数三角形................................................................. - 15 -第七讲数长方形和正方形......................................................... - 18 -第八讲加法的渐变运算----凑整................................................... - 21 -第九讲减法简便运算-----凑整.................................................... - 23 -第十二讲添加运算符号(二)..................................................... - 29 -第十三讲横式算式谜(一)....................................................... - 31 -第十四讲横式算式谜(二)....................................................... - 33 -第十五讲竖式加减算式谜......................................................... - 35 -第十六讲竖式乘除算式谜......................................................... - 38 -第十七讲文字算式谜............................................................. - 41 -第十八讲填数阵图(一)......................................................... - 44 -第十九讲填数阵图(二)......................................................... - 47 -第二十讲不封闭路线上植树....................................................... - 50 -第二十一讲封闭路线上植树....................................................... - 53 -第二十二讲与植树相关的问题(一)................................................. - 56 -第二十三讲数三角形............................................................. - 59 -第二十四讲等量代换............................................................. - 62 -第二十五讲用等量代换解应用题................................................... - 64 -第二十六讲等差数列............................................................. - 67 -第二十七讲配对求和............................................................. - 70 -第二十九讲乘法的速算与巧算..................................................... - 74 -第三十讲除法中的巧算........................................................... - 76 -第三十一讲乘除法的简便运算..................................................... - 79 -第三十二讲数的整除............................................................. - 82 -第三十三讲有余数的除法......................................................... - 85 -第三十四讲周期问题............................................................. - 87 -第三十五讲个位数字是几......................................................... - 90 -第三十六讲时间与日期........................................................... - 92 -第三十七讲试商技巧............................................................. - 95 -第三十八讲包含与排除........................................................... - 98 -第三十九讲盈亏问题............................................................ - 101 -第四十讲鸡兔同笼.............................................................. - 104 -第四十一讲平均数(一)........................................................ - 107 -第四十二讲平均数(二)........................................................ - 110 -第四十三讲和倍问题(一)...................................................... - 113 -第四十四讲和倍问题(二)...................................................... - 115 -
第六章 第2讲 电化学基础 【复习重点】 1.掌握原电池和电解池的工作原理,能写出电极反应和电池反应方程式。 2.了解常见化学电源的种类及其工作原理。 3.理解金属发生电化学腐蚀的原因,掌握一般防护方法,能区别化学腐蚀与电化学腐蚀。 4.掌握铜的电解精炼、电镀铜、氯碱工业等反应原理。 【知识梳理】 一、原电池 1.定义:___________________________________________________。 2.组成原电池的条件:_________________;______________;___________________。 3.原电池的工作原理: (1)以Zn---Cu (H 2SO 4)设计的不带盐桥的原电池 负极: 作负极,负极发生 反应 电极反应式: 正极: 作正极,正极发生 反应 电极反应式: 总反应式: 电子流向:外电路中电子由 到 溶液中离子移动方向: (2)依据氧化还原反应:2Ag +(aq) +Cu(s)=Cu 2+ (aq) +2Ag(s)设计的带盐桥的原电池 负极: 作负极,负极发生 电极反应式: 正极电解质溶液为: ,正极发生 电极反应式: 电子流向:外电路中电子由 到 盐桥中离子移动方向: 学案 班级: 姓名: 组题人: 刘红林 审核人:
4.原电池正负极判断方法; (1) 根据电极材料判断: (2)根据电子的流向判断: (3)根据发生的反应类型判断: (4)根据反应现象判断: (5)根据给出的方程式判断: (6) 根据溶液中阴、阳离子的定向移动判断: 5.电极反应式的书写: (1)先确定原电池的正负极,列出正负极上的反应物质,并标出相同数目电子的得失。(2)注意负极反应生成的阳离子与电解质溶液中的阴离子是否共存。若不共存,则该电解质溶液中的阴离子应写入负极反应式。 (3)若正极上的反应物质是O2,且电解质溶液为中性或碱性,电极反应式中不能出现H+,且水必须写入正极反应式中,与O2结合生成OH-,若电解质溶液为酸性,电极反应式中不能出现OH-,且H+必须写入正极反应式中,与O2结合生成水。 (4)正负极反应式相加(电子守恒)得到电池反应的总反应式。若已知电池反应的总反应式,可先写出较易书写的电极反应式,然后在电子守恒的基础上,总反应式减去较易写出的电极反应式,即得到较难写出的电极反应式 (5)对于可逆电池反应,需要看清楚“充电、放电”的方向,放电过程是体现原电池原理,充电过程是体现电解池原理。 【练习】 1)如下图所示,用Mg和Al组成一个原电池. (1)当电解质溶液为稀硫酸时: Mg电极是____极,其电极反应式为,该反应是_____反应; ② Al电极是____极,其电极反应式为,该反应是_____反应. (2)当电解质溶液为NaOH溶液时: ①Mg电极是_____极,其电极反应式为,该反应是_____反应.
第1课时:5.1.1 相交线导学案 【学习目标】1、了解邻补角、对顶角, 能找出图形中的一个角的邻补角和对顶角 2、理解对顶角相等,并能运用它解决一些问题. 【学习重点】邻补角、对顶角的概念,对顶角性质与应用. 【学习难点】理解对顶角相等的性质. 【学习过程】 一、温故知新(5分钟) 各小组对七年级上学过的直线、射线、线段、角做总结.每人写一个总结小报告,并编写两道与它们相关的题目,在小组交流,并推出小组最好的两道题在班级汇报. 二、自主探索(15分钟) 探索一:完成课本P2页的探究,填在课本上. 你能归纳出“邻补角”的定义吗?. “对顶角”的定义呢?. 自学检测一: 1.如图1所示,直线AB和CD相交于点O,OE是一条射线. (1)写出∠AOC的邻补角:____ _ ___ __; (2)写出∠COE的邻补角: __; (3)写出∠BOC的邻补角:____ _ ___ __; (4)写出∠BOD的对顶角:____ _. 2.如图所示,∠1与∠2是对顶角的是() 探索二:任意画一对对顶角,量一量,算一算,它们相等吗?如果相等,请说明理由. 请归纳“对顶角的性质”:. 自学检测二: 1.如图,直线a,b相交,∠1=40°,则∠2=_______∠3=_______∠4=_______ 2.如图直线AB、CD、EF相交于点O,∠BOE的对顶角是______,∠COF 的邻补角是____,若∠AOE=30°,那么∠BOE=_______,∠BOF=_______ 3.如图,直线AB、CD相交于点O,∠COE=90°,∠AOC=30°,∠FOB=90°, 则∠EOF=_____. 三、当堂反馈(25分钟) 图1 b a 4 3 2 1 第1题F E O D C B A 第2题F E O D C B A 第3题
4-1 原电池 【学习目标】 1.以铜锌原电池为例,熟悉原电池的工作原理 2.会正确判断原电池的正极和负极 3.学会原电池电极反应式的书写方法 【学习重难点】 学习重点:原电池的工作原理及电极反应式的书写。 学习难点:原电池的工作原理及电极反应式的书写。 【自主预习】 一.1.氧化还原反应的本质是 2.原电池是将转化为的装置。其本质是原理的应用。二.原电池工作原理: 1.知识回顾—以Cu-Zn-硫酸铜原电池为例,如右图 锌片:极,_________ 电子,发生________ 反应。 铜片:极,_________ 电子,发生________ 反应。 外电路:电子从极流入极 内电路:________向负极移动,______ 向正极移动 思考:如果用以上装置作电源,能持续稳定地产生电流吗?怎样进行改进? 2.探究活动—有盐桥的原电池的工作原理:阅读课本P71页有关【实验4-1】的论述,结合 图4-1,和上述“题1”的Cu-Zn原电池装置对照,实验装置有何变化 _____________________ 根据实验,填写下表: 电极Zn电极Cu电极 现象 得失电子 电极名称 电子流向 反应类型 电极反应式
总反应式 【思考】原电池的工作原理是怎样的?(教材P72) 【结论】把氧化反应和还原反应分开在不同的区域进行,再以适当的方式连接起来,就可以获得电流 三.原电池的形成条件: (1)两个活泼性不同的电极.相对活泼的金属作,较不活泼的金属或能导电的非金属作;(2)有溶液; (3)形成回路; (4)能自发地发生反应。 四.原电池的设计方法—构成原电池的基本条件,是进行原电池设计的基本依据。 1、根据电池反应写出电极反应式,以2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s)为例。把以上反 应分解为氧化反应和还原反应两个半反应,从而确定电极反应。 氧化反应(负极):; 还原反应(正极):。 2.电极材料的选择:电池的电极必须导电。一般电池的负极必须能够与电解质溶液反应,容易失去电子,往往以负极反应为依据确定电极材料,这里选用为负极。正极与负极之间只有产生电势差,电子才能定向移动,所以正极和负极一般不用同一种材料,且正极材料的活动性比Ag弱,多采用惰性电极C。本例也可用等金属3.电解质溶液的选择。电解质溶液一般要能够与负极发生反应。本例电解质溶液要含有,可以为溶液。 但若是两个半反应分别在两个烧杯中进行,则左右两个烧杯中的电解质溶液应与电极材料具有相同的,如下图,图中的X是,Y是