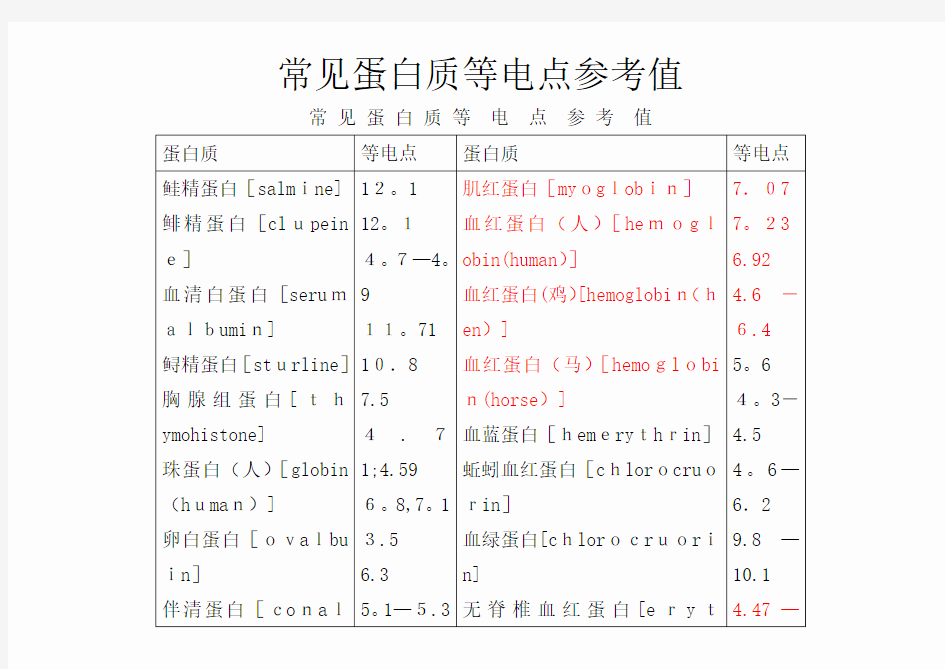
常见蛋白质等电点参考值
常见蛋白质等电点参考值
蛋白质等电点蛋白质等电点
鲑精蛋白[salmine]鲱精蛋白[clupein e]
血清白蛋白[serumalbumin]
鲟精蛋白[sturline]胸腺组蛋白[thymohistone]
珠蛋白(人)[globin (human)]
卵白蛋白[ovalbu in]
伴清蛋白[conal12。1
12。1
4。7—4。
9
11。71
10.8
7.5
4.7
1;4.59
6。8,7。1
3.5
6.3
5。1—5.3
肌红蛋白[myoglobin]
血红蛋白(人)[hemogl
obin(human)]
血红蛋白(鸡)[hemoglobin(h
en)]
血红蛋白(马)[hemoglobi
n(horse)]
血蓝蛋白[hemerythrin]
蚯蚓血红蛋白[chlorocruo
rin]
血绿蛋白[chlorocruori
n]
无脊椎血红蛋白[eryt
7.07
7。23
6.92
4.6-
6.4
5。6
4。3-
4.5
4。6—
6.2
9.8—
10.1
4.47—
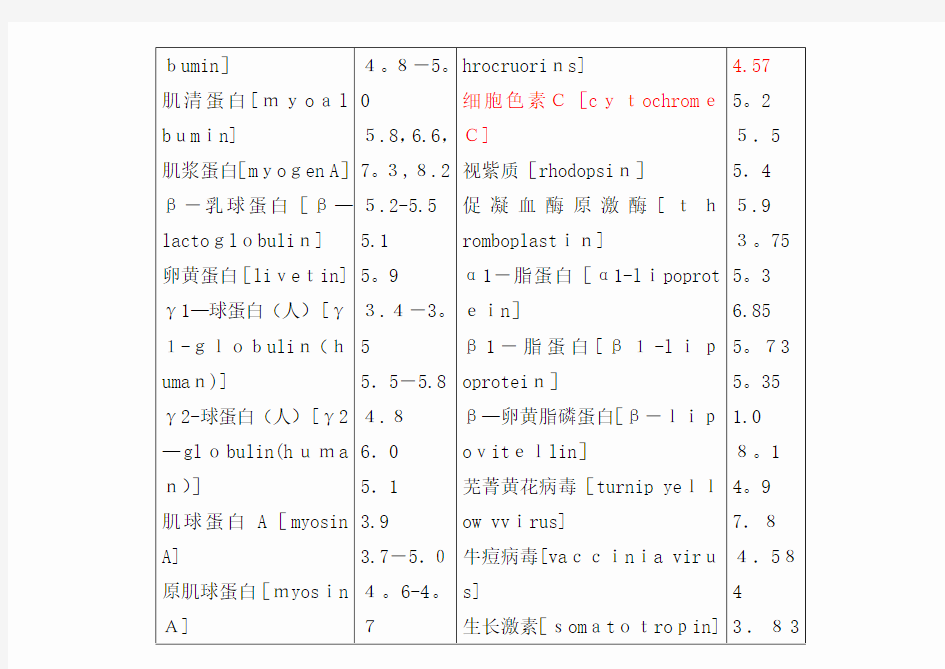
bumin]
肌清蛋白[myoal bumin]
肌浆蛋白[myogen A]β-乳球蛋白[β—lactoglobulin]
卵黄蛋白[livetin]γ1—球蛋白(人)[γ1-globulin(human)]
γ2-球蛋白(人)[γ2—globulin(huma n)]
肌球蛋白A[myosin A]
原肌球蛋白[myosin A]4。8-5。
5.8,6.6,
7。3,8.2
5.2-5.5
5.1
5。9
3.4-3。
5
5.5-5.8
4.8
6.0
5.1
3.9
3.7-5.0
4。6-4。
7
hrocruorins]
细胞色素C[cytochrome
C]
视紫质[rhodopsin]
促凝血酶原激酶[th
romboplastin]
α1-脂蛋白[α1-lipoprot
ein]
β1-脂蛋白[β1-lip
oprotein]
β—卵黄脂磷蛋白[β-lip
ovitellin]
芜菁黄花病毒[turnip yell
ow vvirus]
牛痘病毒[vaccinia viru
s]
生长激素[somatotropin]
4.57
5。2
5.5
5.4
5.9
3。75
5。3
6.85
5。73
5。35
1.0
8。1
4。9
7.8
4.58
4
3.83
铁传递蛋白[siderophilin]
胎球蛋白[fetuin]
血纤蛋白原[fibrinogen]
α-眼晶体蛋白[α-crystallin]
β-眼晶体蛋白[β-crystallin]
花生球蛋白[arachin]
伴花生球蛋白[conarrachin]
角蛋白类[keratin s]
还原角蛋白[kerat ein]6。5—6.8
4.8-
5.2
4。7-5。
4.0—4.1
4.5
5。8-6.0
催乳激素[prolactin]
胰岛素[insulin]
胃蛋白酶[pepsin]
糜蛋白酶(胰凝乳蛋白酶[chy
motrypsin]
牛血清白蛋白[bovine serum
albumin]
核糖核酸酶(牛胰)[ribonucl
ease或Rnase(bovine
pancreas)]
甲状腺球蛋白[thyroglo
bulin]
γ-酷蛋白[γ-casein]
α-卵清粘蛋白[α—
ovomucoid]
α1—粘蛋白[α1-mucoprot
ein]
-4。4
1
1.8-
2。7
5。5
3.2-3.
3
11。0-
11.2
6.99
胶原蛋白[collagen]
鱼胶[ichthyocol]白明胶[gelatin]α-酷蛋白[α—casein]
β-酷蛋白[β-casein]
卵黄类粘蛋白[vitellomu
coid]
尿促性腺激素[urinary go
nadotropin]
溶菌酶[lyso zyme]
氨基酸的解离常数和等电点
氨基酸pK1(—COOH)pK2(—NH3+)pKR(R基)pI
甘氨酸2。349。605.97
丙氨酸 2.349.60 6.02缬氨酸2.329。625。97亮氨酸2.369.60 5.98异亮氨酸2。369.686.02
离表面越远,过剩的反离子越少, 直至在溶液内部反离子 蛋白质等电点测定 及性质实验 、目的: 了解等电点的意义及其与蛋白质分子聚沉能力的关系。 初步学会测定蛋白质等电点的基本方法,了解蛋白质的性质。 、原理: 固体颗粒在液体中为什么能够带电? 当固体与液体接触时,固体可以从溶液中选择性吸附某种离子,也可以是固体分子本 身发生电离作用而使离子进入溶液, 以致使固液两相分别带有不同符号的电荷, 由于电中性 的要求,带电表面附近的液体中必有与固体 表面电荷 数量相等但符号相反的多余的反离子。 在界面上 带电表面和反离子 形成了双电层的结构。 在两种不同物质的 界面上,正负电荷分 别排列成的面层。 对于双电层的具体结构,一百多年来不同学者提出了不同的看法。最早于 1879年 Helmholz 提出平板型模型;1910年Gouy 和1913年Chap man 修正了平板型模型, 提出了扩 散双电层模型;后来 Stern 又提出了 Stern 模型。 根据O.斯特恩的观点,一部分反离子由于电性吸引或非电性的特性吸引作用(例如范 德华力)而和表面紧密结合,构成 吸附层(或称紧密层、斯特恩层)。其余的离子则扩散地 分布在溶液中,构成双电层的 扩散层(或称滑移面)。由于带电表面的吸引作用,在 扩散层 中反离子的浓度远大于同号离子。 紧密层(Stern 层〉 +++++^+++ 9 反号离子溶剂分子 扩散层
紧密层:溶液中反离子及溶剂分子受到足够大的静电力,范德华力或特性吸附力,而紧 密吸附在固体表面上。其余反离子则构成扩散层。 滑动面:指固液两相发生相对移动的界面,是凹凸不平的曲面。滑动面至溶液本体间的 电势差称为Z电势。 固体颗粒带电量的大小及测量方式? Z电势只有在固液两相发生相对移动时才能呈现出来。Z电势的大小由Zeta电位表示, 其数值的大小反映了胶粒带电的程度,其数值越高表明胶粒带电越多,扩散层越厚。一般来说,以pH值为横坐标,Zeta电位为纵坐标作图,Zeta电位为零对应的pH值即为等电点。 对于蛋白质分子来说: 蛋白质分子的大小在胶粒范围内,约1?100微米。大部分蛋白质分子的表面都有很多 亲水集团,这些集团以氢键形式与水分子进行水合作用,使水分子吸附在蛋白质分子表面而 形成一层水合膜,具有亲水性;又由于蛋白质分子表面的亲水集团都带有电荷,会与极性水分子中的异性电荷吸引形成双电层。而水合膜和双电层的存在,使蛋白质的分子与分子之间 不会相互凝聚,成为比较稳定的胶体溶液。如果消除水合膜或双电层其中一个因素,蛋白质溶液就会变得不稳定,两种因素都消除时,蛋白质分子就会互相凝聚成较大的分子而产生沉淀。在生活实践中,常利用蛋白质的胶体性质沉淀或分离蛋白质。如做豆腐、肉皮冻就是利 用蛋白质的胶凝作用。 蛋白质分子所带的电荷与溶液的pH值有很大关系,蛋白质是两性电解质,在酸性溶液 在碱性溶液中羧基形成-C00-而带负电 中的氨基酸分子氨基形成-NH3+而带正 电, COO-COO J p\+ 0H- NH2 兼性痒孑 pH>pI pK = pl pl 电殛申:拓向配覆不暮动 蛋白质分子所带净电荷为零时的pH值称为蛋白质的等电点(PI)。其定义为:在某一 pH的溶液中,蛋白质解离成阳离子和阴离子的趋势或程度相等时,呈电中性,此时溶液的pH称为该蛋白质的等电点。 等电点的应用:主要用于蛋白质等两性电解质的分离、提纯和电泳。 蛋白质等电点的测量方式:溶解度最低时的溶液pH。
蛋白质的两性性质及等电点的测定 一实验目的 通过实验了解蛋白质的两性性质和等电点的意义及与蛋白质分子聚沉的关系。 二实验原理 蛋白质是由许多氨基酸组成的,故也是两性电解质。蛋白质分子中可以解离的基团除末端a -氨基与羧基外,还有肽链上氨基酸残基的侧链基团,如非a -羧基及氨基、胍基、咪唑基等基团,它们都能解离成带电基团。因此,蛋白质分子与氨基酸一样,在酸性溶液中作碱性解离,成为带正电荷的阳离子,在碱性溶液中作酸性解离,成为带负电荷的阴离子。 R N H 3+ R COO N H 3+ R COO H 2N OH OH 在一定氢离子浓度时,蛋白质分子的酸性解离与碱性解离相等,成为中性颗粒,所带正负电荷相等,净电荷为零,此时溶液的pH 值称为蛋白质的等电点(pI )。在等电点时蛋白质分子在电场中既不向阴极移动,也不向阳极移动。而且分子间因碰撞而引起聚沉的倾向增加。所以此时蛋白质溶解度最小,若再加入乙醇、丙酮等试剂与蛋白质分子争夺水分子,减低了蛋白质分子外水化膜的厚度,而使浑浊度增加,蛋白质等电点与所含氨基酸种类和数量有关。若蛋白质含酸性氨基酸多,则等电点多略酸性,如胃蛋白酶的等电点为pH1左右,也有一些蛋白质含碱性氨基酸多,则等电点偏碱性。如鱼精蛋白等电点为pH12.0-12.4,含酸性和碱性氨基酸残基数目相近的蛋白质,其等电点为中性偏酸约5左右。本实验采用酪蛋白在不同pH 溶液中形成的混浊度来确定其等电点,即混浊度最大的溶液pH 值为该种蛋白质的等电点。 三实验设备 (1) 试管架 1个 (2) 吸管1mL 2支;2mL 1支;5mL 1支;10mL 1支 (3) 试管1.5×15mL10支 (4) 滴管2支 四实验试剂 (1)1mol/L 醋酸溶液: 量取99.5%醋酸(比重1.05)2.875 mL ,加水至50 mL 。 (2)0.1mol/L 醋酸溶液: 量取1mol/L 醋酸5 mL ,加水至50 mL 。 (3)0.01mol/L 醋酸溶液:
蛋白质的等电点测定 一、蛋白质等电点的测定 1.目的 (1)了解蛋白质的两性解离性质。 (2)学习测定蛋白质等电点的一种方法。 2.原理 蛋白质是两性电解质。在蛋白质溶液中存在下列平衡: 蛋白质分子的解离状态和解离程度受溶液的酸碱度影响。当溶液的pH达到一定数值时,蛋白质颗粒上正负电荷的数目相等,在电场中,蛋白质既不向阴极移动,也不向阳极移动,此时溶液的pH值称为此种蛋白质的等电点。不同蛋白质各有其特异的等电点。在等电点时,蛋白质的理化性质都有变化,可利用此种性质的变化测定各种蛋白质的等电点。最常用的方法是测其溶解度最低时的溶液pH值。 本实验借观察在不同pH溶液中的溶解度以测定酪蛋白的等电点。用醋酸与醋酸钠(醋酸钠混合在酪蛋白溶液中)配制成各种不同pH值的缓冲液。向诸缓冲溶液中加入酪蛋白后,沉淀出现最多的缓冲液的pH值即为酪蛋白的等电点。 3.器材 (1)水浴锅(2)温度计 (3)200mL锥形瓶4)100mL容量瓶 (5)吸管(6)试管 (7)试管架(8)乳钵 4.试剂 (1)0.4%酪蛋白醋酸钠溶液200mL 取0.4g酪蛋白,加少量水在乳钵中仔细地研磨,将所得的蛋白质悬胶液移入200mL锥形瓶内,用少量40—50℃的温水洗涤乳钵,将洗涤液也移入锥形瓶内。加入10mL1mol/L 醋酸钠溶液。把锥形瓶放到50 C水浴中,并小心地旋转锥形瓶,直到酪蛋白完全溶解为止。
将锥形瓶内的溶液全部移至100mL容量瓶内,加水至刻度,塞紧玻塞,混匀。 (2)1.00mol/L醋酸溶液100mL (3)0.10mol/L醋酸溶液100mL (4)0.01 mol/L醋酸溶液 50mL 5.操作 取同样规格的试管4支,按下表顺序分别精确地加入各试剂,然后混匀。 (2)向以上试管中各加酪蛋白的醋酸钠溶液1mL,加一管,摇匀——管。此时1、2、3、4管的pH依次为5.9、5.3、4.7、3.5。观察其混浊度。静置10分钟后,再观察其混浊度。最 混浊的一管的pH即为酪蛋白的等电点。
实验三蛋白质的两性反应和等电点的测定 一、目的和要求 1.了解蛋白质的两性解离性质。 2.初步学会测定蛋白质等电点的方法。 二、原理 蛋白质由许多氨基酸组成,虽然绝大多数的氨基与羧基成肽键结合,但是总有一定数量自由的氨基与羧基,以及酚基等酸碱基团,因此蛋白质和氨基酸一样时两性电解质。调节溶液的酸碱度达到一定的氢离子浓度时,蛋白质分子所带的正电荷和负电荷相等,以兼性离子状态存在,在电场内该蛋白质分子既不向阴极移动,也不向阳极移动,这时溶液的PH值称为该蛋白质的等电点(PI)。当溶液的PH低于蛋白质等电点时,即在氢离子较多的条件下,蛋白质分子带正电荷成为阳离子;当溶液的PH高于蛋白质等电点时,即在氢氧根离子较多的条件下,蛋白质分子带负电荷成为阴离子。 在等电点时蛋白质溶解度最小,容易沉淀析出。 三、试剂和器材 1.试剂 0.5%酪蛋白溶液;酪蛋白醋酸钠溶液;0.04%溴甲酚绿指示剂;0.02N盐酸; 0.1N醋酸溶液;0.01N醋酸溶液;1N醋酸溶液;0.02N氢氧化钠溶液 2.器材 试管及试管架;滴管;吸量管(1、5ml) 四、操作方法 1.蛋白质的两性反应
(1)取1支试管,加0.5%酪蛋白溶液20滴和0.04%溴甲酚绿指示剂5-7滴,混匀。观察溶液呈观的颜色,并说明原因。 (2)用细滴管缓慢加入0.02N盐酸溶液,随滴随摇,直至有明显的大量沉淀发生,此时溶液的PH接近与酪蛋白的等电点。观察溶液颜色的变化。(3)继续滴入0.02N盐酸溶液,观察沉淀和溶液颜色的变化,并说明原因。(4)再滴入0.02N氢氧化钠溶液进行中和,观察是否出现沉淀,解释其原因。 继续滴入0.02N氢氧化钠溶液,为什么沉淀又会溶液?溶液的颜色如何 变化?说明了什么问题? 2.酪蛋白等电点的测定 (1)取9支粗细相近的干燥试管,编号后按下表的顺序准确地加入各种试剂。 加入每种试剂后应混合均匀。 (2)静置约20分钟,观察每支试管内溶液的混浊度,以—,+,++,+++,++++符号表示沉淀的多少。根据观察结果,指出哪一个PH是酪蛋白的 等电点?
蛋白质等电点测定及性质实验 一、目的: 了解等电点的意义及其与蛋白质分子聚沉能力的关系。 初步学会测定蛋白质等电点的基本方法,了解蛋白质的性质。 二、原理: 固体颗粒在液体中为什么能够带电 当固体与液体接触时,固体可以从溶液中选择性吸附某种离子,也可以是固体分子本身发生电离作用而使离子进入溶液,以致使固液两相分别带有不同符号的电荷,由于电中性的要求,带电表面附近的液体中必有与固体表面电荷数量相等但符号相反的多余的反离子。在界面上带电表面和反离子形成了双电层的结构。在两种不同物质的界面上,正负电荷分别排列成的面层。 对于双电层的具体结构,一百多年来不同学者提出了不同的看法。最早于1879年Helmholz提出平板型模型;1910年Gouy和1913年Chapman修正了平板型模型,提出了扩散双电层模型;后来Stern又提出了Stern模型。 根据O.斯特恩的观点,一部分反离子由于电性吸引或非电性的特性吸引作用(例如范德华力)而和表面紧密结合,构成吸附层(或称紧密层、斯特恩层)。其余的离子则扩散地分布在溶液中,构成双电层的扩散层(或称滑移面)。由于带电表面的吸引作用,在扩散层中反离子的浓度远大于同号离子。离表面越远,过剩的反离子越少,直至在溶液内部反离子的浓度与同号离子相等。
紧密层:溶液中反离子及溶剂分子受到足够大的静电力,范德华力或特性吸附力,而紧密吸附在固体表面上。其余反离子则构成扩散层。 滑动面:指固液两相发生相对移动的界面,是凹凸不平的曲面。滑动面至溶液本体间的电势差称为ζ电势。 固体颗粒带电量的大小及测量方式 ζ电势只有在固液两相发生相对移动时才能呈现出来。ζ电势的大小由Zeta电位表示,其数值的大小反映了胶粒带电的程度,其数值越高表明胶粒带电越多,扩散层越厚。一般来说,以pH值为横坐标,Zeta电位为纵坐标作图,Zeta电位为零对应的pH值即为等电点。 对于蛋白质分子来说: 蛋白质分子的大小在胶粒范围内,约1~100微米。大部分蛋白质分子的表面都有很多亲水集团,这些集团以氢键形式与水分子进行水合作用,使水分子吸附在蛋白质分子表面而形成一层水合膜,具有亲水性;又由于蛋白质分子表面的亲水集团都带有电荷,会与极性水分子中的异性电荷吸引形成双电层。而水合膜和双电层的存在,使蛋白质的分子与分子之间不会相互凝聚,成为比较稳定的胶体溶液。如果消除水合膜或双电层其中一个因素,蛋白质溶液就会变得不稳定,两种因素都消除时,蛋白质分子就会互相凝聚成较大的分子而产生沉淀。在生活实践中,常利用蛋白质的胶体性质沉淀或分离蛋白质。如做豆腐、肉皮冻就是利用蛋白质的胶凝作用。 蛋白质分子所带的电荷与溶液的pH值有很大关系,蛋白质是两性电解质,在酸性溶液中的氨基酸分子氨基形成-NH3+而带正电,在碱性溶液中羧基形成-COO-而带负电: 蛋白质分子所带净电荷为零时的pH值称为蛋白质的等电点(PI)。其定义为:在某一pH的溶液中,蛋白质解离成阳离子和阴离子的趋势或程度相等时,呈电中性,此时溶液的pH称为该蛋白质的等电点。 等电点的应用:主要用于蛋白质等两性电解质的分离、提纯和电泳。 蛋白质等电点的测量方式:溶解度最低时的溶液pH。
常见蛋白质等电点参考值 常见蛋白质等电点参考值 蛋白质等电点蛋白质等电点 鲑精蛋白[salmine]鲱精蛋白[clupein e] 血清白蛋白[serumalbumin] 鲟精蛋白[sturline]胸腺组蛋白[thymohistone] 珠蛋白(人)[globin (human)] 卵白蛋白[ovalbu in] 伴清蛋白[conal12。1 12。1 4。7—4。 9 11。71 10.8 7.5 4.7 1;4.59 6。8,7。1 3.5 6.3 5。1—5.3 肌红蛋白[myoglobin] 血红蛋白(人)[hemogl obin(human)] 血红蛋白(鸡)[hemoglobin(h en)] 血红蛋白(马)[hemoglobi n(horse)] 血蓝蛋白[hemerythrin] 蚯蚓血红蛋白[chlorocruo rin] 血绿蛋白[chlorocruori n] 无脊椎血红蛋白[eryt 7.07 7。23 6.92 4.6- 6.4 5。6 4。3- 4.5 4。6— 6.2 9.8— 10.1 4.47—
bumin] 肌清蛋白[myoal bumin] 肌浆蛋白[myogen A]β-乳球蛋白[β—lactoglobulin] 卵黄蛋白[livetin]γ1—球蛋白(人)[γ1-globulin(human)] γ2-球蛋白(人)[γ2—globulin(huma n)] 肌球蛋白A[myosin A] 原肌球蛋白[myosin A]4。8-5。 5.8,6.6, 7。3,8.2 5.2-5.5 5.1 5。9 3.4-3。 5 5.5-5.8 4.8 6.0 5.1 3.9 3.7-5.0 4。6-4。 7 hrocruorins] 细胞色素C[cytochrome C] 视紫质[rhodopsin] 促凝血酶原激酶[th romboplastin] α1-脂蛋白[α1-lipoprot ein] β1-脂蛋白[β1-lip oprotein] β—卵黄脂磷蛋白[β-lip ovitellin] 芜菁黄花病毒[turnip yell ow vvirus] 牛痘病毒[vaccinia viru s] 生长激素[somatotropin] 4.57 5。2 5.5 5.4 5.9 3。75 5。3 6.85 5。73 5。35 1.0 8。1 4。9 7.8 4.58 4 3.83
1蛋白质的等电点是指( ) 蛋白质分子的正电荷与负电荷相等时溶液的pH值 2 蛋白质高分子溶液的特性有( ) 黏度大、 3维持蛋白质三级结构的主要键是( )次级键 4 DNA水解后可得下列哪组产物( ) 胞嘧啶、胸腺嘧啶 5 蛋白质的主要特点是( ) . 生物学活性丧失 6 肽类激素诱导cAMP生成的过程是( ) 激素受体复合物使G蛋白结合GTP而活化,后者再激活腺苷酸环化酶 7 芳香族氨基酸是( ) 苯丙氨酸 8 蛋白质分子中主要的化学键是( ) 肽键 9对酶来说,下列不正确的有( ) 酶可加速化学反应速度,因而改变反应的平衡常数 10盐析沉淀蛋白质的原理是( ) 中和电荷,破坏水化膜 11 酶化学修饰调节的主要方式是( ) 磷酸化与去磷酸化 12 关于蛋白质的二级结构正确的是( ) 是多肽链本身折叠盘曲而形成 13 DNA复制的叙述错误的是( ) 两条子链均连续合成 14 关于酶的叙述正确的一项是( ) 所有酶的本质都是蛋白质 15下列脱氧核苷酸不存在于DNA中的是, . dUMP 16 关于组成蛋白质的氨基酸结构,正确的说法是( ) 在α-碳原子上都结合有氨基或亚氨基 17 核酸对紫外线的最大吸收峰在( ) 260nm 18关于酶的非竞争性抑制作用正确的说法是( ) Km值不变 19非竞争性抑制作用与竞争性抑制作用的不同点在于前者的( ) 提高底物浓度,Vm仍然降低 20 下列影响细胞内cAMP含量的酶是( ) 腺苷酸环化酶 21. 关于酶与温度的关系,错误的论述是()D. 酶的最适温度与反应时间有关 22变性蛋白质的特性有( ) B. 生物学活性丧失 4. 逆转录时碱基的配对原则是( ) B. U-A 5. 分子病主要是哪种结构异常() A. 一级结构 6. DNA分子中的碱基组成是( ) A. A+C=G+T 7. 蛋白质的一级结构和空间结构决定于( ) C. 氨基酸组成和顺序 8. 关于碱基配对,下列错误的是( ) E. A-G,C-T相配对 9. 参加DNA复制的是( ) D. DNA指导的DNA聚合酶 10. DNA分子杂交的基础是( ) A. DNA变性后在一定条件下可复性 11. 酶的活性中心是指( ) A. 由必需基团组成的具有一定空间构象的区域 13. 关于肽键与肽,正确的是( ) A. 肽键具有部分双键性质 14. 酶原所以没有活性是因为( ) B. 活性中心未形成或未暴露 15. 有关cAMP的叙述是( C. cAMP是激素作用的第二信使 16. 下列具有四级结构的蛋白质是( ) D. 乳酸脱氢酶H型和M型两种亚基组成的四聚体 17 关于酶的竞争性抑制作用的说法正确的是( ) D. 增加底物浓度可减弱抑制剂的影响 19. 蛋白质变性和DNA变性的共同点是( ) A. 生物学活性丧失 20. 在核酸中占9%-11%,且可用于计算核酸含量的元素是( ) E. 磷 21. 维持DNA双螺旋结构稳定的因素有( ) B. 碱基对之间的氢键 22. DNA分子中的碱基组成是( ) A. A+C=G+T 1. 嘌呤环中的氮原子来自( ) C. 谷氨酰胺 2. 关于尿糖,哪项说法是正确的B. 尿糖阳性是肾小管不能将尿糖全部重吸收 3. 激素敏感脂肪酶是指( ) D. 脂肪细胞中的甘油三酯脂肪酶 4. 正常人摄入糖过多后,不可能发生的反应是E. 糖转变为蛋白质
第一章 1.何谓蛋白质的等电点?其大小和什么有关系? 2.经氨基酸分析测知1mg某蛋白中含有45ug的亮氨酸(MW131.2),23.2ug的酪氨酸(MW204.2),问该蛋白质的最低分子量是多少? 3.一四肽与FDNB反应后,用6mol/L盐酸水解得DNP-Val.及三种其他氨基酸。当这种四肽用胰蛋白酶水解,可得到两个二肽,其中一个肽可发生坂口反应,另一个肽用LiBH4还原后再进行水解,水解液中发现有氨基乙醇和一种与茚三酮反应生成棕褐色产物的氨基酸,试问在原来的四肽中可能存在哪几种氨基酸,它们的排列顺序如何? 4.一大肠杆菌细胞中含 10个蛋白质分子,每个蛋白质分子的平均分子量为40 000,假定所有的分子都处于a螺旋构象。计算其所含的多肽链长度? 5.某蛋白质分子中有一40个氨基酸残基组成的肽段,折叠形成了由2条肽段组成的反平行?折叠结构,并含有一?转角结构,后者由4个氨基酸残基组成。问此结构花式的长度约是多少? 6.某一蛋白样品在聚丙烯酸胺凝胶电泳(PAGE)上呈现一条分离带,用十二烷基硫酸钠(SDS)和硫基乙醇处理后再进行SDS-PAGE电泳时得到等浓度的两条分离带,问该蛋白质样品是否纯? 7.“一Gly-Pro-Lys-Gly-Pro-Pro-Gly-Ala-Ser-Gly-Lys-Asn一”是新合成的胶原蛋白多肽链的一部分结构,问: 1)哪个脯氨酸残基可被羟化为4一羟基脯氨酸? 2)哪个脯氨酸残基可被羟化为3一羟基脯氨酸? 3)哪个赖氨酸残基可被羟化? 4)哪个氨基酸残基可与糖残基连接? 8.一五肽用胰蛋白酶水解得到两个肽段和一个游离的氨基酸,其中一个肽段在280nm有吸收,且 Panly反应、坂口反应都呈阳性;另一肽段用汉化氰处理释放出一个可与茚三酮反应产生棕褐色产物的氨基酸,此肽的氨基酸排列顺序如何? 9.研究发现,多聚一L-Lys在pH7.0呈随机螺旋结构,但在pH10为a螺旋构象,为什么?预测多聚一L-Glu在什么pH条件下为随机螺旋,在什么pH下为a螺旋构象?为什么?10.Tropomyosin是由两条a螺旋肽链相互缠绕构成的超螺旋结构。其分子量为 70 000,假设氨基酸残基的平均分子量为110,问其分子的长度是多少? 11.某肽经 CNBr水解得到三个肽段,这三个肽的结构分别是:Asn-Trp-Gly-Met,Gly-Ala -Leu,Ala-Arg-Tyr-Asn-Met;用胰凝乳蛋白酶水解此肽也得到三个肽段,其中一个为四肽,用 6mol/L盐酸水解此四肽只得到(Asp)2和 Met三个氨基酸,问此肽的氨基酸排列顺序如何? 12.列举蛋白质主链构象的单元及它们的主要结构特征。 13.试比较蛋白质的变性作用与沉淀作用。 14.将一小肽(pI=8.5)和 Asp溶于 pH7.0的缓冲液中,通过阴离子交换树脂柱后,再进行分子排阻层析,那么Asp和小肽哪一个先从凝胶柱上被洗脱下来,为什么? 15.从理论和应用上说明有机溶剂、盐类、SDS、有机酸等对蛋白质的影响。 16.血红蛋白和肌红蛋白都具有氧合功能,但它们的氧合曲线不同,为什么? 17.为什么无水肼可用于鉴定C-端氨基酸? 18.Anfinsen用核糖核酸酶进行的变性一复性实验,在蛋白质结构方面得出的重要结论是什么? 19.蛋白质分离纯化技术中哪些与它的等电点有关?试述这些技术分离提纯蛋白质的原理。20.根据下列资料推出某肽的氨基酸排列顺序。
实验3 蛋白质的等电点测定和沉淀反应 一、目的 1、了解蛋白质的两性解离性质。 2、学习测定蛋白质等电点的一种方法。 3、加深对蛋白质胶体溶液稳定因素的认识。 4、了解沉淀蛋白质的几种方法及其实用意义。 二、原理 蛋白质是两性电解质。在蛋白质溶液中存在下列平衡: 蛋白质分子的解离状态和解离程度受溶液的酸碱度影响。当溶液的PH达到一定数值时,蛋白质颗粒上正负电荷的数目相等,在电场中,蛋白质既不向阴极移动,也不向阳极移动,此时溶液的pH值称为此种蛋白质的等电点。不同蛋白质各有特异的等电点。在等电点时,蛋白质的理化性质都有变化,可利用此种性质的变化测定各种蛋白质的等电点。最常用的方法是测其溶解度最低时的溶液pH值。 本实验通过观察不同pH溶液中的溶解度以测定酪蛋白的等电点。用醋酸与醋酸钠(醋酸钠混合在酪蛋白溶液中)配制各种不同pH值的缓冲液。向诸缓冲溶液中加入酪蛋白后,沉淀出现最多的缓冲液的pH值即为酪蛋白的等电点。 在水溶液中的蛋白质分子由于表面生成水化层和双电层而成为稳定的亲水胶体颗粒,在一定的理化因素影响下,蛋白质颗粒可因失去电荷和脱水而沉淀。 蛋白质的沉淀反应可分为两类。 (1)可逆的沉淀反应此时蛋白质分子的结构尚未发生显著变化,除去引起沉淀的因素后,蛋白质的沉淀仍能溶解于原来溶剂中,并保持其天然性质而不变性。如大多数蛋白质的盐析作用或在低温下用乙醇(或丙酮)短时间作用于蛋白质。提纯蛋白质时,常利用此类反应。
(2)不可逆沉淀反应此时蛋白质分子内部结构发生重大改变,蛋白质常变性而沉淀,不再溶于原来溶剂中。加热引起的蛋白质沉淀与凝固。蛋白质与重金属离子或某些有机酸的反应都属于此类。 蛋白质变性后,有时由于维持溶液稳定的条件仍然存在(如电荷),并不析出。因此变性蛋白质并不一定都表现为沉淀,而沉淀的蛋白质也未必都已变性。 三、材料、试剂与器具 (一)材料 新鲜鸡蛋 (二)试剂 1、0.4%酪蛋白醋酸钠溶液200ml 取0.4g酪蛋白,加少量水在乳钵中仔细地研磨,将所得的蛋白质悬胶液移入200mL锥形瓶内,用少量40—50℃的温水洗涤乳钵,将洗涤液也移入锥形瓶内。加入10mL 1mol/L 醋酸钠溶液。把锥形瓶放到50℃水浴中,并小心地旋转锥形瓶,直到酪蛋白完全溶解为止。将锥形瓶内的溶液全部移到100mL容量瓶内,加水至刻度,塞紧玻塞,混匀。 2、1.00mol/L 醋酸溶液100mL 3、0.10 mol/L醋酸溶液300mL 4、0.01 mol/L醋酸溶液50mL 5、蛋白质溶液500mL 5%卵清蛋白溶液或鸡蛋清的水溶液(新鲜鸡蛋清:水=1:9) 6、pH4.7醋酸—醋酸钠的缓冲溶液100mL 7、3%硝酸银溶液10mL 8、5%三氯乙酸溶液50mL 9、95%乙醇250mL 10、饱和硫酸铵溶液250mL 11、硫酸铵结晶粉末10000mL 12、0.1mol/L盐酸溶液300mL 13、0.1mol/L氢氧化钠溶液300mL 14、0.05mol/L碳酸钠溶液300mL 15、甲基红溶液20mL (三)器具 1、水浴锅 2、温度计 3、200mL锥形瓶 4、100mL容量瓶 5、吸管 6、试管及试管架 7、 7、乳钵 四、操作步骤 (一)酪蛋白等电点的测定 (1)取同样规格的试管4支,按下表顺序分别精确地加入各试剂,然后混匀。 试管号蒸馏水 (mL) 0.01 mol/L蜡酸 (mL) 0. 1 mol/L蜡酸 (mL) 1. 0 mol/L蜡 酸(mL) 1 8.4 0.6 - — 2 8.7 - 0. 3 — 3 8.0 - 1.0 — 4 7.4 - - 1.6
实验项目一、蛋白质的等电点测定及沉淀反应 姓名:指导教师:实验室: 组员:成绩: 第三部分:实验记录与分析 实验现象记录及分析: (一)蛋白质等电点测定 (二)蛋白质的盐析 1.蛋白质的盐析
2.重金属离子沉淀蛋白质 3.有机酸沉淀蛋白质
4.有机溶剂沉淀蛋白质 5.乙醇引起的变性与沉淀
第四部分:课后研讨题 1.通过本次合作实验后,有否对该项目改进的合理建议。 适当增加对照组和空白组,使实验数据更加科学可信。 2.鸡蛋清为何可做铅、汞中毒的解素剂? 铅、汞是重金属离子,与蛋白质结合能使蛋白质分子内部结构发生重大改变,发生变性而沉淀,不再溶于原来的溶剂中。 3.氯化汞为何能做为杀菌剂? 细菌由蛋白质构成,氧化汞是重金属盐,与蛋白质结合能使蛋白质分子内部结构发生重大改变,发生变性而沉淀,不再溶于原来的溶剂中。 4.在等电点时,蛋白质溶液为什么容易发生沉淀? 蛋白质颗粒上正负电荷的数目相等,在水溶液中的蛋白质分子由于表面生产水化层和双电层而成为稳定的亲水胶体颗粒,在一定的理化因素影响下,蛋白质颗粒可因失去电荷和脱水而沉淀。
5.将本实验中所涉及到的几种蛋白质沉淀方法各举一应用实例加以说明。 (1)盐析:硫酸铵的浓溶液能析出蛋白质。 (2)乙醇引起的变性与沉淀:低温下用乙醇或丙酮短时间作用于蛋白质,用于提纯蛋白质。 (3)重金属离子沉淀蛋白质:取一支离心管,加入2ml的蛋白质溶液,再加入3%硝酸银溶液1-2滴,振荡试管,观察现象。 (4)某些有机酸沉淀蛋白质:取一支离心管,加入2ml蛋白质溶液,再加入1ml 5%三氯乙酸溶液,振荡试管,观察现象。 (5)有机溶剂沉淀蛋白质:取一支离心管,加入2ml蛋白质溶液,再加入2ml 95%乙醇,观察现象。 教师评阅: 签名
1、方法:平板等电聚焦 ●原理:蛋白质分子在含有载体两性电介质形成的连续而稳定的线性pH梯度中进行电泳。但不自是按照等电点不同被分离。 ●仪器:Bio-Rad Model 111Mini IEF Cell ●样品要求:液体:浓度>3mg/ml;体积>200ul;固体:质量>200ug 样品纯度>90%;含盐量<3 0mM;分子量:一般要求大于1000Da ●常见影响测试情况:1、蛋白质纯度不足2、含盐量过高3、蛋白质分子量太小,导致无法固定染色 一、目的: 学习聚丙烯酰胺凝胶平板等电聚焦电泳测定蛋白质等电点的原理及方法。 二、原理: 等电点聚焦(isoelectric focusing, IEF)或简称电聚焦(electrofocusing),也曾称等电点分离聚焦电泳等。它是60年代中期出现的技术,克服了一般电泳易扩散的缺点。近年来,等电点聚焦电泳又有了新的进展,可以分辨等电点只差0.001pH单位的生物分子。由于它的分辨力高、重复性好、样品容量大、操作简便、迅速,在生物化学、分类学、分子生物学及临床医学研究等诸方面,都得到广泛应用。 等电点聚焦电泳产生pH梯度的方法有两种:一是用两种不同的pH缓冲液相互扩散,在混合区形成pH梯度,此为人工pH梯度。这种pH梯度不稳定,常用于制备电泳;另一种是利用载体两性电解质在电场作用下形成自然pH梯度。本实验就是利用载体两性电解质形成的自然pH梯度进行蛋白质样品等电焦聚电泳的。 理想的载体两性电解质应该在其本身的等电点处有足够的缓冲能力和良好的导电性,且分子量要小,组成与被分析样品有所区别,对分析样品无变性作用或发生化学反应。常用的载体两性电解质是一系列脂肪族多氨基和多羧基类的混合物,即是一系列的异构物和同系物,分子量在300—1000之间,各组分的等电点(pI)既有差异又相接近,pI的范围在2.5—11之间。合成载体两性电解质的原料是丙烯酸和多乙烯多胺,合成反应如下: R1和R2为氢或带有氨基的脂肪基。这一反应的特点是生成众多的异构物和同系物的混合物,而不是均一的化合物。混合物中各成分的含量、等电点的分布,取决于原材料的性质、比例和合成条件。目前常用的载体两性电解质的商品有:Ampholine(LKB公司)、Pharmlyte (Pharmacia公司)、Serralyty(Serva公司),近来已有国产商品了。不同厂家合成的方法不同,电泳的条件也略有不同。目前,载体两性电解质商品在使用时还存在一些问题,如
1.蛋白质的一级结构 2.蛋白质的二级结构 3.模体 4.蛋白质的三级结构 5.结构域 、 6.协同效应 7.变构效应 8.蛋白质的等电点 9.蛋白质沉淀 1.蛋白质的一级结构:是指多肽链中氨基酸排列顺序称为蛋白质的一级结构。 2.蛋白质的二级结构:是指蛋白质分子中某一段肽链的局部空间结构,也就是该段肽链主链骨架原子的相对空间位置,它不包括残基侧链构象的内容和与其他肽链的关系。二级结构主要是借主链原子之间形成的氢键维系构象稳定,包括”螺旋、8-折叠、p转角以及无规卷曲等形式。 ]
3.模体:在许多蛋白质分子中,可发现2个或3 个具有二级结构的肽段,在空间上相互接近,形成一个特殊的空间构象,并具有相应的功能,称为膜体。 4.蛋白质的三级结构:蛋白质三级结构是指整条多肽链中全部氨基酸残基 的相对空间位置,也即整条多肽链所有原子在三维空间的排布位置。 5.结构域:蛋白质的三级结构常可分割成1个和数个球状区域,折叠得较为紧密,各行其功能,称为结构域 6.协同效应:指一个亚基与其配体结合后,能影响此寡聚体中的另一个亚基与配体的结合能力。促进作用则为正协同效应;反之为负协同效应。 7.变构效应:蛋白质空间构象的改变伴随其功能的变化,称为变构效应。具有变构效应的蛋白质称为变构蛋白,常有四级结构。以血红蛋白为例,一分子O2与一个血红素辅基结合,引起亚基构象变化,进而引进相邻亚基构象变化,更易与O2结合。 ! 8.蛋白质的等电点:某一pH值的溶液中,蛋白质分子解离成的正电荷和负电荷相等,净电荷为零,此溶液的pH值即为该蛋白质的等电点。 9.蛋白质的变性:在某些物理和化学因素作用下,蛋白质特定的空间构象被破坏,从而导致其理化性质的改变和生物活性的丧失,称为蛋白质的变性。变性主要发生二硫键和非共价键的破坏,不涉及一级结构的改变。
实验十三蛋白质的两性性质及等电点的测定 一、目的 通过实验了解蛋白质的两性性质及等电点与蛋白质分子聚沉的关系。掌握通过聚沉测定蛋白质等电点的方法。 二、原理 蛋白质是两性电解质。蛋白质分子中可以解离的基团除N-端α-氨基与C-端α-羧基外,还有肽链上某些氨基酸残基的侧链基团,如酚基、巯基、胍基、咪唑基等基团,它们都能解离为带电基团。因此,在蛋白质溶液中存在着下列平衡: 调节溶液的pH使蛋白质分子的酸性解离与碱性解离相等,即所带正负电荷相等,净电荷为零,此时溶液的pH值称为蛋白质的等电点。在等电点时,蛋白质溶解度最小,溶液的混浊度最大,配制不同pH的缓冲液,观察蛋白质在这些缓冲液中的溶解情况即可确定蛋白质的等电点。 三、仪器和试剂 1.仪器 (1)试管架 (2)试管:15ml ×6 (3)刻度吸管:lml×4,2mI×4,10ml×2 (4)胶头吸管×2 2. 试剂 (1)1 mol/L乙酸 (2)0.1 mol/L乙酸 (3)0.01 mol/L乙酸 (4)0.2 mol/L NaOH (5)0.2 mol/L盐酸 (6)0.01%溴甲酚兰绿指示剂 (7)0.5%酪蛋白
四、操作步骤 (1)取一支试管,加0.5%酪蛋白1ml,再加溴甲酚兰绿指示剂4滴,摇匀。 此时溶液呈蓝色,无沉淀形成。 (2)用胶头滴管慢慢加入0.2 mol/L盐酸,边加便边摇直到有大量的沉淀生成。此时溶液是pH值接近酪蛋白的等电点。观察溶液颜色的变化。(3)继续滴加0.2 mol/L盐酸,沉淀会逐渐减少以至消失。观察此时溶液的颜色变化。 (4)滴加0.2 mol/L NaOH进行中和,沉淀又出现。继续滴加沉淀又逐渐消失。观察此时溶液的颜色变化。 2. 酪蛋白等电点的测定 (2)充分摇匀,然后向以上各试管依次加入0.5%酪蛋白l ml,边加边摇,摇匀后静置5min,观察各管的混浊度。 五、结果处理 用一、+、++、+++等符号表示各管的混浊度。根据混浊度判断酪蛋白的等电点。最混浊的一管的pH值即为酪蛋白的等电点。 六、注意事项 缓冲液的pH值必须准确。 七、思考题 1.解释蛋白质两性反应中颜色及沉淀变化的原因。 2.该方法测定蛋白质等电点的原理是什么? 参考文献 宋治军,纪重光主编现代分析仪器与测试方法。西安:西北大学出版社,1995 文树基,主编基础生物化学实验指导。西安:陕西科学技术出版社,1994 西北农业大学主编基础生物化学实验指导。西安:陕西科学技术出版社,1986 张龙翔主编生化实验方法和技术。北京:人民教育出版社,1982
常见蛋白质等电点参考值
氨基酸的解离常数和等电点
辣根过氧化物酶 过氧化物酶,酶学分类号为EC 1.11.1.7。该酶催化 Donor+ H2O2--→Oxidized donor+2 H2O。 过氧化物酶,通常来源于辣根(因此称辣根过氧化物酶),是临床检验试剂中的常用酶。该产品不但广泛用于多个生化检测项目,也广泛运用于免疫类(ELISA)试剂盒。过氧化物酶作为多个试剂盒显色体系的关键成分,对试剂盒的质量有重要影响。 辣根过氧化物酶(Horseradish Peroxidase, HRP)比活性高,稳定,分子量小,纯酶容易制备,所以最常用。HRP广泛分布于植物界,辣根中含量高,它是由无色的酶蛋白和棕色的铁卟啉结合而成的糖蛋白,糖含量18%。HRP由多个同功酶组成,分子量为40,000,等电点为PH3~9,酶催化的最适PH因供氢体不同而稍有差异,但多在PH5左右。酶溶于水和58%以下饱和度硫酸铵溶液。HRP的辅基和酶蛋白最大吸收光谱分别为403nm和275nm,一般以OD403nm /OD275nm的比值RZ(德文Reinheit Zahl)表示酶的纯度。高纯度的酶RZ值应在3.0左右(最高可达3.4)。RZ值越小,非酶蛋白就越多。 英文名称:Glucose oxidase;GOX;GOD CAS号:9001-37-0 分子量:15.4~16万KDa(SDS-PAGE中约80KDa,等电点4.6) 活力:100~250u/mg 酶活定义:37℃,PH5.7条件下,每分钟形成1umol过氧化氢所需要的酶量 Solubility (1%, Water):Pass PH稳定性:4.5~6.5 最佳PH:5.5 热稳定性:<50℃(PH7.0,15min) 最适作用温度30℃~60℃ 使用方法:测活时,用10mM柠檬酸钠缓冲液(PH5.7)溶解冻干粉末 性状:黄色粉末。一种能氧化葡萄糖生成葡萄糖酸的氧化还原酶。该酶需黄素腺嘌呤二核苷酸(FAD)作为辅酶,每个分子中含两个FAD。易溶于水,完全不溶于乙醚、氯仿、丁醇、吡啶、甘油、乙二醇等有机溶剂,50%丙酮、66%的甲醇能使其沉淀。化学物质EDTA、KCN、NaF不影响其酶活性,但酶活性受HgCL(氯化汞)、AgCL(氯化银)、苯肼、对氯汞苯甲酸等影响而使酶活性降低
蛋白质等电点测定及性质实验 一、目的: 了解等电点的意义及其与蛋白质分子聚沉能力的关系。 初步学会测定蛋白质等电点的基本方法,了解蛋白质的性质。 二、原理: 固体颗粒在液体中为什么能够带电? 当固体与液体接触时,固体可以从溶液中选择性吸附某种离子,也可以就是固体分子本身发生电离作用而使离子进入溶液,以致使固液两相分别带有不同符号的电荷,由于电中性的要求,带电表面附近的液体中必有与固体表面电荷数量相等但符号相反的多余的反离子。在界面上带电表面与反离子形成了双电层的结构。在两种不同物质的界面上,正负电荷分别排列成的面层。 对于双电层的具体结构,一百多年来不同学者提出了不同的瞧法。最早于1879年Helmholz提出平板型模型;1910年Gouy与1913年Chapman修正了平板型模型,提出了扩散双电层模型;后来Stern又提出了Stern模型。 根据O、斯特恩的观点,一部分反离子由于电性吸引或非电性的特性吸引作用(例如范德华力)而与表面紧密结合,构成吸附层(或称紧密层、斯特恩层)。其余的离子则扩散地分布在溶液中,构成双电层的扩散层(或称滑移面)。由于带电表面的吸引作用,在扩散层中反离子的浓度远大于同号离子。离表面越远,过剩的反离子越少,直至在溶液内部反离子的浓度与同号离子相等。
紧密层:溶液中反离子及溶剂分子受到足够大的静电力,范德华力或特性吸附力,而紧密吸附在固体表面上。其余反离子则构成扩散层。 滑动面:指固液两相发生相对移动的界面,就是凹凸不平的曲面。滑动面至溶液本体间的电势差称为ζ电势。 固体颗粒带电量的大小及测量方式? ζ电势只有在固液两相发生相对移动时才能呈现出来。ζ电势的大小由Zeta电位表示,其数值的大小反映了胶粒带电的程度,其数值越高表明胶粒带电越多,扩散层越厚。一般来说,以pH值为横坐标,Zeta电位为纵坐标作图,Zeta电位为零对应的pH值即为等电点。 对于蛋白质分子来说: 蛋白质分子的大小在胶粒范围内,约1~100微米。大部分蛋白质分子的表面都有很多亲水集团,这些集团以氢键形式与水分子进行水合作用,使水分子吸附在蛋白质分子表面而形成一层水合膜,具有亲水性;又由于蛋白质分子表面的亲水集团都带有电荷,会与极性水分子中的异性电荷吸引形成双电层。而水合膜与双电层的存在,使蛋白质的分子与分子之间不会相互凝聚,成为比较稳定的胶体溶液。如果消除水合膜或双电层其中一个因素,蛋白质溶液就会变得不稳定,两种因素都消除时,蛋白质分子就会互相凝聚成较大的分子而产生沉淀。在生活实践中,常利用蛋白质的胶体性质沉淀或分离蛋白质。如做豆腐、肉皮冻就就是利用蛋白质的胶凝作用。 蛋白质分子所带的电荷与溶液的pH值有很大关系,蛋白质就是两性电解质,在酸性溶液中的氨基酸分子氨基形成-NH3+而带正电,在碱性溶液中羧基形成-COO-而带负电: 蛋白质分子所带净电荷为零时的pH值称为蛋白质的等电点(PI)。其定义为:在某一pH 的溶液中,蛋白质解离成阳离子与阴离子的趋势或程度相等时,呈电中性,此时溶液的pH称为该蛋白质的等电点。 等电点的应用:主要用于蛋白质等两性电解质的分离、提纯与电泳。 蛋白质等电点的测量方式:溶解度最低时的溶液pH。
等电点聚焦测蛋白质等电点 一.实验目的 1.了解蛋白质的两性解离性质和等电点聚焦的原理; 2. 学习测定蛋白质等电点的方法并掌握圆盘电泳技术。 二.实验原理 等电点聚焦(IEF)是在电场中分离蛋白质技术的一个重要发展,IEF实质就是在稳定的pH梯度中按等电点的不同分离两性大分子的平衡电泳方法。 在电场中充有两性载体和抗对流介质,当加上电场后,由于两性载体移动的结果,在两极之间逐步建立起稳定的pH梯度,当蛋白质分子或其它两性分子存在于这样的pH梯度中时,这种分子便会由于其表面电荷在此电场中运动,并最终到达一个使其表面静电荷为0的区带,这时的pH则是这种分子的pI。聚焦在等电点的分子也会不断地扩散。一旦偏离其等电点后,由于pH环境的改变,分子又立即得到正电荷或负电荷,从而又向pI迁移。因此,这些分子总是处于不断地扩散和抗扩散的平衡之中,在pI处得以“聚焦”。 三.实验步骤 1.凝胶制备 按表1的比例配制4ml工作胶液,在真空干燥器中抽气10min。每组4管,每管加胶液1.8ml。混匀后立即注入到已准备好的凝胶管中,胶液加至离管顶部1cm 处,在胶面上再覆盖3mm厚的水层,应注意不要让水破坏胶的表面,室温下放置20~30min即可聚合。 表1 凝胶工作液配比 1ml 凝胶母液(丙烯酰胺30%:甲叉双丙烯 酰胺0.8%) 10%过硫酸铵0.02ml 水 2.68ml 载体两性电解液0.15ml 蛋白样品液0.1ml,0.05ml TEMED 0.02ml 2.电泳 吸去凝胶柱表面上的水层,将凝胶管垂直固定于圆盘电泳槽中。于电泳槽下槽加
入0.2%的500ml 硫酸作正极;上槽加入0.5%的800ml 乙醇胺作负极打开电源,将电压恒定为300V ,因为聚焦过程是电阻不断加大的过程,故聚焦电泳过程中,电流将不断下降,降至稳定时,即表明聚焦已完成,继续电泳约30min 后,停止电泳,全程约需3h 。 3.剥胶 电泳结束后,取下凝胶管,用水洗去胶管两端的电极液,按照柱状电泳剥胶的方法取出胶条,以胶条的正极为“头”,负极为“尾”,正极端呈酸性,负极端呈碱性。剥离后,量出并记录凝胶的长度。 4.固定 取其中的凝胶条3根置于一个小培养皿内,倒入10%放在三氯乙酸固定液中固定,约半小时后,即可看到胶条内蛋白质的白色沉淀带。固定完毕,倒出固定液用直尺量出胶条长度L 1和正极端到蛋白质白色沉淀带中心,即聚焦部位的长度L 2。 5.pH 梯度的测量 切段法:将未经固定的1根胶条,按照从正极端(酸性端)到负极端(碱性端)的顺序切成相等的10段,按次放人有标号的、装有0.0lM 氯化钾的试管中,浸泡过夜。然后用pH 计测出每管浸泡液的pH 并记录。 四.实验结果 1.凝胶条的长度及染色蛋白带的位置 凝胶条编号 1 2 3 4 固定前的长度L 0 7.8cm 7.8cm 7.4cm 7.7cm 固定后的长度L 1 7.7cm 7.8cm 7.4cm 未染色,测pH 梯度 蛋白带距酸端距离L 2 1.3cm 1.4cm 1.3cm 蛋白质距正极实际长度L S 1.32cm 1.4cm 1.3cm 2.pH 梯度表及其相应标准曲线 标号 1 2 3 4 5 6 7 8 9 10 长度/cm 0.77 0.77 0.77 0.77 0.77 0.77 0.77 0.77 0.77 0.77 pH 值 3.05 3.72 5.04 6.76 7.24 7.99 8.62 9.58 10.1 4 10.18