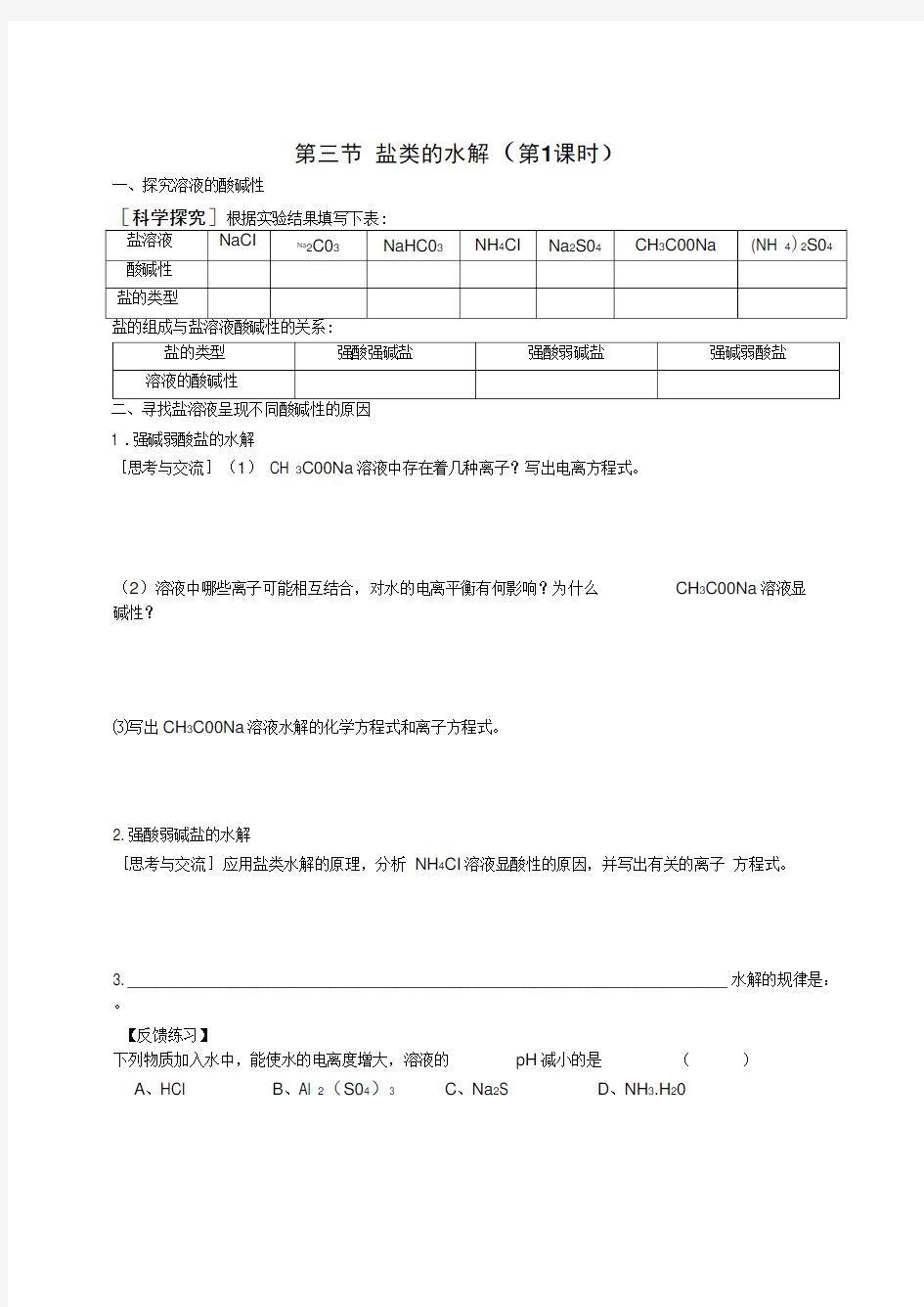

第三节盐类的水解(第1课时)
一、探究溶液的酸碱性
[科学探究]根据实验结果填写下表:
1 .强碱弱酸盐的水解
[思考与交流](1) CH 3C00Na溶液中存在着几种离子?写出电离方程式。
(2)溶液中哪些离子可能相互结合,对水的电离平衡有何影响?为什么CH3C00Na溶液显
碱性?
⑶写出CH3C00Na溶液水解的化学方程式和离子方程式。
2. 强酸弱碱盐的水解
[思考与交流]应用盐类水解的原理,分析NH4CI溶液显酸性的原因,并写出有关的离子方程式。
3. _________________________________________________________________ 水解的规律是:。
【反馈练习】
下列物质加入水中,能使水的电离度增大,溶液的pH减小的是()
A、HCI
B、Al 2(S04)3
C、Na2S
D、NH3.H20
第三节盐类的水解(第2课时)
【反馈练习】
写出下列盐水解的离子方程式:
CH 3C00Na ______________________________
K2CO 3_________________________________________
FeCb ___________________________
NH4))2SO4 ____________________________________________
【反馈练习】判断下列盐溶液的酸碱性,若该盐能水解,写出其水解反应的离子方程式。
(1)KF (2)NH4NO3 (3)Na2SO4 (4)FeC^ (5)NaHC0 3
五、影响盐类水解的因素
[归纳总结]影响盐类水解的因素
(1)盐类本身的性质:这是影响盐类水解的主要因素。组成盐的酸或碱越弱,其水解程
度_____________ ,溶液的碱性或酸性_____________________ 。
(2)温度:盐的水解是_________ 反应。因此升高温度其水解程度___________________ .
(3)浓度:盐的浓度越小,其水解程度越______________________ .
(4)溶液的酸碱性:控制溶液的酸碱性,可以促进或抑制盐的水解。如Na2CO3溶液中加碱可以_________________ 水解。加酸可以 __________________ 水解。
[科学探究]通过实验探究促进或抑制FeCb水解的条件,了解影响盐类水解程度的因素。
写出FeCl3水解的化学方程式_____________________________________________ ,设计实验完成下表
[思考与交流]
⑴用_______________________ 可鉴别NH4CI、NaCI、CH s COONa三种溶液。
⑵相同浓度的Na2CO3、NaHCO3、CH3COONa溶液的PH大小顺序为_________________________
⑶相同浓度拓NaX、NaY、NaZ溶液的PH值分别等于8、9、10,则对应三种酸的酸性强弱顺序为.【反馈练习】
1 .能使Na2CO3溶液中Na+与CO32-更接近2:1的措施是()
A 加水B加Na2CO3粉末C加KOH固体D加热
2?为什么热的纯碱溶液去污效果好?
第三节盐类的电离(第3课时)
应用平衡移动原理分析醋酸钠溶液水解平衡的移动情况,如下表所示:
1?日常生活中的应用:
(1 )泡沫灭火器原理(方程式) ___________________________________________________
(2)为什么,KAI (SO4) 2 ,Fe2 (SO4) 3等盐可用做净水剂
(3)在必修I学习胶体性质时,我们知道制取氢氧化铁胶体时是在沸水中滴入FeCb溶液,你现在知道其中的原理了吗?
(4 )热的纯碱去污能力更强,为什么?
2. 易水解盐溶液的配制与保存
为了防止配制FeCb溶液时可能浑浊,应向溶液中加入__________________ 抑制_____________ 水解。
试剂存放:盛放Na2CO3溶液的试剂瓶不能用玻璃塞,原因是
盛放NH4F溶液不能用玻璃瓶,是因为__________________________________________________
3. 判断溶液的酸碱性:
将O.1mol/L的下列溶液按PH由小到大的顺序排列①Na2CO3②NaHCO?③NaOH
④NaNO3 ⑤CH3COOH ⑥ NaHSO4 ⑦NH4CI ___________________ ______________ ______
4. 判断溶液中的离子能否共存:
5. 把盐溶液蒸干制取无水盐晶体:把下列盐溶液蒸干得到何种物质:
AICI3 _____ ___ Al2 (SO4) 3 _____^____ FeCl3 _____________________________________ —
Na2CO3 ________ ____ CuSO4 ____________ __
6. 判断溶液中离子浓度的大小:
(1)CH3COONa溶液中离子浓度大小顺序为________________________________ _________________
⑵(NH4)2SO4溶液中离子浓度大小顺序为__________________________ _________________________
(3) ________________________________________________________ Na2CO3溶液中离子浓度大小顺序为___________________________________________________________ ___________________ 七、电解质溶液中的守恒关系:
(1 )电荷守恒:电解质溶液中无论含多少种离子,但溶液总是呈电中性的。即整个溶液
中__________ 所带的负电荷总数一定等于__________________ 所带正电荷总数。如在NH4CI溶液
中有________ _ _ ___________
(2 )原子守恒(物料守恒):电解质溶液中尽管有些离子水解、电离等原因发生改变,但某原子总数是保持不变的。
女口NH4CI中存在_______________________________________ .
(3)质子(H +)守恒:电解质溶液中分子或离子得到或失去质子(H+ )的物质的量应相等。
女口NH4CI中存在_______________________________________ .
[思考与交流]
写出下列溶液中的各种守恒关系:
①O.lmol/L Na2CO3溶液中:
电荷守恒:___________ __________________________ ____
物料守恒:_________________________________________ _.
质子(H+)守恒 ____________________________________________
②0.1mol/L H2S溶液中
电荷守恒_____________________________________
物料守恒_______ _______________________________________
质子(H+)守恒 ____________________________________________
【反馈练习】
1?在一定条件下发生下列反应,其中属于盐类水解反应的是()
+ ___________________ +
A. NH4 + 2H2O ———NH3 H2O + H3O
-亠 + 2?
B. HCO3 + H2O - H3O + CO3
C. HS + H === H 2S
D. CI2+ 出0 = ?H + + C「+ HCIO
2?在CH3COONa溶液中各离子的浓度由大到小排列顺序正确的是( ) + - - + - + - +
A.c(Na ) > C(CH3COO ) > c(OH )> c(H )
B.c(CH 3COO ) > c(Na ) > c(OH ) > c(H )
+ - + - + - - +
C.c(Na ) > c(CH3COO ) > c(H ) > c(OH )
D.c(Na ) > c(OH ) > c(CH3COO ) > c(H )
3.25C时,在物质的量浓度均为1moI/ L 的(NH 4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2三种溶液中,c (NH4+)分别为a、b、c (单位为mol/L )。下列判断正确的是()A. a>b>c B.b>a>c C.a>c>b D.c>a>b
3.3 盐类的水解(第1课时导学案) 连山高级中学高二化学备课组 班级________________ 姓名________________ 学号________________ 【学习目标】 知识与技能: 1.掌握盐溶液酸碱性的规律。 2.理解盐类水解的原理。 3.正确的书写盐类的水解的离子方程式。 过程与方法: 1.发现问题,实验探究,探讨不同盐类的酸碱性。 2.归纳总结,能将信息有效的分类和提炼。 3.类比分析,将盐类的水解的知识加以应用。 情感态度与价值观: 1.体会实验探究在化学学习中的重要性。 2.体会表象与内在的联系,透过现象看本质。 3.运用主要矛盾及矛盾的主要方面来分析事物的辩证唯物主义观点。 4.认识从个别到一般的演绎推理方法在分析事物本质问题上的重要性。 【学习重点】 初步根据盐的组成判断盐溶液的酸碱性。 【学习难点】 掌握盐类水解的实质和规律。 【旧知回顾】 溶液呈酸性,则c(H+)____ c(OH-),pH____7;呈中性,则c(H+)____ c(OH-),pH____7;呈碱性,则c(H+)____ c(OH-),pH____7。常见的酸有________________________,常见的碱有________________________,常见的盐有________________________。H 2 0的电离方程 式为________________________,CH 3 COOH的电离方程式为________________________, NH 3·H 2 0的电离方程式为________________________。【实验探究】 1.根据实验结果,填写下表
第三节盐类的水解(第一课时) 一、教学目标 1.使学生理解强碱弱酸盐和强酸弱碱盐的水解。 2.培养学生分析问题的能力,使学生会透过现象看本质。 3.培养学生的实验技能,对学生进行科学态度和科学方法教育。 二、教学重点盐类水解的本质 三、教学难点盐类水解方程式的书写和分析 四、教学过程 [提问引入]酸溶液显酸性,碱溶液显碱性,盐溶液是否都显中性? 一、探究盐溶液的酸碱性 【回忆提问】盐的定义(从电离的角度) 盐的分类按组成分:正盐 2.按生成盐的酸和碱的强弱分:强酸强碱盐强酸弱碱 盐强碱弱酸盐弱酸弱碱盐 3.按溶解性分:易溶性盐微溶性盐难溶性盐 【演示】用pH试纸检验下列溶液的酸碱性: NaCl、Na 2CO 3 、 Na 2 HCO 3 、NH 4 Cl、 Na 2 SO 4 、CH 3 COONa、(NH 4 ) 2 SO 4 (通过示范说明操作要领,并强调注意事项) 【讨论】由上述实验结果分析,盐溶液的酸碱性与生成该盐的酸和碱的强弱间有什么关系? 【学生小结】1. 盐的组成与盐溶液酸碱性的关系: ①强碱弱酸盐的水溶液显碱性 ②强酸弱碱盐的水溶液显酸性 ③强酸强碱盐的水溶液显中性
【讲述】下面我们分别研究不同类盐的水溶液酸碱性不同的原因。【板书】二、盐类的水解 1. 强碱弱酸盐的水解 【讨论】(1)CH 3 COONa溶液中存在着几种离子? (2)哪些离子可能相互结合,对水的电离平衡有何影响? (3)为什么CH 3 COONa溶液显碱性? 【讲解】CH 3COONa溶于水时,CH 3 COONa电离出的CH 3 COO-和水电离出的H+结合生 成难电离的CH 3 COOH,消耗了溶液中的H+,使水的电离平衡向右移动,产生更多的OH-,建立新平衡时,C(OH-)>C(H+),从而使溶液显碱性。 【小结】 (1)这种在溶液中盐电离出来的离子跟水所电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解。 (2)只有弱酸的阴离子或弱碱的阳离子才能与H+或OH-结合生成弱电解质。 (3)盐类水解使水的电离平衡发生了移动,并使溶液显酸性或碱性。 (4)盐类水解反应是酸碱中和反应的逆反应。 (5)盐类水解是可逆反应,反应方程式中要写“”号。 【讨论】分析Na 2CO 3 的水解过程,写出有关反应的离子方程式。 【板书】(2)Na 2CO 3 的水解 第一步:CO 32- + H 2 O HCO 3 - + OH-(主要) 第二步:HCO 3- + H 2 O H 2 CO 3 + OH-(次要) 【强调】(1)多元弱酸的盐分步水解,以第一步为主。
第三节盐类的水解 第一课时 知识目标:1、使学生理解盐类水解的本质及盐类水解对溶液酸、碱性的影响及变化规律。 2、盐类水解的离子方程式与化学方程式。 能力目标:1、培养学生分析问题的能力,使学生学会透过现象看本质。 2、培养学生归纳思维能力和逻辑推理能力。 3、培养学生的实验技能,对学生进行科学态度和科学方法教育。 美育目标:通过对盐类水解规律的总结,体会自然万物变化的丰富多彩。 教学重点:盐类水解的本质,理解强酸弱碱盐和强碱弱酸盐的水解的规律。 教学难点:盐类水解方程式的书写和分析。教学方法:启发式实验引导法教学过程: 复习提问:当溶液中,c(H+) = c(OH-) 中性,常温下,pH = 7 c(H+) < c(OH-) 碱性,常温下,pH > 7 c(H+) < c(OH-) 酸性,常温下,pH < 7 酸的溶液显酸性,碱的溶液显碱性,那么酸与碱反应生成的盐,溶液显什么性? 讲解:同学们,实验是我们探求未知问题的好方法,下面我们做一个实验来看看,将盐溶于水后,溶液的酸碱性到底如何呢? 实验:①取少量CH3COONa溶于水,滴加几滴酚酞试剂,观察颜色变化。 ②取少量NH4Cl溶于水,滴加几滴紫色石蕊试剂,观察颜色变化。 ③取少量NaCl,溶于水,找一名同学测一下pH值。 注:对于②可以做一个对比,清水中加几滴紫色石蕊试剂,进行比较。 结论:①CH3COONa 碱性②NH4Cl 酸性③NaCl 中性 学生实验:用PH试纸检验Na2CO3、Al2(SO4)3、KNO3溶液的酸碱性。 讨论:由上述实验结果分析,盐溶液的酸碱性与生成该盐的酸和碱的强弱有什么关系? 小结:盐的组成与盐溶液酸碱性的关系:强碱弱酸盐的水溶液显碱性 强酸弱碱盐的水溶液显酸性强酸强碱盐的水溶液显中性 讲述:下面我们分别来研究不同类盐的水溶液酸碱性不同的原因。 同学活动:请同学们讨论一下第一个问题,为什么CH3COONa水溶液呈碱性呢?醋酸钠、氯化钠都是盐,是强电解质,他们溶于水完全电离成离子,电离出的离子中既没有氢离子,也没有氢氧根离子,而纯水中[H+]=[OH-],显中性。而实际上醋酸钠显碱性,即[H+]<[OH-],氯化铵溶液显酸性,即[H+]>[OH-] 板书:一、盐类的水解:讲解:CH3COONa溶于水之后,完全电离。(因为CH3COONa是强电解质。) 板书:CH3COONa ═ CH3COO-+ Na+………⑴引导:把CH3COONa溶于水之后,溶液中存在哪些电离平衡? 板书: H2O H+ + OH-………⑵ 讲解:我们知道,CH3COOH是一种弱酸,在溶液中部分电离,溶液中既然存在CH3COO-和H+,根据,可逆反应,反应物和生成物同时共存,那么就一定有CH3COOH。 板书:CH3COO- + H+ CH3COOH………⑶讲解:把⑴⑵⑶式联立,可得到 板书:水解方程式:CH3COONa + H2O CH3COOH + NaOH 讲解:这说明CH3COONa溶于水后,反应有NaOH生成,所以溶液显碱性。 学生活动:把上述化学方程式改写成离子方程式。板书:CH 3COO-+ H2O CH3COOH + OH- 说明:盐类水解方程式书写注意点 1、盐类水解是可逆反应,写方程式要用“”
学案47盐类的水解 [考纲要求] 1.了解盐类水解的原理,了解影响盐类水解程度的主要因素。2.了解盐类水解的应用。 知识点一盐类水解的原理 1.定义 在溶液中盐电离出来的离子跟______________________结合生成____________的反应。 2.实质 问题思考 1.怎样证明Na2CO3溶液呈碱性是由CO2-3水解引起的? 3.特点 4.规律 有弱才水解,越弱越水解;谁强显谁性;同强显中性。 问题思考 2.同浓度的Na2CO3和CH3COONa溶液相比,谁的pH较大?为什么?
知识点二水解反应方程式的书写 1.书写形式 盐+水 盐中的离子+水 2.书写规律 (1)多元弱酸的正盐(如Na2S):________________________________ ____________(主要),____________________________________(次要)。 (2)多元弱碱的正盐(如AlCl3): ________________________________________________________________________。 (3)双水解反应(如Na2S与AlCl3溶液混合) ________________________________________________________________________。 易错警示一般盐类水解程度很小,水解产物很少,不标“↑”或“↓”,不把产物(如NH3·H2O、H2CO3)写成其分解产物的形式。 问题思考 3.下列离子方程式中,属于水解反应的是() A.HCOOH+H2O-+H3O+ B.CO2+H2O-3+H+ C.CO2-3+H2O-3+OH- D.HS-+H2O2-+H3O+ 知识点三影响盐类水解的因素 1.内因 酸或碱越弱,其对应的弱酸阴离子或弱碱阳离子的水解程度________,溶液的碱性或酸性________。 问题思考 4.在CH3COONa溶液中,加入少量冰醋酸对CH3COO-的水解平衡将产生什么影响? 5.(1)为什么热的纯碱液去油渍效果会更好? (2)配制FeCl3溶液时,常加入少量的盐酸,为什么?
第三章物质在水溶液中的行为 第二节弱电解质的电离盐类的水解 第2课时盐类的水解 一、教材分析 本节课位于新课程鲁科版高中化学选修4《化学反应原理》第三章《物质在水溶液中的行为》的第二节《弱电解质的电离盐类的水解》的第二大部分。 (一)本节课在教材中的地位和作用 1、从教材编排上看---承前启后 承前:在本节课内容之前,学生已经学习了化学平衡的移动原理以及弱电解质的电离平衡和水的电离平衡两个平衡体系,也初步从微观角度认识了溶液呈现酸碱性的本质。在此基础上再来探究盐类的水解规律,既能促进学生认知层次上的阶梯式发展,又能使学生对平衡原理和弱电解质概念进行具体而明确的应用。 启后:盐类水解的知识与本章第三节《沉淀溶解平衡》将要学习的难溶电解质的沉淀溶解平衡紧密相连,其相关知识还可以进一步指导高三有关物质性质的检测及应用等知识的学习。 2、从知识结构上讲--完善体系 盐类水解平衡是继化学平衡、弱电解质的电离平衡之后的又一平衡体系,它们与将要学习的难溶电解质的沉淀溶解平衡共同构成了中学化学完整的平衡体系。通过学习盐类的水解,有利于学生构建一个完整的电解质溶液的平衡体系。 二、教学目标 1、知识与技能 (1)你知道为什么碳酸钠水溶液显碱性吗?希望在本节课上你学会分析并通过实验验证及理论推理获得盐类水解的原理。 (2)你会判断盐溶液的酸碱性吗?希望在本节课上你能通过所获取的理论知识准确快速地判断哪些物质水解呈酸性,哪些物质水解呈碱性。 (3)你会用化学方程式及离子方程式来表示盐类的水解吗?希望在本节课上你能学会水解方程式的书写。 2、过程与方法 (1)你掌握小组合作探究的技巧吗?希望在小组合作实验与讨论的过程中,你能学会如何进行有效的小组合作与探究。 (2)你会通过具体的实验结果及合理的理论分析归纳出有效的定义及规律吗?我想,在本节课上,你绝对可以掌握,同时,自己的文字归纳能力也会得到一定锻炼。 (3)在化学理论的学习上,你能总结出一些行之有效的方法吗?本节课会教给你一些。 3、情感态度与价值观 你能感觉到探究学习的奇妙吗?你能发现实验的神奇吗?在这节课上,你能感受到化学学科的真谛-从生活中来,到生活中去,并注定在快乐中学习,在快乐中成长。 三、重点难点 1、重点:盐类水解的实质及规律。 2、难点:探究并解释盐溶液酸碱性的成因。 四、学情分析 1、知能有积累:高二学生已具备较为成熟的独立思考问题的能力,而且思维活跃。通过前一阶段学习,学生已经掌握了离子方程式书写、化学平衡、电离平衡以及溶液pH 等知识,且具备了分析溶液中粒子微观行为的能力,具备了学习本节内容的知识前提。因此,通过本课教学,让学生掌握盐类水解的相关知识是完全能够实现的。
盐类的水解 知识目标:1、使学生理解盐类水解的本质及盐类水解对溶液酸、碱性的影响及变化规律。 2、盐类水解的离子方程式与化学方程式。能力目标: 1、培养学生分析问题的能力,使学生学会透过现象看本 质。 2、培养学生归纳思维能力和逻辑推理能力。 3、培养学生的实验技能,对学生进行科学态度和科学方法教育。美育目标:通过对盐类水解规律的总结,体会自然万物变化的丰富多彩。教学重点:盐类水解的本质,理解强酸弱碱盐和强碱弱酸盐的水解的规律。教学难点:盐类水解方程式的书写和分析。 教学方法:启发式实验引导法 教学过程: 复习提问:当溶液中,c(H+) = c(OH-)中性,常温下,pH = 7 c(H+) < c(OH -) 碱性,常温下,pH > 7 c(H+) < c(OH -) 酸性,常温下,pH < 7 酸的溶液显酸性,碱的溶液显碱性,那么酸与碱反应生成的盐,溶液显什么性? 讲解:同学们,实验是我们探求未知问题的好方法,下面我们做一个实验来看看,将盐溶于水后,溶液的酸碱性到底如何呢? 实验:①取少量CH s COONa溶于水,滴加几滴酚酞试剂,观察颜色变化。 ②取少量NH4CI溶于水,滴加几滴紫色石蕊试剂,观察颜色变化。 ③取少量NaCI,溶于水,找一名同学测一下pH值。 注:对于②可以做一个对比,清水中加几滴紫色石蕊试剂,进行比较。 结论:①CH s COONa 碱性②NH4CI 酸性③NaCI 中性 学生实验:用PH试纸检验Na2CO3、AI*SO4)3、KNO 3溶液的酸碱性。 讨论:由上述实验结果分析,盐溶液的酸碱性与生成该盐的酸和碱的强弱有什么关系?小结:盐的组成与盐溶液酸碱性的关系: 强碱弱酸盐的水溶液显碱性 强酸弱碱盐的水溶液显酸性 强酸强碱盐的水溶液显中性 讲述:下面我们分别来研究不同类盐的水溶液酸碱性不同的原因。 同学活动:请同学们讨论一下第一个问题,为什么CH3COONa水溶液呈碱性呢? 醋酸钠、氯化钠都是盐,是强电解质,他们溶于水完全电离成离子,电离出的离子中既没有氢离子,也没有氢氧根离子,而纯水中[H+]=[OH-],显中性。而实际上醋酸钠显碱性, 即[H+]<[OH-],氯化铵溶液显酸性,即[H+]>[OH-] 板书:一、盐类的水解: 讲解:CH3COONa溶于水之后,完全电离。(因为CH3COONa是强电解质。) 板书:CH3COONa —CH3COO- + Na+................ ⑴ 引导:把CH3COONa溶于水之后,溶液中存在哪些电离平衡? 板书:H?。- ' H + OH ..... ⑵ 讲解:我们知道,CH3COOH是一种弱酸,在溶液中部分电离,溶液中既然存在CH3COO- 和H +,根据,可逆反应,反应物和生成物同时共存,那么就一定有CH3COOH。 板书:CH3COO- + H+ ------- :CH3COOH ........ ⑶ 讲解:把⑴⑵⑶式联立,可得到 板书:水解方程式: CH s COONa + H 2O ------ :CH3COOH + NaOH
公开课盐类的水解教学 设计 集团档案编码:[YTTR-YTPT28-YTNTL98-UYTYNN08]
集体备课教案高2020级化学组
教材先提出盐溶液的酸碱性的问题,然后通过实验得出盐溶液的酸碱性与其组成的关系,再通过微观分析得出其本质原因。针对这一内容组织形式、结合学生已经基本具备解决问题的弱电解质电离平衡知识和平衡移动原理知识,本节课适合于采用探究式教学模式。同时,本节课的核心任务是形成盐类水解的概念,根据概念的分类和学习的认知学心理,概念的形成要通过具体的例证进行概念感知、对例证进行分析、比较、辨别,在此基础上舍弃非本质特征、提取其本质特征、进行抽象概括,形成概念。综合上述两点,我设计了如下探究教学模式。 教学模式:提出问题――实验探究――得出结论――质疑――理论讲解――交流应用 教学环境、教学媒体选择 教学场地:高2020级(17)班 实验器材:试剂瓶、烧杯、玻璃棒、pH试纸等 本节课将用到 白板,白板笔,计算机,投影仪,图片,课件PPT等。 板书设计 第三节盐类的水解 一、探究盐溶液的酸碱性 强酸强碱盐:中性 强酸弱碱盐:酸性 强碱弱酸盐:碱性 二、盐溶液呈现酸碱性的原因 1、理论分析:CH 3 OONa溶液(显碱性): CH 3OONa=CH 3 OO—+Na+ + H 2 OH++OH— CH 3 COOH 2、盐类水解的定义 3、实质 4、规律 5、条件 6、特征 三、水解方程式的书写规则 ①一般用,不用气体或沉淀符号; ②多元弱酸根分布写,以第一步为主;
教师活动学生活动设计意图【引言】被蜂蛰伤莫大 意——大妈差点送了 命! 某日上午10点左右,家 住市区的李大妈与邻居 一起到附近山上采槐花 时,不慎被蜜蜂蜇伤, 当时她并未在意,以为 没什么大碍。 回家后,李大妈感到被 蜇处疼痛加剧、呼吸困 难、意识模糊,家人急 忙拨打急救电话,医生 对症处理,经过治疗, 李大妈才脱离危险。 【问】为什么Na2CO3溶 液、NaHCO3溶液、肥皂 水可以消除疼痛? 探究2:盐溶液是否一定 呈中性? 【演示探究】实验内 容:室温下,用PH试纸 测以下5种盐溶液的pH 值,确定它们的酸碱 性。 【质疑】盐,既不会电 离出H+,也不会电离出 OH-,为什么也会显示出 不同的酸碱性?这就是 我们今天要解决的问 题:盐类的水解 【质疑】如果盐不同, 则情况可能不同,我们 就先以CH 3 OONa溶液(显 碱性)为例来分析。在 溶液中,存在两种电解 质CH 3OONa和H 2 O,所以 存在两个电离: NH 4Cl=NH 4 ++Cl-,H 2 O H+ +OH-,电离之后,按理说,也应该有[OH -]=[H+],最终不相等的原因是什么呢?为什思考回答: Na2CO3溶液、NaHCO3溶 液、肥皂水可能显碱性 仔细观察实验现象,分 析得出结论: 盐溶液不一定都是 中性,有的呈酸性,有的 呈碱性 思考,回答:只能来自 离子之间的反应,溶液 电离出的离子与水电离 出的H+或OH-反应。 思考,回答:H+与CH 3 OO- 反应能结合成弱电解质 CH 3 COOH,才能不断地反 应,所以 设置问题情境,激发学 习兴趣,轻松进入学习 状态。 , 吸引学生注意,培养学 生的观察、分析能力。 问题情景,引入新课, 过渡自然 不断地设置台阶,由学 生熟悉的旧知识入手, 逐渐由旧知识引出新知 识。经过层层分析,最 后找到本质原因——盐 类水解。
《盐类的水解》学案 考纲要求:1、了解盐类水解的原理 2、了解影响盐类水解程度的主要因素 一、盐类水解的概念及实质 1.概念 ______________________________________________________________________ 2.实质 ______________________________________________________________________ 例:醋酸钠在溶液中的变化 二、盐类水解的特点 (1)_______________________ 水解程度一般,不能进行到底。 (2)________________ 水解可水的电离。 (3)_________________________ 水解可看作的逆向反应,所以水解反应是吸热反应。三、水解反应方程式的书写 ⑴多元弱酸的正盐(如NazS): ________________________________ (主要),________________________ 欲要). (2)多元弱碱的正盐(如AlCh): ________________________________________ - 四、盐类水解的规律: 1、(1)无弱不水解:强酸强碱正盐:不水解,溶液显_____ 性。如NaCl、K2SO4等。(2)有弱才水解:①强碱弱酸盐: 如CH3COONa水解离子方程式为:_______________________________ ;显____ 性Na2CO3水解离子方程式: ______________________________________ ;显____ 性 ②强酸弱碱盐: 如FeCh水解离子方程式为:__________________________________ ;显 ___ 性。 NH4C1水解化学方程式为:____________________________________ ;显 ____ 性。(3)越弱越水解 比较均为0.lmol/L 的NaCl、C6H5ONa> CH3COONa> Na2CO3> NaHCO a溶液的pH 由大到小的顺序___________________________________________________________
盐类的水解(导学案四) 【考纲要求】 了解盐类水解的原理、影响盐类水解程度的主要因素以及盐类水解的应用。 【回归课本】 重新审视课本P54页科学探究,重新思考“科学探究”两表格内容 一.盐的水解 将0.1mol碳酸钠加适量蒸馏水配成0.1mol/L溶液。 1.溶液中存在哪些粒子?溶液为什么显碱性?请用相关的式子表示其来源? 2.若想促进碳酸钠的水解,可以采用的措施有? 3.若想抑制碳酸钠的水解,可以采用的措施有? 4.比较溶液中离子浓度的大小关系 【结论】: 1、盐类水解的定义:溶液中盐电离出来的离子跟的H+或OH-结合生成弱电解质的反应, 叫做盐类的水解。 2、盐类水解的实质:溶液中盐电离出来的某一种或多种离子跟水所电离出来的H+或OH-结合生成弱电 解质的反应,从而了水的电离(填促进或抑制)。 3、盐类水解的条件:盐必须能;构成盐的离子中必须有,如NH4+、Al3+、CO32-、S2-等。 4、特征:①属于反应,是中和反应的逆反应②水解程度一般比较 二、盐类水解的规律 例1:比较相同条件下相同物质的量浓度的下列盐溶液的碱性强弱: NaCl CH3COONa Na2CO3NaHCO3 【结论】:盐类水解的规律:
练习: 1.将滴有甲基橙的醋酸钠饱和溶液加热,溶液的颜色是() A.黄色不变 B.黄色变橙色 C.黄色变红色 D.橙色不变 2.在含有酚酞的0.1mol·L-1氨水中加入少量的NH4Cl晶体,则溶液颜色() A. 变蓝色 B. 变深 C.变浅 D. 不变 3.现有等浓度的下列溶液:①醋酸,②硫酸氢钠,③醋酸钠,④碳酸,⑤碳酸钠,⑥硫酸钠.按溶液pH 由小到大排列正确的是() A.④①②⑤⑥③B.⑥①②④③⑤ C.②①④⑥③⑤D.①④②③⑥⑤ 4、相同条件,相同物质的量浓度的下列八种溶液:Na2CO3、CH3COONa、Na2SO4、NaHCO3、NaOH 、 (NH4)2SO4、NaHSO4等溶液,pH值由大到小的顺序为: 三、盐类水解应用 请用必要的文字和化学方程式或离子方程式解释下列事实: (1)使用明矾净水: (2)用热的纯碱溶液洗去油污: (3)实验室将饱和氯化铁溶液滴入沸水,制备Fe(OH)3胶体: (4)配制CuSO4溶液时,用冷水溶解并加入少量稀硫酸;配制氯化铁溶液时,常将氯化铁先溶于盐酸,然后再加水稀释,: (5)泡沫灭火器原理: (6)铵盐不宜和草木灰(K2CO3)混合使用: (7)焊接时用NH4Cl溶液除锈: (8)NaOH与CH3COOH恰好反应后溶液呈碱性: (9)加热蒸干AlCl3、MgCl2、FeCl3等溶液时,得不到AlCl3、MgCl2、FeCl3晶体,必须在蒸发过程中不断通入气体,以抑制AlCl3、MgCl2、FeCl3的水解,才能得到其固体: (10)Na2CO3、Na2SiO3等溶液,不能存放在磨口玻璃塞的试剂瓶中: (11)课本P58 用TiCl4制备TiO2的反应方程式为: (12)课本P60 习题9、10、11
第三讲盐类的水解 (时间:45分钟满分:100分) 题意) 1.下列过程或现象与盐类水解无关的是()。 A.纯碱溶液去油污 B.铁在潮湿的环境下生锈 C.加热氯化铁溶液颜色变深 D.浓硫化钠溶液有臭味 解析纯碱去油污利用其水解显碱性;加热氯化铁溶液时促进FeCl3水解为红褐色Fe(OH)3胶体,颜色加深;浓硫化钠溶液有臭味是因Na2S水解产生少量的H2S气体;而铁生锈主要是Fe在潮湿条件下发生电化学腐蚀。 答案 B 2.要求设计实验证明:某种盐的水解是吸热的,有四位同学分别作出如下回答,其中不正确的是()。 A.甲同学:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的B.乙同学:用加热的方法可除去KNO3溶液中混有的Fe3+,说明含Fe3+的盐水解是吸热的 C.丙同学:通过实验发现同浓度的热的纯碱液比冷的纯碱液去油污效果好,说明碳酸钠水解是吸热的 D.丁同学:在醋酸钠溶液中滴入酚酞试液,加热(不考虑水蒸发)后若红色加深,说明醋酸钠水解是吸热的 解析A中甲同学所选盐为NH4NO3,在其溶于水的过程中就吸热,故即使水温下降,也不能说明NH4NO3水解是吸热的。 答案 A
3.混合下列各组物质使之充分反应,加热蒸干产物并在300 ℃灼烧至质量不变,最终残留固体不是纯净物的是()。 A.向红褐色的Fe(OH)3固体中加入过量盐酸 B.等物质的量浓度、等体积的(NH4)2SO4与BaCl2溶液 C.等物质的量的NaHCO3与Na2O2固体 D.向NaBr溶液中通入过量氯气 解析A项反应得到的溶液中含有FeCl3和HCl,加热蒸干产物并灼烧后最终得到的固体是Fe2O3;NH4Cl受热分解,B项最终得到BaSO4;C项最终得到Na2CO3和NaOH的混合物;D项最终得到NaCl。 答案 C 4.向三份0.1 mol·L-1CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl2固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为()。 A.减小、增大、减小B.增大、减小、减小 C.减小、增大、增大D.增大、减小、增大 解析CH3COO-离子水解显碱性,SO2-3水解也呈碱性会抑制CH3COO-离子的水解,CH3COO-浓度增大,NH+4和Fe2+水解均呈酸性,会促进CH3COO-离子水解,CH3COO-离子浓度会减小。 答案 A 5.下列说法不正确的是()。 A.0.2 mol·L-1的NaHCO3溶液中:c(Na+)>c(HCO-3)>c(OH-)>c(H+) B.叠氮酸(HN3)与醋酸酸性相似,NaN3水溶液中离子浓度大小顺序为c(Na+)>c(N-3)>c(OH-)>c(H+) C.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH+4)=c(Cl-) D.常温下,pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 解析由于NaHCO3中存在HCO-3+H2O H2CO3+OH-的水解平衡和HCO-3 H++CO2-3的电离平衡,且水解程度大于电离程度,所以溶液显碱性,故溶液中离子浓度大小关系为c(Na+)>c(HCO-3)>c(OH-)>c(H+),A项正确;由信息可知,NaN3为强碱弱酸盐,溶液呈碱性,离子浓度关系为c(Na +)>c(N-3)>c(OH-)>c(H+),B项正确;溶液的pH=7,则c(OH-)=c(H+),
盐类的水解(第一课时) 【考纲要求】 1. 了解盐类水解的原理。 2. 影响盐类水解程度的主要因素。 3. 盐类水解的应用。 【考点基础梳理】 一、盐类水解及规律 1.定义:在溶液中盐电离出来的离子跟水所电离出来的 结合生 成 的反应。 2. 实质: 弱酸阴离子(结合 ) 生成弱电解质 破坏 弱碱阳离子(结合 ) 水的电离程度 C(H +)≠ C(OH -) 溶液呈酸性、碱性或中性 3. 盐类水解规律 规律: 有 才水解,越 越水解;谁 显谁性,同强显 性。 [巩固练习]1.同浓度NaX 、NaY 、NaZ 三种钠盐溶液的pH 分别为8、9、10,则HX 、HY 、HZ 三种一元酸的相对强弱的顺序应为: 2.相同物质的量浓度的下列溶液,Na 2CO 3、NaHCO 3、Na 2SO 4、NH 4Cl 、(NH 4)2SO 4、CH 3COOH 、 HCl ,pH 由大到小的顺序为(用化学式表示): 二、盐类水解离子方程式的书写 书写规则:一般来说,盐类水解程度不大,书写时用“ ”。盐类水解所得产物的浓度很小,所以不用“ ”或“ ”表示水解产物。 a . 多元弱酸盐水解: b . 多元弱碱盐水解: 1.写出下列盐水解的离子方程式。
NH4Cl AlCl3 NaHCO3Na2CO3 三、影响盐类水解的因素 思考:外界条件对反应Fe3++3H 2O Fe(OH)3+3H+的影响如下: 条件移动方向n(H+) pH Fe3+水解程度 升高温度 通H2O 加HCl 1.内因:酸或碱越弱,对应的弱酸根离子或弱碱阳离子的水解程度越大,溶液的酸性或碱性越强。 2.外因: (1)温度:盐类水解是反应,升高温度,平衡移动,水解程度。 (2)浓度:加水稀释,则水解平衡移动,水解程度。 (3)发生化学反应: ①强碱弱酸盐水解,加酸其水解,加碱其水解。 ②强酸弱碱盐水解,加碱其水解,加酸其水解。 [巩固练习]3.向0.01 mol·L-1 CH3COONa溶液中分别加入少量NaOH固体、Na2CO3固体、NH4Cl固体,使CH3COO-水解平衡移动的方向分别为__________、____________、 ____________。(填“正向”、“逆向”或“不移动”) 【触摸高考】 1.判断正误 (1)升高NH4Cl溶液的温度,溶液的pH增大 (2)pH均为4的盐酸和NH4Cl溶液分别加水稀释100倍,pH均变6 (3)在滴有酚酞的Na2CO3溶液中逐滴加入BaCl2溶液,红色逐渐褪去,说明Na2CO3溶液中存在水解平衡 (4)pH=5的CH3COOH和AlCl3两溶液中,水的电离程度相同 (5)0.1mol/L Na2CO3溶液加蒸馏水稀释,CO32-的水解程度变大,溶液的pH不断增大2.有①Na2CO3溶液②CH3COONa溶液③NaOH溶液各25 mL,物质的量浓度均为0.1 mol·L-1,下列说法正确的是() A.3种溶液pH大小顺序是③>②>① B.若将3种溶液稀释相同的倍数,pH变化最大的是② C.若分别加入25 mL 0.1 mol·L-1盐酸后,pH最大的是① D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>②
第三节盐类的水解 李度一中陈海思 一、盐类水解 1、定义:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电 解质的反应。 2、实质:水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合,破坏水的 电离,是平衡向右移动,促进水的电离 3、盐类水解的规律:①有弱才水解,无弱不水解,越弱越水解;谁强显谁 性,两弱都水解,同强显中性。 ②多元弱酸根,浓度相同时正酸根比酸式酸根水解程度大, 碱性更强。(如:Na2CO3 >NaHCO3) 3、影响盐类水解的外界因素: ①温度:温度越高水解程度越大(水解吸热,越热越水解) ②②浓度:浓度越小,水解程度越大(越稀越水解) ③酸碱:促进或抑制盐的水解(H+促进阴离子水解而抑制阳离子水解促进阳离子 水解而抑制阴离子水解) 4、水解平衡常数 ○1对于强碱弱酸盐: =/ (为该温度下水的离子积,为该条件下该弱酸根形成的弱酸的电离平衡常数) ○2对于强酸弱碱盐: =/(为该温度下水的离子积,为该条件下该弱碱根形成的弱碱的电离平衡常数) 5、双水解反应 (1)构成盐的阴阳离子均能发生水解的反应。双水解反应相互促进,水解程度较大,有的甚至水解完全。使得平衡向右移。 (2)双水解反应特点是相互水解成沉淀或气体。双水解完全的离子方程式配平依据是两边电荷平衡。
【习题一】 (2018春?宾阳县校级月考)下列水解方程式正确的是() A. B. C. D. 【考点】盐类水解的原理. 【专题】盐类的水解专题. 【分析】水解反应的实质是:弱酸或弱碱离子结合水电离出的氢离子或氢氧根离子生成弱电解质的过程,水解反应方程式用可逆符号表示,以此分析得出正确结论. 【解答】解:A、水解是非常微弱的,水解方程式应该用“?”,且不能使用沉淀符号,故A错误; B、溴离子是强酸酸根离子不发生水解,故B错误; C、CH3COOH+H2O?CH3COO-+H3O+,是醋酸的电离方程式,不是水解离子方程式,故C错误; D、水解是非常微弱的,水解方程式应该用“?”,铵根离子水解生成一水合氨和氢离子,书写氢离子为水和氢离子得到离子方程式为NH4++2H2O?NH3? H2O+H3O+,故D正确。 故选:D。 【习题二】 (2018春?邯郸期末)一定条件下,C3COONa溶液在水解平衡:CH3COO- +H2OCH3COOH+OH-,下列说法正确的是() A.加入少量NaOH固体,c(CH3COO-)增大 B.加入少量FeCl3固体,c(CH3 COO-)增大 C.稀释溶液,溶液的pH增大 D.加入适量醋酸得到的酸性混合溶液:c( Na+)>c(CH3COO-)>c(H+)>c( OH-)【考点】影响盐类水解程度的主要因素. 【专题】盐类的水解专题.
第三节《盐类的水解》导学案第一课时 【学习目标】 1. 理解什么是盐类的水解。 2. 了解盐类发生水解的条件 3. 了解盐类水解的本质 4、学会书写简单的盐类水解离子方程式。 【学习重难点】 ①从微粒(离子)的角度理解盐类的水解的实质。 ②水解离子方程式的书写 一、【旧知回顾】 1、盐可以看成是反应除水之外的产物。根据生成盐所对应的酸和碱的强弱,对下列盐①NaCl ②CH3COONa ③ Na2CO3④NH4Cl ⑤Al2(SO4)3⑥KNO3进行分类: 强酸和强碱反应生成的盐有;弱酸和强碱反应生成的盐有;强酸和弱碱反应生成的盐有。 2、水溶液的酸碱性由什么决定?写出常见的弱酸。 3、CH3COOH、NH3〃H2O的电离方程式 在溶液中NH4+与OH-能否大量共存,原因解释: 二、【学习新知】自主学习 【合作实验】用PH试纸检验常见盐溶液酸碱性(表一) 1 2、根据实验可以得到什么结论? 3、结合课前温故中对盐的分类,盐溶液的酸碱性规律是什么? 合作探究 一、往纯水中分别加入NaCl(强酸强碱盐)、NH4Cl(强酸弱碱盐)、CH3COONa(强碱弱酸 盐)形成溶液后,结合实验结果 小组合作分析后,填写下面表格,汇报交流(表二) 1、盐类的水解:在水溶液中电离出的与水电离出的H+或OH-结合生成的反应 2、盐类的水解发生的条件:
3、盐类水解可看成反应的逆反应。 4、合作交流:总结盐类的水解实质: 二、学以致用 1、判断正误: ⑴、盐类水解的过程是盐的电离平衡被破坏过程 ⑵、盐类水解的过程中水的电离平衡发生移动 ⑶、盐类水解的过程中溶液的pH减小 ⑷、盐溶液呈现酸碱性的原因是盐的电离形成的 ⑸、盐类水解的过程中没有发生中和反应 2、常温下PH=9的NaOH 和CH 3 COONa中,由水电离出的c(OH-)是否相同? 3 4、某些肉类食品中加入适量的亚硝酸钠(NaNO2),可改善食品的外观和增加香味。但NaNO2有毒,其外观和食盐相似而且有咸味,因而将它误认为食盐使用发生的中毒事件时有发生,你知道如何用简单的方法鉴别它们吗?(HNO2为弱酸) 课堂练习 1、在溶液中,不能发生水解的离子是() A、ClO- B、CO32- C、Fe3+ D、SO42- 2、下列盐的水溶液中,哪些呈酸性()哪些呈碱性() ① FeCl3② NaClO ③ (NH4)2SO4④ AgNO3⑤ Na2S ⑥ K2SO4 3. 等物质的量浓度、等体积的酸HA与碱NaOH混合后,溶液的酸碱性是() A、酸性 B、中性 C、碱性 D、不能确定 4. 下列物质分别加入到水中,因促进水的电离而使溶液呈酸性的是() A、硫酸 B、NaOH C、硫酸铝 D. 碳酸钠 5. 在Na 2 S溶液中,c (Na+) 与 c (S2-–) 之比值()于2。 A、大 B、小 C、等 D、无法确定 6、下列各式中属于正确的水解反应离子方程式的是() A、S2-+2H2O H2S+2OH- B、CH3COO-+H2O CH3COOH+OH- C、CH3COOH+H2O CH3COO-+H3O+ D、CH3COOH+OH-CH3COO-+H2O 7、将0.1 mol下列物质置于1 L水中充分搅拌后,溶液中阴离子数最多的是 ( ) A. KCl B. Mg(OH)2 C. Na2CO3 D. MgSO4 8、盐类水解的过程中正确的说法是() A、盐的电离平衡破坏 B、水的电离平衡发生移动 C、溶液的pH减小 D、没有发生中和反应 9、 (1) 溶液浓度均为0.1mol/L的10种溶液: ① HNO3;② H2SO4;③ CH3COOH;④ Ba(OH)2; ⑤ KOH;⑥ CH3COONa;⑦ NaCl;⑧ NH4Cl 其pH由大到小顺序___________ _______ (2) 浓度相同的五种溶液: ① H2CO3;② Na2CO3;③NaHCO3;④ NH4HCO3;⑤ (NH4)2CO3, 其中c(CO 3 2-)由大到小的排序为:_______________________________________
化学选修四第四章第3节《盐类的水解》知识总结 一、探究盐溶液的酸碱性 强碱弱酸盐的水溶液,呈碱性;强酸弱碱盐的水溶液,呈酸性;强酸强碱盐的水溶液,呈中性。 二、盐溶液呈现不同酸碱性的原因 弱酸强碱盐,水解显碱性 CH3COONa= CH3COO?+ Na+ + H2O H++ OH? CH3COOH CH3COONa + H2O CH3COOH + NaOH CH3COO? + H2O CH3COOH + OH? 强酸弱碱盐水解 NH4Cl = NH4++ Cl? + H2O OH?+ H+ NH3·H2O NH4Cl + H2O NH3·H2O + HCl NH4+ + H2O NH3·H2O + H+ 强酸强碱盐:不水解 弱酸弱碱盐:双水解,水解程度增大。 1、盐类水解(hydrolysis of salts):在溶液中,由于盐的离子与水电离出来的H+或OH-结合生成弱电解质的过程中。 2、盐类水解的实质:是酸碱中和反应的逆反应 酸+ 碱 盐+ 水 3、盐类水解破坏了水的电离平衡,促进了水的电离 4、盐类水解的类型及规律 由强碱和弱酸反应生成的盐,称为强碱弱酸盐,含有以下(CH3COONa)CO32-、PO43-、S2-、SO32-、ClO-、F-,弱酸根的盐,常会发生水解。NH4Cl可以看作是强酸HCl和弱碱NH3·H2O反应生成的盐,我们把这种盐叫做强酸弱碱盐。类似这样的盐还有Al2(SO4)3、FeCl3、CuSO4等。由于NaCl电离出的Na+和Cl-都不能与水电离出来的H+或OH-结合生成弱电解质,所以强碱强酸盐不能水解,不会破坏水的电离平衡,因此其溶液显中性。强酸强碱盐、难溶于水的盐不水解。对于弱酸弱碱盐(NH4Ac),由于一水合氨和醋酸的电离度相近,因此铵离子、醋酸跟离子水解程度相近,从二溶液显中性。 (1)有弱才水解,无弱不水解,越弱越水解,都弱都水解;谁强显谁性,同强显中性。 (2) 组成盐的酸越弱,水解程度越大 例如,已知物质的量浓度相同的两种盐溶液,NaA和NaB,其溶液的pH前者大于后者,则酸HA 和HB的相对强弱为HB>HA,这条规律可用于利用盐的pH值判断酸性的强弱。 酸的强弱顺序:H3PO4>H2SO3>HF>CH3COOH>H2CO3>H2S>HClO>Al(OH)3 (3) 同浓度的正盐与其酸式盐相比,正盐的水解程度比酸式盐的水解程度大。 (4) 弱酸酸式盐的酸碱性要看酸式酸根电离和水解的相对强弱。HCO3-、HS-、HPO42-在溶液中以水解为主,其溶液显碱性;HSO3-、H2PO4-在溶液中以电离为主,其溶液显酸性 5、盐类水解离子方程式的书写 (1) 写法:谁弱写谁,都弱都写;阳离子水解生成H+,阴离子水解生成OH― ;阴阳离子都水解,生成弱酸和弱碱。 以CO32-为例,的水解的离子方程式: CO32- +H2O HCO3- +OH- (主要) HCO3- +H2O H2CO3 +OH- (次要) Al3+水解的离子方程式:Al3++3H2O Al(OH)3 +3H+ (2) 注意的问题:水和弱电解质应写成分子式,不能写成相应的离子。水解反应是可逆过程,因此要用可逆符号,并不标“↑”、“↓” 符号。(Al2S3、Al2(SO4)3例外)多元酸盐的水解是分步进行的。如: CO32?+ H2O HCO3? +OH? HCO3? +H2O H2CO3 + OH? 多元碱的盐也是分步水解的,由于中间过程复杂,可写成一步,如: Cu2++2H2O Cu(OH)2 + 2H+ Al3+ + 3H2O Al(OH)3 + 3H+ 多元弱酸的酸根离子既有水解倾向,又有电离倾向,以水解为主,溶液显碱性,以电离为主的,溶液显酸性。 些盐溶液在混合时,一种盐的阳离子和另一种盐的阴离子在一起都发生水解,相互促进对方的水解,使两种离子的水解趋于完全。例如,将Al2(SO4)3溶液和NaHCO3溶液混合,立即产生白色沉淀和大量气体。这是由于混合前Al2(SO4)3溶液显酸性,Al3++3H2O Al(OH)3 +3H+,NaHCO3溶液显酸性:HCO3-+H2O H2CO3 +OH-,混合后由于H++OH- = H2O,使两个水解反应互相促进,使其水解反应互相促进,使其各自水解趋于完全,所以产生白色沉淀和CO2气体,Al3++3HCO3-=Al(OH)3↓ +3CO2↑ (3) 双水解方程式的书写:弱酸弱碱盐中阴、阳离子相互促进水解,我们称之为双水解。
第三节盐类的水解(第1课时) 一、探究溶液的酸碱性 [科学探究]根据实验结果填写下表: 1 .强碱弱酸盐的水解 [思考与交流](1) CH 3C00Na溶液中存在着几种离子?写出电离方程式。 (2)溶液中哪些离子可能相互结合,对水的电离平衡有何影响?为什么CH3C00Na溶液显 碱性? ⑶写出CH3C00Na溶液水解的化学方程式和离子方程式。 2. 强酸弱碱盐的水解 [思考与交流]应用盐类水解的原理,分析NH4CI溶液显酸性的原因,并写出有关的离子方程式。 3. _________________________________________________________________ 水解的规律是:。 【反馈练习】 下列物质加入水中,能使水的电离度增大,溶液的pH减小的是() A、HCI B、Al 2(S04)3 C、Na2S D、NH3.H20
第三节盐类的水解(第2课时) 【反馈练习】 写出下列盐水解的离子方程式: CH 3C00Na ______________________________ K2CO 3_________________________________________ FeCb ___________________________ NH4))2SO4 ____________________________________________ 【反馈练习】判断下列盐溶液的酸碱性,若该盐能水解,写出其水解反应的离子方程式。 (1)KF (2)NH4NO3 (3)Na2SO4 (4)FeC^ (5)NaHC0 3 五、影响盐类水解的因素 [归纳总结]影响盐类水解的因素 (1)盐类本身的性质:这是影响盐类水解的主要因素。组成盐的酸或碱越弱,其水解程 度_____________ ,溶液的碱性或酸性_____________________ 。 (2)温度:盐的水解是_________ 反应。因此升高温度其水解程度___________________ . (3)浓度:盐的浓度越小,其水解程度越______________________ . (4)溶液的酸碱性:控制溶液的酸碱性,可以促进或抑制盐的水解。如Na2CO3溶液中加碱可以_________________ 水解。加酸可以 __________________ 水解。 [科学探究]通过实验探究促进或抑制FeCb水解的条件,了解影响盐类水解程度的因素。 写出FeCl3水解的化学方程式_____________________________________________ ,设计实验完成下表 [思考与交流]