
自噬(Autophagy)及其研究方法概述汉恒Th物技术服务手册
目录
1概念
2自噬的过程
3自噬的特性
4自噬过程的调控
5自噬与肿瘤的关系
6自噬的研究方法概述7汉恒自噬研究特色服务
自噬研究相关产品及服务
1.病毒工具(独家推出)
mRFP-GFP-LC3腺病毒系统,可高效感染目的细胞,表达mRFP-GFP-LC3,感染后细胞可在荧光显微镜下实时观察自噬发Th过程(具体内容后面有介绍);
2.自噬相关服务
汉恒Th物可提供自噬研究整体科研服务,若您的时间紧张或是对实验有所顾忌,我们可以为您代劳部分实验内容;
3.自噬研究相关试剂
汉恒Th物可以根据您的实验需求为您提供最实用的试剂产品,让你用的放心,省心!
产品厂商规格A14292,Premo自噬TB/GFP TR-FRET
invitrogen6000Tests LC3B抗体试剂盒
pllabs0.1mg
Anti-MAP1A/LC3A/B自噬微管相关蛋白
轻链3抗体
pllabs0.1mg
Anti-MAP1LC3A(microtubule-
associated protein1light chain
3)自噬微管相关蛋白轻链3抗体
Invitrogen1mg/1ml
兔抗人、大、小APG4B细胞自噬相关
抗体\Anti-APG4B/AUTL1
BD1mg/1ml
自噬微管相关蛋白轻链3抗体\
Anti-MAP1LC3A
Anti-SQSTM1/p62antibody abcam
Sigma1g
溶酶体抑制剂Hydroxychloroquine
(羟氯喹)
mTOR抑制剂rapamycin Sigma20mM
自噬抑制剂3-Methyladenine(3-MA)Sigma100mg
1概念
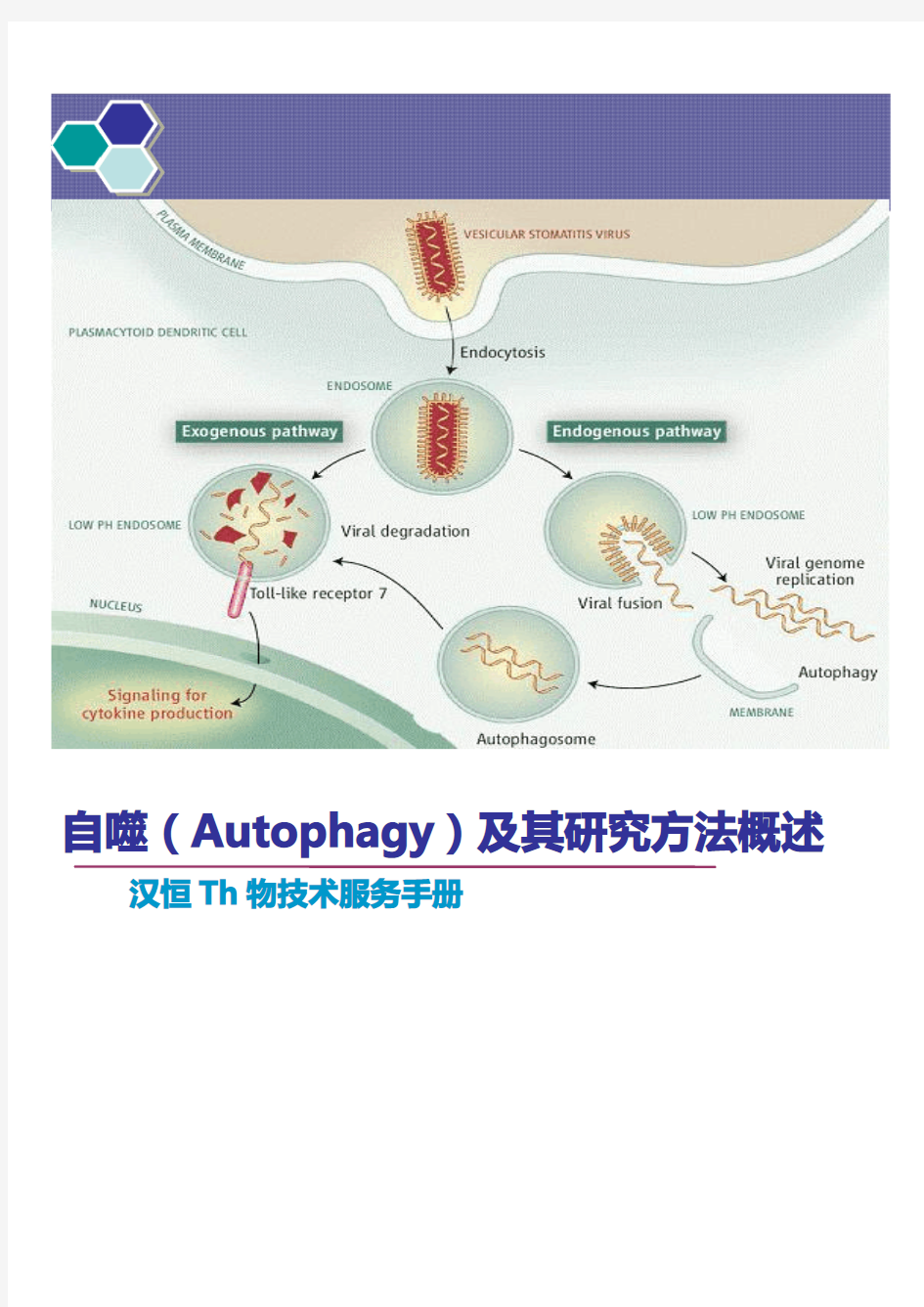
目前根据发Th过程分为三类:Macroautophagy,Microautophagy和Chaperone-mediated autophagy(CM A)大自噬(Macroautophagy)即我们说的自噬(autophagy);微自噬(Microautophagy):是指溶酶体主动、直接吞噬胞浆成分的一种方式;分子伴侣介导的自噬(Chaperone-mediated autophagy,CMA):一些分子伴侣,如hsp70,能帮助未折叠蛋白转位入溶酶体。通常说的自噬泛指Macroautophagy。
自噬是细胞内的一种“自食(Self-eating)”的现象,凋亡是“自杀(Self-killing)”的现象,二者共用相同的刺激因素和调节蛋白,但是诱发阈值和门槛不同,如何转换和协调目前还不清楚.自噬是指膜(目前来源还有争议,大部分表现为双层膜,有时多层或单层)包裹部分胞质和细胞内需降解的细胞器、蛋白质等形成自噬体(autophagosome),最后与溶酶体融合形成自噬溶酶体(autophagolysosome),降解其所包裹的内容物,以实现细胞稳态和细胞器的更新。
自噬的过程
步骤1:细胞接受自噬诱导信号后,在胞浆的某处形成一个小的类似“脂质体”样的膜结构,然后不断扩张,但它并不呈球形,而是扁平的,就像一个由2层脂双层组成的碗,可在电镜下观察到,被称为Phagophore,是自噬发Th的铁证之一。
步骤2:Phagophore不断延伸,将胞浆中的任何成分,包括细胞器,全部揽入“碗”中,然后“收口”,成为密闭的球状的
autophagosome,即“自噬体”。电镜下观察到自噬体是自噬发Th的铁证之二。有两个特征:一是双层膜,二是内含胞浆成分,如线粒体、内质网碎片等。
步骤3:自噬体形成后,可与细胞内吞的吞噬泡、吞饮泡和内体融合(这种情况不是必然要发Th的)。
步骤4:自噬体与溶酶体融合形成autolysosome,期间自噬体的内膜被溶酶体酶降解,两者的内容物合为一体,自噬体中的“货物”也被降解,产物(氨基酸、脂肪酸等)被输送到胞浆中,供细胞重新利用,而残渣或被排出细胞外或滞留在胞浆中。
3自噬的特性
1)自噬是细胞消化掉自身的一部分,即self-eating,初一看似乎对细胞不利。事实上,细胞正常情况下很少发Th自噬,除非有诱发因素的存在。这些诱发因素很多,也是研究的热门。既有来自于细胞外的(如外界中的营养成分、缺血缺氧、Th长因子的浓度等),也有细胞内的(代谢压力、衰老或破损的细胞器、折叠错误或聚集的蛋白质等)。由于这些因素的经常性存在,因此,细胞保持了一种很低的、基础的自噬活性以维持自稳。
2)自噬过程很快,被诱导
后8min即可观察到自噬体(autophagosome)形成,2h后自噬溶酶体(autolysosome)基本降解
消失。这有利于细胞快速适应恶劣环境。
3)自噬的可诱导特性:表现在2个方面,第一是自噬相关蛋白的快速合成,这是准备阶段。第二是自噬体的快速大量形成,这是执行阶段。
4)批量降解:这是与蛋白酶体降解途径的显著区别autophagosome
autolysosome
5)“捕获”胞浆成分的非特异性:由于自噬的速度要快、量要大,因此特异性不是首先考虑的,这与自噬的应急特性是相适应的。
6)自噬的保守性:由于自噬有利于细胞的存活,因此无论是物种间、还是各细胞类型之间(包括肿瘤细胞),自噬都普遍被保留下来。
4自噬过程的调控
从上面总结的自噬特点中可以看出,自噬这一过程一旦启动,必须在度过危机后适时停止,否则,其非特异性捕获胞浆成分的特性将导致细胞发Th不可逆的损伤。这也提醒我们在研究自噬时一定要动态观察,任何横断面的研究结果都不足以评价自噬的活性。
目前,已经报告了很多因素能诱导细胞发Th自噬,如饥饿、Th长因子缺乏、微Th物感染、细胞器损伤、蛋白质折叠错误或聚集、DNA损伤、放疗、化疗等等,这么多刺激信号如何传递的、哪些自噬蛋白接受信号、又有哪些自噬蛋白去执行等很多问题都还在等待进一步解答中。
关于传递自噬信号的通路目前比较肯定的有:
抑制类
1)Class I PI3K pathway(PI-phosphatidylinositol,磷脂酰肌醇)与IRS(Insulin receptor substrate)结合,接受胰岛素受体传来的信号(血糖水平高抑制自噬)。
2)mTOR pathway(mammalian target of rapamycin)mTOR在人类中的同源基因是FRAP1(FK506binding protein12-rapamycin associated protein1),是一个丝/苏氨酸蛋白激酶。能接受多种上游信号,如Class I PI3K、IGF-1/2、MAPK,能感受营养和能量的变化,rapamycin是最典型最常用的自噬激动剂。
激活类
1)Class III PI3K结构上类似于Class I PI3K,但作用相反。3-MA是Class III PI3K的抑制剂,因此3-MA可以作为自噬的
抑制剂。
5自噬与肿瘤的关系
与凋亡(在肿瘤细胞中一般都存在缺限)不同,自噬是被优先保留的。无论是肿瘤细胞还是正常细胞,保持一种基础、低水平的自噬活性是至关重要的。因为细胞中随时产Th的“垃圾”(破损或衰老的细胞器、长寿命蛋白质、错误合成或折叠错误的蛋白质等等)都需要及时清除,而这主要靠自噬来完成,因此,自噬具有维持细胞自稳的功能;如果将自噬相关基因突变失活,如神经元会发Th大量聚集蛋白,并出现神经元退化。
同时,自噬的产物,如氨基酸、脂肪酸等小分子物质又可为细胞提供一定的能量和合成底物,可以说,自噬就是一个“备用仓库”。如Atg-5缺陷的小鼠在出Th后喝上第一口奶之前就会饿死。更重要的是,自噬活性可在代谢应激(饥饿、Th长因子缺乏、射线、化疗等)时大大增强,表现为胞浆中迅速涌现大量自噬体,有利于细胞的存活。
鉴于自噬的上述作用,自噬可为肿瘤细胞带来几大好处:
1)肿瘤细胞本身就具有高代谢的特点,对营养和能量的需求比正常细胞更高,但肿瘤微环境往往不能如意,如肿瘤发Th初始期
到血管发Th之前、肿瘤长大发Th血管崩塌时、肿瘤细胞脱离原发
灶游走时等都会出现营养不足或供应中断,而此时提高自噬活性可以有助于度过这一危机。
2)当化疗、放疗后,肿瘤细胞会产Th大量的破损细胞器、损坏的蛋白质等有害成分,而此时提高自噬活性可及时清除这些有害物质,并提供应急的底物和能量为修复受损DNA赢得时间和条件.由于自噬减少了肿瘤细胞在代谢应激时发Th坏死的机会,而对于肿瘤细胞群体而言,需要一部分细胞发Th坏死,以引发适度的炎症(有利于血管的长入、吸引免疫细胞分泌Th长因子等)。研究发现,很多类型的肿瘤在代谢应激时会“组成性”活化PI3K信号以抑制自噬(由于凋亡通路已受阻,抑制自噬会促进坏死),但具体机制尚不清楚。
Inhibiting autophagy for cancer
therapy.A,surgery,
chemotherapy,targeted
therapies,and radiation can all
activate autophagy.Treatment
of cancer cells with chloroquine
(CQ)derivatives leads to
deacidification of lysosomes
followed by an accumulation of
ineffective autophagic vesicles.
In cells dependent on
autophagy for survival,
autophagy inhibition with
chloroquine leads to cell death.
B and C,electron micrographs
of PC3prostate cancer cells
either untreated(B)or treated
with chloroquine(C).Bar,2
μm.
自噬与肿瘤的关系可能是双重的。①对不同的细胞,自噬的作用可能不同。②相同的细胞在不同的外部因素作用时,自噬的作用可能不同。③在肿瘤发Th发展的不同阶段,自噬的作用可能不同。肿瘤Th长的早期阶段自噬增强,是由于此时肿瘤的血管化作用不足,癌细胞的营养供给有限,需要通过自噬为自身提供营养。肿瘤进入发展阶段后基因变异积累,使包括B e c li n1在内的众多抑癌基因失活,自噬活力降低。④对单个细胞和对整个肿瘤阻滞的作用可能不同。
自噬功能不全的细胞易于坏死,但是坏死组织产Th的细胞因子(包括部分Th长因子)反而会促进肿瘤的Th长。上述各种假设均有待证实。肿瘤为细胞分化障碍性的疾病已得到肯定,但自噬在肿瘤细胞的分化抑制过程中起着什么样的作用,自噬水平提高是抑制分化甚至导致去分化还是促进分化等问题尚未解决。
6自噬的研究方法概述
正常培养的细胞自噬活性很低,不适于观察,因此,必须对自噬进行人工干预和调节,经报道的工具药有:
(一)自噬诱导剂
1)B r e d e l d i n A/T h a p s i g a r g i n/T un i c a m y c i n:模拟内质网应激
2)C a r b a m a z e p i n e/L-690,330/L i t h i u m C h l o r i d e(氯化锂):I M P a s e抑制剂(即I no s i t o l m ono p ho s p h a t a s e,肌醇单磷酸酶)
3)Earle's平衡盐溶液:制造饥饿
4)N-A c e t y l-D-s p h i ngo s i n e(C2-c e r a m i d e):C l a ss I P I3K P a t h w ay抑制剂
5)R a p a m y c i n:m T O R抑制剂(这是最常用的)6)
X e s t o s p ong i n B/C:I P3R阻滞剂
(二)自噬抑制剂
1)3-Methyladenine(3-MA):(Class III PI3K)hVps34抑制剂
2)Bafilomycin A1:质子泵抑制剂
3)Hydroxychloroquine(羟氯喹)
除了选用上述工具药外,一般还需结合遗传学技术对自噬相关基因进行干预:包括反义RNA干扰技术(Knockdown)、突变株筛选、外源基因导入等。
7汉恒自噬研究特色服务
汉恒Th物已开发并完善了多套自噬相关的研究体系
和工具,并积累了丰富的自噬研究经验。
细胞经诱导或抑制后,需对自噬过程进行观察和检测,常用的策略和技术有:
1)观察自噬体的形成由于自噬体属于亚细胞结构,普通光镜下看不到,因此,直接观察自噬体需在透射电镜下。Phagophore的特征为:新月状或杯状,双层或多层膜,有包绕胞浆成分的趋势。自噬体(AV1)的特征为:双层或多层膜的液泡状结构,内含胞浆成分,如线粒体、内质网、核糖体等。自噬溶酶体(AV2
)的特征为:单层膜,胞浆成分已降解。(a u t o p h a g i c va c uo l e ,AV)
2)在荧光显微镜下采用GFP-LC3等融合蛋白来示踪自噬形成:(常用)
GFP-LC3单荧光指示体系:由于电镜耗时长,不利于监测(Monitoring)自噬形成。我们利用LC3在自噬形成过程中发Th 聚集的现象开发出了GFP-LC3指示技术:无自噬时,GFP-LC3融合蛋白弥散在胞浆中;自噬形成时,GFP-LC3融合蛋白转位至自
噬体膜,在荧光显微镜下形成多个明亮的绿色荧光斑点,一个斑点相当于一个自噬体,可以通过计数来评价自噬活性的高低。汉恒Th物已开发出高效的评价用GFP-LC3病毒载体,通过瞬时高效感染细胞,配合活细胞工作站成功评价自噬流。
双荧光指示体系:汉恒Th物科技(上海)有限公司已开发出用于表达m R F P-G F P-L C3融合蛋白的病毒产品。m R F P用于标记及追踪LC3,GFP的减弱可指示溶酶体与自噬小体的融合形成自噬溶酶体,即由于GFP荧光蛋白对酸性敏感,当自噬体与溶酶体融合后
G F P荧光发Th淬灭,此时只能检测到红色荧光。
我们在显微镜成像后红绿荧光m e r g e后通过m e r g e后出现的黄色斑点即只是自噬体.红色的斑点指示自噬溶酶体,通过不同颜色斑点的计数可以清晰的看出自噬流的强弱。
如下图:细胞转染mRFP-GFP-LC3病毒后给予氨基酸剥夺处理2小时后出现明显增强的自噬以及自噬流。
3)利用W e s t e r n B l o t检测L C3-II/I比值的变化以评价自噬形成(L C3抗体购自s i g m a,L8918)。自噬形成时,胞浆型L C3(即L C3-I)会酶解掉一小段多肽,转变为(自噬体)膜型(即L C3-II),因此,L C3-II/I比值的大小可估计自噬水平的高低。(N o t e:L C3抗体对L C3-II有更高的亲和力,会造成假阳性。方法2和3需结合使用,同时需考虑溶酶体活性的影响。)
白p62,p62i s s e l e c t i v e l y i n c o r p o r a t e d i n t o a u t o p h a go s o m e s t h r ough d i r e c t b i nd i ng t o L C3a nd i s e ff i c i e n t l y d e g r a d e d b y a u t o p h a g y;t hu s,t h e t o t a l c e ll u l a r ex p r e ss i on l e v e l s o f p62i n v e r s e l y c o rr e l a t e w i t h a u t o p h a g i c a c t i v i t y.(p62蛋白水平的多少与自噬流的强弱有着反比例关系)
自噬(Autophagy)及其研究方法概述汉恒Th物技术服务手册
目录 1概念 2自噬的过程 3自噬的特性 4自噬过程的调控 5自噬与肿瘤的关系 6自噬的研究方法概述7汉恒自噬研究特色服务
自噬研究相关产品及服务 1.病毒工具(独家推出) mRFP-GFP-LC3腺病毒系统,可高效感染目的细胞,表达mRFP-GFP-LC3,感染后细胞可在荧光显微镜下实时观察自噬发Th过程(具体内容后面有介绍); 2.自噬相关服务 汉恒Th物可提供自噬研究整体科研服务,若您的时间紧张或是对实验有所顾忌,我们可以为您代劳部分实验内容; 3.自噬研究相关试剂 汉恒Th物可以根据您的实验需求为您提供最实用的试剂产品,让你用的放心,省心!
产品厂商规格A14292,Premo自噬TB/GFP TR-FRET invitrogen6000Tests LC3B抗体试剂盒 pllabs0.1mg Anti-MAP1A/LC3A/B自噬微管相关蛋白 轻链3抗体 pllabs0.1mg Anti-MAP1LC3A(microtubule- associated protein1light chain 3)自噬微管相关蛋白轻链3抗体 Invitrogen1mg/1ml 兔抗人、大、小APG4B细胞自噬相关 抗体\Anti-APG4B/AUTL1 BD1mg/1ml 自噬微管相关蛋白轻链3抗体\ Anti-MAP1LC3A Anti-SQSTM1/p62antibody abcam Sigma1g 溶酶体抑制剂Hydroxychloroquine (羟氯喹) mTOR抑制剂rapamycin Sigma20mM 自噬抑制剂3-Methyladenine(3-MA)Sigma100mg
Advances in Clinical Medicine 临床医学进展, 2019, 9(3), 163-179 Published Online March 2019 in Hans. https://www.doczj.com/doc/1113300931.html,/journal/acm https://https://www.doczj.com/doc/1113300931.html,/10.12677/acm.2019.93027 Advances in the Regulation of Autophagy Dan Xia Pathology Department of Shandong Medical College, Linyi Shandong Received: Feb. 4th, 2019; accepted: Feb. 13th, 2019; published: Feb. 25th, 2019 Abstract In this review, we will describe the dynamic progress how cells form isolation membranes with the participation of various autophagy-related proteins under the stimulation of upstream signals such as MTOR and AMPK, and further extend to form autophagic characteristic structures “auto-phagosome”, and how mature autophagosomes combine with lysosome to complete the degrada-tion and reuse of cytoplasmic substances. In addition, the research progress of post-translational modification (including phosphorylation, glycosylation, ubiquitination, acetylation and mercaptan modification) in regulating autophagy was briefly reviewed. It was pointed out that post-translational modification of autophagic proteins played an important role in the process of autophagy. Understanding which amino acid residues in autophagic proteins are modified and confirming the expression of these modified amino acids in related diseases will provide impor-tant targets for disease diagnosis and treatment. Keywords Autophagy, MTOR, Post-Translational Modification 细胞自噬调控的研究进展 夏丹 山东医学高等专科学校病理教研室,山东临沂 收稿日期:2019年2月4日;录用日期:2019年2月13日;发布日期:2019年2月25日 摘要 本文介绍了细胞在接受MTOR、AMPK等上游信号刺激下,在多种自噬相关蛋白参与下如何形成隔离膜、并进一步延伸形成自噬特征性结构“自噬体”以及成熟的自噬体如何与溶酶体结合完成胞浆物质的降解
自噬研究鼻祖的最终选择 细胞自噬是细胞应对恶劣环境的一种主动反应,就是将自身一部分动员出来,采用自吃的方式,作为能量物质来应对各种不利因素,细胞凋亡则是细胞整体的主动死亡方式,最近有研究发现细胞坏死也存在一种主动的方式被称为程序性坏死,细胞自噬也是一种程序性坏死的类型。细胞自噬(autophagy)是继细胞凋亡(apoptosis)后,近年来生命科学领域的又一热门研究方向。 比利时科学家克里斯汀·德迪夫主要的研究领与在生物化学与细胞生物学,上世纪50年代,他利用刚刚出现的细胞分级分离技术(通过超速离心来分离细胞成分),发现了溶酶体(lysosome)和过氧化物酶体(peroxisome),让人们对细胞内部结构有了更清楚的认识,极大推动了细胞生物学研究。1974年因“细胞的结构和功能组织方面的发现(for their discoveries concerning the structural and functional organization of the cell)”而与阿尔伯特·克劳德、乔治·埃米尔·帕拉德分享了诺贝尔生理学或医学奖。后来,随着研究的深入,德迪夫的兴趣逐渐转向细胞起源,例如内共生学说。 克里斯汀·德迪夫Christian de Duve在上世纪50年代通过电镜观察到自噬体(autophagosome)结构,并且在 1963 年溶酶体国际会议(CIBA Foundation Symposium on Lysosomes)上首先提出了“自噬”这种说法。因此克里斯汀·德迪夫被公认为自噬研究的鼻祖。目前根据发生过程分为三类:Macroautophagy,Microautophagy和
自噬(Autophagy)及其研究方法概述 一、背景 概念: 目前根据发生过程分为三类:Macroautophagy,Microautophagy和Chaperone-mediated autophagy CMA), 大自噬(Macroautophagy)即我们说的自噬(autophagy);微自噬(Microautophagy):是指溶酶体主动、直接吞噬胞浆成分的一种方式;分子伴侣介导的自噬(Chaperone-mediated autophagy,CMA):一些分子伴侣,如hsp70,能帮助未折叠蛋白转位入溶酶体。通常说的自噬泛指Macroautophagy. 自噬是细胞内的一种“自食(Self-eating)”的现象,凋亡是“自杀(Self-killing)”的现象,二者共用相同的刺激因素和调节蛋白,但是诱发阈值和门槛不同,如何转换和协调目前还不清楚. 自噬是指膜(目前来源还有争议,大部分表现为双层膜,有时多层或单层)包裹部分胞质和细胞内需降解的细胞器、蛋白质等形成自噬体(autophagosome),最后与溶酶体融合形成自噬溶酶体(autophagolysosome),降解其所包裹的内容物,以实现细胞稳态和细胞器的更新。自噬的步骤可以大概总结为下面四步: 步骤1:细胞接受自噬诱导信号后,在胞浆的某处形成一个小的类似“脂质体”样的膜结构,然后不断扩张,但它并不呈球形,而是扁平的,就像一个由2层脂双层组成的碗,可在电镜下观察到,被称为Phagophore,是自噬发生的铁证之一。 步骤2:Phagophore不断延伸,将胞浆中的任何成分,包括细胞器,全部
揽入“碗”中,然后“收口”,成为密闭的球状的autophagosome,即“自噬体”。电镜下观察到自噬体是自噬发生的铁证之二。有2个特征:一是双层膜,二是内含胞浆成分,如线粒体、内质网碎片等。 步骤3:自噬体形成后,可与细胞内吞的吞噬泡、吞饮泡和内体融合(这种情况不是必然要发生的)。 步骤4:自噬体与溶酶体融合形成autolysosome,期间自噬体的内膜被溶酶体酶降解,2者的内容物合为一体,自噬体中的“货物”也被降解,产物(氨基酸、脂肪酸等)被输送到胞浆中,供细胞重新利用,而残渣或被排出细胞外或滞留在胞浆中。 自噬的特性: 1)自噬是细胞消化掉自身的一部分,即self-eating,初一看似乎对细胞不利。事实上,细胞正常情况下很少发生自噬,除非有诱发因素的存在。这些诱发因素很多,也是研究的热门。既有来自于细胞外的(如外界中的营养成分、缺血缺氧、生长因子的浓度等),也有细胞内的(代谢压力、衰老或破损的细胞器、折叠错误或聚集的蛋白质等)。由于这些因素的经常性存在,因此,细胞保持了一种很低的、基础的自噬活性以维持自稳。 2)自噬过程很快,被诱导后8min即可观察到自噬体(autophagosome)形成,2h后自噬溶酶体(autolysosome)基本降解消失。这有利于细胞快速适应恶劣环境。 3)自噬的可诱导特性:表现在2个方面,第一是自噬相关蛋白的快速合成,这是准备阶段。第二是自噬体的快速大量形成,这是执行阶段。 4)批量降解:这是与蛋白酶体降解途径的显着区别
细胞自噬的研究进展 孙雅婧,郭青龙* 中国药科大学生理教研室,南京210009 细胞自噬(autophagy )是指细胞内受损、变性或衰老的蛋白质和细胞器被运输到溶酶体,溶酶体对其消化降解,以胞质内自噬体的出现为标志的细胞自我消化过程,以双层膜结构包裹部分胞质和细胞器的自噬体为判断指标。早在1962年,自噬现象的奠基人Ashford 和Porten 在人的肝细胞中用电子显微镜观察到了自噬现象。随着分子生物技术的发展,人们对自噬的形态特点和分子机制了解逐步深入。近年来对自噬的研究十分广泛,自噬是在体内普遍存在的过程,其在清除代谢废物进而回收能量为细胞正常运转提供能量的过程中发挥重要作用,因而对自噬的研究尤为重要。 1 细胞自噬的研究现状 1.1 自噬的过程 自噬的过程分为四个阶段(见图1)。 第一阶段:自噬诱导信号被细胞接受后,类“脂 质体”碗状结构即在胞浆某处形成小的膜结构,在电镜下观察到其不断扩张、呈非球形、扁平状双层膜的碗状结构,称为自噬前体(phagophore ),这种结构的电镜观察结果是指示自噬发生的金标准之一。 第二阶段:不断延伸的自噬前体,将胞浆中的若干成分(包括细胞器)收口包入,成为密闭的球状自噬体(autophagosome )。自噬体的电镜观察结果是指示自噬发生的金标准之一。自噬体的特征有两个:双层膜,内含诸如线粒体、内质网碎片等胞浆成分。 第三阶段:自噬体形成后,可能与细胞内吞的吞噬泡(phagocytic vacuole )、吞饮泡(pinosome )和内 体(endosome )融合(此阶段为非必需步骤)。 第四阶段:自噬体与溶酶体(lysosome )发生融合,形成自噬溶酶体(autolysosome )。期间溶酶体酶降解自噬体的内膜,使两者的内容物合为一体,自噬体中的包含物被降解,将产物诸如氨基酸、脂肪酸之类输送到胞浆中,重新利用供能,残渣则被排出细胞外或滞留于胞浆[1]。 1.2自噬的分类 根据细胞内底物运送到溶酶体腔方式的不同, 哺乳动物细胞自噬分为3种主要方式:巨自噬(macroautophagy )、微自噬(microautophagy )和分子伴侣介导自噬(chaperone-mediated autophagy ,简称 CMA )。巨自噬是最主要的自噬形式,在巨自噬中由 内质网来源的膜包绕待降解物,形成自噬体后与溶酶体融合并降解其内容物;然而在微自噬中,溶酶体膜直接内陷包裹长寿命蛋白等,并在溶酶体内降解,没有形成自噬小体的过程;分子伴侣介导自噬则为胞浆内蛋白结合到分子伴侣后转运到溶酶体腔中,被溶酶体酶消化。CMA 的底物是可溶蛋白分子,因此CMA 降解途径在清除蛋白质时有选择性,而前两者无明显的选择性[3]。 2自噬与凋亡 在多细胞生物体内,维持自身的稳态和内环境 的平衡,是保持复杂生物体系正常运转的重要条件。正常的细胞体系当中,有细胞的生长增殖必然 摘要本文综述了细胞自噬概念的研究现状、自噬与凋亡、自噬与肿瘤的关系,展望了自噬在抗癌药物介导的细胞死亡中发挥的重要作用以及自噬现象的临床意义。 关键词自噬;凋亡;肿瘤 中图分类号 Q25;R979.1文献标志码A 文章编号1673-7806(2012)03-236-04 作者简介 孙雅婧,女,硕士生E-mail:yj7782@https://www.doczj.com/doc/1113300931.html, 通讯作者郭青龙,男,教授,博士生导师,研究方向:肿瘤药理学 E-mail:anticancer_drug@https://www.doczj.com/doc/1113300931.html, 收稿日期 2012-03-14 修回日期2012-03-26* 图1自噬的基本过程[2] Jun;20(3) 236
龙源期刊网 https://www.doczj.com/doc/1113300931.html, 哺乳动物细胞悬浮驯化方法研究进展 作者:陆陈晨谭树华 来源:《科学与财富》2018年第13期 摘要:哺乳动物细胞表达系统是药用蛋白的主要表达方式,传统的贴壁细胞培养有诸多不利,本文介绍常用的贴壁细胞悬浮驯化的方法,通过将贴壁细胞驯化成悬浮细胞,提高哺乳动物细胞表达水平,降低生产成本。 关键词:哺乳动物细胞;驯化;无血清培养 重组蛋白表达是研究蛋白质功能与结构、药物筛选以及后续应用的关键环节,常规的蛋白表达系统有原核表达和真核表达两大类。现代医药工业的快速发展需要重组蛋白拥有接近天然蛋白分子的复杂结构、理化性质和生物功能,特别是糖蛋白及抗体类药物。这就要求表达的重组蛋白需要正确的翻译后修饰、组装和折叠,这是原核表达系统所欠缺的[1-2]。真核表达系统包括酵母表达系统、昆虫杆状病毒表达系统和哺乳动物细胞表达系统,其中以哺乳动物细胞表达系统较为常用。 1 贴壁细胞表达外源蛋白的缺点 传统细胞培养或表达外源重组蛋白采用贴壁细胞进行表达,这种表达方式虽然操作简便,但细胞密度和表达量较低,并且培养时需要加入血清,亦具很多缺点[3]: 1.1 血清组分复杂,含有多种杂蛋白不利于目的蛋白纯化; 1.2 血清批间差异较大,不同批次的血清浓度不稳定,影响工艺的连贯性; 1.3 血清中可能携带有未充分灭活的动物病毒或支原体,有细胞污染和传染人类的风险。 2 细胞无血清悬浮培养的优势 细胞无血清悬浮培养由于具有培养基的化学成分限定、批间产品质量稳定、简化下游生产、生理环境易于控制等优点,在重组蛋白表达、单克隆抗体制备和疫苗生产等中应用广泛。 3 贴壁细胞驯化成悬浮细胞的方法 3.1 分子生物学手段改造 贴壁细胞驯化成悬浮细胞通常有两种方法,一种是通过分子生物学手段,改造贴壁细胞。Noelle-Anne Sunstrom, Sugiyono 等人通过将编码胰岛素样生长因子 I(IGF-I)和转铁蛋白的基因稳定整合到CHO-K1细胞系的基因组中,使用 lac 操纵子/阻遏子系统调控 IGF-I 基因的表
线粒体自噬 线粒体自噬研究概论 关于线粒体自噬 线粒体自噬(mitophagy)是指细胞通过自噬的机制选择性地清除线粒体的过程。选择性清除受损伤或功能不完整的线粒体对于整个线粒体网络的功能完整性和细胞生存来说十分关键。 线粒体自噬主要的作用有几个方面: 1.选择性清除功能受损的线粒体 2.选择性调节细胞内线粒体数量 3.通过线粒体影响诸多生理和病理学过程 Fig:The pathways of mitophagy for quality control and clearance of mitochondria Cell Death and Differentiation(2013)20,31–42
线粒体自噬的信号通路 1)Pink/Parkin pathway 2)Bnip3/Nix pathway 3)FUNDC1pathway Fig.Mitophagy pathway:Pink1/Parkin OR Bnip3/Nix Pink1/Parkin pathway:E3泛素连接酶Parkin和蛋白激酶Pink1一起介导了线粒体膜电位下降,引起的线粒体自噬的发生,当线粒体损伤后,线粒体膜电位下降,引起Pink1蛋白在损伤线粒体上的积累,能够吸引Parkin到损伤的线粒体上。Parkin使得线粒体外膜上的很多蛋白发生泛素化,从而能够募集其他一些相关蛋白,介导线粒体自噬的发生。
线粒体自噬 汉恒线粒体自噬研究工具与研究方法 汉恒生物有多种线粒体自噬病毒研究工具可以提供,便于直接感染目的细胞后直观地观察线粒体自噬的变化 一、汉恒线粒体自噬表型研究工具 1)Ad-GFP-LC3腺病毒病毒系统,可高效感染目的细胞,表达GFP-LC3,感染感染后细胞可在荧光显微镜下实时观察自噬的整体水平(由于GFP荧光偏弱,暂停Ad-GFP-LC3销售, 慢病毒单标LV-GFP-LC3荧光正常,正常销售); 2)Ad-HBmTur-Mito腺病毒系统(红光标记),为汉恒生物自主研发的线粒体特异性定位荧光探针(pHBmTur-Mito)可准确定位标记线粒体,结合汉恒独家推出的双荧光LC3细胞自噬腺病毒的使用,即可准确实时地追踪线粒体自噬的动态过程; 使用方法:Ad-GFP-LC3+Ad-HBmTur-Mito共感染目的细胞,confocal检测双荧光共定位的情况,如果共定位,则存在线粒体自噬!(下图说明:红色标记为线粒体,绿色标记自噬小体,二者有共定位时代表自噬发生) 二、汉恒线粒体自噬通路研究工具 1)Ad-Parkin-EGFP 2)Ad-Bnip3-EGFP+Ad-Nix-EGFP 3)Ad-FUNDC1-EGFP
发表时间:2011-6-2 来源:《中外健康文摘》2011年第8期作者:刘杉珊李薇[导读] 自噬是真核细胞特有的普遍生命现象,在维持细胞自我稳态、促进细胞生存方面起重要作用。 刘杉珊李薇(吉林大学第一医院血液肿瘤中心吉林长春130021) 【中图分类号】R329 【文献标识码】A【文章编号】1672-5085 (2011)8-0448-04 【摘要】自噬是真核细胞特有的普遍生命现象,在维持细胞自我稳态、促进细胞生存方面起重要作用,广泛参与多种生理和病理过程。自噬与细胞卫士p53的关系密切,目前已成为肿瘤研究中的一个新热点。本文对自噬的概念、生物学特性、自噬过程及其信号调控、以及与p53的关系作以概述,同时简要概述了目前自噬的研究方法和检测方法并提出问题和展望,为进一步研究自噬奠定基础。 【关键词】自噬分子机制p53 近年来,自噬作为II型程序性细胞死亡,越来越成为除凋亡之外备受关注和研究的领域。目前自噬不仅被证实是一种细胞自我死亡的方式,同时也是一种细胞的自我保护机制,在肿瘤、老化和神经退化等细胞增殖和死亡紊乱疾病中发挥着重要的作用。因此通过对自噬的发生过程、分子机制、信号调控、及与细胞卫士P53之间关系的总结,为进一步研究其机制调控和临床应用奠定坚实的基础。 1 自噬的概念 自噬又称为II型程序性细胞死亡(type II programed cell death)是以胞质内出现双层膜结构包裹长寿命蛋白和细胞器的自噬体为特征的细胞“自我消化”的一系列生化过程。正常细胞内的物质主要有两种降解途径,一种通过蛋白酶体被降解,另一种是通过自噬作用。自噬主要降解细胞质的长寿命蛋白和一些细胞器的降解,这种降解有助于细胞内组分和细胞器的正常更新,而蛋白酶体主要降解胞内的短寿命蛋白[1]。 根据细胞内底物运送到溶酶体腔方式的不同,哺乳动物细胞可分为3种主要方式:大自噬(macroautophagy)、小自噬(microautophagy)和分子伴侣介导自噬(chaperone—mediated autophagy, CMA)。无论大自噬还是小自噬都可以选择性和非选择性吞噬大的物质,CMA为胞浆内蛋白结合到分子伴侣后转运到酶体腔中,被溶体酶消化。由于目前对大自噬及其在疾病发生的作用的研究日益增多,所以本综述着重介绍大自噬。 2 自噬的诱导
哺乳动物自噬研究方法 【摘要】 自噬涉及到许多的生理和病理过程,因此,我们越来越需要科学地准确认识,并且量化操控自噬的过程。但是,由于自噬涉及了许多动态复杂的过程,关于它的研究分析经常不正确。在本文中,我们探讨监控自噬以及调控自噬活性的各种方法,主要集中关注哺乳动物中的大自噬。 【简介】 过去的十年中,有大量的研究围绕一个基本的细胞生物学通路“自噬”(希腊语中意味自我吞噬)。一系列进化上保守的基因(最初在酵母中被鉴定)被发现是自噬过程中所必需的,这一发现使得科学家能够去发现大量的自噬的功能,如:维持自身平衡稳态、参与细胞发展和其他生理活动。此外,越来越多的证据证明自噬的失控可能与许多哺乳动物的疾病发生有关。因此,科学家们迫切需要能够准确的检测自噬和研究在不同生物学进程中的功能的方法,特别是在哺乳动物系统。 在哺乳动物自噬的研究历史中一直有两个主要的困扰。首先的挑战在于如何将“一个动态的进程”和“静态的测量”进行捕获,并且这个固有的局限性与基于这些测量作出的生物学推论相关。第二个挑战在于将“形式”与“功能”分离,并且避免在给定的生理条件下,基于自身检测到(或没有)导致的将生理功能归至自噬的这个常见陷阱。这两个挑战可能导致了在我们研究哺乳动物自噬功能的历史中的许多误解。例如,一些神经退行性和肌退化性疾病最初被认定的结果,至少一部分被认为是由于自噬的增加(基于显微镜下观察到通路中早期的中间产物的增加)。然而实际上,早期中间产物的蓄积在这些疾病中代表着后阶段自噬通路的阻滞。自噬的一个常见的形态特征是细胞的垂死状态,但这也被错误的认为是一种细胞死亡通路,然而,现在似乎已经很明确自噬的主要功能是帮助细胞抵抗各种“生死攸关”的应激条件并使细胞存活。 这些哺乳动物自噬研究中的历史挑战部分已经通过将阐述自噬分子机制的最新进展运用到新的自噬研究的方法被克服。因此,在过去的十年里,许多新的技术被发明,用于动态监控自噬和通过调控自噬来明确其在给定的细胞状态下的功能。本文的目的在于提供一个重要的关于目前可行的研究哺乳动物自噬的技术和这些技术在解释过程中的限制的概述。更多的各种技术的细节信息可以再其他综述中获得。 自噬的基础知识 自噬是一般用于描述细胞内物质包括细胞器到溶酶体中降解的过程。在自噬的三种类型中(大自噬、小自噬和分子伴侣介导的自噬),研究得最多的就是大自噬。分子伴侣介导的自噬是通过伴侣蛋白展开蛋白质,直接将细胞质蛋白转移,穿过溶酶体膜。小自噬涉及溶酶体膜表面的内陷提供一小部分细胞质进入溶酶体内腔。 大自噬(简称自噬)是本文主要关注的通路。这个通路从酵母到哺乳类都呈现保守,它是通过一些特定的细胞器(自噬体)介导的。在初始的诱导阶段,一个小的囊状的称作隔离膜或者延长的吞噬膜,随后封闭一部分细胞质,导致双层膜结构即自噬体的形成。然后自噬体的外膜融合至一个溶酶体(形成自噬溶酶体),导致所封闭的物质和自噬体的内膜共同降
自噬现象及其分子机制的研究进展 发表时间:2011-06-02T10:04:12.903Z 来源:《中外健康文摘》2011年第8期作者:刘杉珊李薇 [导读] 自噬是真核细胞特有的普遍生命现象,在维持细胞自我稳态、促进细胞生存方面起重要作用。 刘杉珊李薇(吉林大学第一医院血液肿瘤中心吉林长春 130021) 【中图分类号】R329 【文献标识码】A【文章编号】1672-5085 (2011)8-0448-04 【摘要】自噬是真核细胞特有的普遍生命现象,在维持细胞自我稳态、促进细胞生存方面起重要作用,广泛参与多种生理和病理过程。自噬与细胞卫士p53的关系密切,目前已成为肿瘤研究中的一个新热点。本文对自噬的概念、生物学特性、自噬过程及其信号调控、以及与 p53的关系作以概述,同时简要概述了目前自噬的研究方法和检测方法并提出问题和展望,为进一步研究自噬奠定基础。 【关键词】自噬分子机制 p53 近年来,自噬作为II型程序性细胞死亡,越来越成为除凋亡之外备受关注和研究的领域。目前自噬不仅被证实是一种细胞自我死亡的方式,同时也是一种细胞的自我保护机制,在肿瘤、老化和神经退化等细胞增殖和死亡紊乱疾病中发挥着重要的作用。因此通过对自噬的发生过程、分子机制、信号调控、及与细胞卫士P53之间关系的总结,为进一步研究其机制调控和临床应用奠定坚实的基础。 1 自噬的概念 自噬又称为II型程序性细胞死亡(type II programed cell death)是以胞质内出现双层膜结构包裹长寿命蛋白和细胞器的自噬体为特征的细胞“自我消化”的一系列生化过程。正常细胞内的物质主要有两种降解途径,一种通过蛋白酶体被降解,另一种是通过自噬作用。自噬主要降解细胞质的长寿命蛋白和一些细胞器的降解,这种降解有助于细胞内组分和细胞器的正常更新,而蛋白酶体主要降解胞内的短寿命蛋白[1]。 根据细胞内底物运送到溶酶体腔方式的不同,哺乳动物细胞可分为3种主要方式:大自噬(macroautophagy)、小自噬(microautophagy)和分子伴侣介导自噬(chaperone—mediated autophagy, CMA)。无论大自噬还是小自噬都可以选择性和非选择性吞噬大的物质,CMA为胞浆内蛋白结合到分子伴侣后转运到酶体腔中,被溶体酶消化。由于目前对大自噬及其在疾病发生的作用的研究日益增多,所以本综述着重介绍大自噬。 2 自噬的诱导 当细胞受到饥饿、高温、低氧及荷尔蒙等外界刺激, 或细胞器的损坏、突变蛋白的积聚及微生物的侵袭等应激时, 可引起细胞自噬的发生。雷帕霉素靶点TOR蛋白激酶(target of rapamycin)作为细胞中氨基酸、ATP和激素的感受器, 是调控细胞生长的关键因子之一,其是细胞氮水平的负调节剂,参与自噬反应的调节[3]。研究表明, TOR对自噬反应的调节与细胞的营养条件有关,当营养充足时, 细胞中TOR被激活而抑制自噬,而当细胞处于饥饿状态时, TOR被抑制而促进自噬。在哺乳动物细胞中又有Tor蛋白,同时Tor蛋白也随着周围环境的改变来调节自噬但是调节机制要较酵母细胞复杂。在哺乳动物细胞中mTor的上游负调节有I型PI3K激酶,PDK1和AKt/PKB,而PTEN能拮抗PI3K而促进自噬。同时伴随着自噬的发生。TOR 的失活引起Atg结构的改变, 如Atg13p部分去磷酸化, 在营养充足时Atg13可高度磷酸化而不易于Atg1激酶结合从而抑制自噬发生。相反,在细胞处饥饿状态时Atg13可很快与Atg1结合,从而增加自噬。同时mTor可增强与Atg17p和Atg1p之间的相互作用,从而调节其激酶活性。 3 自噬过程 自噬其发生过程大致分为3个阶段:(1)在饥饿、氧化应激损伤等情况下,粗面内质网的非核糖体区域、高尔基体等来源的自噬体膜脱落形成杯状分隔膜,包绕在被降解物(如蛋白质降解产物,细胞器和核糖体等)周围[3,4] ;(2)分隔膜逐渐延伸,将要被降解的胞浆成分完全包绕形成双层膜自噬体;(3)自噬体通过细胞骨架微管系统运输至溶酶体,与之融合形成自噬溶酶体并降解其内成分,自噬体膜脱落再循环利用。因此自噬可被视为细胞的“回收工厂”,其不仅促进能量的利用同时转运无功能的蛋白和细胞器。而调节这个复杂的过程的分子水平有五个关键阶段[5]:(1)形成吞噬泡(2)Atg5-12复合物与Atg16L并且多聚化(3)LC3形成并且插入吞噬泡膜(4)包绕预被降解物(5)自噬体与溶酶体融合。 3.1吞噬泡的形成 酵母细胞的吞噬泡膜形成于PAS,而哺乳动物细胞吞噬泡膜来其于内质网[6,7],高尔基体[3,8,9]等,甚至可能在严密调控下来源于细胞核[10]。酵母细胞形成吞噬泡膜需要Atg1激酶与Atg13和Atg17复合物,该复合物可能通过跨膜蛋白Atg9补充脂质而促进吞噬泡膜的扩增[4,11]。这个过程可通过Tor激酶调节,其磷酸化Atg13从而阻止其与Atg1激酶作用[13]哺乳动物细胞吞噬泡的形成过程仍需要进一步研究。III型PI3K激酶,Vps34和Atg6/Beclin-1在哺乳动物细胞的吞噬泡形成和自噬的作用已经很好的认识。Vps34参与细胞膜的形成,但其需要与Beclin-1和其他调控蛋白来选择性的参与自噬过程[14]。PI3P在吞噬泡的延伸和不断补充Atg蛋白过程中起重要作用,Vps34与PI3K以PI为底物获得PI3P过程中,Vps34是十分重要的[15]。Vps34与Beclin-1作用可增加PI3P的水平。其他与Vps34与Beclin-1复合物结合促进自噬调节蛋白为UCRAG,BIF-1,Atg14L和AMBRA[16,17] ,或抑制自噬蛋白Rubicon, Bcl-2[18,19]. Beclin-1与Bcl-2结合可破坏Beclin-1与Vps34的作用,所以Beclin-1与Bcl-2,Bcl-XL作用与内质网可抑制自噬[21]。 3.2 Atg5-Atg12复合物形成 由Atg3、Atg5、Atg7、Atg10、Atgl2和LC3(Microtubule—associated protein 1 light chain 3,MAP1-LC3)参与组成的两条泛素样蛋白加工修饰过程,在Atg 12结合过程和LC3修饰过程起着至关重要的作用。有的两个泛素样蛋白系统参与形成Atg5-Atg12复合物和LC3, Atgl2首先由El样酶Atg 7活化,之后转运至E2样酶Atgl0,最后与Atg5结合,形成自噬体前体。Atg5-12复合物与Atg16L结合形成Atg5、Atgl2和Atgl6L 以复合物形式存在,这种结合一方面促进了自噬泡的伸展扩张,使之由开始的小囊泡样、杯样结构逐渐发展为半环状、环状结构;另一方面,Atg5复合物与自噬泡膜的结合还促进了LC3-向自噬泡的募集。Atg5-12复合物不依赖于自噬的作用,一旦自噬体形成,Atg5-Atgl2-Atgl6L复合物就脱离胞膜,使之Atg5-12复合物不是自噬的标志物。 3.3 LC3形成 第二条泛素样蛋白加工修饰过程参与LC3B 的形成,LC3B由哺乳动物细胞Atg8同源染色体编码。LC3B 被Atg4分解,生成LC3B-I,并暴露出其羧基末端的甘氨酸残基。同样LC3B-I也被E1样酶Atg7活化,转运至第二种E2样酶Atg3,并被修饰成膜结合形式LC3B-II。LC3B-II定位于前自噬体和自噬体,使之成为自噬体的标志分子。一旦自噬体与溶酶体融合,自噬体内的LC3II即被溶酶体中的水解酶降解。哺乳动物
MDC:取12 mg粉末溶于720 nl DMSO使其浓度为50 mmol/L,分装后-20冰箱保存。 临用前用MEM稀释到终浓度50 umol/L; Rapamycin:用MEM培养基配成终浓度为1 umol/L,现用现配; 400ng/ml喹乙醇:称取4 mg喹乙醇,DMSO预溶(体积<0.1%)后加入10 ml MEM培养液至完全溶解,现用现配,避光保存; 3-MA:首先用PBS溶解粉末,临用前加热至完全溶解后再加入MEM培养基至终浓度10mmol/L; PI3K抑制剂(3-MA,Wortmannin)可干扰或阻断自噬体的形成 用RAPAMYCIN诱导自噬我也查过一部分文献,有用无血清的,也有用,一般培养基的,浓度从25nM到100nM都有,用的是50nM的雷帕霉素,加入一般的培养基中,目的是排除无血清所诱导出来的自噬。 文献说饥饿初期激活的是大分子自噬,在4-6小时活力达到最大,24h后以CMA途径为主Earle's balanced salts solution (EBSS) for 48 h sigma的EBSS,货号E2888,有碳酸氢钠,有酚红的,酚红到不是很必须,只是一个PH指示作用,好看些 无血清诱导自噬:EBSS 诱导6个小时就可以了。 EBSS一定可以诱导出来,只是需要说明的是时间点的设置,因为从饥饿诱导开始半个小时就可能开始自噬了,一直到24小时都持续,所以应该设置不同的时间点观察这个作用。另外一个很大的问题是,饥饿诱导的一个很大的弊端是细胞死亡,这也是我面临的问题,就是在细胞收养的时候蛋白浓度太小了。24小时就很少了,更不要说48小时和72小时了 Hank's诱导,也就是通常所说的饥饿诱导,细胞培养到对数生长期后以Hank's替代常规完全培养基,3h后就可诱导出自噬。我用Hank's诱导了3h后电镜观察有30%细胞都有自噬这种现象,但不如国外报道的高。 sigma的氯喹的货号C6628。用氯喹做自噬抑制剂,293T细胞50uM就可以。1. 可以用双蒸水配制2. 配制后4度保存 不同的自噬抑制剂机制不同。抑制的步骤也不同。有的不能抑制lc3的剪切,但能抑制后续的步骤,Chloroquine抑制自噬体与溶酶体的融合过程,autophgy不能完成,所以lc3才会累积。因此加了抑制剂lc3之后会比不加的要高。氯喹能提高溶酶体中的pH值,使溶酶体中的酸性水解酶丧失活性,从而导致“自噬溶酶体”不能降解,因此,位于自噬体和自噬溶酶体膜上的LC3不能按时降解,表现为LC3荧光长时间的保留或WB中LC3条带变粗。 Z-VAD-FMK(caspase-3 抑制剂)抑制EV71感染所引起的细胞凋亡,观察细胞的自噬情况。研究发现,抑制细胞凋亡能增加LC3-I转化为LC3-II以及p62的降解。 1. 雷帕霉素:作为以mTOR 为靶点最经典的诱导剂已经被广为应用,推荐工作浓度为1μmol-10μmol; 2. 氯喹:氯喹(Chloroquine)作为溶酶体的抑制剂,可以抑制自噬体与溶酶体的融合从而可以用来作为自噬以及自噬流的抑制剂用于实验研究,推荐使用浓度:10umol-50umol。 正常培养的细胞自噬活性很低,不适于观察,因此,必须对自噬进行人工干预和调节,经报道的
I C M Y K —] 430 ·综述. 线粒体自噬在血管性认知障碍中的 研究进展* 刘山*解丽*张强A董艳红*畴 【关键词】线粒休自噬血管性认知障碍慢性脑低灌 注脑缺血再灌注损伤 血管性认知障碍(vascular cognitive impairment,VCI)指 由脑血管病的危险因素(高血压病、糖尿病、高脂血症和高 同型半胱氨酸血症等)、显性脑血管病(脑梗死和脑出血等) 及非显性脑血管病(白质疏松和弥漫性脑缺血等)引起的一 组从轻度认知损害到痴呆的综合征。线粒体是缺血后神经 细胞死亡的关键靶区,机体可通过自噬控制线粒体数最,其 功能紊乱是慢性脑低灌注(chronic cerebral hypoperfusion, CCH)、脑缺血再灌注损伤(cerebral ischemia reperfusion injury, CIR)所致VCI的主要机制。通过阐述线粒体自噬机 制及其在CCH、CIR所致VCI中的作用,有利千寻找药物作 用靶点,早期干预VCI的发生发展,提升患者生存质掀。 1线粒体自噬 线粒体自噬指损伤线粒体利用自噬机制选择性清除 受损的蛋白质和细胞器,控制线粒体质最与数最,在营养 不良或外界刺激时维持细胞稳态四线粒体自噬可以通过 相关分子通路介导和影响线粒体动力学平衡发生。 1.1线粒体自噬相关分子通路 1.1.1 PINKl/Parkin分子通路同源性磷酸酶张力蛋白诱导 激酶1(phosphatase and tensin homologinduced putative kinasel, PINKl)是一种丝氨酸/苏氨酸激酶。各种原因使得线粒体 功能紊乱时,线粒体膜电位降低,膜上的PINKl聚集,将 Parkin蛋白从细胞质募集到线粒体,其具有E3泛索连接 酶活性,将标记的泛索化底物通过微管相关蛋白1轻链 doi: 10.3969/j.issn.1002-0152.2020.07.012 女河北省中医药管理局科研计划项目(编号:2019158);河北省 卫生厅科研基金项目青年科技课题(编号:20160459) * 河北医科大学研究生学院(石家庄050000) A 华北理工大学 米河北省人民医院神经内三科 。通信作者(E-mail:d_yanhongniu@https://www.doczj.com/doc/1113300931.html,) | C hin? 2020 LC3相互作用区域在自噬体上募集LC3,最终导致线粒体 与自噬体结合发生自噬性降解[2]。 1.1.2 HIF -la/BNIP3/Beclinl信号通路低氧诱导因子-l (hypoxia inducible factor-I, HIF -1)是由HIF-la亚基和 HIF-lb亚基组成的异二聚体,而HIF-la在调节氧稳态中 起着关键作用。BNIP3是Bcl-2蛋白家族成员,主要表达于 线粒体和内质网。Beclinl是磷脂酰肌醇3,是细胞自噬过 程中最重要的正性调节因子。缺血缺氧时,HIF-la表达上 调,BNIP3蛋白表达上调,BNIP3和Beclinl竞争Bcl-2结 合位点,释放Beclinl,参与线粒体自噬的激活,降解受损 的线粒体,对抗各种凋亡因子[3]。 1.1.3 PI3K-Akt-mTOR通路PI3K,即磷酸肌醇激酶3; Akt,即蛋白激酶B;mTOR,哺乳动物雷帕霉索靶蛋白 (mammalian Target Of Rapamycin),是雷帕霉素的作用靶 点。LV等[4]的研究表明,缺血/低氧条件下,线粒体能量代 谢障碍,在某种程度上通过阻断PI3K/AKT/mTOR信号通 路,增强线粒体自噬,清除受损的线粒体,保护线粒体的正 常生理功能。 1.2线粒体动力学变化线粒体通过线粒体融合、分裂蛋白 精确调控,在融合和分裂形态中不断变换维持平衡。线粒 体融合蛋自主要有视神经萎缩蛋自1(Opa l)、线粒体融合 蛋自Mfnl和Mfn2。Opal或Mfnl/2缺乏的细胞可导致线 粒体碎片聚集及线粒体自噬[5--6]。D rp l(DLPl, Dymple)主要 调控线粒体分裂,其具有G TP酶活性。D rp l的下调及敲除 可抑制线粒体自噬而导致功能紊乱的线粒体聚集[7]。如果 线粒体裂变和融合失衡,则会引发线粒体膜电位改变,进 而激活线粒体自噬,导致神经元死亡。 2线粒体自噬与血管性认知障碍 在所有认知障碍性疾病中,VCI是目前唯一一个可干 预的认知障碍性疾病。干预VCI的早期阶段,延缓疾病的 发生发展,对千提升患者及其家庭的生活质最至关重要。 从临床研究来讲,CCH、CIR都是与脑血管病有关的病因, 二者均可导致VCI。CCH指长期脑血流降低导致血流动力 学性脑缺血。既往研究表明,CCH可通过诱导血管损伤,血 脑屏障系统功能失调,神经递质紊乱等因素最终导致认知 障碍[8]。CIR损伤是指脑缺血一定时间恢复血液供应后,其 功能不但未能恢复,反而出现了更加严重的脑机能障碍。 已有国内外研究表明CIR损伤可能通过能量代谢障碍、突 触损伤、炎症反应等引起认知障碍[9]。从基础研究层面来 讲,目前VCI动物模型采用两种方法较多:CD永久结扎双 侧颈总动脉的CCH模塑;@反复结扎再灌注双侧颈总动脉 的CIR模型。在分子机制上,VCI发病涉及自噬、氧化应激、
自噬荧光研究方法及具体步骤 自噬(Autophagy)一词来源于古希腊语,是“auto”(自我)与“phagein”(吞噬)的结合。自噬发生在细胞内,是一个吞噬自身细胞质蛋白或细胞器,使其包被进入双层膜囊泡(自噬体),进而与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物的过程,自噬的意义在于实现细胞本身的代谢需要和某些细胞器的更新。在自噬过程中,自噬体的形成是关键,其直径平均500nm,囊泡内包裹胞质成分和某些细胞器如线粒体、内吞体、过氧化物酶体等。与其他细胞器相比,自噬体的半衰期很短,只有8min 左右,说明自噬是细胞对于环境变化的有效反应。细胞质中的线粒体等细胞器首先被囊泡所包被,这种囊泡主要来自于内质网和高尔基体;囊泡最终形成双层膜结构,即自噬体(autophagosome);自吞噬体与胞内体融合形成中间自体吞噬泡,最终自体吞噬泡的外膜与溶酶体融合形成自噬溶酶体(autolysosome),由溶酶体内的酶降解自体吞噬泡中的内容物和内膜。 自噬观察检测方法: 1.透射电镜下直接观察自噬体Phagophore 的特征为:新月状或杯状,双层或多层膜;自噬体的特征为:双层或多层膜的液泡状结构,内含胞浆成分,如线粒体、内质网、核糖体等;自噬溶酶体的特征为:单层膜,胞浆成分已降解。 2.利用Western Blot 检测LC3-II/I 比值的变化以评价自噬形成自噬形成过程中,胞浆型LC3(LC3-I)会酶解掉一段多肽,转变为膜型LC3 (LC3-II)。故而LC3-II/LC3-I 比值的大小可估计自噬水平的高低。 3.在荧光显微镜下采用GFP-LC3 融合蛋白来示踪自噬形成无自噬时,
博 士导师新论 中 华中医药学刊 神经细胞自噬的研究进展 方永奇,刘林 (广州中医药大学第一附属医院,广东广州510405) 摘要:自噬是溶酶体降解利用细胞内物质成分的过程,是近年来分子生物学的研究热点。自噬对应激状态 下神经细胞存活、 清除神经细胞内衰老细胞器和错误折叠蛋白等起重要作用;其可作为神经细胞的保护机制,也可作为神经细胞死亡方式之一。缺血缺氧是神经细胞自噬激活的重要诱因之一。综述自噬的过程及形态特征;自噬的特性及功能;自噬体形成的一般分子机制;自噬对神经细胞的影响;自噬与神经退行性疾病;缺血缺氧下自噬调节的分子机制;自噬的诱导与抑制;自噬的检测等。 关键词:自噬;神经细胞;分子机制;综述中图分类号:R338文献标识码:A 文章编号:1673-7717(2011)03-0453-03 Review in Neuronal Autophagy FANG Yong-qi ,LIU Lin (The First Affiliated Hospital of Guangzhou University of TCM ,Guangzhou 510405,Guangdong ,China ) Abstract :Autophagy is the regulated process by which cytoplasmic organelles and other substances are delivered for lysosomal degradation.It is the research point of the molecular biology in recent years.Autophagy plays a major role in neuronal survival and the clearance of damaged or long -lived proteins and organelles.It can not only protect the neurons but also lead to neuronal death.Hypoxic -ischemic damage is a major inducer of autophagy.This review summarizes the process ,morphological features ,characteristic ,function ,general molecular mechanism of autophagy ,and the influence to the nerve cell and neurodegeneration disease ;the regulate mechanism under hypoxia -ischemia ;inducement and in-hibit ;inspect of autophagy. Key words :Autophagy ;Neuronal ;Molecular mechanism ;Review 收稿日期:2010-10-09 基金项目:广东省科技厅攻关项目(2007B031408005) 作者简介:方永奇(1957-),男,广东惠来人,研究员,博士研究生 导师,研究方向:中医药治疗脑病。 细胞的死亡方式有2种:细胞坏死和程序性细胞死亡,其中程序性细胞死亡有Ⅰ型(细胞凋亡)和Ⅱ型(自噬性细 胞死亡)两种类型[1] 。自噬(autophagy ),即自体吞噬,是指溶酶体降解利用细胞内物质成分(如长寿命蛋白和某细胞 器)的过程 [1-3] 。它具有高度保守性,乃真核细胞所特有的自我保护机制,自噬是近年来分子生物学的研究热点。自噬贯穿于正常细胞生长发育和生理病理过程,对防止如神 经退行性病变、 肿瘤、心肌病、病原微生物侵入感染等疾病以及对防止老化、延长寿命有积极作用,但过多细胞自噬则引起细胞的过量损伤导致细胞死亡。本文仅就神经细胞自噬相关研究进行综述。1自噬概述 1.1自噬的过程及形态特征 自噬的过程:前自噬体结构(Photosphere , PAS ):细胞接受自噬诱导信号(如饥饿、生长因子缺乏、缺血缺氧、微 生物感染、细胞器损伤、蛋白质折叠错误或聚集、 DNA 损伤、放疗、化疗等)后,来源于内质网的非核糖体区域、高尔基体等的自噬体膜脱落,形成杯状分隔膜,包绕被降解物。 自噬体(autophagosome )[4] :PAS 逐渐延伸,将要被降解的胞浆成分完全包绕形成密闭的球状自噬体。自噬溶酶体(au-tolysosome ):自噬体通过细胞骨架微管系统运输至溶酶体,与之融合形成自噬溶酶体,二者的内容物合为一体,并降解 其内成分, 自噬体膜脱落再循环利用,产物(氨基酸、脂肪酸等)被输送到胞浆中,供细胞重新利用,而残渣或被排出细胞外或滞留在胞浆中。电镜下观察到自噬体有两个特 征:一是双层膜, 二是内含胞浆成分,如线粒体、内质网碎片等。 1.2自噬的特性及功能 自噬具有如下特性:维持细胞稳态:细胞正常情况下很少发生自噬,除非有诱发因素的存在。自噬既可以作为一 种防御机制清除胞质内受损的细胞器、 代谢产物,进行亚细胞水平上的重构,保护受损的细胞,同时它作为一种细胞死 亡程序诱导细胞主动性死亡[5] 。自噬过程很快, 被诱导后8min 即可观察到自噬体形成,2h 后自噬溶酶体基本降解消失。自噬的可诱导性:快速合成自噬相关蛋白,导致大量自噬体的快速形成。批量降解:这是与蛋白酶体降解途径的 显著区别 。“捕获”胞浆成分的非特异性:自噬的速度快、量大。自噬的保守性:自噬有利于细胞存活,因此自噬普遍被保留下来。 自噬具有维持细胞自稳的功能,如果将自噬相关基因突变失活,则神经元会发生大量聚集蛋白,并出现神经元退化。自噬主要有两方面的作用,其一,作为细胞的保护机制,防止细胞死亡。如一些器官有很强的募集自噬标志ATG8到自噬液泡中的能力[6],当自噬受到抑制时,对细胞 的生存有伤害性作用。其二,对细胞死亡起作用[7] 。自噬一旦达到损伤阈值时,细胞就进入凋亡通路。1.3自噬体形成的一般分子机制 自噬体发生的分子机制主要有以下4个步骤:①自噬 的诱导:雷帕霉素作用的靶位点(Target of rapamycin , TOR )354