
第一类医疗器械产品分类目录
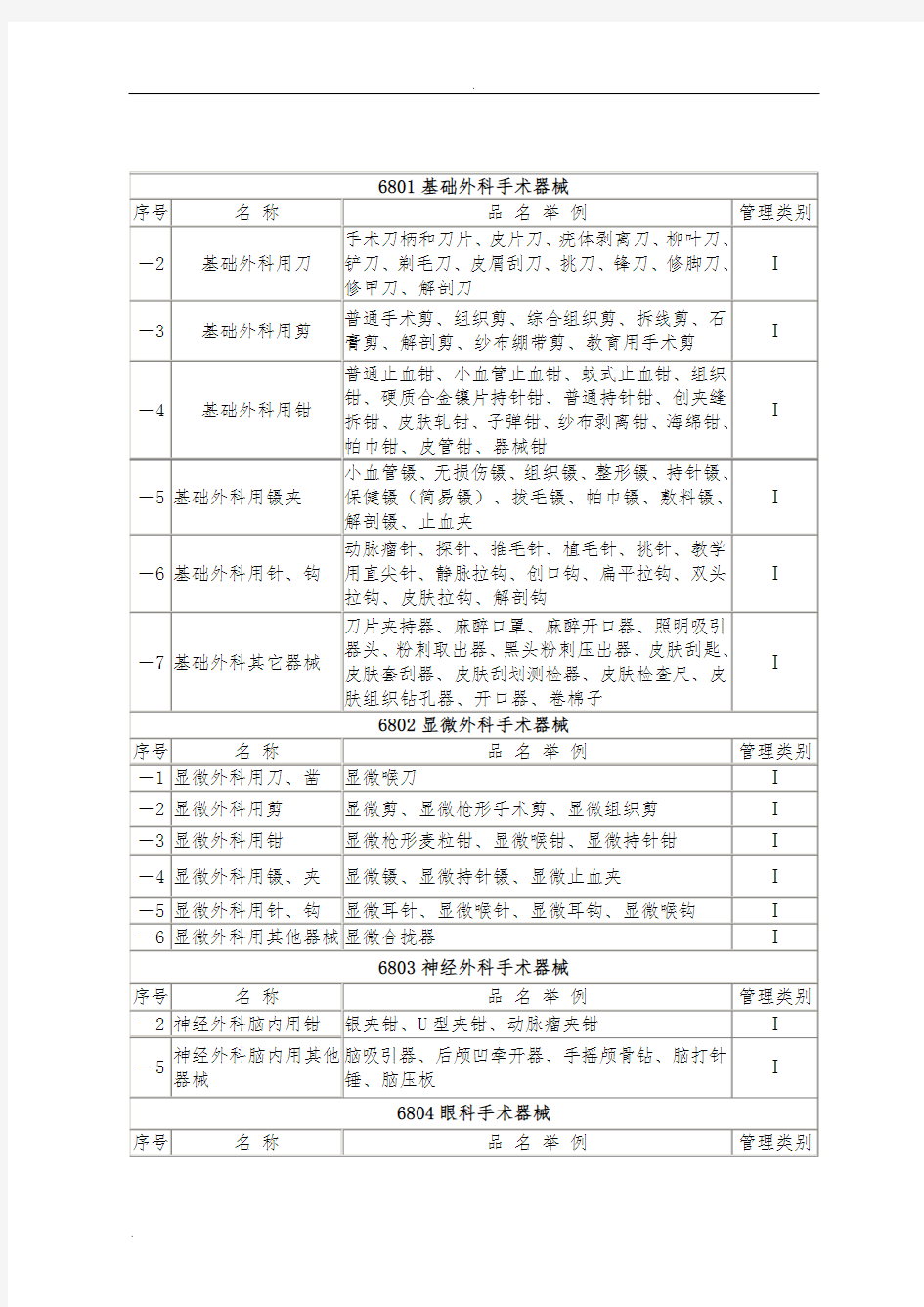
2005年12月28日 6801基础外科手术器械 序号名称品名举例管理类别 -1医用缝合针(不带 线) n -2基础外科用刀手术刀柄和刀片、皮片刀、疣体剥离刀、柳叶刀、铲 刀、剃毛刀、皮屑刮刀、挑刀、锋刀、修脚刀、修甲 刀、解剖刀 I 基础外科用剪普通手术剪、组织剪、综合组织剪、拆线 -3剪、石膏剪、解剖剪、纱布绷带剪、教育用手术剪I -4基础外科用钳普通止血钳、小血管止血钳、蚊式止血钳、组织钳、 硬质合金镶片持针钳、普通持针钳、创夹缝拆钳、皮 肤轧钳、子弹钳、纱布剥离钳、海绵钳、帕巾钳、皮 管钳、器械钳 I -5基础外科用镊夹小血管镊、无损伤镊、组织镊、整形镊、持针镊、保 健镊(简易镊)、拔毛镊、帕巾镊、敷料镊、解剖 镊、止血夹 I -6 基础外科用针、钩动脉瘤针、探针、推毛针、植毛针、挑针、教学用直 尖针、静脉拉钩、创口钩、扁平拉钩、双头拉钩、皮 肤拉钩、解剖钩 i -7基础外科其它器械刀片夹持器、照明吸引器头、粉刺取出器、黑头粉刺 压出器、皮肤刮匙、皮肤套刮器、皮肤刮划测检器、 皮肤检查尺、皮肤组织钻孔器、开口器、卷棉子、 可重复使用活检器、术前肢体消毒抬升小车、塑型 针、丫i 型连接器、扭转器
序号名称品名举例管理类别 -1显微外科用 刀、凿 显微喉刀I -2显微外科用 剪 显微剪、显微枪形手术剪、显微组织剪I -3显微外科用钳显微枪形麦粒钳、显微喉钳、显微持针钳I -4显微外科用 镊、夹 显微镊、显微持针镊、显微止血夹I -5显微外科用 针、钩 显微耳针、显微喉针、显微耳钩、显微喉钩I -6显微外科用 其他器械 显微合拢器I
丿序 号 名称品名举例 —1 神经外科脑脑神经刀、可拆卸式脑膜刀、脑神经刀、 内用刀脑膜刀 肿瘤摘除钳、脑组织咬除钳 —2 神经外科脑内 用钳 银夹钳、U型夹钳、动脉瘤夹钳 —3神经外科脑 内用镊 脑膜镊、垂体瘤镊、肿瘤夹持镊 —4神经外科脑脑膜钩、脑膜拉钩、神经钩、神经根拉钩、内用钩、刮交感神经钩、脑刮匙、脑垂体刮匙 门I、脑活检抽吸器、脑膜剥离器 神经外科脑 —5 内用其他器 械脑吸引器、后颅凹牵开器、手摇颅骨钻、 脑打针锤、脑压板管理类别 n n i n n n
医疗器械分类目录 基础外科手术器械 医用缝合针:医用缝合针 基础外科用刀:手术刀柄皮片刀疣体剥离刀柳叶刀铲刀剃毛刀皮屑刮刀挑刀锋刀修脚刀修甲刀解剖刀手术刀片 基础外科用剪:手术剪组织剪综合组织剪拆线剪石膏剪解剖剪纱布绷带剪教育用手术剪 止血钳小血管止血钳蚊式止血钳组织钳硬质合金镶片持针钳持针钳创夹缝拆钳皮肤轧钳子弹钳纱布剥离钳海绵钳帕巾钳皮管钳基础外科用钳: 器械钳 基础外科用镊夹:小血管镊无损伤镊组织镊整形镊持针镊保健镊拔毛镊帕巾镊敷料镊解剖镊止血夹病历夹 基础外科用针、钩:动脉瘤针探针推毛针植毛针挑针直尖针静脉拉钩创口钩扁平拉钩双头拉钩皮肤拉钩解剖钩 刀片夹持器麻醉口罩麻醉开口器照明吸引器头粉刺取出器黑头粉刺压出器皮肤刮匙皮肤套刮器皮肤刮划测检器皮肤检查尺皮肤组基础外科其它器械: 织钻孔器开口器卷棉子毁形机洗瓶机 显微外科手术器械 显微外科用刀、凿:显微喉刀 显微外科用剪:显微剪显微枪形手术剪显微组织剪
显微外科用钳:显微枪形麦粒钳显微喉钳显微持针钳 显微外科用镊、夹:显微镊显微持针镊显微止血夹 显微外科用针、钩:显微耳针显微喉针显微耳钩显微喉钩 显微外科用其他器械:显微合拢器 神经外科手术器械 神经外科脑内用刀:脑神经刀可拆卸式脑膜刀脑神经刀脑膜刀 神经外科脑内用钳:肿瘤摘除钳脑组织咬除钳银夹钳U型夹钳动脉瘤夹钳 神经外科脑内用镊:脑膜镊垂体瘤镊肿瘤夹持镊 神经外科脑内用钩、刮:脑膜钩脑膜拉钩神经钩神经根拉钩交感神经钩脑刮匙脑垂体刮匙神经外科脑内用其他器械:脑活检抽吸器脑膜剥离器脑吸引器后颅凹牵开器手摇颅骨钻脑打针锤脑压板 眼科手术器械 眼科手术用剪:角膜剪眼用手术剪眼用组织剪 眼科手术用钳:晶体植入钳环状组织钳
医疗器械创新设计程序 词的起源与发展 创新?词,在中国出现得很早,《魏书》有“?弊创新”,《周书》中有“创新改旧”;在西?,英语中Innovation这个词起源于拉丁语,原意有三层含义:?是更新,即对原有的东西就?替换;?是创造新的东西,即创造出原来没有的东西;三是改变,即对原有的东西进?发展和改造。 创新?次?次进?经济领域,具有商业意义,是1912年,约瑟夫?A?熊彼得(1883 – 1950)在《经济发展理论》?书中提出“创新理论”(Innovation Theory),并界定了创新的五种形式:开发新产品;引进新技术;开辟新市场;发掘新的原材料来源;实现新的组织形式和管理模式。 经过百年的发展,?到团队、组织和企业,?到国家或区域性全球经济联合体,都把创新作为?要的发展战略来进?规划。对于全球经济??,创新已经成为?命之源,因为真正的创新是能够为企业带来品牌价值和商业利润的。 表1-2018福布斯全球最具创新?企业榜(前25名) 排名 公司名称 国家 ?业 创新溢价 1 SERVICENOW 美国 系统软件 89.22 2 WORKDAY 美国 应?软件 82.84 3 https://www.doczj.com/doc/0a5065090.html, 美国 应?软件 82.27 4 特斯拉 美国 汽车制造 78.27 5 亚马逊 美国 互联?和直接营销零售 77.4 6 NETFLIX 美国 互联?和直接营销零售 71.23 7 INCYTE 美国 ?物技术 70.59 8 HINDUSTAN UNILEVER 印度 家?产品 67.2
9 NAVER 韩国 互联?软件和服务 64.62 10 FACEBOOK 美国 互联?软件和服务 64.42 11 怪物饮料 美国 软饮料 64.26 12 UNILEVER INDONESIA 印尼 家?产品 63.91 13 ADOBE SYSTEMS 美国 应?软件 62.38 14 CELLTRION 韩国 ?物技术 62.3 15 欧特克 美国 应?软件 62.04 16 REGENERON 美国 ?物技术 61.11 PHARMACEUTICALS 美国 ?物技术 60.93 17 VERTEX PHARMACEUTICALS 18 爱茉莉太平洋 韩国 个?产品 60.81 19 美源伯根 美国 药品分销 58.69 20 ILLUMINA 美国 ?命科学?具和服务 58.33 21 万豪 美国 酒店、度假村和游轮业务 58.15 22 亚?兄制药 美国 ?物技术 58.04 23 CP ALL 泰国 ?品零售 57.32 24 红帽 美国 系统软件 56.93 25 腾讯控股 中国 互联?软件和服务 56.77 当然,不同机构发布的排名榜单,由于其评选规则的不同,排名先后会有所变化。但?论如何,我们可以看到https://www.doczj.com/doc/0a5065090.html,、特斯拉、亚马逊和FACEBOOK 这些在商业价值和创新能?上都有?皆碑的公司,连续?年都排列在前10名。创新不
工程物资清查、盘点实施方案 一、实施目的:为保证工程项目顺利进行竣工决算,全面掌握国内 外采购合同的执行情况,明晰工程物资的数量与状态。 二、清查盘点工作日程安排及相关要求 (一)国内外物资清查阶段:2010年5月18日至5月28日 1、国内物资清查组 (1)供销部对公司自成立之日起至2010年5月14日止,由供销部签订的所有采购合同进行梳理并编制“合同执行情况明细表” (格式见附件),重点列出变更、终止、未执行完毕合同,并说明理由。 (2)法务部对上述变更、终止等合同的法律手续是否完备进行清查,找出问题,并提出合理化建议。 (3)财务部将“合同执行情况明细表”逐一与K3核对,重点清查每一合同项下的工程物资K3入库数据是否与“合同执行情况明细表”中的数据一致。发现差异及时提交供销部查明原因。 要求:供销部每整理30份合同为一组,整理完毕后及时提交法务部、财务部,每三天由财务部召开一次清查例会,须由供销部、财务部、法务参加,针对清查过程中发现的问题进行讨论并解决。 2、国外物资清查组 (1)供销部对公司自成立之日起至2010年5月14日止,所签订的所有国外采购合同进行梳理并编制“合同执行情况明细
表”(格式见附件),重点列出变更、终止、未执行完毕合同,并说明理由。 (2)法务部对上述变更、终止等合同的法律手续是否完备进行清查,找出问题,并提出合理化建议。 (3)针对各单元退回的进口备品、备件,由仓库主管会同该单元车间主任、对退回的备品、备件进行清点、查验,详细记录 备品、备件名称、规格、型号。 (4)财务部对“合同执行情况明细表”逐一与K3核对,重点清查每一合同项下的工程物资K3入库数据是否与“合同执行 情况明细表”中的数据一致。发现差异及时提交供销部(沈 扬)查明原因。 要求:供销部整理完毕后及时提交法务部、财务部进行 下一步工作。如在进行过程中发现问题由财务部召集相关人员召开清查例会,讨论并解决问题。 (二)物资盘点准备阶段:2010年5月18日至5月28日 1、盘点范围 国内外所有工程物资(材料、设备、备品、备件等),范围 由财务部确定。 2、盘点准备 (1)供销部根据物资类别对盘点人员进行分组。
医疗器械科技产业十二五专项规划2012年01月18日 17:31 科技部网站 科学技术部 二〇一一年十一月 医疗器械科技产业“十二五”专项规划 目录 一、形势与需求 5 (一)医疗卫生体系建设的重要基础 5 (二)医学诊疗技术发展的重大需求 6 (三)科技创新的前沿高地 6 (四)产业竞争的焦点领域 6 (五)我国战略性新兴产业的发展重点 7 二、指导思想和发展原则 7 (一)指导思想 7 (二)发展原则 8 三、发展目标 9 (一)总体目标 9 (二)具体目标 9 (三)指标体系 10 四、发展重点 10 (一)基础研究重点 10
(二)关键技术发展重点 11 (三)产品发展重点方向 12 五、“十二五”重点任务布局 15 (一)基础装备升级 15 (二)高端产品突破 16 (三)前沿方向创新 16 (四)创新能力提升 17 (五)应用示范工程 17 六、保障措施 18 (一)强化创新引导 18 (二)完善政策措施 18 (三)优化产业环境 18 医疗器械科技产业“十二五”专项规划 “十二五”是我国全面建设小康社会的关键时期,是提高自主创新能力、培育战略性新兴产业、建设创新型国家的重要阶段,也是进一步深化医药卫生体制改革的攻坚时期。医疗器械是医疗卫生体系建设的重要基础,具有高度的战略性、带动性和成长性,其战略地位受到了世界各国的普遍重视,已成为一个国家科技进步和国民经济现代化水平的重要标志。 为加快推进医疗器械产业发展,更好地满足广大人民群众健康需求,支撑我国医疗卫生服务体系建设,促进医疗卫生体制改革的顺利实施,按照《国家中长期科学和技术发展规划纲要(2006-2020年)》、《中华人民共和国国民经济和社会发展第十二个五年规划纲要》、《国务院关于加快培育和发展战略性新兴产业的决定》与《中共中央、国务院关于深化医药卫生体制改革的意见》等相关要求,特制定医疗器械科技产业“十二五”专项规划。 一、形势与需求 (一)医疗卫生体系建设的重要基础
附件 创新医疗器械特别审批申报资料 编写指南 为规范创新医疗器械特别审批申请,提高申报资料质量,促进医疗器械创新发展,结合目前创新医疗器械特别审批申请实践经验,根据《医疗器械监督管理条例》(国务院令第650号)、《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)、《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)、《创新医疗器械特别审批程序(试行)》(食药监械管〔2014〕13号)要求,特制定本指南。 本指南对申请创新医疗器械的申报资料准备和撰写进行了规范,旨在使申请人明确在申报过程中应予关注的重点内容,以期解决申报过程中遇到的一些共性问题。 一、申报资料内容 (一)创新医疗器械特别审批申请表 产品名称应符合《医疗器械通用名称命名规则》等文件 相关规定。性能结构及组成、主要工作原理/作用机理、预期用途部分填写的内容应可反映产品特性的全部重要信息,简明扼要,用语规范、专业,不易产生歧义。 (二)申请人企业法人资格证明文件 1?境内申请人应当提交: 企业营业执照副本复印件和组织机构代码证(如适用)复印件。
2?境外申请人应当提交: 境外申请人注册地所在国家(地区)医疗器械主管部门出具的企业法人资格证明文件。文件需经原出证机关签章或者经当地公证机构公证。 (三)产品知识产权情况及证明文件 1?提供产品核心技术知识产权情况说明。如存在多项发明专利,建议以列表方式展示发明专利名称、专利权人、专利状态等信息。 2?提供相关知识产权情况证明文件 (1)申请人已获取中国发明专利权的,需提供经申请人签章的专利授权证书、权利要求书、说明书复印件和专利主管部门出具的专利登记簿副本。 (2)申请人依法通过受让取得在中国发明专利使用权的,除提交专利权人持有的专利授权书、权利要求书、说明书、专利登记簿副本复印件外,还需提供经专利主管部门出具的《专利实施许可合同备案证明》原件。 (3)发明专利申请已由国务院专利行政部门公开、未获得授权的,需提供经申请人签章的发明专利已公开证明文件(如发明专利申请公布通知书、发明专利申请公布及进入实质审查阶段通知书、发明专利申请进入实质审查阶段通知书等)复印件和公布版本的权利要求书、说明书复印件。发明专利申请审查过程中,权利要求书和说明书应专利审查部门要求发生修改的,需提交修改文本;专利权人发生变更的,提交专利主管部门出具的证明性文件,如手续合格通知书复印件。 (四)产品研发过程及结果的综述
创新医疗器械注册、生产及委托生产流程 附录A:创新医疗器械的界定条件 1、申请人经过其技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权;或者核心技术发明专利的申请已由国务院专利行政部门公开。 2、产品主要工作原理/作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显着的临床应用价值。
3、申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。? 依据:食药监械管〔2014〕13号《创新医疗器械特别审批程序(试行)》 ? 附录B:申请创新医疗器械特别审批提交的资料 境内申请人申请创新医疗器械特别审批,应当向其所在地的省级食品药品监督管 ?(2).核心刊物公开发表的能够充分说明产品临床应用价值的学术论文、专着及文件综述; ?(3).国内外已上市同类产品应用情况的分析及对比(如有); ?(4).产品的创新内容及在临床应用的显着价值。 7、产品安全风险管理报告。
8、产品说明书(样稿)。 9、其他证明产品符合本程序第二条的资料。 10、所提交资料真实性的自我保证声明。 申报资料应当使用中文。原文为外文的,应当有中文译本。 若为境外申请人,应当委托中国境内的企业法人作为代理人或者由其在中国境内的办事机构提出申请,除上诉资料外还应提交以下文件: 5、临床评价资料 6、产品说明书及最小销售单元标签设计样稿 7、生产制造信息 8、证明性文件 境内备案人提供:企业营业执照复印件、组织机构代码证复印件。
9、符合性声明 ? 创新医疗器械为第二、三类医疗器械时,按注册管理提供资料: 1、申请表; 2、证明性文件; 15、标签样稿; 16、符合性声明; 依据:《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号)? 附录D:开办创新医疗器械生产
物资盘点管理办法(试行) 第一条目的 为加强公司内部管理,及时掌握公司各单位物资的数量及状态,准确真是地核算项目成本和消耗定额,保证公司财产的安全性、完整性、真实性,同时也使盘点工作规范化,特制定本制度。 第二条适用范围 本办法适用于公司属各单位。 第三条依据 《中交第一航务工程局有限公司项目管理标准化手册》 《中交第一航务工程局有限公司物资管理细则》 《物资管理部工作手册》 《周转材料管理办法》 《废旧钢铁管理办法》 第四条盘点概述 4.1定义 物资盘点是指对在库储存保管着的全部物资进行清点数量的一项业务管理活动。即为了掌握物资的流动情况(入库、在库、出库的流动状况),对仓库现有物品的实际数量与保管账上记录的数量相核对,以便准确地掌握库存数量。 4.2公司物资盘点的主要方法
公司物资盘点采用永续盘存制,亦称“账面盘存制”。它是对于存货的增加和减少,根据各种有关凭证,在账簿中逐日逐笔进行登记,并随时结算出各种资产账面结存数额的一种方法。采用这种盘存制度,要按存货明细账收发、结存数量予以记录。 公式:期末结存数=期初结存数+本期增加数-本期减少数一般情况下,各企业都应采用永续盘存制。 物资盘点采用永续盘点和定期盘点相结合的方式。 1)定期盘点。指一定时间点对库房和料场保存的物资进行全面、彻底盘点。达到有物有账,账物相符,账账相符。把数量、规格、质量及主要用途搞清楚。 2)永续盘点。对库房每日有变动(增加、减少)的物资,当日复查一次,即当天对库房收入或发出的物资,核对账、卡、物是否对口;每月抽查库存物资的一半;季末全面盘点。必须做到当天收发、当天记账和登卡。 第五条盘点内容 公司管理要求各单位对主材(钢筋、砼原材)、周转材料进行月度盘点,每月25日前完成盘点;每季度最后一个月25号前对本单位内所有物资进行全面盘点(包括在账、账外、报废、待报废物资)。 第六条盘点要求 ㈠盘点工作必须统一领导,事先制定计划,做好组织工作。 ㈡负责盘点的有关人员在进行盘点前要明确自己的职责,
医疗器械分类目录(2002版) 01.《医疗器械分类目录》的说明 02.6801基础外科手术器械03.6802显微外科手术器械 04.6803神经外科手术器械05.6804眼科手术器械 06.6805耳鼻喉科手术器械07.6806口腔科手术器械 08.6807胸腔心血管外科手术器械09.6808腹部外科手术器械 10.6809泌尿肛肠外科手术器械11.6810矫形外科(骨科)手术器械12.6812妇产科用手术器械13.6813计划生育手术器械 14.6815注射穿刺器械15.6816烧伤(整形)科手术器械16.6820普通诊察器械17.6821 医用电子仪器设备 18.6822 医用光学器具、仪器及内窥镜设备19.6823医用超声仪器及有关设备20.6824医用激光仪器设备21.6825医用高频仪器设备 22.6826物理治疗及康复设备23.6827中医器械 24.6828医用磁共振设备25.6830医用X射线设备 26.6831医用X射线附属设备及部件27.6832医用高能射线设备 28.6833医用核素设备29.6834医用射线防护用品、装置30.6840临床检验分析仪器31.6841医用化验和基础设备器具32.6845体外循环及血液处理设备33.6846植入材料和人工器官 34.6854手术室、急救室、诊疗室设备及器具35.6855口腔科设备及器具 36.6856病房护理设备及器具37.6857消毒和灭菌设备及器具38.6858医用冷疗、低温、冷藏设备及器具39.6863口腔科材料 40.6864医用卫生材料及敷料无41.6865医用缝合材料及粘合剂42.6866医用高分子材料及制品无43.6870 软件无 44.6877介入器材
2017年12个创新医疗器械产品上 市,均为国内首创 近日,国家食品药品监督管理总局发布《2017年度医疗器械注册工作报告》,报告中提到,2017年,食品药品监管总局按照《创新医疗器械特别审批程序(试行)》,批准了部分创新医疗器械产品上市。共收到创新医疗器械特别审批申请273项,完成323项审查(含2016年申请事项),确定63个产品进入创新医疗器械特别审批通道。 批准注册分支型主动脉覆膜支架及输送系统等12个创新产品上市。其中,有源医疗器械4项,无源医疗器械8项,与2016相比总数增加2项。 这些创新产品核心技术都有我国的发明专利权或者发明专利申请已经国务院专利行政部门公开,产品主要工作原理/作用机理为国内首创,具有显著的临床应用价值。 (一)分支型主动脉覆膜支架及输送系统(国械注准20173463241,上海微创医疗器械(集团)有限公司)。该产品由预装覆膜支架和输送系统组成,适用于治疗胸主动脉夹层近端破口在左颈总动脉远端15mm与左
锁骨下动脉(LSA)远端20mm之间或夹层逆撕至左锁骨下动脉的患者。该产品的技术属于国内首创,作为首个批准上市的分支型主动脉覆膜支架,为胸主动脉夹层患者的临床治疗提供了新的治疗方法。 (二)折叠式人工玻璃体球囊(国械注准20173223296,广州卫视博生物科技有限公司)。该产品由球囊、引流管和引流阀组成,由医用硅橡胶材料制成,适用于严重视网膜脱离,不能用现有的玻璃体替代物进行治疗的患者。该产品是我国独立研制的创新产品,属于国际首创。该产品可长期填充在眼内,解决了玻璃体替代物不能长期停留在眼内、不能长期顶压视网膜或需反复手术等问题,避免患者眼球摘除和植入义眼座。 (三)经皮介入人工心脏瓣膜系统(国械注准20173460680,杭州启明医疗器械有限公司)。该产品由主动脉瓣膜、输送系统组成,适用于经心脏团队结合评分系统评估后认为患有症状的、钙化的、重度主动脉瓣狭窄,且不适合接受常规外科手术置换瓣膜的患者。该产品是国内首个自膨式经皮介入人工心脏瓣膜,为不适合接受常规外科手术置换瓣膜的患者带来了显著的临床获益。 (四)一次性可吸收钉皮内吻合器(国械注准
第二类医疗器械经营备案表(填写样本)
填表说明:1.本表按照实际内容填写,不涉及的可缺项。其中,企业名称、统一社会信用代码、住所、法定代表人、注册资本、成立日期、营业期限等按照营 业执照内容填写。 2.本表经营范围应当按照国家食品药品监督管理部门发布的医疗器械分类目 录中规定的管理类别、分类编码及名称填写。 3.本表经营方式指批发、零售、批零兼营。
医疗器械经营企业提供贮存、配送服务基本情况表(填写样本) 填表日期:年月日
第二类医疗器械经营备案表(填写样本)(同时从事第三类医疗器械经营)
附: 第二类医疗器械经营备案申请材料 1.第二类医疗器械经营备案表》; 2.第二类医疗器械经营备案表(同时从事第三类医疗器械经营); [依据《关于医疗器械经营备案有关事宜的公告》(国家食品药品监督管理总局公告2017年第129号),已取得《医疗器械经营许可证》的企业申请办理第二类医疗器械经营备案,应填写第二类医疗器械经营备案表(同时从事第三类医疗器械经营)]; 3.营业执照复印件; 4.法定代表人、企业负责人、质量负责人的身份证明、学历或者职称证明复印件(关键人员达到拟申请经营范围的人员资质要求); 5.组织机构与部门设置说明; 6.经营范围、经营方式说明(符合医疗器械分类目录中规定的管理类别、类代号名称); 7.经营场所、库房地址的地理位置图、平面图(标识温控区域、功能区域、人流物流方向、实际使用面积等); (1)自有或租赁库房:房屋产权证明文件或者租赁协议(附房屋产权证明文件)复印件; (2)库房委托其他医疗器械第三方物流储运的提交:①拟委托的医疗器械第三方物流经营企业营业执照和《第二类医疗器械经营备案凭证》复印件(加盖印章,受托方提供医疗器械贮存、配送服务范围应包含委托方经营范围);②双方签定的拟委托贮存配送服务协议复印件(委托协议应有效,并含有明确双方质量责任的内容);③委托方的计算机系统端口与第三方物流仓储管理对接说明; 8.经营设施、设备目录(委托第三方物流的可豁免仓库用的设施设备); 9.经营质量管理制度、工作程序等文件目录(至少包括《医疗器械经营质量管理规范》要求的内容); 10.计算机信息管理系统基本情况介绍和功能说明(如有); 11.凡申请企业申报材料时,具体办理人员不是法定代表人或负责人本人,企业应当提交《授权委托书》; 12.申报材料真实性自我保证声明,并对材料作出如有虚假承担法
国家大力鼓励医疗器械技术创新给予真正的“绿色通道” 2015年4月21日,财政部与国家发改委联合发布财税[2015]2号通知,重新规定了食品药品监督管理部门行政事业性收费项目。该《通知》发布了一系列有关医疗器械相关的项目主要:注册申请费,临床试验申请费,检验费,注册加急费。特别引人注目的是,该《通知》还特别规定:创新医疗设备产品注册免费。 这是一个相当积极的信号,国家大力鼓励医疗器械技术创新,这是否意味着医疗器械创新进入了“免费”时代? 前几日,有关西门子、通用电气、飞利浦等外资医疗器械巨头接受中国工商总局调查的新闻甚嚣尘上。有人天真地认为,外资医疗器械巨头被查,无疑是本土医疗器械企业的一大利好。这种把自我发展的希望寄托在他人倒霉的不良思维,不仅狭隘自私而且无良无德! 本土器械包括本土医疗影像设备的崛起,只能依赖于国产医疗器械技术更新以及质量升级,这样才能获得消费者的认可。因此,超越外企医械巨头,只能走技术升级打造质量航母的路线。因此,联想于此,我们自然能够想到上述两部委对创新医疗器械的注册为什么要实施免费政策了。这样的激励,也是本土器械实现跨越式发展所需要的。 为了保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展,2014年2月7日,国家食品药品监督管理总局组织制定了《创新医疗器械特别审批程序(试行)》。要创新,走抄袭模仿就是死路一条。创新医疗器械一定要有“干货”,这些“干货”在该《程序》第二条已被明确,它们是: (一)申请人经过其技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权;或者核心技术发明专利的申请已由国务院专利行政部门公开。 (二)产品主要工作原理/作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显著的临床应用价值。 (三)申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。只有存有这些“干货”的器械才能被认定是创新医疗器械,食品药品监督管理部门才能对此实施审评审批。 值得注意的是,CFDA官网在5月5日发布了两款创新医疗器械产品获得审批的通知。 一是深圳艾尼尔角膜工程有限公司的脱细胞角膜基质。该产品取材于猪眼角膜,经病毒灭活与脱细胞等工艺制备而成,是猪角膜的细胞外基质,由前弹力层和部分基质层构成,主要成分为胶原蛋白。在临床上适用于用药无效的尚未穿孔角膜溃疡的治疗,以及角膜穿孔的临时性覆盖。 二是博奥生物集团有限公司的恒温扩增微流控芯片核酸分析仪。该产品主要由仪器主机、电源线、数据线组成,其中仪器主机主要包含前面板组件、运动平
创新医疗器械特别审批程序(试行)第一条为鼓励医疗器械的研究与创新,促进自主创新医疗器械产业发展,根据《医疗器械监督管理条例》、《医疗器械注册管理办法》等法规和规章,制定本程序。 第二条食品药品监督管理部门对同时符合下列情形的医疗器械按本程序实施审评审批: (一)申请人具有产品核心技术的自主知识产权,权益状况明确。申请人具有自主知识产权是指,申请人经过其主导的技术创新活动,在我国依法拥有发明专利的所有权,或依法通过受让取得在我国发明专利的所有权或使用权。 (二)产品主要工作原理/作用机理为国内首创,产品性能或安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显著的临床应用价值。 (三)申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。 (四)申请人为中国境内的企业法人,产品在中国境内生产,并具有医疗器械生产企业许可证。 第三条各级食品药品监督管理部门及相关技术机构,根据各自职责和本程序规定,按照早期介入、专人负责、科学审批的原则,在标准不降低、程序不减少的前提下,对创新医疗器械予以优先办理,并加强与申请人的沟通交流。 第四条申请人申请创新医疗器械特别审批,应当填写《创新医疗器械特别审批申请表》(见附件1),并提交支
持拟申请产品符合本程序第二条要求的资料。资料应当包括: (一)申请人企业法人资格证明文件。 (二)医疗器械生产企业许可证。 (三)产品知识产权情况及证明文件。 (四)产品研发过程及结果的综述。 (五)产品技术文件,至少应包括: 1. 产品的预期用途; 2. 产品工作原理/作用机理; 3. 产品主要技术指标及确定依据,主要原材料、关键元器件的指标要求,主要生产工艺过程及流程图,主要技术指标的检验方法。 (六)产品创新的证明性文件,至少应包括: 1. 国家级信息或专利检索机构出具的查新报告; 2. 核心刊物公开发表的能够充分说明产品临床应用价值的学术论文、专著及文件综述; 3. 与产品主要技术相关的发明专利说明书; 4. 国内外已上市同类产品应用情况的分析; 5. 产品的创新内容及在临床应用的显著价值。 (七)产品安全风险管理报告。 (八)产品使用说明书。 (九)其他证明产品符合本规定第二条的资料。 第五条申请人应当向其所在地的省级食品药品监督管理部门提出创新医疗器械特别审批申请,省级食品药品监督管理部门对申报项目是否符合本程序第二条要求进行
首营企业审批表 填表日期:企业名称 类别 □器械生产企业企业地址□器械经营企业许可证号到期期限 执照注册号注册资金 经营或生产范围经营方式 拟供应品种 法定代表人传真 联系人联系电话 销售人员身份证号 采购员申请原因 (签字):年月日 业务部门意见 负责人(签字):年月日 审核意见 质量管理负责人(签字):年月日 审批意见□同意作为合格供货方 □不同意作为合格供货方 总经理或主管副总经理(签字):年月日 审核表应附资料: 1、医疗器械经营许可证或医疗器械生产许可证复印件 2、营业执照复印件
3、委托书原件 首营品种审批表 编号: 供货单位(经营企业)名称及资质证明、联系方式医疗器械产品名称规格生产企业名称及资质证明 许可证号: 许可证号: 电话: 医疗器械性能、用途、外观、质量情况审核 注册证号质量标准 装箱规格有效期储存条件 采购员意见 负责人签字:日期: 质检员意见 负责人签字:日期: □同意进货□不同意进货 经理审批意见 负责人签字:日期:
注:附医疗器械生产/经营企业许可证、营业执照、医疗器械产品注册证、质量标准、出厂 检验报告、委托书及业务员身份证复印件、样品、价格批文等资料。 验收单 日期:页次:质检部: 供货商名称 数量 品名规格 实交 生产批号(编号)有效期 许可证号 养护员签名 注册证号 符合性 结论 验收员签名:日期:年月日
复核:日期:年月日 在库养护、检查表 日期:页次:养护: 供货方名称品名规格外观效期 情况 养护工具/设 备/设施情况 温湿度 堆码情况、安 全、卫生情况 检查记 录日期
不合格品处理记录表品名生产日期规格数量采购日期采购人 不合格原因
创新医疗器械的品牌之旅 武汉王强 怎样脱离价格血拼的残酷竞争? 怎样从众多的竞争对手中“跳”出来? 怎样获取高额利润的回报? 怎样打造企业的核心竞争力? 怎样成为本行业的领导者? 科特勒语:只有有远见的公司领导者才愿意做出产品品牌建设的尝试。中国有远见的领导者已经成功地营造了令人信任的公司形象,现在也必须由有远见的领导者来构建令人振奋的产品品牌。这是中国企业领导者在营销领域面临的下一个任务,这一任务完成之时,就是中国企业超越国外竞争者,获取属于自己的市场超额利润之日。 在残酷的市场竞争中,产品、技术及管理体系等容易被对手模仿,难以成为核心专长。而品牌一旦树立,则不但有核心价值并且不可模仿,因为良好的品牌形象是一种客户认知,一种信任,是一种心理感觉,这种认知,信任和心理感觉不能被模仿的。 快速消费品行业诞生了很多耳熟能详的品牌----可口可乐,王老吉,娃哈哈,海飞丝洗发水,德芙巧克力等,而现在中国医疗器械行业需
要品牌吗?答案是肯定的。因为凭关系你可以在一个区域市场买几台,十几台,但你不可能卖几十台,上百台!要想成为行业的领导者必须树立专业的品牌形象。 “企业品牌战略”的标杆-----深圳迈瑞 深圳迈瑞创建于1991年,经过十年的发展2013年销售额为76亿。深圳迈瑞在打造“企业品牌”战略的过程中,也经历很多艰难困苦的磨难! 创业期“企业品牌战略”在于取舍之间:一是深圳迈瑞放弃自己的专长超声诊断仪器,而选择临床监护仪。二是深圳迈瑞放弃自主经营,而是选择做外资品牌代理商,积累资金,人才,网络,技术等。 成长期“企业品牌战略”在于坚持:一是坚持自主经营,不做洋代理。二是坚持自主研发,坚持“实用型技术创新”、“渐进型技术创新”。特别是在1996、1997两年资金压力几近解散之际,部分公司创始人选择离开迈瑞,另谋发展之际,依然将自主研发的道路坚持到最后。 成熟期“企业品牌战略”在于整合:一是于2006年在美国纽交所成功上市, 促进完善公司治理结构,加速深圳迈瑞的国际化进程的同时,整合“美国纽交所”在国际市场的影响力,由此深圳迈瑞的营销
2018年医疗器械生产企业-GMP 认证-记录表格
质量记录表 版次/: A/0 依据YY/T0287-2017&ISO13485:2016标准 《医疗器械生产质量管理规范》 编制: 审核: 批准:
5 基础设施控制程 序 设施配置申请单 生产部设施验收单 主要生产设备明细表 主要检验设备明细表 设施报废单 生产设备记录表 检验设备记录表 6 工作环境控制程 序 生产环境检查记录 生产部纠正和预防措施处理单 7 产品实现的策划 控制程序 文件更改申请技术部 序号程序文件记录名称文件编号 责任 部门 8 风险管理控制程 序 风险分析——预期用途/目的的特征表 技术部风险分析——已知或可预见的危害表 风险管理报告 9 与顾客有关的过 程控制程序 产品要求评审表 质保部销售计划通知单 产品销售记录表 特殊销售合同评审记录表 售后服务记录表 顾客需求、投诉、报怨处理记录 顾客投诉调查处理记录 10 设计和开发控制 程序 项目建议报告 技术部项目可行性分析报告 项目评审报告 项目立项报告 项目实施计划任务书 设计更改通知单 年度开发项目计划 项目变更审批表 项目评审报告 设计和开发输入清单 设计开发输入评审单 设计和开发输出清单 设计和开发评审记录表 小批量试产通知单 小批试产过程记录表 11 采购控制程序供方调查评价表 生产部合格供方名录 供方业绩评定表
采购计划表 采购合同 采购记录 主要原材料清单 12 生产和服务提供 控制程序 销售计划通知单 生产部月生产计划 主要原材料清单 生产原始记录 变更申请 成品出厂检验报告 出厂检验记录 13 产品的监视和测 量控制程序 元器件检验记录表 质保部元器件检验报告 主要原材料清单 原材料入库记录表 生产原始记录 成品出厂检验报告 成品入库记录表 成品一次交验合格率汇总表 14 关键工序控制程 序 关键工序监控制点记录表质保部 15 产品质量控制程 序 元器件检验记录表 质保部元器件检验报告 原材料入库记录表 生产原始记录 产品出厂检验报告 成品入库记录表 成品一次交验合格率汇总表 产品合格证 16 交付和服务活动 的控制程序 售后服务记录 生产部产品销售记录表 17 产品放行控制程 序 产品合格证 质保部生产原始记录 产品放行记录 产品放行证书 18 产品标识和可追 溯性控制程序 元器件检验记录表 质保部产品销售记录表 成品入库记录表 19 产品防护控制程 序 产品防护记录表技术部 20 顾客财产的控制 程序 售后服务记录表生产部 21 监视和测量设备主要生产设备明细表质保部
医疗器械生产批记录管理规定 1.范围和目的 1.1目的 为规范生产过程中生产批记录文件的编制、审核、批准、使用和保管,特制订本规定。 1.2适用范围 适用于本公司的所有产品的生产批记录。 1.3发放范围 所有部门。 2.规范性引用文件 下列文件中条款通过本规则引用而成为本规则的条款,其最新版本适用于本规则。 医疗器械生产质量管理规范(总局公告2014年第64号)(2015年3月1日起施行) 医疗器械生产质量管理规范附录无菌医疗器械(2015年第101号)(2015年10月1日起实施)医疗器械生产质量管理规范无菌医疗器械现场检查指导原则(食药监械监〔2015〕218号附件2)(2015年9月25日发布实施) 3.组织和职责 3.1主责部门 本规则的主责部门为生技部,其职责为: ——根据适用法律法规要求,制定本规定; ——负责按照本规定实施生产批记录管理。 3.2相关部门 其它部门负责配合生技部实施生产批记录的管理。 4.步骤和方法 4.1生产批记录的编制原则 1)生产批记录根据产品生产工艺规程、标准操作规程和技术参数等内容设计,并能体现产品的特点。 2)生产批记录需具有产品质量的可跟踪性,通过批生产记录能了解产品生产全过程的质量情况。 3)生产批记录按产品生产先后顺序依次进行编制。 4)生产批记录由生技部制定,经管理者代表批准后使用。 5)生产批记录设计时应有足够的填写空间,但尽量无空格。 4.2生产批记录的编制要求
1)反映生产产品的基本情况,如:产品名称、规格型号、生产批号、生产日期、岗位操作法或SOP 名称等。 2)反映产品生产过程中的各项卫生管理及清场管理结果。 3)反映产品生产过程中的全部操作步骤。如:生产记录、检验记录等。 4)反映原辅料的品名、规格数量、原材料编号、原材料检测结果等。 5)反映工艺规程执行情况及其采取的特殊措施情况。 6)反映生产过程中出现偏差、质量事故的处理情况。 7)反映出物料平衡情况。 8)反映出操作人员、复核人员、检查人员及审批人员信息。 4.3批生产记录内容包括 1)生产计划表; 2)生产筹备会议记录; 3)领料单; 4)批生产工艺记录、分割包装记录、返工记录(如有); 5)各检验报告单(半成品、成品); 6)生产交接单; 7)批清场记录(按工序); 8)批审核放行单。 4.4批生产记录填写要求 1)任何记录表格中不得填写与本表格要求无关的内容。 2)内容需真实,记录及时,按工艺要求记录,不得提前填写,不得写回忆录。 3)字迹清晰,不得随意更改。 4.5批生产记录的修订 1)生产批记录根据工艺规程、生产条件及标准操作规程的变动情况随时进行修订。 2)生产批记录的修订程序与其制定程序相同。 3)生产批记录一经修订、执行,其以前批生产记录即时作废,不得再度使用或在生产过程中出现。 4.6批生产记录的发放 1)生产批记录批准后,原件由办公室存档。生技部保留一份复印件作为基准样张。 2)生技部在制订生产计划的同时,做好批记录发放,注明所有记录的名称、编码、页数、份数等。 4.7批生产记录的整理与保管 1)每批产品生产结束后,批记录由现场操作人员填写好交由生技部经理批准,由生技部经理负责收集所有该批次的批生产记录,对照《批生产记录明细表》逐一划定,生技部经理初审合格后交质量部经理审核,质量部经理对批记录进行全面审核,做出该批次产品放行与否的判断。 2)所有工序已完成的完整的批生产记录由办公室存档。 3)产品批生产记录至少保存至该产品有效期后一年。 4)生产批记录借阅范围为总经理、管理者代表、生技部和质量部,其它任何部门及个人不得随意借阅、调用,若需借阅须由管理者代表批准。 4.8批记录的销毁 生产批记录是企业产品重要机密文件,因此需经总经理批准后指定专人销毁,由管理者代表监督,确保文件彻底销毁,防止泄密。
附件2 医疗器械生产企业日常监督检查表 企业名称: 条款检查内容及要求检查方式检查情况备注 生产企业许可证有效性1.生产企业许可证有效性 查看生产现场,核对企业工商营业执照与生产企业 许可证内企业名称、注册地址、生产地址一致性。 2.所生产产品是否与许可证核发 的产品范围相符合 查看企业生产现场,成品库房、销售台帐、与企业 许可证核定范围进行核对。 3.企业生产、质量管理人员有无 变化 查看企业人员名单,核对企业工商营业执照和生产 企业许可证内法人代表与负责人姓名的一致性。 4.企业管理层人员是否经过医疗 器械法规的培训 查看培训证书(各级食品药品监督管理部门或企业 内部培训)。 5.三类医疗器械生产企业是否有 内审员 查看证书。 生产条件的符合性检查1.生产、组装能力是否具备,设 备能否正常工作,维护保养是否 在有效期内 查看生产现场,看是否配备完成该工艺的生产设 备,核对企业工艺要求及设备维护保养记录。2.生产现场是否管理有序 查看现场及企业是否按产品注册标准的要求进行 生产,并查看是否制定了生产过程控制和管理文 件。 3.生产场地环境、照明是否与其 生产的产品及规模相适应 查看生产现场环境与照明情况,并查看环境监测记 录,查看生产面积是否拥挤。注:一次性无菌医疗 器械生产现场应符合《无菌医疗器具生产管理规
范》(YY0033)的要求。 医疗器械生产企业日常监督检查表 条款检查内容及要求检查方式检查情况备注 4.《生产实施细则》执行情况;有专项要求的,是否符合相应的《生产实施细则》的要求查看生产现场与生产记录是否符合相应的实施细则。尤其是生产输液器、注射器等一次性使用无菌医疗器械是否符合《一次性使用无菌医疗器械产品(注、输器具)生产实施细则》;生产外科植入物的是否符合《外科植入物的生产实施细则》。 5.原材料、外协件和外购件等采购产品是否符合规定要求检查企业供方的评审记录。原材料、外协件和外购件的采购检验记录,采购合同/技术协议是否符合该产品的质量要求,检查物资供应方的资质证明,尤其是原材料必须是有医疗器械注册证的(如义齿等),要注意检查相关资质证明。 6.生产过程的控制,在产品形成过程中,是否有清晰的状态标识和可追溯标识检查企业生产工艺的验证报告(或记录)。检查生产过程的记录,按生产批号能否追溯到产品原材料的批号、每批产品关键工序及特殊过程的控制情况、每批产品生产过程中有关设备、人员情况和质量记录。 出厂检验记录1.检验设备的配置是否能够覆盖 标准中所规定的出厂检验项目。检 验人员是否经过培训持证上岗 查看检验现场,检验设备清单,查验出厂检验报告 (与注册产品标准的要求核对)查看检验人员的上 岗证及相关的证明培训记录。 2.企业是否对检验设备(含计量器 具)的管理建立制度 查检验设备管理制度,应包括采购、入库、首次检 定、使用保养、周期检定及停用报废等内容。 3.检验设备的精度是否符合检验 要求,检验记录是否真实有效,出 查看(技术监督局)检定合格证是否在有效期内, 查看检验设备上的检定标签是否在有效期内,查看
工程物资清查、盘点实施方案 实施目的:为保证工程项目顺利进行竣工决算,全面掌握国内外采购合同的执行情况,明晰工程物资的数量与状态。 清查盘点工作日程安排及相关要求 一)国内外物资清查阶段:2010年5月18日至5月28日 1、国内物资清查组 1)供销部对公司自成立之日起至2010年5月14日止,由供销部签订的所有采购合同进行梳理并编制“合同执行情况明细表” (格式见附件),重点列出变更、终止、未执行完毕合同,并说明理由。 2)法务部对上述变更、终止等合同的法律手续是否完备进行清查,找出问题,并提出合理化建议。 3)财务部将“合同执行情况明细表”逐一与K3 核对,重点清查每一合同项下的工程物资K3 入库数据是否与“合同执行情况明细表”中的数据一致。发现差异及时提交供销部查明原因。 要求:供销部每整理30份合同为一组,整理完毕后及时提交法务部、财务部,每三天由财务部召开一次清查例会,须由供销部、财务部、法务参加,针对清查过程中发现的问题进行讨论并解决。 2、国外物资清查组 1)供销部对公司自成立之日起至2010年5月14日止,所签订的所有国外采购合同进行梳理并编制“合同执行情况明细表”(格式
见附件),重点列出变更、终止、未执行完毕合同,并说明理 由。 (2)法务部对上述变更、终止等合同的法律手续是否完备进行清查,找出问题,并提出合理化建议。 (3)针对各单元退回的进口备品、备件,由仓库主管会同该单元车间主任、对退回的备品、备件进行清点、查验,详细记录备品、备 件名称、规格、型号。 (4)财务部对“合同执行情况明细表”逐一与K3 核对,重点清查每一合同项下的工程物资K3 入库数据是否与“合同执行情况明细表”中的数据一致。发现差异及时提交供销部(沈扬)查明原 因。 要求:供销部整理完毕后及时提交法务部、财务部进行下一步工作。如在进行过程中发现问题由财务部召集相关人员召开清查例会,讨论并解决问题。 (二)物资盘点准备阶段:2010年5月18日至5月28日 1、盘点范围国内外所有工程物资(材料、设备、备品、备件等),范 围由财务部确定。 2、盘点准备 (1)供销部根据物资类别对盘点人员进行分组。