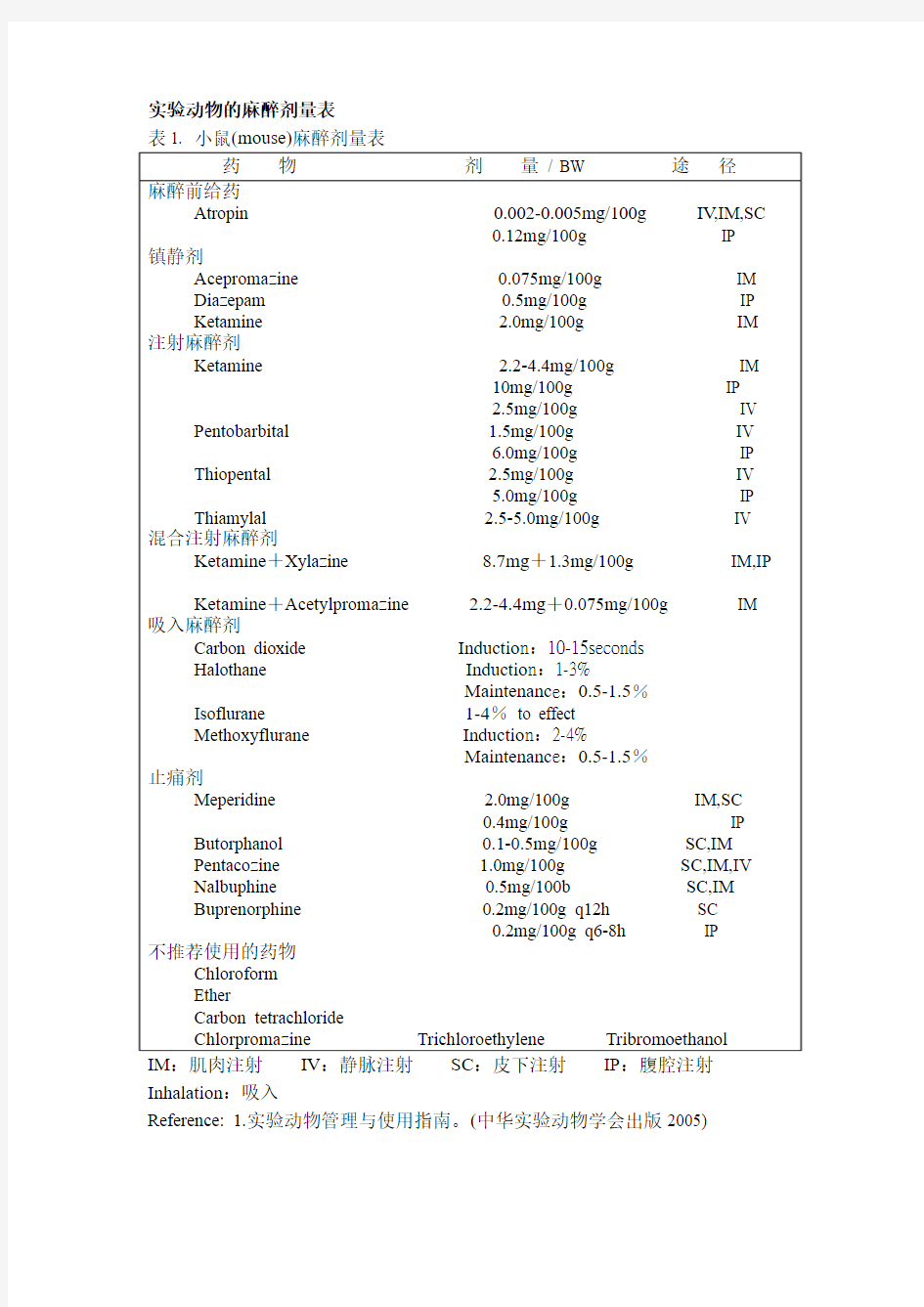

实验动物的麻醉剂量表
表1. 小鼠(mouse)麻醉剂量表
IM:肌肉注射IV:静脉注射SC:皮下注射IP:腹腔注射Inhalation:吸入
Reference: 1.实验动物管理与使用指南。(中华实验动物学会出版2005)
表2. 大鼠(Rat)麻醉剂量表
IM:肌肉注射IV:静脉注射SC:皮下注射IP:腹腔注射Inhalation:吸入Reference: 1.实验动物管理与使用指南。(中华实验动物学会出版2005)
2.Clinical laboratory animal medicine。(K. Hrapkiewicz, Iowa State
University Press1998)
IM:肌肉注射IV:静脉注射SC:皮下注射IP:腹腔注射Inhalation:吸入
Reference: 1.Clinical laboratory animal medicine。(K. Hrapkiewicz, Iowa State University Press1998)
IM:肌肉注射IV:静脉注射SC:皮下注射IP:腹腔注射Inhalation:吸入
Reference: 1.实验动物管理与使用指南。(中华实验动物学会出版2005)
2.Clinical laboratory animal medicine。(K. Hrapkiewicz, Iowa State
University Press1998)
表5. 犬(Dog)麻醉剂量表
IM:肌肉注射IV:静脉注射SC:皮下注射IP:腹腔注射Inhalation:吸入
Reference: 1.实验动物管理与使用指南。(中华实验动物学会出版2005)
表6. 天竺鼠(Guinea Pig)麻醉剂量表
IM:肌肉注射IV:静脉注射SC:皮下注射IP:腹腔注射Inhalation:吸入Reference: 1.Clinical laboratory animal medicine。(K. Hrapkiewicz, Iowa State University Press1998)
表7. 兔(Rabbit)麻醉剂量表
IM:肌肉注射IV:静脉注射SC:皮下注射IP:腹腔注射Inhalation:吸入
Reference: 1.实验动物管理与使用指南。(中华实验动物学会出版2005)
2.Clinical laboratory animal medicine。(K. Hrapkiewicz, Iowa State
University Press1998)
动物麻醉方法及给药剂量 一、动物麻醉的目的 1.清醒状态的动物虽然更加接近其生理状态,但是试验过程中的各种强刺激容易引起动物大脑皮质的抑制,使动物机体发生生理机能障碍影响到实验的结果。甚至引起动物死亡或休克。 2.防止动物伤害实验操作者。 3.基于人道主义的考虑,麻醉是动物保护所必需采取的措施。 二、麻醉的类型和方法 1.全身麻醉的方法: 吸入麻醉:吸入麻醉是将挥发性麻醉剂或气体的麻醉剂经过动物的呼吸道进入体内产生麻醉的效果。常见的麻醉剂有乙醚、安氟醚、三氟乙烷等,其中乙醚因麻醉深度容易掌握、安全、动物容易恢复等优点,使用最为广泛。 1)大鼠、小鼠、豚鼠的乙醚麻醉:将含有乙醚的棉球/纱布放在大烧杯中,将动物放入,封口。动物先兴奋后抑制,自行倒下。当动物角膜反应迟钝,肌肉紧张度降低时,即可取出动物。如果动物逐渐恢复肌肉紧张(挣扎),可重复麻醉一次,待平静后即可开始试验。如果试验时间较长,可将动物固定在其口鼻处放置含有乙醚的棉球或纱布,并在实验中注意动物的反应,适时追加乙醚的吸入量,以维持麻醉的深度和实践。 2)猫、兔的乙醚麻醉:将动物放进内装含有乙醚的棉球/纱布的麻醉瓶中,封口。经过1~2min,从动物后腿依次出现麻痹现象,而后失去运动能力,表明动物进入麻醉状态。4~6min后可以将动物麻醉,如观察到动物倾斜不能站立、跌倒时,说明动物已经深度麻醉,立即取出动物,这时动物肌肉松弛、四肢紧张度降低,角膜反射迟钝,皮肤痛觉消失,可进行试验。3)犬的乙醚麻醉:首先将犬用绳子绑定,根据犬的大小选择适合的麻醉口罩,将纱布/棉花放到口罩内,加入乙醚。一人固定犬的前后肢,另一人用膝盖顶住犬的胸颈处,一手捏住头颈(注意力量,防止窒息),将口罩套在犬嘴上。开始乙醚用量可大一些,之后逐渐减少。犬开始兴奋后出现挣扎、呼吸不规则现象,而后呼吸逐渐平稳,肌肉紧张度逐渐消失,角膜反射迟钝,对皮肤刺激无反应,此时可开始试验。 乙醚吸入如果出现呼吸窒息应暂停吸入乙醚,等呼吸恢复后在继续吸入。随着吸入乙醚麻醉的加深,犬的呼吸加深,肌肉紧张度增加,可能会出现窒息。预防的办法是:在犬每吸入数次乙醚后,取下口罩,让其呼吸一次新鲜空气。
实验动物采血指南 采血方法的选择,决定于实验的目的所需血量以及动物种类。凡用血量较少的检验如红、白细胞计数、血红蛋白的测定,血液涂片以及酶活性微量分析法等,可刺破组织取毛细血管的血。当需血量较多时可作静脉采血。静脉采血时,若需反复多次,应自远离心脏端开始,以免发生栓塞而影响整条静脉。例如,研究毒物对肺功能的影响、血液酸碱平衡、水盐代谢紊乱,需要比较动、动脉血氧分压、二氧化碳分压和血液pH值以及K+、Na+、CI-离子浓度,必须采取动脉血液。采血时要注意:⑴采血场所有充足的光线;室温夏季最好保持在25-28℃,冬季,15-20℃为宜;⑵采血用具有采用部位一般需要进行消毒;⑶采血用的注射器和试管必须保持清洁干燥;⑷若需抗凝全血,在注射器或试管内需预先加入抗凝剂. 不同动物采血部位与采血量的关系
(一)小鼠、大鼠采血法 1.割(剪)尾采血当所需血量很少时采用本法。固定动物并露出鼠尾。将尾部毛剪去后消毒,然后浸在45℃左右的温水中数分钟,使尾部血管充盈。再将尾擦干,用锐器(刀或剪刀)割去尾尖0.3-0.5cm,让血液自由滴入盛器或用血红蛋白吸管吸取,采血结束,伤口消毒并压迫止血。也可在尾部作一横切口,割破尾动脉或静脉,收集血液的方法同上。每鼠一般可采血10余次以上。小鼠每次可取血0.1ml,大鼠0.3~0.5ml。 2.鼠尾刺血法大鼠用血量不多时(仅做白细胞计数或血红蛋白检查),可采用本法。先将鼠尾用温水擦拭,再用酒精消毒和擦拭,使鼠尾充血。用7号或8号注射针头,刺入鼠尾静脉,拔出针头时即有血滴出,一次可采集10~50mm3。如果长期反复取血,应先靠近鼠尾末端穿刺,以后再逐渐向近心端穿刺。 3.眼眶静脉丛采血采血者的左手拇食两指从背部较紧地握住小鼠或大鼠的颈部(大鼠采血需带上纱手套),应防止动物窒息。当取血时左手拇指及食指轻轻压迫动物的颈部两侧,使眶后静脉丛充血。右手持续接7号针头的1ml注射器或长颈(3~4cm)硬质玻璃滴管(毛细管内径0.5-1.0mm),使采血器与鼠面成45℃的夹角,由眼内角刺入,针头斜面先向眼球,刺入后再转180度使斜面对着眼眶后界。刺入浓度,小鼠约2~3mm,大鼠约4~5mm。当感到有阻力时即停止推进,同时,将针退出约0.1-0.5mm,边退边抽。若穿刺适当血液能自然流入毛细管中,当得到所需的血量后,即除去加于颈部的压力,同时,将采血器拔出,以防止术后穿刺孔出血。若技术熟练,用本法短期内可重复采血均无多大困难。左右两眼轮换更好。体重20-25g的小鼠每次可采血0.2-0.3ml;体重200-300g大鼠每次可采血0.5-1.0ml,可适用于某些生物化学项目的检验。 4.断头取血采血者的左手拇指和食指以背部较紧地握住大(小)鼠的颈部皮肤,并作动物头朝下倾的姿势。右手用剪刀猛剪鼠颈,约1/2-4/5的颈部前剪断,让血自由滴入盛器。小鼠可采用约0.8~1.2ml;大鼠约5-10ml。 5.心脏采血鼠类的心脏较小,且心率较快,心脏采血比较困难,故少用。活体
一、动物麻醉的目的 1.清醒状态的动物虽然更加接近其生理状态,但是试验过程中的各种强刺激容易引起动物大脑皮质的抑制,使动物机体发生生理机能障碍影响到实验的结果。甚至引起动物死亡或休克。 2.防止动物伤害实验操作者。 3.基于人道主义的考虑,麻醉是动物保护所必需采取的措施。 二、麻醉的类型和方法 1.全身麻醉的方法: 吸入麻醉:吸入麻醉是将挥发性麻醉剂或气体的麻醉剂经过动物的呼吸道进入体内产生麻醉的效果。常见的麻醉剂有乙醚、安氟醚、三氟乙烷等,其中乙醚因麻醉深度容易掌握、安全、动物容易恢复等优点,使用最为广泛。 1)大鼠、小鼠、豚鼠的乙醚麻醉:将含有乙醚的棉球/纱布放在大烧杯中,将动物放入,封口。动物先兴奋后抑制,自行倒下。当动物角膜反应迟钝,肌肉紧张度降低时,即可取出动物。如果动物逐渐恢复肌肉紧张(挣扎),可重复麻醉一次,待平静后即可开始试验。如果试验时间较长,可将动物固定在其口鼻处放置含有乙醚的棉球或纱布,并在实验中注意动物的反应,适时追加乙醚的吸入量,以维持麻醉的深度和实践。 2)猫、兔的乙醚麻醉:将动物放进内装含有乙醚的棉球/纱布的麻醉瓶中,封口。经过1~2min,从动物后腿依次出现麻痹现象,而后失去运动能力,表明动物进入麻醉状态。4~6min后可以将动物麻醉,如观察到动物倾斜不能站立、跌倒时,说明动物已经深度麻醉,立即取出动物,这时动物肌肉松弛、四肢紧张度降低,角膜反射迟钝,皮肤痛觉消失,可进行试验。3)犬的乙醚麻醉:首先将犬用绳子绑定,根据犬的大小选择适合的麻醉口罩,将纱布/棉花放到口罩内,加入乙醚。一人固定犬的前后肢,另一人用膝盖顶住犬的胸颈处,一手捏住头颈(注意力量,防止窒息),将口罩套在犬嘴上。开始乙醚用量可大一些,之后逐渐减少。犬开始兴奋后出现挣扎、呼吸不规则现象,而后呼吸逐渐平稳,肌肉紧张度逐渐消失,角膜反射迟钝,对皮肤刺激无反应,此时可开始试验。 乙醚吸入如果出现呼吸窒息应暂停吸入乙醚,等呼吸恢复后在继续吸入。随着吸入乙醚麻醉的加深,犬的呼吸加深,肌肉紧张度增加,可能会出现窒息。预防的办法是:在犬每吸入数次乙醚后,取下口罩,让其呼吸一次新鲜空气。 非吸入麻醉:该方法是一种简单方便能够让动物很快进入麻醉期,而且没有明显的兴奋期麻醉方法。一般采用注射的方法,有静脉注射、肌肉注射、腹腔注射等。 静脉注射、肌肉注射主要用于较大的动物的麻醉,如兔、猫、猪、犬等;腹腔注射多用于较小动物的麻醉,如小鼠、大鼠、沙鼠、豚鼠等。
动物常用麻醉药及应用 舒泰麻醉剂使用说明书简要说明: 舒泰是一种新型分离麻醉剂,它含镇静剂替来他明和肌松剂唑拉西泮。在全身麻醉时,舒泰能够保证诱导时间短、极小的副作用和最大的安全性。在经肌肉盒静脉途径注射时,舒泰具有良好的局部受耐性。舒泰是一种非常安全的麻醉剂。适用范围 用于犬、猫和野生动物的保定及全身麻醉。应用剂量麻醉前给药 注射舒泰前15分钟按以下剂量给予硫酸阿托品犬:0.1mg/kg ,皮下注射猫:0.05mg/kg ,皮下注射诱导麻醉剂剂量 犬:7—25mg/kg ,肌肉注射5—10mg/kg ,静脉注射 犬:10—15mg/kg ,肌肉注射5—7.5mg/kg ,静脉注射 麻醉维持时间:根据剂量不同,从20到60分钟不等。维持麻醉剂量 建议给予初始剂量的1/3—1/2 ,静脉注射。野生动物:使用详细说明 灵长类动物(平均值)肌肉注射..........................4—6mg/kg 。猫科动物(平均值)肌肉注射..........................4—7.5mg/kg 。犬科动物(平均值)肌肉注射..........................5—11mg/kg 。熊科动物(平均值)肌肉注射..........................3.5—8mg/kg 。牛科动物(平均值)肌肉注
射..........................3.5—33mg/kg 。灵猫科动物(平均值)肌肉注射..........................2.5—6mg/kg 。小鼠(平均值)肌肉注射..........................50—75mg/kg 。大鼠(平均值)肌肉注射..........................50—75mg/kg 。豚鼠(平均值)肌肉注射..........................20mg/kg 。仓鼠(平均值)肌肉注射..........................50mg/kg 。应用指南 为了获得需要的麻醉药浓度,可将含有效成分的冻干粉与总量无菌溶液混合(舒泰20:20mg/ml ;舒泰50:50mg/ml ;舒泰100:100mg/ml )。野生动物需要投掷注射时,可将减少加入溶剂,从而使舒泰浓度提高到400mg/ml 。应用禁忌 用有机磷盒氨基酸酯进行系统治疗的动物。严重的心机能和呼吸机能不全。胰脏功能不全。患严重高血压。 注意事项 舒泰只能用于动物。 建议麻醉前12小时禁食。 动物处于麻醉恢复期时应保证环境黑暗和安静。注意麻醉动物的保暖,防止热量过度散失。与其他药物的配伍禁忌 不要与以下药物一起联合应用: *吩噻嗪类药物(乙酰丙嗪、氯丙嗪等),一起应用抑制心肺功能和引起体温降低。 *氯霉素,一起应用引起麻醉药物的清除率。贮存 舒泰冻干粉在至少2年内是稳定的。
实验动物麻醉方法 麻醉(anesthesia)的基本任务是消除实验过程中所至的疼痛和不适感觉,保障实验动物的安全,使动物在实验中服从操作,确保实验顺利进行。 一、常用的麻醉药 (一)常用局部麻醉剂:普鲁卡因,此药毒性小,见效快,常用于局部浸润麻醉,用时配成0.5%~1%;利多卡因,此药见效快,组织穿透性好,常用1%~2%溶液作为大动物神经干阻滞麻醉,也可用0.25%~0.5%溶液作局部浸润麻醉。 (二)常用全身麻醉剂: 1. 乙醚乙醚吸入法是最常用的麻醉方法,各种动物都可应用。其麻醉量和致死量相差大,所以其安全度大。但由于乙醚局部刺激作用大,可刺激上呼吸道粘液分泌增加;通过神经反射还可扰乱呼吸、血压和心脏的活动,并且容易引起窒息,在麻醉过程中要注意。但总起来说乙醚麻醉的优点多,如麻醉深度易于掌握,比较安全,而且麻醉后恢复比较快。其缺点是需要专人负责管理麻醉,在麻醉初期出现强烈的兴奋现象,对呼吸道又有较强的刺激作用,因此,需在麻醉前给予一定量的吗啡和阿托品(基础麻醉),通常在麻醉前20-30分钟,皮下注射盐酸或硫酸吗啡(每公斤体重5~10mg)及阿托品(每公斤体重0.1mg)。盐酸吗啡可降低中枢神经系统兴奋性,提高痛阈,还可节省乙醚用量及避免乙醚麻醉过程中的兴奋期。阿托品可对抗乙醚刺激呼吸道分泌粘液的作用,可避免麻醉过程中发生呼吸道堵塞,或手术后发生吸入性肺炎。 进行手术或使用过程中,需要继续给予吸入乙醚,以维持麻醉状态。慢性实验预备手术的过程中,仍用麻醉口罩给药,而在一般急性使用,麻醉后可以先进行气管切开术,通过气管套管连接麻醉瓶继续给药。在继续给药过程中,要时常检查角膜反射和观察瞳孔大小(如发现角膜反射消失,瞳孔突然放大,应立即停止麻醉。万一呼吸停止,必须立即施行人工呼吸。待恢复自动呼吸后再进行操作。 2. 苯巴比妥钠此药作用持久,应用方便,在普通麻醉用量情况下对于动物呼吸、血压和其它功能无多大影响。通常在实验前半至一小时用药。使用剂量及方法为:狗腹腔注射80~100mg/kg体重,静脉注射70~120mg/kg体重( 一般每公斤体重给70~80mg即可麻醉,但有的动物要100~120mg 才能麻醉,具体用量可根据各个动物的敏感性而定)。兔腹腔注射150~200mg/kg体重。 3. 戊巴比妥钠此药麻醉时间不很长,一次给药的有效时间可延续3-5小时,所以十分适合一般使用要求。给药后对动物循环和呼吸系统无显著抑制作用,药品价格也很便宜。用时配成1~3%生理盐水溶液,必要时可加温溶解,配好的药液在常温下放臵1~2月不失药效。静脉或腹腔注射后很快就进入麻醉期,使用剂量及方法为:狗、猫、兔静脉注射30~35mg/kg体重,腹腔注射40~45mg/kg体重。 4. 硫喷妥钠为黄色粉末,有硫臭,易吸水。其水溶液不稳定,故必须现用现配,常用浓度为1~5%。此药作静脉注射时,由于药液迅速进入脑组织,故诱导快,动物很快被麻醉。但苏醒也很快,一次给药的麻醉时效仅维持半至一小时。在时间较长的实验过程中,可重复注射,以维持一定的
常用实验动物 1、小鼠 喜欢群居,怕热,高温容易中暑 雌雄性小鼠交配后10~12小时,在雌性小鼠阴道口会形成白色的阴道栓 主要解剖学特性 消化系统:食管内壁有角质化鳞状上皮,利于灌胃;有胆囊;胰腺分散,色淡红,似脂肪组织。 生殖系统:雌性小鼠为双子宫型,呈“Y”形,卵巢不予腹腔相通,无宫外孕。 骨髓为红骨髓,无黄骨髓,终身造血。 皮肤无汗腺。 小鼠常用品种、品系 1. 近交系小鼠 C3H:1975年从美国引进,野生色毛; ? C57BL/6:1975年从日本引进,黑色毛; ? BALB/c:Bagg1913年获得小鼠白化株,经近亲繁殖20代以上育成,毛色为白色; ? DBA:分为DBA/1和DBA/2两个品系,1977年由美国实验动物中心引进,毛色均为浅灰色。 2、封闭群小鼠 ①KM小鼠:我国使用量最大的远交种小鼠,白色,抗病、适应力强,繁殖、成活率高。 ②ICR:1973年由日本国立肿瘤研究所引入我国,白色,其显著特点是繁殖
力强。 ③LACA :1973年由英国实验动物中心引入我国,白色。其实是小鼠改名而成。 ④NIH :由美国国立卫生研究院培育,白色,繁殖力强,幼仔成活率高,雄性好斗 3、突变系 1、裸鼠:第11对染色体上的裸基因(nu)导致无毛裸体、无胸腺 2、SCID小鼠:第16对染色体上的Scid隐性基因突变基因导致T、B淋巴细胞联合免疫缺陷.外观与普通小鼠差别不大,被毛白色,体重发育正常 3、快速老化模型小鼠:4~6月龄以前与普通小鼠的生长一样,4~6月龄以后迅速出现老化症状。如心、肺、脑、皮肤等器官老化,出现骨质疏松和老化淀粉样变。侏儒症:比正常小鼠体型小,缺少生长素和促甲状腺素,用于内分泌研究。小鼠在医学、生物学的应用 1、重组近交系小鼠将双亲品系的基因自由组合和重组产生一系列的子系,是遗传分析的重要依据,用作基因定位及其连锁关系的研究 2、提供自然的动物模型 2、大鼠染色体数2n=42 喜独居,喜啃咬,性情较凶猛、抗病力强,对新环境适应力强,但对环境刺激、炎症反应敏感。强烈噪音可引起食仔或抽搐;湿度低于40%易发生环尾巴症。行为表现多样,情绪反应敏感,易接受通过正负强化进行的多种感觉指令的训练雌性2.5月龄达到性成熟,具有产后发情、产后妊娠的特点。寿命2.5~3年。解剖学特征
实验动物麻醉 所有可能引起实验动物疼痛或不适的实验方案都必须使用合适的麻醉剂、止痛剂和镇静剂。如麻醉剂、止痛剂或镇静剂可能影响实验数据,该实验方案可不使用麻醉剂、止痛剂或镇静剂,但必须在实验方案中予以详细说明,并在实验动物管理委员会批准后方可开展相关实验。 包括动物品系、使用途径、体重、性别、动物健康状况、温度、其它同时使用的药物在内的多种因素影响麻醉剂、止痛剂或镇静剂的使用剂量和有效时间。因此,在使用麻醉剂时必须时刻监测实验动物的麻醉深度,以防止过度麻醉导致动物死亡或麻醉不足无法缓解动物的疼痛。足底反射、角膜反射、肌肉紧张和对皮肤夹捏的反应是检测动物麻醉深度的有用指标,在条件许可时,推荐测量动物心率、血压、呼吸频率及体温作为检测动物麻醉深度更为精确的指标。 使用麻醉剂时,一定要注意方法的可靠性,根据不同的动物选择合适的方法。1.麻醉剂的用量,除参照一般标准外,还应考虑个体对药物的耐受性不同。一般说,衰弱和过胖的动物,其单位体重所需剂量较小。在使用麻醉剂过程中,特别是使用巴比妥类药物时,一般应首先使用较小剂量,随时检查动物的反应情况,并逐步提高剂量。 2.动物在麻醉期体温容易下降,要采取保温措施。相比清醒的动物,麻醉后的动物反应相对迟钝。因此,推荐使用循环水浴保温垫,不推荐使用照明灯、电加热器等不易控制温度的设备,以免灼伤实验动物。 3.静脉注射麻醉剂发挥作用速度快,静脉注射必须缓慢,同时观察肌肉紧张、角膜反射和对皮肤夹捏的反应,当这些活动明显减弱或消失时,应立即停止注射。配制的药液浓度要适中,不可过高,以免麻醉过急;但也不能过低,以减少注入溶液的体积。实验操作涉及腹腔注射时,不应使用腹腔注射麻醉剂。 4.气温较低时,麻醉剂在注射前应加热至动物体温水平。 5.注射麻醉剂前12小时实验动物应禁食,以防止食物回流。注射前3小时应限制饮水。 6.如需使用抗生素以防止术后感染,手术前1小时应肌肉注射抗生素,并于手术过程中静脉注射抗生素。 7.手术过程中如实验动物大量失血,应补充大约3倍失血体积的0.9%生理盐水。 肌肉舒张剂 肌肉舒张剂必须与全身麻醉同时使用。如需使用肌肉舒张剂,必须在实验动物研究方案中予以详细说明,并得到实验动物管理委员会的批准。 止痛剂 不同动物疼痛持续时间不同,因此应密切观察实验动物的行为等指标。对创口较大的手术,至少在术后48小时内应给予实验动物适当的止痛剂,对较小的手术,至少在术后24小时内应给予实验动物适当的止痛剂。如24小时或48小时后实验动物表现出明显的疼痛,应持续给药,并应与兽医讨论实验动物是否存在其它的健康问题。通常同时给予两种以上不同的止痛剂有更好的效果,如鸦片类止痛剂与非类固醇类消炎药共同使用。在手术前提前使用止痛剂也有助于帮助实验动物减轻疼痛感,并可减小麻醉剂和止痛剂的使用剂量。
A Good Practice Guide to the Administration of Substances and Removal of Blood,Including Routes and Volumes 良好的实验动物给药和采血(包括途径和体积)规范指南 Karl-Heinz Diehl1, Robin Hull2, David Morton3, Rudolf Pfister4, Yvon Rabemampianina5, David Smith6,*, Jean-Marc Vidal7 and Cor van de V orstenbosch 8 1Aventis, PO Box 1140, D35001 Marburg, Germany 德国马尔堡市35001区1140信箱安万特公司 2N I B S C, Blanch Lane, South Miimms, Potters Bar, Hertfordshire EN6 3QG 英国赫特福德郡EN6 3QG波特斯巴镇South Miimms布兰奇道英国国家生物制品检定所 3The University of Birmingham, Medical School, Edgbaston, Birmingham B15 2TT 英国伯明翰市B15 2TT艾吉马斯顿伯明翰大学医学院 4Novartis Pharma AG, CH-4002 Basel, Switzerland 瑞士巴塞尔CH-4002诺华制药公司 5Centre de Recherche Pfizer, Etablissement d’Amboise, Z1 Poce′-sur-Cisse-BP 159 37401 Amboise Cedex, France 法国Amboise Cedex Z1 Poce′-sur-Cisse-BP 159 37401 Etablissement d’Amboise 辉瑞研究中心 6AstraZeneca R&D Charnwood, Bakewell Road, Loughborough, Leics LE11 5RH 英国莱斯特郡LE11 5RH拉夫堡市贝克韦尔路Charnwood阿斯利康研究中心 7Aventis, 102 Route de Noisy, 95235 Romainville Ce′dex, France 法国Romainville Ce′dex 95235 Noisy路102号安万特公司 8N V Organon, PO Box 20, 5340 BH Oss, Netherlands 荷兰BH Oss5340 20号信箱欧加农公司 Key words: blood volumes; blood removal; administration substances; laboratory animals; refinement. 关键词:血容量;采血;给药;实验动物;简化 This article is the result of an initiative between the European Federation of Pharmaceutical Industries Associations (EFPIA) and the European Centre for the Validation of Alternative Methods (ECV AM).Its objectives are to provide the researcher in the safety evaluation laboratory with an up-to-date, easyto-use set of data sheets to aid in the study design process whilst at the same time affording maximum welfare considerations to the experimental animals. 该文章为欧盟制药工业协会(EFPIA)和欧洲替代动物实验方法验证中心(ECV AM)之间的初步结果。其目的在于为安全性评价实验室的研究者提供最新的易于使用的数据库以帮助研究设计过程,同时最大可能地考虑到实验动物的福利。 Although this article is targeted at researchers in the European Pharmaceutical Industry, it is considered that the principles underpinning the data sets and refinement proposals are equally applicable to all those who use these techniques on animals in their research, whether in research institutes,universities or other sectors of industry. The implications of this article may lead to discussion with regulators, such as those responsible for pharmacopoeial
常用的麻醉剂和麻醉方法 常用的麻醉剂大致分为三类,即挥发性麻醉剂、非挥发性麻醉剂和中药麻醉剂。麻醉方法一般分为吸入、注入(静脉、皮下、肌肉、腹腔等)、口服、灌胃等。 麻醉药物应用的方法和剂量如下: 一最常用的挥发性麻醉药物为乙醚 开放麻醉法是用脱脂棉浸湿乙醚后,小动物如大鼠、小鼠可将头部放入蘸有乙醚棉球的广口瓶内,4~6分钟后即处于麻醉状态。适用于各种实验动物。如实验过程较长,可在其鼻部放棉花或纱布,不时滴加乙醚维持,也可用乙醚先麻醉后再用非挥发性麻醉剂维持麻醉。较大动物可用麻醉口罩滴药法。 封闭麻醉法是将小动物置于一封闭容器中,该容器中预先置于浸泡乙醚之棉球,乙醚挥发后使动物吸入而置麻醉。在给药过程中必须随时观察动物的变化,如果发现动物的角膜反射消失,瞳孔突然放大,应立即停止麻醉。防止麻醉过深,引起死亡。 常用全身麻醉剂: 乙醚乙醚吸入法是最常用的麻醉方法,各种动物都可应用。其麻醉量和致死量相差大,所以其安全度大。但由于乙醚局部刺激作用大,可刺激上呼吸道粘液分泌增加;通过神经反射还可扰乱呼吸、血压和心脏的活动,并且容易引起窒息,在麻醉过程中要注意。但总起来说乙醚麻醉的优点多,如麻醉深度易于掌握,比较安全,而且麻醉后恢复比较快。其缺点是需要专人负责管理麻醉,在麻醉初期出现强烈的兴奋现象,对呼吸道又有较强的刺激作用,因此,需在麻醉前给予一定量的吗啡和阿托品(基础麻醉),通常在麻醉前20-30分钟,皮下注射盐酸或硫酸吗啡(每公斤体重5~10mg)及阿托品(每公斤体重0.1mg)。 盐酸吗啡可降低中枢神经系统兴奋性,提高痛阈,还可节省乙醚用量及避免乙醚麻醉过程中的兴奋期。阿托品可对抗乙醚刺激呼吸道分泌粘液的作用,可避免麻醉过程中发生呼吸道堵塞,或手术后发生吸入性肺炎。 进行手术或使用过程中,需要继续给予吸入乙醚,以维持麻醉状态。慢性实验预备手术的过程中,仍用麻醉口罩给药,而在一般急性使用,麻醉后可以先进行气管切开术,通过气管套管连接麻醉瓶继续给药。在继续给药过程中,要时常检查
动物麻醉剂及麻醉剂量 Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】
动物麻醉方法及给药剂量 一、动物麻醉的目的 1.清醒状态的动物虽然更加接近其生理状态,但是试验过程中的各种强刺激容易引起动物大脑皮质的抑制,使动物机体发生生理机能障碍影响到实验的结果。甚至引起动物死亡或休克。 2.防止动物伤害实验操作者。 3.基于人道主义的考虑,麻醉是动物保护所必需采取的措施。 二、麻醉的类型和方法 1.全身麻醉的方法: 吸入麻醉:吸入麻醉是将挥发性麻醉剂或气体的麻醉剂经过动物的呼吸道进入体内产生麻醉的效果。常见的麻醉剂有乙醚、安氟醚、三氟乙烷等,其中乙醚因麻醉深度容易掌握、安全、动物容易恢复等优点,使用最为广泛。 1)大鼠、小鼠、豚鼠的乙醚麻醉:将含有乙醚的棉球/纱布放在大烧杯中,将动物放入,封口。动物先兴奋后抑制,自行倒下。当动物角膜反应迟钝,肌肉紧张度降低时,即可取出动物。如果动物逐渐恢复肌肉紧张(挣扎),可重复麻醉一次,待平静后即可开始试验。如果试验时间较长,可将动物固定在其口鼻处放置含有乙醚的棉球或纱布,并在实验中注意动物的反应,适时追加乙醚的吸入量,以维持麻醉的深度和实践。 2)猫、兔的乙醚麻醉:将动物放进内装含有乙醚的棉球/纱布的麻醉瓶中,封口。经过1~2min,从动物后腿依次出现麻痹现象,而后失去运动能力,表明动物进入麻醉状态。4~6min后可以将动物麻醉,如观察到动物倾斜不能站立、跌倒时,说明动物已经深度麻醉,立即取出动物,这时动物肌肉松弛、四肢紧张度降低,角膜反射迟钝,皮肤痛觉消失,可进行试验。 3)犬的乙醚麻醉:首先将犬用绳子绑定,根据犬的大小选择适合的麻醉口罩,将纱布/棉花放到口罩内,加入乙醚。一人固定犬的前后肢,另一人用膝盖顶住犬的胸颈处,一手捏住头颈(注意力量,防止窒息),将口罩套在犬嘴上。开始乙醚用量可大一些,之后逐渐减少。犬开始兴奋后出现挣扎、呼吸不规则现象,而后呼吸逐渐平稳,肌肉紧张度逐渐消失,角膜反射迟钝,对皮肤刺激无反应,此时可开始试验。
动物麻醉方法及给药剂量 令狐文艳 一、动物麻醉的目的 1.清醒状态的动物虽然更加接近其生理状态,但是试验过程中的各种强刺激容易引起动物大脑皮质的抑制,使动物机体发生生理机能障碍影响到实验的结果。甚至引起动物死亡或休克。 2.防止动物伤害实验操作者。 3.基于人道主义的考虑,麻醉是动物保护所必需采取的措施。 二、麻醉的类型和方法 1.全身麻醉的方法: 吸入麻醉:吸入麻醉是将挥发性麻醉剂或气体的麻醉剂经过动物的呼吸道进入体内产生麻醉的效果。常见的麻醉剂有乙醚、安氟醚、三氟乙烷等,其中乙醚因麻醉深度容易掌握、安全、动物容易恢复等优点,使用最为广泛。 1)大鼠、小鼠、豚鼠的乙醚麻醉:将含有乙醚的棉球/纱布放在大烧杯中,将动物放入,封口。动物先兴奋后抑制,自行倒下。当动物角膜反应迟钝,肌肉紧张度降低时,即可取出动物。如果动物逐渐恢复肌肉紧张(挣扎),可重复麻醉一次,待平静后即可开始试验。如果试验时间较长,可将动物固定在其口鼻处放置含有乙醚的棉球或纱布,并在实验中注意动物的反应,适时追加乙醚的吸入量,以维持麻醉的深度和实践。
2)猫、兔的乙醚麻醉:将动物放进内装含有乙醚的棉球/纱布的麻醉瓶中,封口。经过1~2min,从动物后腿依次出现麻痹现象,而后失去运动能力,表明动物进入麻醉状态。4~6min 后可以将动物麻醉,如观察到动物倾斜不能站立、跌倒时,说明动物已经深度麻醉,立即取出动物,这时动物肌肉松弛、四肢紧张度降低,角膜反射迟钝,皮肤痛觉消失,可进行试验。3)犬的乙醚麻醉:首先将犬用绳子绑定,根据犬的大小选择适合的麻醉口罩,将纱布/棉花放到口罩内,加入乙醚。一人固定犬的前后肢,另一人用膝盖顶住犬的胸颈处,一手捏住头颈(注意力量,防止窒息),将口罩套在犬嘴上。开始乙醚用量可大一些,之后逐渐减少。犬开始兴奋后出现挣扎、呼吸不规则现象,而后呼吸逐渐平稳,肌肉紧张度逐渐消失,角膜反射迟钝,对皮肤刺激无反应,此时可开始试验。 乙醚吸入如果出现呼吸窒息应暂停吸入乙醚,等呼吸恢复后在继续吸入。随着吸入乙醚麻醉的加深,犬的呼吸加深,肌肉紧张度增加,可能会出现窒息。预防的办法是:在犬每吸入数次乙醚后,取下口罩,让其呼吸一次新鲜空气。 非吸入麻醉:该方法是一种简单方便能够让动物很快进入麻醉期,而且没有明显的兴奋期麻醉方法。一般采用注射的方法,有静脉注射、肌肉注射、腹腔注射等。 静脉注射、肌肉注射主要用于较大的动物的麻醉,如兔、猫、猪、犬等;腹腔注射多用于较小动物的麻醉,如小鼠、大鼠、沙鼠、豚鼠等。
项目二十七常用实验动物的接种和采血方法 一、接种方法 (一) 皮下注射 皮下组织疏松的部位都可皮下注射。一般小鼠在腹部两侧,豚鼠在腹部或大腿内侧,家兔取背部,大腿内侧或耳根部皮下注射。注射部位消毒后,左手提起皮肤,右手持注射器将针头水平刺入皮下,针头摆动无阻力,说明已进入皮下,慢慢注入,注射部位随即隆起。注射完毕,用棉球压住针刺处,再拔出针头。小鼠注入量一般为0.2~0.5ml。家兔或豚鼠注入量为0.5~1.0ml. (二) 皮内注射 先将动物注射部位的毛剪去,消毒,然后左手绷紧皮肢,针头斜面向上,紧贴皮肤表层刺入,然后向上挑起再稍刺入,缓慢注射。若注入皮内,注射部位马上有小泡隆起。皮内注射量一般为0.1~0.2ml。 (三) 肌内注射 应选择肌肉发达、无大血管通过的部位。一般多选臀部、大腿内侧或外侧。针头直接刺入肌肉,回抽针栓如无回血即可注射。家兔等大动物注射量不超过2ml。 (四) 腹腔注射 小白鼠腹腔注射时,用右手拉鼠尾,左手食指和拇指捏住脑背部皮肤,翻转鼠体,把鼠尾和一侧的后腿夹于小指和无名指之间,使动物处于头低位,使内脏移向上腹,右手持注射器在下腹部左侧或右侧刺入皮下,沿皮下朝头部方向进针0.5~1.0cm,再以45°角刺入腹腔,此时有落空感,回抽无肠液,尿液或血液即可缓缓注入。家兔等较大动物注射,应先固定,于腹部腹中线旁侧1cm处进针。小鼠注射量一般为0.5~1.0ml,家兔或豚鼠为5ml。 (五) 静脉注射 1.家兔将家兔固定,用酒精棉球轻轻按摩耳翼,压迫耳根部静脉,使耳缘静脉扩张。用左手拇指与中、食指抓住耳尖部,从耳尖部边缘静脉平行进针,试推进少量注射液,如果觉得没有阻力,局部也没有隆起,表示已进入静脉,将注射液缓缓注入。若失败,再逐步向耳根部移位重新注射。注射完毕,用棉球压住针眼处,拔出针头。注射部位一般选用耳外缘静脉,易固定,表浅;耳内缘静脉深,不易固定,故不常用。 2.小鼠于尾部两侧静脉注射。固定小鼠使尾巴露出,置45℃~50℃温水浸泡1~2min,使尾部静脉扩张。取出尾巴,擦干消毒,在末端1/3或1/4处用左手捏住尾巴,右手持注射器,针头与静脉平行缓慢进针,试注入少许注射液,如无阻力,皮肤不发白,表示针头刺入静脉,否则应更换部位重扎。注射时多选用4 1/2# 针头。最大注射量为0.5ml。 二、采血方法 (一) 小鼠采血方法 1.断尾采血将小鼠固定,露出尾巴,用手轻揉或浸泡于45℃温水中数分钟或用酒精棉球涂擦,使尾血管充血。将鼠尾擦干,用剪刀剪去尾尖1~2mm。然后用手指从尾根部向尾尖捋,血即从断端流出。采血结束后消毒止血。此法采血每只小鼠可采十余次,每次可采血约0.1ml。 2.眼眶后静脉丛采血左手抓注鼠耳间头部皮肤,将头按在桌面或鼠笼上,轻压颈部两侧,引起头部静脉血液回流困难,使眼球充分突出,眶后静脉丛充血。右手持长为7~10cm 玻璃滴管(毛细管端内径1~1.5mm,长约1cm)或7# 针头的1ml 注射器,在内眼角与眼球之
实验动物麻醉药物使用指南 第一部分不同类型麻醉药物的一般特性 一、镇静剂和安定剂镇静剂使用前动物的生理状态能显著影响镇静的程度。给药前攻击性强的、不听话的、极其兴奋的动物会比较难处理,除非给予高剂量的呼吸抑制药物。 1. 吩噻嗪类Phenothiazines 常用制剂:乙酰丙嗪acepromazine ,氯丙嗪chlorpromazine ,丙嗪promazine 理想疗效 增强麻醉剂、安眠药和麻醉性镇痛药的效果(包括减少药物剂量,延长作用时间和顺利地从麻醉中恢复) 止吐作用 促进骨骼肌松弛引起兔耳静脉血管扩张 不良反应 中度低血压 导致低体温症 潜在的、与研究相关的并发症 基底神经节多巴胺阻塞降低自发肌动活动阻塞儿茶酚胺的外周作用 下丘脑儿茶酚胺耗尽引起的低体温症 高剂量阻碍FSH 和LH 的释放提高鼠、绵羊和山羊的催乳素水平发生肾上腺素通过肾上腺髓质释放引起的高血糖应用于猫,小剂量可减小肾 上腺素导致的血管加压作用,大剂量可翻转血管加压作用
减少动物的血细胞比容拮抗阿朴吗啡诱发的犬呕吐可能引起犬心律 不齐高剂量的氯丙嗪使猫产生颤动和僵硬可能导致胎鼠产生唇裂和 腭裂长时间使用可产生眼部病变 2. 苯二氮平类药物Benzodiazepines 常用制剂:地西泮diazepam,咪达唑仑midazolam 理想疗效 镇静作用因物种而异(作用最小的是犬, 最大的是兔子和鼠)增强 大部分麻醉药和麻醉镇痛药的药效良好的松弛骨骼肌作用不良反应 正常剂量下无不良反应 管制药物 潜在的、与研究相关的并发症主要通过作用脑干网状结构抑制中枢神经系统阻断脊髓多突触反射作用减少大鼠脑和纹状体边缘区多巴胺的合成 增强GABA 介导的中枢神经系统抑制在犬静脉注射后产生瞬时的动脉降血压作用人的腭裂的发生与怀孕期间母体摄入该药物有关其他 应通过静脉注射地西泮,肌肉注射和皮下注射会引起全身不均一的吸收。地西泮在溶液中不与其他药物相溶,因此不应与其他药物在同一注射器内混合(除氯胺酮) 咪达唑仑可以通过肌肉注射或皮下注射途径给药,也可与某些其他药物联合使用 3. a-2-肾上腺素受体激动剂 常用制剂:美托咪定xylazine,甲苯噻嗪medetomidine,地托咪定
动物麻醉剂及麻醉剂量文稿归稿存档编号:[KKUY-KKIO69-OTM243-OLUI129-G00I-FDQS58-
动物麻醉方法及给药剂量 一、动物麻醉的目的 1.清醒状态的动物虽然更加接近其生理状态,但是试验过程中的各种强刺激容易引起动物大脑皮质的抑制,使动物机体发生生理机能障碍影响到实验的结果。甚至引起动物死亡或休克。 2.防止动物伤害实验操作者。 3.基于人道主义的考虑,麻醉是动物保护所必需采取的措施。 二、麻醉的类型和方法 1.全身麻醉的方法: 吸入麻醉:吸入麻醉是将挥发性麻醉剂或气体的麻醉剂经过动物的呼吸道进入体内产生麻醉的效果。常见的麻醉剂有乙醚、安氟醚、三氟乙烷等,其中乙醚因麻醉深度容易掌握、安全、动物容易恢复等优点,使用最为广泛。 1)大鼠、小鼠、豚鼠的乙醚麻醉:将含有乙醚的棉球/纱布放在大烧杯中,将动物放入,封口。动物先兴奋后抑制,自行倒下。当动物角膜反应迟钝,肌肉紧张度降低时,即可取出动物。如果动物逐渐恢复肌肉紧张(挣扎),可重复麻醉一次,待平静后即可开始试验。如果试验时间较长,可将动物固定在其口鼻处放置含有乙醚的棉球或纱布,并在实验中注意动物的反应,适时追加乙醚的吸入量,以维持麻醉的深度和实践。
2)猫、兔的乙醚麻醉:将动物放进内装含有乙醚的棉球/纱布的麻醉瓶中,封口。经过1~2min,从动物后腿依次出现麻痹现象,而后失去运动能力,表明动物进入麻醉状态。4~6min后可以将动物麻醉,如观察到动物倾斜不能站立、跌倒时,说明动物已经深度麻醉,立即取出动物,这时动物肌肉松弛、四肢紧张度降低,角膜反射迟钝,皮肤痛觉消失,可进行试验。 3)犬的乙醚麻醉:首先将犬用绳子绑定,根据犬的大小选择适合的麻醉口罩,将纱布/棉花放到口罩内,加入乙醚。一人固定犬的前后肢,另一人用膝盖顶住犬的胸颈处,一手捏住头颈(注意力量,防止窒息),将口罩套在犬嘴上。开始乙醚用量可大一些,之后逐渐减少。犬开始兴奋后出现挣扎、呼吸不规则现象,而后呼吸逐渐平稳,肌肉紧张度逐渐消失,角膜反射迟钝,对皮肤刺激无反应,此时可开始试验。 乙醚吸入如果出现呼吸窒息应暂停吸入乙醚,等呼吸恢复后在继续吸入。随着吸入乙醚麻醉的加深,犬的呼吸加深,肌肉紧张度增加,可能会出现窒息。预防的办法是:在犬每吸入数次乙醚后,取下口罩,让其呼吸一次新鲜空气。 非吸入麻醉:该方法是一种简单方便能够让动物很快进入麻醉期,而且没有明显的兴奋期麻醉方法。一般采用注射的方法,有静脉注射、肌肉注射、腹腔注射等。 静脉注射、肌肉注射主要用于较大的动物的麻醉,如兔、猫、猪、犬等;腹腔注射多用于较小动物的麻醉,如小鼠、大鼠、沙鼠、豚鼠等。
常见动物实验中实验动物的选择 一、药理学研究中的选择 1、临床药物代谢动物学研究:首选动物及性别,应尽量与药效量或毒理学研究所用动物一致。 药物动力学参数测定:最好使用犬、猴子等大动物,可在同一动物上多次采样。药物分布实验:大、小鼠较方便。药物排泄试验:一般首选大鼠,胆汁采集可在乙醚麻醉,胆管插管引流。 2、一般药理研究 主要药效作用以外广泛药理作用的研究。动物:小鼠、大鼠、猫、犬等性别不限。 3、作用于神经系统的药物研究: 促智药:成年大小鼠一般应用幼年、老年鼠。 镇静催眠药:成年小鼠便于分组。 抗痛药:成年大小鼠,以雄性为宜。 镇痛药:需在整体动物上进行,常用成年小鼠、兔,也可用豚鼠、犬等,雌雄兼用。 中枢性肌松药:小鼠、猫。 解热药:首选兔。兔:品种、年龄、室温、动物活动情况等不同,对发热反应速度和程度有明显影响,应按药典规定进行。 神经节传导阻滞影响药物:首选猫,最常用的是颈神经节,因其前后部易于区分。 4、心血管系统的药物研究: 抗心肌缺血药:狗、猫、兔、大小鼠。 抗心率失常药:豚鼠。小鼠不便操作。 降压药:狗、猫、大鼠。不宜用兔:外周循环对外界环境刺激极敏感,血压变化大。 治疗心功能不全药:狗、猫、豚鼠、兔。一般不用大鼠。 降血压药:大鼠、兔。模型动物:遗传性高脂血症WHHL兔。 抗动脉粥样硬化药:一般用兔、鹌鹑。 抗血小板聚集药、抗凝血药:大鼠、兔,个别也可用小鼠。 5、呼吸系统药物: 镇咳药筛选:首选豚鼠,对化学刺激或机械刺激都很敏感。猫:生理条件下很少咳嗽,可用于刺激喉上神经诱发咳嗽,在初筛基础上进一步肯定药物的镇咳作用。犬:适用于观察药物的镇咳作用持续时间。 兔:对化学、电刺激不敏感。大小鼠:实验可靠性差。 支气管扩张药:常用豚鼠:气道平滑肌对致痉剂药物反应敏感。大鼠:某些免疫和药理学特点与人类较近。 祛痰药:一般用雄性小鼠,兔、猫。 6、消化系统药物: 胃肠解痉药:大鼠、豚鼠、家兔、犬等,雌雄均可。 催吐、止吐:犬、猫、鸽等。兔、豚鼠、大鼠,无呕吐反射,故不选用。 7、泌尿系统药物: 利尿、抗利尿药:雄性大鼠或犬为好。 8、内分泌系统药物:
(首都医科大学平谷教学医院,北京平谷 101200) 【摘要】:目的:通过本中心1000例的实验动物猪的麻醉,总结出一种猪实用的麻醉方法。方法:对本中心4年来共1000例猪选用咪达唑仑0.1-0.2mg/kg及速眠新0.25—0.3ml/kg 复合肌注诱导镇静,琥珀酰胆碱、地西泮注射液、利多卡因加入到平衡液中配成麻醉混合液缓慢静脉滴注维持的方法实现对猪耐受各种手术的麻醉。结果:6例猪在麻醉过程中由于操作不当,于气管插管前后不幸死亡,1例死于氧气供给缺乏,9例死于术中大出血,其余猪均顺利维持到手术结束。结论:速眠新和地西泮复合用药,用于猪的麻醉是非常经济、实用的,有很好的应用价值。 【关键词】:猪;实验动物;麻醉 随着医学技术的迅猛发展,各种新的仪器设备及新的手术方式在向临床不断的推广,在这些设备及技术运用到临床推广之前通常要在实验动物上模拟真实的手术,用以验证可行性及可操作性。我中心自2009年4月至今的四年中,开展了外科腹腔镜培训班40多期,消化内镜及心脏介入的培训班30多期,协助外院完成医学课题研究40多项。各种实验动物麻醉近2000例,其中实验用猪的麻醉已经超过了1000例,从中总结了对动物猪麻醉的一些麻醉原则、方法、注意事项,现介绍如下。 1 材料与方法 1.1实验动物:本中心2009年4月——2013年4月的四年间麻醉的实验用猪共计1000头,3—24个月,均为雌性,体重40±20kg,临床检查健康,由北京市房山区琉璃河实验用猪场购入。在同一环境下饲养3—7天再进行实验。 1.2 实验器械和药品:实验器械有麻醉机、监护仪、麻醉床、喉镜、听诊器及其它常用的物品。实验药品包括阿托品、地塞米松、咪达唑仑、速眠新、琥珀酰胆碱、地西泮注射液、利多卡因等。 1.3 实验方法:实验动物和实验人员麻醉前均做好充分的准备,麻醉过程中注意实验动物的生理反应和生命体征变化。 1.3.1 麻醉前的准备 1.3.1.1 实验动物的术前准备:根据不同的实验操作选择合适的实验动物。一般做腹腔镜手术的猪需要15-20KG左右,这样的猪体内各个器官已经基本发育完全,体型偏小有利于腹腔镜器械的操作。而行心脏介入的猪最好为50KG以上,以便术者更好的寻找目标血管以及在该血管中进行手术操作。术前禁食水是术前至关重要的环节。通常情况下要做到实验前对猪禁食6-8小时,禁水2小时,以保证其胃部的空虚,防止充满食物的胃压迫膈肌而影响猪的呼吸1。同时防止猪的呕吐及误吸。不仅有利于气管插管的操作,同时也提高了实验动物操作的安全性。如果需要进行胃肠镜手术,则至少需要禁食72小时,禁水12小时,以充分达到胃排空的目的,有利于术中暴露清晰的视野。同时,术前尽量将实验动物单笼饲养(见图1),每天定期进行笼舍的清理。不仅可以避免猪产生的大量污染物影响手术室的环境卫生,同时在一定程度上提高了术中无菌环境的程度。 1.3.1.2 麻醉人员的术前准备:作为麻醉工作者,术前必须掌握实验动物的一般情况,根据猪的身体状况调节麻醉药剂量,对体弱猪适量减少麻醉用药。麻醉前应穿戴合适的手术衣、帽子、口罩、无菌手套,做好自身的防护。根据所要实施的手术制定合理的麻醉方案,准备所需要的麻醉仪器、设备、药品等。