小鼠腹水型肝癌淋巴道转移实验
- 格式:docx
- 大小:31.03 KB
- 文档页数:5

采用直接注射法制作BALB/c小鼠肝癌原位移植瘤模型探讨摘要目的:培养小鼠BNL肝癌细胞,采用直接注射法制作BALB/c小鼠肝癌原位移植瘤,为后续实验奠定基础。
方法:小鼠BNL肝癌细胞体外培养,将调整好的对数生长期的肝癌细胞直接注射到小鼠肝脏,15日后解剖实验小鼠取下肝左叶,4%多聚甲醛固定、常规组织包埋、切片及HE染色后镜下观察。
结果:实验小鼠在肝脏左叶均可以见到肿瘤生长,HE染色示肝细胞肝癌。
结论:直接注射法制作BALB/c小鼠肝癌原位移植瘤模型可操作性强,成癌率高且周期短,值得推广使用。
标签:BALB/c小鼠;肝癌;原位移植瘤;前言肝癌是世界范围内发病率第五,死亡率第三的癌症,而在我国肝癌死亡率居恶性肿瘤死亡率的第二位[1 2]。
所以早期发现、早期诊断、早期治疗是肝癌防治的关键。
因此,如果能够建立一个类似人肝癌的理想模型,从而积极的用于癌症的相关研究,将会对肝癌药物的临床实验治疗具有深远的意义。
建立肝癌的模型临床报道较多,但采用培养好的肝癌细胞直接注射在小鼠肝脏上制作肝癌原位模型在临床上是比较常见的[3]。
查阅文献发现BALB/c小鼠属于近交系的小鼠,此类小鼠的成瘤率高,而且容易饲养,因此我们探索了采用直接注射法[4]建立BALB/c小鼠肝癌原位移植瘤的方法。
1 实验材料与方法1.1 实验动物健康雌性BALB/c近交系小鼠,6周龄,体重18±2g,购自北京华阜康生物科技股份有限公司,合格证号:SCXK(京)2009-0007,饲养于贵阳中医学院中心实验室动物房。
1.2 实验试剂胎牛血清、DMEM高糖购自美国Gibco公司,青链霉素混合液、0.25%的胰蛋白酶购自美国Hyclone公司。
1.3 实验方法和步骤1.3.1 细胞培养将购买的小鼠BNL肝癌细胞株培养于浓度为15%的DMEM 高糖培养基中,37度,5%的CO2培养箱中常规培养,细胞生长到一定程度用0.25%的胰蛋白酶进行消化,继续传代培养,最终达到实验要求的细胞浓度。
疾病小鼠模型系列之肝癌篇前面疾病模型专题已经为大家介绍了肺癌及胃癌小鼠模型,今天是疾病模型专题第三讲,小编将为大家介绍肝癌相关的小鼠模型。
近年来,肝癌的发病率在全球呈上升趋势。
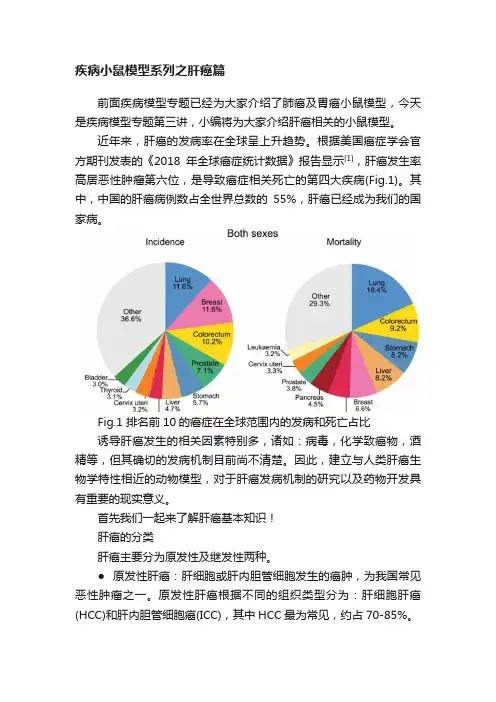
根据美国癌症学会官方期刊发表的《2018年全球癌症统计数据》报告显示[1],肝癌发生率高居恶性肿瘤第六位,是导致癌症相关死亡的第四大疾病(Fig.1)。
其中,中国的肝癌病例数占全世界总数的55%,肝癌已经成为我们的国家病。
Fig.1 排名前10的癌症在全球范围内的发病和死亡占比诱导肝癌发生的相关因素特别多,诸如:病毒,化学致癌物,酒精等,但其确切的发病机制目前尚不清楚。
因此,建立与人类肝癌生物学特性相近的动物模型,对于肝癌发病机制的研究以及药物开发具有重要的现实意义。
首先我们一起来了解肝癌基本知识!肝癌的分类肝癌主要分为原发性及继发性两种。
●原发性肝癌:肝细胞或肝内胆管细胞发生的癌肿,为我国常见恶性肿瘤之一。
原发性肝癌根据不同的组织类型分为:肝细胞肝癌(HCC)和肝内胆管细胞癌(ICC),其中HCC最为常见,约占70-85%。
●继发性肝癌:又称为转移性肝癌,其他脏器的肿瘤细胞经过血液、淋巴或直接侵入肝脏引发的肿瘤。
肝癌的发展进程肝癌的发生是一个多阶段逐渐演变恶化的过程,从最初的肝炎到肝硬化,再到最后的肝癌,是一个多步骤的发展过程[2]。
Fig.2 肝损伤不同阶段(图片来自于网络)由于不同病因会引发不同基因的改变,导致肝癌具有异质性(Fig.3)[3],因此肝癌模型不具有普遍性。
接下来,小编就目前常用的肝癌模型进行综述,供广大研究者进行参考。
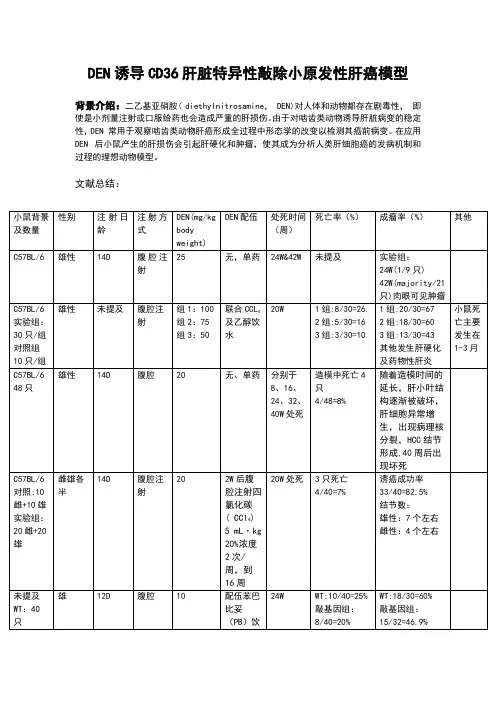
Fig.3 常见的肝癌模型病理图(a.DEN诱发的肝癌; b. DEN+CCl4诱发的肝癌;c.Mdr2肝特异性敲除引发的肝癌;d.Tak1肝特异性敲除引发的肝癌; e.Pten肝特异性敲除引发的肝癌;f.原位注射肿瘤细胞引发的肝癌)常见的肝癌动物模型01 01诱发性肝癌模型许多化学致癌剂达到足够的剂量及时间可诱发动物形成肿瘤。


不同方法建立小鼠肝癌原位移植瘤模型差异性的探讨潘蕊;喻锟;张海亮;郑永仁;赵笑雨;唐钧泽;吴健铭;程欣【期刊名称】《中国实验动物学报》【年(卷),期】2024(32)3【摘要】目的比较肿瘤细胞注射和肿瘤组织块移植方法建立小鼠肝癌原位模型的差异,为小鼠肝癌原位模型的建立提供技术参考。
方法取健康雄性KM小鼠,随机分为4组:A组注射小鼠肝癌H22细胞;B组注射腹水型肝癌H22细胞;C组采用小鼠肝癌组织块移植法;D组肝部注射生理盐水作为假手术组。
定期观察各组小鼠活动情况、体重变化。
记录4组小鼠的生存时间。
观察各组小鼠肝部成瘤状况、肿瘤程度、与腹腔脏器粘连程度和转移情况,并进行B超成像,检测血清中甲胎蛋白(alpha-fetoprotein, AFP)、异常凝血酶原(des-gamma-carboxyprothrombin, DCP)的浓度及苏木素-伊红(HE)染色观察肝组织病理学变化。
结果 A组、B组、C 组小鼠造模操作时间分别为(3.36±0.44)min、(3.30±0.41)min、(5.68±0.65)min。
建模第25天,A组、B组、C组小鼠成瘤率均100.0%,A组腹腔重度粘连率为40.0%,B组腹腔重度粘连率为60.0%,C组与D组均未出现重度腹腔粘连。
A组、B组、C组小鼠腹水出现率分别为40.0%、100.0%、0.0%;腹壁瘤出现率分别为30.0%、60.0%、0.0%。
B组小鼠还存在肝转移情况(40.0%)。
B超成像、血清AFP和DCP水平检测、组织病理学检查结果显示,与D组小鼠相比,A组、B组、C 组小鼠肝边缘均不光滑,回声欠均匀,可见稍低回声包块;保持AFP、DCP高分泌;存在大量炎症细胞与肿瘤细胞。
结论在第25天时,3种方法均可以建立肝癌原位移植模型,其中,相较于肝癌组织块移植,肿瘤细胞注射具有操作简单、肝内存在多个转移结节的特点。
而肝癌组织块移植相较于肿瘤细胞注射,则具有对腹腔等脏器影响较小等特点。

一、实验目的本实验旨在研究荷瘤小鼠的肿瘤生长、转移及治疗效果,为肿瘤的防治提供理论依据和实验数据。
二、实验材料与方法1. 实验动物:C57BL/6小鼠,雌雄各半,体重18-22g。
2. 实验试剂:肿瘤细胞株、细胞培养试剂、免疫组化试剂、流式细胞术试剂等。
3. 实验方法:(1)肿瘤细胞培养:将肿瘤细胞株在细胞培养箱中培养,待细胞生长至对数生长期后,收集细胞进行实验。
(2)荷瘤小鼠模型建立:取对数生长期的肿瘤细胞,以1×10^6个细胞/只的浓度注射至小鼠皮下,建立荷瘤小鼠模型。
(3)分组与处理:将荷瘤小鼠随机分为以下五组:模型组、药物低剂量组、药物中剂量组、药物高剂量组和对照组。
药物低、中、高剂量组分别给予相应浓度的药物灌胃,对照组给予等体积的生理盐水灌胃。
(4)观察指标:①肿瘤生长情况:每周测量肿瘤体积,计算肿瘤生长抑制率。
②肿瘤转移情况:在实验结束时,解剖小鼠,观察肿瘤转移情况。
③免疫组化检测:采用免疫组化技术检测肿瘤组织中相关蛋白的表达。
④流式细胞术检测:采用流式细胞术检测小鼠外周血中T淋巴细胞亚群的变化。
三、实验结果1. 肿瘤生长情况:与模型组相比,药物低、中、高剂量组肿瘤生长抑制率显著提高,差异具有统计学意义(P<0.05)。
2. 肿瘤转移情况:与模型组相比,药物低、中、高剂量组肿瘤转移率显著降低,差异具有统计学意义(P<0.05)。
3. 免疫组化检测:药物低、中、高剂量组肿瘤组织中相关蛋白表达显著降低,差异具有统计学意义(P<0.05)。
4. 流式细胞术检测:药物低、中、高剂量组小鼠外周血中T淋巴细胞亚群CD3+、CD4+、CD8+细胞数显著增加,差异具有统计学意义(P<0.05)。
四、讨论本实验通过建立荷瘤小鼠模型,研究了药物对肿瘤生长、转移及免疫功能的抑制作用。
结果表明,药物低、中、高剂量组均能有效抑制肿瘤生长和转移,提高小鼠的免疫功能。
1. 药物对肿瘤生长的抑制作用:药物通过抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡等途径,发挥抗肿瘤作用。

快速处理小鼠腹水的方法
小鼠腹水是一种常见的疾病,如果不及时处理,会导致小鼠死亡。
以下是快速处理小鼠腹水的方法:
1. 为小鼠提供清洁和干燥的环境,确保它的饮食和饮水充足。
2. 使用针头和注射器抽取腹水,并将其送往实验室进行分析和诊断。
3. 根据实验室的报告,确定小鼠腹水的原因,并给予相应的治疗。
4. 如果小鼠腹水是由感染引起的,可以使用抗生素和其他药物进行治疗。
5. 饲养小鼠时要注意药物的使用和剂量,避免过度使用药物。
6. 定期观察小鼠的健康状况,及时发现问题并采取措施。
以上是快速处理小鼠腹水的方法,如果情况较为严重,建议及时联系兽医进行治疗。
- 1 -。



肿瘤模型我们一般常用的就是小鼠模型和人肿瘤裸小鼠移植瘤模型。
其中用得最多的是皮下模型,另外还有腹水(或者尾静脉注射)以及原位模型,其他的模型很少用,就不提他们了。
小鼠模型分三大类:第一类是以S180、EAC、H22等为代表的,他们的宿主小鼠多选用KM,可产生腹水,也可在皮下成瘤。
多以腹水传代,实验时抽取腹水,经过一定稀释后皮下接种构建模型,接踵后第二天开始给药,给药7到10天,接种10天后结束试验,剥取肿瘤称瘤重。
1. 关于构建瘤种可以用体外细胞株培养后,用PBS悬浮至1~3×106/mouse,接种即可,最好用6号左右的针头,就是常用的2ml一次性注射的针头。
2. 关于腹水传代观察到第一代的种鼠肚子较大后(一般约8~9天左右),可以传代,传代时取1ml注射器,用2ml 注射器的针头,种鼠腹部消毒后直接将针头插入抽取腹水即可,注意不要把针头插得很深,尽量浅一点,还可以把老鼠拎起来,利用重力,让腹水集中在某处便于抽取,一般抽个就可以了,不用离心,直接用P BS3~6倍稀释后,接种到新的老鼠腹腔,腹水颜色为白色或者略有发黄都是正常的,但是血性腹水说明不好,需要注意调整,第二代以后,尽量6~7天的时候传代,不要等的时间太久,否则腹水容易血性。
三代后可用于试验。
3. 关于接种进行试验这个时候抽取的腹水需要量比较多,一般需要处死种鼠后,小心地用消毒眼科剪刀镊子剥开腹部皮肤,注意不要弄破肌肉,然后,用镊子(最好是哪种前面有倒勾的镊子,学名好像是唇型镊)拎起腹部的肌肉,用剪刀剪开一个小口,然后用玻璃滴管或者去掉针头的注射器吸取腹水。
然后进过一定的稀释后,接种到小鼠的腋下。
关于稀释量,各个实验室的情况都不一样,最好摸索一下,开始的时候可以适当的计数,但是要用台盼兰染色后计活细胞数。
接种部位在小鼠腋下,但是不要深入到腋窝里面,会给以后的操作带来麻烦。
接种时的进针处离接种处远一点,让针头在皮下多走一段,不容易污染。

小鼠原发性肝癌模型第一篇:小鼠原发性肝癌模型一种小鼠原发性肝癌模型的建立方法名称: 一种小鼠原发性肝癌模型的建立方法申请(专利)号: CN200610040803.5 申请日: 2006.07.25 公开(公告)号: CN1920008 公开(公告)日: 2007.02.28 主分类号: C12N5/06(2006.01)I 范畴分类: 分类号: C12N5/06(2006.01)I 优先权: 申请(专利权)人:南京大学地址: 210093江苏省南京市汉口路22号发明(设计)人:张煜;徐涵文;沈萍萍国际申请:国际公布:进入国家日期:专利代理机构: 南京知识律师事务所代理人:高桂珍分案申请号:颁证日:光盘号: D0709 摘要:本发明属于生物医药技术领域,具体涉及一种以研究人类肝癌发生发展机制及抗肿瘤药物开发为目的的小鼠原发性肝癌模型的建立方法。
将HepG2细胞在 ICR昆明小鼠腹腔培养,抽取腹水,分离细胞并制成细胞悬液,打开小鼠腹腔,用微量注射器抽取细胞悬液注射入小鼠肝脏,用75%酒精棉签按压针孔至肝脏表面不再渗血,用α-氰基丙烯酸盐乙酯粘合剂封闭针孔,再以生理盐水冲洗冲洗肝脏表面,分层关闭腹腔。
结果显示模型小鼠肝癌发生率为100%,自然消退率为零。
该模型是一种可以用于研究人类原发性肝癌发生发展的机制、同时也适用于抗肿瘤药物开发、肝癌的实验性治疗及诊断研究的理想的原发性肝癌模型。
主权项:权利要求书1.一种小鼠原发性肝癌模型的建立方法,其特征在于:选用HepG2细胞株,选用的ICR昆明小鼠是我国常用的实验动物品系,将HepG2细胞在小鼠腹腔培养,抽取腹水,分离细胞并制成细胞悬液,用微量注射器抽取细胞悬液注射入小鼠肝脏,用75%酒精棉签按压针孔至肝脏表面不再渗血,用α-氰基丙烯酸盐乙酯粘合剂封闭针孔,以生理盐水冲洗冲洗肝脏表面。
全文获取:联系电话:************, 85410394 信箱:***********.cn、***********.cn第二篇:原发性肝癌讲稿原发性肝癌病因机制迄今尚不清楚,根据高发区流行病学调查,以下因素可能与肝癌流行有关。
小鼠H22肝癌肺转移模型的建立及其意义赵方;胡明道;陈鹏【摘要】目的:建立小鼠H22肝癌肺转移模型,为后续研究肝癌的侵袭转移机制奠定实验基础.方法:复苏H22肝癌细胞,在培养皿中进行传代培养并计数,当细胞达到预定数目时,收集处于对数期细胞,用生理盐水洗涤2次,调整细胞浓度为1.0×107/ml,取0.5 ml细胞悬液在无菌环境下注射到小鼠腹腔进行体内传代培养,收集小鼠腹水瘤细胞,用生理盐水洗涤2次,细胞浓度调至2×107/ml,取50μl细胞悬液通过小鼠尾静脉注射到小鼠体内,14 d后人道主义处死小鼠,解剖取出小鼠全肺组织,病理组织学方法鉴定肿瘤组织,全肺连续切片,显微镜下计数肿瘤转移灶数目.结果:全部小鼠肺组织均肿瘤转移灶形成,肉眼可见成肺组织表面微小转移灶,病理鉴定为肝癌肺转移灶,小鼠肺部肿瘤转移灶数平均为23个.结论:成功建立了小鼠H22肝癌肺转移模型,为研究肝癌转移机制提供了理想的动物模型.【期刊名称】《医学理论与实践》【年(卷),期】2017(030)016【总页数】3页(P2346-2348)【关键词】小鼠;H22;细胞;肝癌;肺转移【作者】赵方;胡明道;陈鹏【作者单位】昆明医科大学第二附属医院肝胆胰外科一病区,云南省昆明市650000;昆明医科大学第二附属医院肝胆胰外科一病区,云南省昆明市 650000;昆明医科大学第二附属医院肝胆胰外科一病区,云南省昆明市 650000【正文语种】中文【中图分类】R-33肝细胞肝癌(Hepatocellular carcinoma,HCC)是临床上常见的消化细胞恶性肿瘤,每年新发肝癌病例和死亡病例中有50%以上发生在中国[1]。
2017年美国癌症协会发表癌症统计[2],统计显示,过去25年之间美国总的癌症死亡率降了25%,但是肝癌的死亡率却仍在上升。
目前,手术治疗是当前治疗肝癌的主要方法,但预期效果不佳,后期仍有较大的转移复发率。
小鼠腹水型肝癌淋巴道转移实验 【署名】 指导教师:于晓棠 【摘要】 目的:通过可移植性小鼠腹水型肝癌淋巴道转移实验,从感性上认识肿瘤侵袭与淋巴道转移的生物学特性,了解肿瘤动物实验模型建立的过程及意义。 方法:使用近交系615小鼠皮下接种腹水型肝癌高淋巴道转移菌株(HCa-F)进行肿瘤淋巴道转移实验,取其淋巴结观察是否有淋巴道转移以及检测瘤株淋巴结转移能力。取肺肝肾组织切片以观察是否有血道转移。 结果:小鼠腹水型肝癌发生淋巴道转移,转移率为40%,并可造成相关器官发生病变。 结论:此方法操作简单,结果直观,小鼠腹水型肝癌淋巴道转移率较高。 【关键词】小鼠 腹水型肝癌 淋巴道转移 【前言】 为更好地了解肿瘤的发病机制、肿瘤与宿主的关系、肿瘤侵袭与转移的过程和治疗措施的有效性,需要建立合适的动物模型。小鼠与人类在遗传学、病理学、生物学许多特性方面相似,是肿瘤研究的理想动物模型。而且目前的技术能够在鼠的基因水平上设计与人类疾病相关的基因突变而获得相关疾病模型[1]。小鼠模型是目前可以整合基础和临床肿瘤研究的武器[2],已应用于肿瘤研究的各个领域。随着对肿瘤认识的不断深入,以及实验动物学的发展和一些新技术的运用,小鼠肿瘤模型的研究取得了重要进展,并已得到广泛应用。 肿瘤转移是导致恶性肿瘤患者死亡的主要原因之一,淋巴结转移是癌早期最常见的转移方式,且淋巴转移还可以成为进一步血道转移的桥头[3]。小鼠腹水型肝癌淋巴道转移试验是研究肝癌的淋巴道转移的生物学特性的试验。因为新近流行病学资料表明,我国的原发性肝癌病人数占全世界肝癌病人的一半以上。由于乙型肝炎、肝炎后肝硬化病人众多,致使我国的肝癌发病率和死亡率居高不下,其死亡率占所有恶性肿瘤的第二位。在上个世纪我国进行大规模的现场筛查,通过早期发现早期治疗,在临床治疗方面取得了巨大进步,使肝癌有不治之症变成了部分可治之症。近来综合治疗技术的发展,大肝癌缩小后二部切除,又使部分病人获得了可治愈机会。随着临床治疗经验的积累,逐渐意识到及时是小肝癌根治性切除,转移复发仍然是一个十分严峻的问题。术后5年复发率可高达50%。解决这些问题,单靠临床经验、病例分析是远远不够的。要涉及到肝癌的实质性问题——肿瘤本身的生物学特性,尤其是其转移的生物学特性。对肝癌转移的生物学行为进行实验研究,必须有一个良好的转移模型系统。 HCa-F是从小鼠腹水型肝癌细胞株H22中筛选出的特异性向淋巴道转移的细胞,HCa-F为高转移细胞株,接种于615小鼠腋中线皮下淋巴结转移率高于80%[4][5]。本实验为感性上认识肿瘤侵袭与淋巴道转移的生物学特性,了解肿瘤动物实验模型建立的过程及意义提供了很好的帮助。 【正文】 方法: 一。实验材料: 1。细胞系:高转移力小鼠腹水型肝癌细胞,由大连医科大学病理教研室建株并保存。 2.实验动物:近交系615小鼠,雌雄兼用,6—8周龄,体重18—22g,由大连医科大学实验动物中心提供。 3。 主要仪器及器皿:搪瓷盆、温度计、离心管、1ml注射器、手术刀、眼科手术剪、眼科手术镊、乳胶手套、生理盐水、1%来苏儿溶液、75%酒精棉、10% 甲醛固定液等。 二。研究方法 1。细胞系获取:从液氮罐中取出高转移力小鼠腹水型肝癌细胞塑料冻存管,立即放入40度的温水中,一分钟内使冻存液全部融化,拉力机送入无菌室中。取出细胞悬液放入离心管中,有生理盐水洗涤2次,离心,弃上清,在加1ml生理盐水吹打均匀。向小鼠腹腔内接种0。2mlHCa-F细胞悬液,于第6天无菌条件取腹水。 2。615小鼠脚垫接种肿瘤细胞:取615小鼠癌性腹水0。1ml,接种于615小鼠脚垫上。定期观察肿瘤生长及淋巴结肿大情况。四周后处死全部小鼠,取瘤体及相关淋巴结,同时观察肺、肝、肾等器官。将上述组织固定于10%甲醛固定液中,石蜡包埋制片,HE染色,显微镜检查。 3。组织取材:将皮下瘤体、淋巴结、肺、肝、肾选取病变部位,切成厚2—3mm的小于2cm×1cm大小的组织块,10%中性甲醛固定。小块组织一般固定数小时,较大标本需固定24—48小时。经冲洗(用递升浓度的酒精等)、透明(用二甲苯等)、浸蜡(用石蜡),然后用石蜡将组织包埋成蜡块,再经切片机切片和染色制成切片。一般常规作苏木精-伊红染色。 4。切片脱色:石蜡切片法、HE染色法。 (1) 脱水程序及时间:组织固定,冲洗,然后: 1)脱水。以下列顺序进行:60%酒精30分钟→80%酒精1—2小时→95%酒精2—4小时或过夜→95%酒精2—4小时→100%酒精2—4小时→100%酒精2—4小时或过夜; 2)透明:二甲苯I30—45分钟;二甲苯Ⅱ30—45分钟; 3)浸蜡。蜡碗Ⅰ、Ⅱ、Ⅲ(各30—45分钟);包埋; 4)修蜡块。修蜡块,贴号; 5)切片; 6)烘烤。烘烤切片60—70摄氏度,1小时; 7)染色。 (2) HE切片染色程序与方法: 1) 切片脱蜡水洗: 将烘干的切片浸入二甲苯Ⅰ、Ⅱ各10分钟。 无水酒精5分钟(消除二甲苯)→95%酒精2分钟→80%酒精2分钟→70%酒精2分钟→50%酒精2分钟→自来水冲洗5分钟(洗去切片上的酒精,切片透明)→蒸馏水清洗(防止污染苏木精染液)。 脱蜡是水华过程,目的是通过酒精的缓冲作用,易于水洗与染色。因为染剂是谁,从无水酒精直接放入染液中,容易引起激烈的扩散作用,造成切片漂浮脱落或损伤组织。而经各级浓度酒精缓冲后即可避免发生这种现象。 2) HE染色: 苏木精-伊红染色是先用苏木精将组织切片适当的果然,经水洗后再用盐酸酒精分化,弱碱性水溶液显蓝。使胞核呈明显的蓝色,胞质及背景无色。再经水洗后用伊红染胞质,染成深浅不同程度的粉红色至红色。 苏木染色(染核)15分钟→自来水冲洗3分钟→0。5%盐酸酒精溶液分化数秒钟→自来水洗2分钟→弱碱性水溶液显蓝30-60秒→自来水冲洗5分钟→伊红1分钟→蒸馏水洗1-2次。 3) 脱水、透明、封固: 脱水、透明的目的是使存留在切片上的水分及漂浮的染色液全部除净,经透明剂的作用后,将脱水剂清除出来,使切片产生适宜的折光率。最后用盖玻片及封固剂封固,便于观察和长期保存。 80%酒精10秒→95%酒精10秒→无水酒精Ⅰ3分钟→污水酒精Ⅱ3分钟→二甲苯Ⅰ5分钟→二甲苯Ⅱ5分钟→中性树胶封固。 结果: 时间 精神状态 是否触及肿块 有肿块只数 10月22日 良好 否 0 10月24日 良好 否 0 10月27日 良好 否 0 10月29日 良好 否 0 10月31日 良好 否 0 11月3日 良好 否 0 11月5日 良好 否 0 11月7日 良好 否 0 11月10日 良好 是 5 11月12日 良好 是 6 11月14日 良好 是 6 11月18日 良好 是 6
显微镜下观察淋巴结转移的分布: 1。皮下瘤体: 大体:皮下瘤体较大,呈灰白色,质硬,与皮下组织粘附紧密,界限不清 LM:瘤细胞分布不规律(组织结构异型性),瘤细胞体积较大,形态不一,核较大,胞质蓝染,呈嗜碱性(细胞异型性)
2。同侧腋下淋巴结: 大体:比正常淋巴结大,呈卵圆形,质硬,切面灰白色 LM:在淋巴结边缘窦处可看到某些细胞分布不规律,细胞体积较大,形态不一,核较大,胞质蓝染,与在皮下瘤体的切片中看到的瘤细胞形态相似,表明此淋巴结中的肿瘤组织是原发在皮下的肿瘤经淋巴道转移的结果
3。肝 肺 肾 大体:未见异常 LM:未见到组织结构和细胞异型性,表明此肿瘤未经血道转移 讨论: 615近系小鼠是我国医学科学院血液学研究所1961年5月用本所饲养的昆明种白化雌性小鼠和由前苏联引进的C57BL血研黑色雄性近交系小鼠杂交而得到第一代后,用杂交第一代严格按照同胞兄妹交配的原则连续繁殖20代以上得到的一系棕色小鼠。由于615小鼠淋巴系统比较发达且有许多近交系,部分近交系有特定的自发性肿瘤,可利用其自发肿瘤与人体肿瘤的相似之处作为动物模型进行肿瘤发生、发展和治疗的研究。和国外的近交系小鼠相比,较易饲养繁殖,性情温顺,也适于实验肿瘤学,肿瘤病毒学的研究[7][8]。 近交系动物主要有如下的特点: ①基因纯合性,即基因型一致,遗传特性相同。从理论上说,不会因为隐性基因的暴露而影响实验结果的一致性。 ②遗传物质同源性。同一品系内的个体间的皮肤或肿瘤移植不会被当作异己来排斥,各个体间的基因位点,及位点的分型是完全一致的。 ③表现型的一致性,近交系动物任何可遗传的体征都应是一致的,如生理、生化以及组织学、形态学上的特征(毛色、体重等),甚至行为的类型都趋于一致。这一特点保证了动物实验数据在统计学上的意义。 由于近郊动物有以上优点,排除了一些对实验结果的不必要干扰。它具有良好的、适合实验要求的遗传特性,被用于众多的实验领域如胚胎学、生理学、遗传学研究等[9]。 人体内对抗癌细胞的功能主要由免疫系统承担。免疫系统被肿瘤细胞阻塞,淋巴液就会向相反的方向流动,导致不符合常规的转移现象。恶性肿瘤细胞转移的可能机制有:1、淋巴道转移 2、血道转移 3、种植性转移。本实验中重点研究淋巴道转移。恶性肿瘤侵入淋巴管后,首先到达局部淋巴结,局部淋巴结发生转移后,可继续转移至下一站的其他淋巴结,最后,可经胸导管入血再继发血道转移。 移植性小鼠肿瘤模型是人为因素制作的一种实验肿瘤类型,已被广泛应用与各种肿瘤的研究。小鼠腹水型肝癌(H22)瘤株可在多种品系小鼠身上移植生长,并发生淋巴道转移,具有瘤细胞易于计数,移植瘤生长良好,淋巴结转移高,肺转移率低等特点[6]。Hca-F是从小鼠腹水型肝癌细胞株H22中筛选出的特异性向淋巴道转移的细胞,Hca-F为高转移细胞株,淋巴结转移率高于80%。 转移率稍微偏低的原因分析如下:①瘤细胞接种时,可能因为操作不熟练,0。1ml(2×10^6个)未能全部注入皮下,造成瘤细胞数量过少。②实验动物数量过少,动物意外死亡等其他原因可造成转移率偏低。 淋巴道转移常有一定的规律,通常先是在局部呈膨胀性生长,并逐渐侵犯肌层、血管、神经,然后侵犯临近正常淋巴结,进行转移。淋巴道转移到晚期常合并血道转移。但实验时间如果短了,血道转移常不发生,这与本实验结果未见肺肝肾转移一致。 H22瘤细胞接种于皮下呈结节状增长。如H22一F20瘤细胞可在615系小鼠的脚掌、腋下等多个部位移植生长,并形成不同程度的转移,且主要沿淋巴系统转移,其中脚掌组转移的范围最广泛,数目也较多[10]。现很多肝癌淋巴道转移实验都采用脚垫接种。但浓度等均无统一标准, 缺乏特异的肿瘤淋巴道转移模型。作为恶性上皮肿瘤早期转移的主要形式,淋巴道转移机制的解析对临床肿瘤