(完整word版)高中化学离子浓度大小比较练习题(附答案).doc
- 格式:doc
- 大小:940.02 KB
- 文档页数:16


高中化学离子浓度大小比较练习题
一、单选题
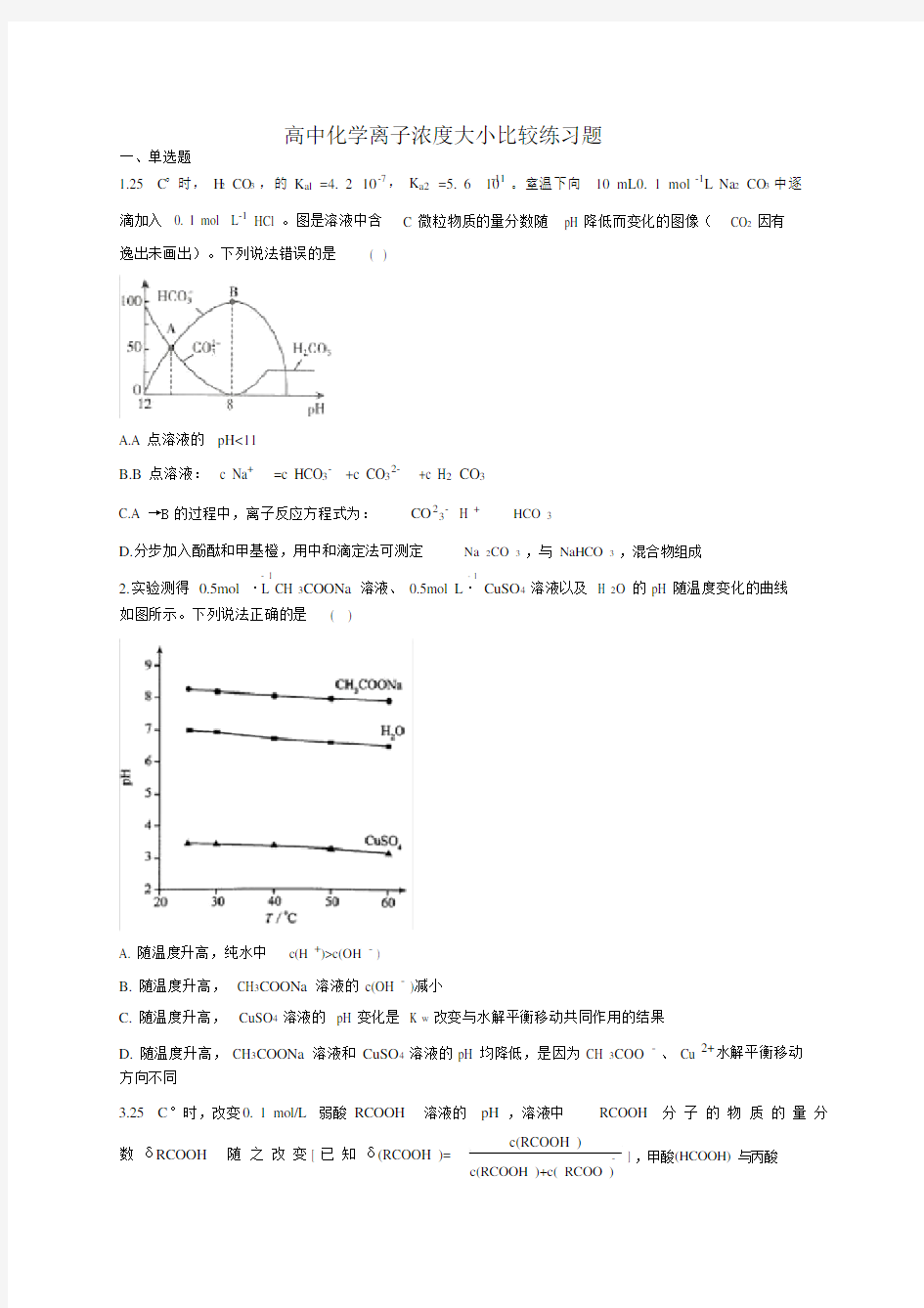
1.25 C°时, H2 CO3,的 K al =4. 2 10-7 , K a2 =5. 6 10-11。室温下向 10 mL0. 1 mol L-1 Na 2 CO3中逐
滴加入 0. 1 mol L-1 HCl 。图是溶液中含 C 微粒物质的量分数随 pH 降低而变化的图像( CO2因有
逸出未画出)。下列说法错误的是( )
A.A 点溶液的pH<11
B.B点溶液: c Na+ =c HCO3- +c CO32- +c H2 CO3
C.A →B的过程中,离子反应方程式为:CO23-H +HCO 3
D.分步加入酚酞和甲基橙,用中和滴定法可测定Na 2CO 3,与 NaHCO 3,混合物组成
- 1- 1
2.实验测得0.5mol ·L CH 3COONa 溶液、 0.5mol L· CuSO4溶液以及 H 2O 的 pH 随温度变化的曲线
如图所示。下列说法正确的是( )
A. 随温度升高,纯水中c(H +)>c(OH - )
B.随温度升高, CH3COONa 溶液的 c(OH - )减小
C.随温度升高, CuSO4溶液的 pH 变化是 K w改变与水解平衡移动共同作用的结果
D.随温度升高, CH3COONa 溶液和 CuSO4溶液的 pH 均降低,是因为 CH 3COO -、 Cu 2+水解平衡移动
方向不同
3.25 C°时,改变0. 1 mol/L弱酸RCOOH溶液的pH,溶液中RCOOH 分子的物质的量分
数δRCOOH 随之改变 [ 已知δ(RCOOH )=
c(RCOOH )
- ] ,甲酸(HCOOH) 与丙酸c(RCOOH )+c( RCOO )
(CH 3CH 2COOH ) 溶液中 δRCOOH 与 pH 的关系如图所示。下列说法正确的是
( )
A. 图中 M 、 N 两点对应溶液中的
c(OH - ) 比较:前者 >后者
B.丙酸的电离常数 K= 10
4.88
C.等浓度的 HCOONa 和 CH 3 CH 2 COONa 两种榕液的
pH 比较:前者 > 后者
D. 将 0. 1 mol/L 的 HCOOH 溶液与 0. 1 mol/L 的 HCOO-Na 溶 液 等 体 积 混 合 , 所 得 溶 液
中 :
c Na >c HCOOH >c HCOO - >c OH -
>c H +
4.常温下 ,Ksp(CaF 2)=4 × 10 -9
,K sp (CaSO 4 )=9.1×10 -6
。取一定量的 CaF
固体溶于水 ,溶液中离子浓度
2 的变化与时间的变化关系如图所示。下列有关说法正确
( )
A.M 点表示 CaF 2 的不饱和溶液
2
-
) = 10 -3
mol/L B.常温下 ,CaF 的饱和溶液中 ,c(F
C.温度不变, t 时刻改变的条件可能是向溶液中加了
KF 固体 , CaF 2 的 K sp 增大
D.常温下 ,向 100 mL CaF 2 的饱和溶液中加入 100 mL 0.2 mol/L Na 2 SO 4 溶液 ,平衡后溶液中的
c(Ca 2+)
约为 9. 1×10-5 mol/L
5.常温下将 NaOH 溶液滴加到己二酸( H 2 X )溶液中,混合溶液的
pH 与离子浓度变化的关系如图
所示。下列叙述错误的是(
)
A. K a2 H 2 X 的数量级为 10-6
c HX
的变化关系
B.曲线 N 表示 pH 与 lg
c H 2X
C.NaHX 溶液中c H>c OH
D.当混合溶液呈中性时, c Na >c HX >c X 2->c OH =c H
6.常温下,钠盐( Na2XO 3)溶液中微粒浓度的变化关系如图所示[pOH=-lg c ( OH -) ]。下列说法正确的是 ( )
c H 2 XO 3
与 pOH 的变化关系
A. 曲线 N 表示 1g c HXO3
B.常温下, K a2( H 2XO 3)=10 -10
C.当 pOH=2 时; NaHXO 3溶液中:c H 2 XO 3
=10 -8
2
c XO 3
D.向 Na2XO 3溶液中滴加稀盐酸至中性时,溶液中:c( Na+) =2c( HXO3 )+2c( XO32 )
7.常温下,向 20 mL 0. 1 mol ?L -1 氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法正确的是()
A. 常温下, 0.1 mol ? L-1氨水中 NH 3 ? H 2O 的电离常数 K 约为 1× 10-5
B.a、 b 之间的点一定满足: c( NH + )> c(Cl - )>c(OH - )>c(H + )
4
C.c 点溶液中c( NH +4 )= c(Cl - )
D.d 点代表两溶液恰好完全反应
8.根据下列各图曲线表征的信息。得出的结论正确的是( )
A. 图 1 表示常温下向体积为10 mL 0.1 mol ?L -1
NaOH 溶液中逐滴加入 0.1 mol ?L
-1 3
CH COOH 溶液后
溶液的 pH 变化曲线,则 b 点处有: c(CH 3COOH)+c(H +) c(OH -)
B.图 2 表示用水稀释 pH 相同的盐酸和 NH 4Cl 溶液时,溶液的pH 变化曲线,其中Ⅰ表示盐酸,Ⅱ表示 NH 4Cl 溶液,且溶液导电性:b>c>a
C.图 3 表示的是 Al 3+与 OH -反应时含铝微粒浓度变化曲线,图中 a 点溶液中大量存在Al 3+
D.由图
2 4 3
溶液中的 Cu
2+,可采用向溶液中加入适量Fe
2 3
4 得出若除去 Fe (SO ) O ,调节溶液的 pH 至
4 左右
9.下列说法正确的是()
A.ph=1 的 NaHSO 4溶液 : c H+<c SO24+c OH
B.室温下, Ph=3 的 CH 3COOH 溶液与 pH=11 的 NaOH 溶液等体积混合后,因生成的CH 3COONa 水解,所以由水电离出的 c H+>10-3 mol L-1
C.已知常温下K a CH 3COOH > K a HCN,则等体积等浓度的NaCN 和 CH 3COONa 溶液中,
CH3COONa 溶液所含的离子数比NaCN 溶液多
D.室温下, pH=11 和 pH=13 的 NaOH 溶液等体积混合后,则混合后的溶液中
c H +
10 11 10 13 -1
= 2 mol L
10.已知 H3 PO4是一种三元中强酸。25 °C 时,向某浓度 H 3 PO4溶液中逐滴加入NaOH 溶液,滴加