油脂中八种脂肪酸的分析测定
- 格式:pdf
- 大小:78.99 KB
- 文档页数:5
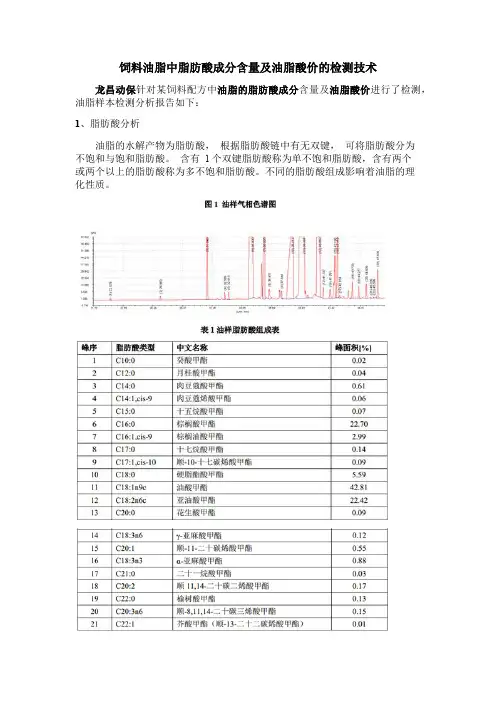
饲料油脂中脂肪酸成分含量及油脂酸价的检测技术
龙昌动保针对某饲料配方中油脂的脂肪酸成分含量及油脂酸价进行了检测,油脂样本检测分析报告如下:
1、脂肪酸分析
油脂的水解产物为脂肪酸,根据脂肪酸链中有无双键,可将脂肪酸分为
不饱和与饱和脂肪酸。
含有 1 个双键脂肪酸称为单不饱和脂肪酸,含有两个
或两个以上的脂肪酸称为多不饱和脂肪酸。
不同的脂肪酸组成影响着油脂的理
化性质。
数据分析:
根据该油样脂肪酸组成,混合油脂可能性较大。
饱和脂肪酸占比30%左右,不饱
和脂肪酸占比70%左右,棕榈酸与硬脂酸(含量越高,消化率越低)总占比29%左右,亚油酸与亚麻酸(动物必需脂肪酸合成前体,含量越高,对动物营养需求有利)总占
比23%左右。
2、油脂酸价评定
油脂中常含有一定数量的游离脂肪酸,其含量与储存时间、保管方法、去
杂程度等因素有关。
因此测定酸值可用于评价储藏方法是否得当及油脂品质的
好坏,同时能为油脂精炼工艺的制定提供参考。
油脂的酸价指中和1g 油脂中的游离脂肪酸所需氢氧化钾的毫克数,单位(mg KOH/g油)。
数据分析:在畜禽饲料中,一般认为,游离脂肪酸≤3.5%,油脂酸价
≤7,为一级油;游离脂肪酸≤10%,油脂酸价≤20,为二级油。
经测定,
该油样酸价为 1.13 mg KOH/g 油,说明油脂质量较好,新鲜度和精炼程度较高。
从上述油脂样本检测分析报告中,可以很详细的了解该饲料油脂的脂肪酸成分组成及含量,以及油脂的酸价进而可以评定饲料油脂的品质,为优化饲料配
方提供有利的技术支持。
(文章来源:山东龙昌动保官方网站)。

红外光谱法分析食用油脂肪酸组成根据油脂中不饱和脂肪酸=C-H在3009 cm~-1附近的特征吸收,使用傅里叶变换红外光谱仪对油脂中碳碳双键进行定量。
提出以石英比色皿作为样品容器,测定油脂碘价(IV)的傅里叶变换红外光谱法(FTIR)。
油脂四氯化碳溶液的FTIR谱图中,=C-H特征吸收峰的峰高A和样品浓度c 的比值A/c,与油脂IV间存在良好线性关系。
以亚麻籽油和椰子油按一定比例,配制不同碘价的标准样品,建立IV测定的标准曲线,相关系数为0.9995。
由该方法测定的36个油脂样品碘价的结果显示,本方法测定的油脂碘价(IV_IR)与国家标准方法(IV_GB)的结果一致,二者相关系数为0.9978,表明该方法可以用于食用油碘价的快速测定。
油酸、亚油酸和亚麻酸中=C-H的特征吸收位置分别为3006、3010和3012~cm-1。
根据这三种不饱和脂肪酸特征吸收位置的不同,利用顺式=C-H伸缩振动在3009 cm-1附近的吸收带预测不饱和脂肪酸含量。
根据吸光度加和原理,利用多元线性拟合技术,通过FTIR光谱数据与气相色谱法(GC)测定的不饱和脂肪酸含量,得到油酸、亚油酸和亚麻酸酰基的顺式=C-H谱带吸收曲线。
用FTIR光谱预测的44种油脂中的油酸、亚油酸和亚麻酸的含量与GC测定结果一致,表明FTIR光谱法可用于快速测定食用油中所有的烯烃键都是顺式构型的主要不饱和脂肪酸组成。
对不同反式脂肪酸含量的橄榄油、大豆油以及亚麻籽油,以硝基苯正己烷溶液做内标,采集在4000~400 cm~-1波段内的傅里叶红外光谱,并求得966 cm-1处负二阶导数。
油样中反式脂肪酸含量和反式脂肪酸中孤立的反式双键在966 cm~-1处的特征吸收符合朗伯比尔定律,建立红外吸收峰强度和气相色谱测定的反式脂肪酸中双键含量间的定量关系。
并利用此标准曲线测定油脂反式脂肪酸含量,结果显示,FTIR法测定结果与GC法偏差较大。
通过对油脂C=C双键的催化转化,制备了具有较高反式双键含量的橄榄油、大豆油和亚麻籽油。

出口植物油中游离脂肪酸的检验方法滴定法1.适用范围本方法适用于出口植物油中游离脂肪酸的测定。
2.原理概要将试样溶于规定的溶剂中,用氢氧化钾标准溶液滴定其中的游离脂肪酸。
3.主要试剂和仪器3.1.主要试剂乙醇-乙醚混合溶剂:按1+1(V+V)将95%乙醇和乙醚混和。
每100ml溶剂中,加入0.3ml 酚酞指示剂(若试样色泽过深,则改用0.3ml碱蓝6B指示剂,使用前用氢氧化钾标准溶液中和至中性;0.1M氢氧化钾标准溶液:称取5.8g氢氧化钾溶于1000ml新沸冷却蒸馏水中,摇匀。
按下法标定其摩尔浓度;称取在125℃烘至恒重的基准邻苯二甲酸氢钾0.8~0.9g,精确至0.0002g,置于250ml锥形瓶中,以50ml蒸馏水溶解。
加入2~3滴酚酞指示剂,用上述氢氧化钾溶液滴定至粉红色。
同时做空白试验;氢氧化钾标准溶液的摩尔浓度M按式(1)计算:M=G (1)(V-V0)×0.2042式中:G ——邻苯二甲酸氢钾的质量,g;V ——氢氧化钾溶液的用量,ml;V0 ——空白试验氢氧化钾溶液的用量,ml;0.2042 ——每毫摩尔邻苯二甲酸氢钾的质量,g。
0.5M氢氧化钾标准溶液:称取28g氢氧化钾溶于1000ml新沸冷却的蒸馏水中,摇匀。
参照0.1M氢氧化钾标准溶液进行标定;1%酚酞指示剂:1g酚酞溶于100ml 95%乙醇中;2%碱蓝6B指示剂:2g碱蓝6B溶于100ml 95%乙醇中。
3.2.仪器锥形瓶:250ml;滴定管:25ml;分析天平。
4.分析步骤4.1.试验样品按照ZB X 04007-86《出口植物油取样方法》取得平均样品,混匀后供检验用。
4.2.测定称取混匀的试样5~10g,精确至0.001g,置于250ml锥形瓶中;加入中和至中性的乙醇-乙醚混合溶剂100ml,摇动使其溶解,用0.1M氢氧化钾标准溶液滴定至指示剂变色。
酚酞由无色变为粉红色,碱蓝6B由蓝色变为红色,至少维持10s不退色。

资料范本本资料为word版本,可以直接编辑和打印,感谢您的下载食品中脂肪酸的测定地点:__________________时间:__________________说明:本资料适用于约定双方经过谈判,协商而共同承认,共同遵守的责任与义务,仅供参考,文档可直接下载或修改,不需要的部分可直接删除,使用时请详细阅读内容食品中脂肪酸的测定基础知识:油脂是食品的重要组分和营养成分。
油脂中脂肪酸组分的测定最常用的方法是气相色谱法。
样品前处理采用酯交换法(甲酯化法),图谱解析采用归一化法。
气相色谱(GC) 是一种把混合物分离成单个组分的实验技术它被用来对样品组分进行鉴定和定量测定。
一个气相色谱系统包括:• 可控而纯净的载气源能将样品带入GC系统• 进样口同时还作为液体样品的气化室• 色谱柱实现随时间的分离• 检测器当组分通过时检测器电信号的输出值改变从而对组分做出响应• 某种数据处理装置氢火焰离子化检测器(FID) :氢气和空气燃烧所生成的火焰产生很少的离子。
在氢火焰中,含碳有机物燃烧产生CHO+离子,该离子强度与含量成正比。
该检测器检出的是有机化合物,无机气体及氧化物在该检测器无响应。
当纯净的载气(没有待分离组分)流经检测器时产生稳定的电信号就是基线。
1——载气(氮气);2——氢气;3——压缩空气;4——减压阀(若采用气体发生器就可不用减压阀);5——气体净化器(若采用钢瓶高纯气体也可不用净化器);6——稳压阀及压力表;7——三通连接头;8——分流/不分流进样口柱前压调节阀及压力表;10——尾吹气调节阀;11——氢气调节阀;12——空气调节阀;13——流量计(有些仪器不安装流量计);14——分流/不分流进样口;15——分流器;16——隔垫吹扫气调节阀;17——隔垫吹扫放空口;18——分流流量控制阀;19——分流气放空口;20——毛细管柱;21——FID检测器;22——检测器放空出口;方法来源:GB 5009.168-2016 食品安全国家标准食品中脂肪酸的测定1、范围本方法规定了食品中脂肪酸含量的测定方法。

第3章油脂的检验油脂是精细化学品生产的常用原料,以植物油脂和动物油脂为主,其组成主要是高级脂肪酸的甘油酯,其次是人工合成的油脂,以及少数的矿物油,如凡土林等。
油脂由于来源、品种、加工条件、保管等情况不同,其质量优劣的差异较大。
油脂分析项目甚多,通常是根据其用途及评价的需要来选择分析项目。
例如化妆品用的油脂和蜡的熔点、色泽、气味等项目是必须测定的。
3.1 油脂物理性能的测定3.1.1 熔点的测定油脂的熔点是指油脂由固态转为液态时的温度。
纯净的油脂和脂肪酸有其固定的熔点,但天然油脂的纯度不高,熔点不够明显。
油脂的熔点与其组成和组分的分子结构密切相关。
一般组成脂肪酸的碳链愈长熔点愈高;不饱和程度愈大,熔点愈低。
双键位置不同熔点也有差异。
固体油脂及硬化油等样品,通常测定熔点目的是用以检验纯度或硬化度。
测定熔点的方法有毛细管法,广口小管法,膨胀法等。
一般常用毛细管法,具体测定方法见本书第2章2.2.1介绍。
3.1.2 凝固点的测定凝固点是油脂和脂肪酸的重要质量指标之一,在制皂工业中,对油脂的配方有重要指导作用。
测定凝固点的原理、仪器装置和测定方法见本书第2章2.2.2介绍。
3.1.3 相对密度的测定纯净油脂的相对密度与其脂肪酸的组成和结构有关,如油脂分子内氧的质量分数越大,其相对密度越大。
因此,随着油脂分子中低分子脂肪酸、不饱和脂肪酸和羟基酸含量的增加,其相对密度增大。
油脂的相对密度范围一般在0.87~0.97之间。
相对密度的测定方法有密度瓶法和密度计法等,具体的测定步骤见本书第2章2.1介绍。
3.1.4 色泽的测定油脂愈纯其颜色和气味愈淡,纯净的油脂应是无色无味无臭的。
通常,油脂受提炼、贮存的条件和方法等因素的影响,具有不同程度的色泽。
一般商品油脂都带有色泽,例如:羊油、牛油、硬化油、猪油、椰子油等为白色至灰白色;豆油、花生油和精炼的棉子油等为淡黄色至棕黄色;蓖麻油为黄绿色至暗绿色;骨油为棕红色至棕褐色等。

食品安全国家标准食品中脂肪酸的测定1范围本标准规定了食品中脂肪酸含量的测定方法。
本标准适用于食品中脂肪酸含量的测定。
本标准适用于食品中总脂肪、饱和脂肪(酸)、不饱和脂肪(酸)含量的测定。
第一法内标法2原理加入内标物的样品经水解-乙醚溶液提取其中的脂肪后,在碱性条件下皂化和甲酯化,生成脂肪酸甲酯,经毛细管气相色谱分析,内标法定量测定脂肪酸甲酯含量。
依据各种脂肪酸甲酯含量和转换系数计算出总脂肪、饱和脂肪(酸)、单不饱和脂肪(酸)、多不饱和脂肪(酸)含量。
3试剂和材料注:除非另有规定,本方法所用试剂均为分析纯,水为GB/T 6682规定的一级水。
3.1试剂3.1.1盐酸(HCl)。
3.1.2氨水(NH3·H2O)。
3.1.3焦性没食子酸(C6H6O3)。
3.1.4乙醚(C4H10O)。
3.1.5石油醚:沸程30℃~60℃。
3.1.6乙醇(C2H6O) (95%)。
3.1.7甲醇(CH3OH):色谱纯。
3.1.8氢氧化钠(NaOH)。
3.1.9正庚烷[CH3(CH2)5CH3]:色谱纯。
3.1.10三氟化硼甲醇溶液,浓度为15%。
3.1.11无水硫酸钠(Na2SO4)。
3.1.12氯化钠(NaCl)。
3.2试剂配制3.2.1盐酸溶液(8.3 mol/L):量取250 mL盐酸,用110 mL水稀释,混匀,室温下可放置2个月。
3.2.2乙醚石油醚混合液(体积比1:1):取等体积的乙醚和石油醚,混匀备用。
3.2.3氢氧化钠甲醇溶液(2%):取2 g氢氧化钠溶解在100 mL甲醇中,混匀。
3.2.4饱和氯化钠溶液:称取360 g氯化钠溶解于1.0L水中,搅拌溶解,澄清备用。
3.3标准品3.3.1十一碳酸甘油三酯。
3.3.2混合脂肪酸甲酯标准溶液(37种)。
3.3.3单个脂肪酸甲酯标准:丁酸甲酯C4:0(C5H10O2)CAS NO. 623-42-7;己酸甲酯C6:0(C7H14O2)CAS NO.106-70-7;辛酸甲酯C8:0(C9H18O2)CAS NO.111-11-5;癸酸甲酯C10:0(C11H22O2)CAS NO.110-42-9;十一烷酸甲酯C11:0(C12H24O2)CAS NO.1731-86-8;月桂酸甲酯C12:0(C13H26O2)CAS NO.111-82-0;十三烷酸甲酯C13:0(C14H28O2)CAS NO.1731-88-0;肉豆蔻酸甲酯C14:0(C15H30O2)CAS NO.124-10-7;肉豆蔻脑酸甲酯C14:1(C15H28O2)CAS NO.56219-06-8;十五烷酸甲酯C15:0(C16H32O2)CAS NO.7132-64-1;顺-10-十五碳烯酸甲酯C15:1(C16H30O2)CAS NO.90176-52-6;棕榈酸甲酯C16:0(C17H34O2)CAS NO.112-39-0;棕榈油酸甲酯C16:1(C17H32O2)CAS NO.1120-25-8;十七烷酸甲酯C17:0(C18H36O2)CAS NO.1731-92-6;顺-10-十七碳烯酸甲酯C17:1(C18H34O2)CAS NO.75190-82-8;硬脂酸甲酯C18:0(C19H38O2)CAS NO.112-61-8;反油酸甲酯C18:1n9t(C19H36O2) CAS NO.1937-62-8;油酸甲酯C18:1(C19H36O2)CAS NO.112-62-9;反亚油酸甲酯C18:2n6t(C19H34O2)CAS NO.2566-97-4;亚油酸甲酯C18:2n6c(C19H34O2)CAS NO.112-63-0;γ亚麻酸甲酯C18:3n6(C19H32O2)CAS NO.16326-32-2;花生酸甲酯C20:0(C21H42O2)CAS NO.1120-28-1;顺-11-二十碳烯酸甲酯C20:1(C20H38O2)CAS NO.2390-09-2;亚麻酸甲酯C18:3n3(C19H32O2)CAS NO.301-00-8;山嵛酸甲酯C22:0(C23H46O2)CAS NO.929-77-1;二十一烷酸甲酯C21:0(C22H44O2) CAS NO.6064-90-0;顺-11,14-二十碳二烯酸甲酯C20:2(C21H38O2) CAS NO.2463-02-7;顺-8,11,14-二十碳三烯酸甲酯C20:3n6( C21H36O2) CAS NO.21061-10-9;顺芥子酸甲酯C22:1n9(C23H44O2) CAS NO.1120-34-9;顺-11,14,17-二十碳三烯酸甲酯C20:3n3(C21H36O2) CAS NO.55682-88-7;花生四烯酸甲酯C20:4n6(C21H34O2) CAS NO.2566-89-4;二十三碳酸甲酯C23:0(C24H48O2) CAS NO.2433-97-8;顺-13,16-二十二碳二烯酸甲酯C22:2(C23H42O2) CAS NO.61012-47-3;木蜡酸甲酯C24:0(C25H50O2) CAS NO.2442-49-1;顺-5,8,11,14,17-二十碳五烯酸甲酯C20:5(C21H32O2) CAS NO.2734-47-6;神经酸甲酯C24:1(C25H48O2) CAS NO.2733-88-2;顺-4,7,10,13,16,19-二十二碳六烯酸甲酯C22:6(C23H34O2)CAS NO. 2566-90-7。

食用油的反式脂肪酸含量分析方法食用油中的脂肪酸是人体所需的重要营养物质,但某些油脂加工过程中会产生一种被称为"反式脂肪酸"的物质,其摄入过多可能对健康产生负面影响。
因此,准确测定食用油中的反式脂肪酸含量至关重要。
本文将介绍两种主要的分析方法——气相色谱法和高效液相色谱法,旨在为食用油生产与质量监测提供指导。
一、气相色谱法分析食用油中反式脂肪酸含量1. 样品准备首先,取食用油样品,通过加热至适当温度使样品液化。
然后使用无水醇(如甲醇或乙醇)将非脂类物质从样品中提取出来。
待提取完成后,将样品转移至小瓶中,用氮气吹干。
2. 反式脂肪酸甲酯化将样品中的脂肪酸转化为甲酯形式,以方便后续的气相色谱分析。
这一步骤通常采用甲醇和硫酸催化进行。
3. 气相色谱分析将甲酯化样品注入气相色谱仪,通过设定合适的温度梯度和流速条件,将样品中的反式脂肪酸分离出来。
根据分离出的峰面积和已知标准样品建立标准曲线,以确定样品中反式脂肪酸的含量。
二、高效液相色谱法分析食用油中反式脂肪酸含量1. 样品准备将食用油样品中的纯油脂取出,通过加热使其溶解。
然后,用乙腈等有机溶剂提取样品中的非脂类物质,待提取完成后,经氮气冲洗,使残留的溶剂蒸发。
2. 脂肪酸乙酯化将样品中的脂肪酸转化为乙酯形式,以方便后续的高效液相色谱分析。
这一步骤通常采用甲醇和硫酸催化进行。
3. 高效液相色谱分析将乙酯化样品注入高效液相色谱仪,通过控制流速、检测波长和列温等参数,将反式脂肪酸定量分离和测定。
同样利用标准曲线来计算样品中反式脂肪酸的含量。
三、结论通过气相色谱法和高效液相色谱法可以准确测定食用油样品中的反式脂肪酸含量。
两种分析方法均需要样品的预处理和适当的仪器设备,对于食用油生产厂商和院校实验室而言,能够选择合适的方法进行分析,以提高产品质量,确保人们的健康。
反式脂肪酸含量的准确测定对于开发和改进食用油生产工艺、质量监测以及相关法规的实施具有重要意义。

油脂和脂肪酸的分析油脂分析的方法有很多种,常用的有传统的化学分析方法和现代的仪器分析方法。
化学分析方法主要是通过溶剂抽提、脂肪酸甲酯化等步骤来提取和转化脂肪酸,并使用气相色谱、高效液相色谱等技术来分离和检测各个脂肪酸的含量和种类。
而现代的仪器分析方法,如核磁共振、质谱等,可以更加精确地定量和鉴定油脂中的脂肪酸。
脂肪酸是由长链碳原子和羧基组成的酸,它可以分为饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸。
饱和脂肪酸指的是碳链上没有双键的脂肪酸,主要存在于动物脂肪和一些植物油中;单不饱和脂肪酸指的是碳链上只有一个双键的脂肪酸,如橄榄油中含有大量的单不饱和脂肪酸;多不饱和脂肪酸指的是碳链上存在多个双键的脂肪酸,如鱼油中富含的ω-3脂肪酸。
脂肪酸的分析首先需要将油脂样品转化为脂肪酸甲酯。
这一步骤通常使用甲醇和碱催化剂,将脂肪酸与甲醇反应生成相应的脂肪酸甲酯。
然后,可以通过气相色谱(GC)和高效液相色谱(HPLC)来分离和定量脂肪酸甲酯。
GC是一种常见且广泛应用的分析技术,它使用高温下的气相载气将脂肪酸甲酯分离,并通过检测器来定量不同脂肪酸甲酯的浓度。
而HPLC则是一种基于液相的分析技术,它使用高效液相色谱柱和流动相将脂肪酸甲酯分离,并通过紫外光谱检测器来定量不同脂肪酸甲酯的浓度。
另外,现代的仪器分析方法也在脂肪酸分析中得到了广泛应用。
例如,核磁共振(NMR)可以通过测量样品中的氢核或碳核来确定不同脂肪酸的含量和分布。
质谱则可以通过测量脂肪酸分子的质荷比来鉴定和定量不同脂肪酸的种类和含量。
总之,油脂和脂肪酸的分析是食品科学与营养学中非常重要的研究内容。
通过对油脂中脂肪酸的分析,可以了解其组成和营养价值,帮助我们合理地选择和利用食物资源,并为食品工业的产品开发和改良提供科学依据。

黄油食品中脂肪酸组成的测定与分析黄油是一种常见的食品,它不仅被广泛应用于烹饪和烘焙中,还被用于改善食品的质地和口感。
然而,对于黄油中脂肪酸的组成和含量的测定与分析对于了解其营养价值和对健康的影响非常重要。
脂肪酸是脂肪的主要组成成分,它们由碳、氢和氧组成,可分为饱和脂肪酸和不饱和脂肪酸两类。
饱和脂肪酸主要存在于动物性脂肪中,而不饱和脂肪酸则多存在于植物油中。
黄油中的脂肪酸组成通常是复杂多样的,其主要成分包括饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸。
测定黄油中脂肪酸组成的一种常用方法是气相色谱法。
该方法利用气相色谱仪对样品中的脂肪酸进行分离和定性分析。
首先,将黄油样品中的脂肪酸通过酯化反应转化为甲酯化脂肪酸,然后将甲酯化脂肪酸溶于有机溶剂中,注入气相色谱仪进行分析。
通过比对样品中的脂肪酸峰与标准品峰的保留时间和相对峰面积,可以确定黄油中各种脂肪酸的含量和组成。
在测定和分析黄油中脂肪酸组成时,我们可以发现其中存在着一定的差异。
首先,不同品牌的黄油可能来源于不同的动物或植物,因此其脂肪酸组成会有所不同。
其次,黄油的生产工艺和原料处理方法也会对脂肪酸组成产生影响。
例如,黄油的搅拌、搅打和加热过程可能会改变其中脂肪酸的含量和构成。
进一步分析黄油中脂肪酸组成的意义在于了解其对健康的影响。
饱和脂肪酸被认为与心血管疾病的发生有一定关系,因此对于高饱和脂肪酸含量的黄油,人们可能需要控制其摄入量。
相反,不饱和脂肪酸对心血管健康有益,因此黄油中富含不饱和脂肪酸的品牌对于选择者而言可能更为理想。
此外,黄油中脂肪酸的分析也有助于了解该食品的适宜用途。
在烹饪和烘焙中,黄油的脂肪酸组成直接影响其性质和特点。
高含量的饱和脂肪酸使黄油在高温下稳定,适合用于煎炸和烤制;而高含量的不饱和脂肪酸则使黄油更易软化和熔化,在面点和糕点制作中具有良好的可塑性。
综上所述,黄油食品中脂肪酸组成的测定与分析对于了解其营养价值和对健康的影响至关重要。

油脂酸值的测定酸值(A.V)是评定油脂中所含游离脂肪酸多少的量度。
其定义为: 中和1g油脂中游离脂肪酸所需氢氧化钾的质量(mg),酸值的单位是mg KOH/g。
油脂酸值得大小瘦很多条件的影响,如原料的质量好坏(成熟的或未霉变的,其酸值较小);原料的组成特性(米糠及棕榈果等中含义解酯酶,其分解油脂产生的游离脂肪酸);油脂在储存、加工、运输期间的含水分、杂质的多少;与温度、空气、光照等因素也有关系。
酸值不能直接表示油脂中游离脂肪酸的百分率(,但能表示油脂中游离脂肪酸含量的高低,所以酸值是评定油脂品质好次、油脂精炼程度的重要指标。
同时,也是油脂工厂碱炼脱酸时计算加碱量的理论依据。
目前,对于不同级别的食用油脂,其酸值都有不同的标准规定(见附录I)。
油脂酸值的表示,国外大多以游离脂肪酸的质量分数表示,我国一直延用1g油脂消耗氢氧化钾的质量(mg)表示。
酸值的测定常用酸、碱中和滴定法。
对于酸值高、颜色深、不易中和滴定的油脂,也可应用pH 计法测定。
(1)测定原理用中性乙醚—乙醇的混合溶剂溶解油脂试样后,再用氢氧化钾标准溶液滴定油脂中的游离脂肪酸,根据消耗氢氧化钾标准溶液的物质的量和油脂的质量,计算出算酸值的大小。
反应过程为RCOOH+KOH RCOOK+2O(2)仪器分析天平(精度O.OOOIg)、250mL锥形瓶、碱式滴定管(10mL,最小刻度0.05mL)。
(3)试剂本方法所列试剂均为分析纯,水位蒸馏水。
①中性乙醚一95%乙醇溶剂:乙醚一95%乙醇(2+1)混合;临用前每10mL混合溶剂中加入0.3mL酚酞指示剂,用氢氧化钾标准溶液准确中和。
②0.05mol/L氢氧化钾标准溶液。
③10g/L酚酞指示剂溶液:用95%(体积)乙醇配制。
(4)操作方法①试样的准备:对于液态样品,充分混匀备用;对于固态样品,缓慢升温使其熔化成液态,充分混匀备用。
②称取试样:准确称取试样 3.00-5.00g于250mL锥形瓶中。

11种食用植物油中脂肪酸组成的GC-MS分析江燕;黎贵卿;张思敏【摘要】为了给人们的合理用油提供有益的指导,本文以花生油、玉米油、大豆油、茶油等11种常见食用植物油为研究对象,运用GC-MS对其脂肪酸组成进行分析,并对各脂肪酸含量进行了对比研究.结果显示:11种植物油除棕榈油外不饱和脂肪酸总含量为80.31%~90.15%,均超过80%;棕榈酸的含量最高为棕榈油(46.54%),但其他的普遍不高(5.12%~12.32%);亚油酸含量较高的有玉米油、大豆油、菜籽油、葵花油、葡萄籽油、核桃油,达到55.64%~60.33%.其中,葵花油和核桃油最高,分别为60.08%、60.33%;油酸含量差异较大,为20.88%~83.12%,其中茶油和橄榄油较为突出,分别为80.86%、83.12%;硬脂酸的含量普遍不高,位于1.65%~6.22%之间;亚麻酸含量较高的为菜籽油、葡萄籽油和核桃油,分别为5.72%、4.42%、3.56%,棕榈油和橄榄油未检出亚麻酸;花生酸含量较高的为花生油和菜籽油,分别为3.10%、3.56%,葡萄籽油、棕榈油、核桃油、茶油未检出花生酸.【期刊名称】《广西林业科学》【年(卷),期】2018(047)004【总页数】3页(P487-489)【关键词】食用植物油;脂肪酸;组成【作者】江燕;黎贵卿;张思敏【作者单位】广西壮族自治区分析测试研究中心,南宁 530022;广西壮族自治区林业科学研究院,南宁 530002;广西壮族自治区分析测试研究中心,南宁 530022【正文语种】中文【中图分类】TS222.1油脂作为人体三大营养成分之一,起到提供人体所需能量,溶解脂溶性维生素(VA,VD,VE,VK),促进其在体内的输送,消化和吸收,同时其作为人体必需脂肪酸的主要来源也发挥着重要的作用[1-2],是人们食物的重要组成部分,是维持生命活动和生长发育不可或缺的物质。
油脂又是食品、医药、化妆和保健等行业的重要原料。
气相色谱法测定食物中脂肪酸含量1.原理气相色谱法是利用色谱柱中装入担体及固定液,用载气把欲分析的混合物带入色谱柱,在一定的温度与压力条件下,各气体组分在载气和固定液薄膜的气液两相相中的分配系数不同,随着载气的向前流动,样品各组分在气,液两相中反复进行分配,使脂肪酸各组分的移动速度有快有慢,从而可将各组分分离开。
然后进行分别测定。
2.适用范围此法适用于食物中脂肪酸的分析。
3.仪器气相色谱仪氢火焰离子化检测器氮气、氢气、压缩空气微处理机色谱柱2m×4mm或3m×4mm填充80--100目ChromosorbW,涂以8%或10%(W/W)二乙二醇琥珀酸酯(DEGS)气相色谱条件柱温:210℃进样器温度:280℃检测器温度:280℃氮气流速:40ml/cm24.试剂所有试剂,如未注明规格,均指优级纯,所有实验用水,均为蒸馏水。
(1)石油醚(沸程30~60℃)分析纯(2)苯(3)无水甲醇(4)0.4mol/L氢氧化钾--甲醇溶液:称2.24g氢氧化钾溶于少许甲醇中,然后用甲醇稀释到10ml。
(5)脂肪酸标准(SIGMA)(6)脂肪酸混合标准CHAIN%BYWT6:01.08:05.010:04.012:027.014:010.016:010.018:02.018:115.018:225.018:31.05.操作步骤称取30--100mg(约2-6滴)油脂,置入10ml量瓶内,加入1-2ml30~60℃沸程石油醚和苯的混合溶剂(1:1),轻轻摇动使油脂溶解。
加入1-2ml0.4mol/L氢氧化钾-甲醇溶液,混匀。
在室温静置5~10分钟后,加蒸馏水使全部石油醚苯甲酯溶液升至瓶颈上部,放置待澄清。
如上清液浑浊而又急待分析时,可滴入数滴无水乙醇,1-2分钟内即可澄清。
吸取上清液,在室温下吹入氮使浓缩,所得到浓缩液即可用于气层分析。
6.结果计算在有微处理机的情况下,用归一化计算法则可自动打印出峰面积和各种脂肪酸占总脂肪酸的百分比。
油脂sn-2位脂肪酸的测定
一、原理
猪油中甘油三酯中的脂肪酸主要是棕榈酸和油酸,其中油酸主要分布于sn-1,3位上,而棕榈酸分布于sn-2位上。
利用sn-1,3位专一性脂肪酶对甘油三酯sn-1,3位上的脂肪酸进行水解,形成sn-2位甘油单酯和游离脂肪酸;之后,通过甘油三酯中脂肪酸总含量和sn-1,3位上脂肪酸含量之间的差值计算出sn-2位上的脂肪酸含量。
二、步骤
1、将猪油置于63℃恒温水浴锅中直至溶解成液态,取6滴猪油放入10mL试管中,依次加入0.02g自制sn-2位专用酶、tris-HCl缓冲试剂2mL、胆酸钠0.6mL以及氯化钙0.4mL,然后轻微振荡混匀。
2、将试管放入45℃水浴锅中使油脂水解1min,期间不断振荡。
从水浴锅中拿出后继续振荡2min,再加入1mL盐酸灭酶,最后加入2mL无水乙醚萃取,强力振荡后混匀离心(1000r/min,2min)。
用点样针取上清液在薄层板上点样,使其在薄层板上展开。
3、在薄层板上展开50min后,用显色剂使其显色,在紫外灯下照射观察薄层板展开情况。
将sn-2位脂肪酸刮下,测其含量。
三、结果与讨论
图1 紫外灯下照射的薄层板
图中谱带从下往上依次为点样线、甘一酯、甘二酯、脂肪酸和甘三酯。
由于点样线太
粗(主要原因)和展开温度太低,导致sn-1,3甘二酯、sn-1,2甘二酯的谱带并未分开。
图2 sn-2位的脂肪酸分析
注:黑体字为脂肪酸名称,绿体字为保留时间。
表1 sn-2位各种脂肪酸含量
名称14:0 16:0 16:1 18:0 18:1 18:2 含量 4.13 57.20 4.39 7.30 21.89 5.09。
粗脂肪1原理索氏脂肪提取器中乙醚提取试样,称试样的减重,提取物中除脂肪外还有有机酸、磷脂、脂溶性维生素、叶绿素等,因而测定结果称粗脂肪或乙醚提取物。
2 测定方法 2.1 仪器和试剂2.1.1 索氏脂肪提取器; 2.1.2 恒温烘箱;2.1.3 电热恒温水浴锅; 2.1.4 无水乙醚。
2.2 操作步骤准确称取试样1.0~2.0g ,用滤纸包好,放入105℃烘箱中烘干2h ,干燥器中冷却30min ,称重,滤纸包长度应以全部浸泡于乙醚中为准。
将滤纸包放入抽提管,在抽提瓶中加无水乙醚60~100ml ,在60~75℃水浴上加热,使乙醚回流,控制乙醚回流次数为每小时约10次,共回流约50次(含油高的试样约70次)或检查抽提管流出的乙醚挥发后不留下油迹为抽提终点。
取出试样,放入105℃烘箱中烘干2h ,干燥器中冷却30min ,称重。
用原抽提器回收乙醚直至抽提瓶几乎全部收完。
2.3 结果计算粗脂肪含量按下式计算: ×100%式中: m 1——提取前试样与滤纸包之总质量,g ;m 2——提取后试样与滤纸包之总质量,g ; m ——试样之质量,g ;粗脂肪含量在10%以上(含10%)允许相对偏差为5%。
粗脂肪含量在10%以下时,允许相对偏差为3%。
m 1− m 2m粗脂肪 =过氧化值的测定1 原理(碘量法)油脂氧化过程中产生过氧化物,在酸性条件下与碘化钾作用,生成游离碘,以硫代硫酸钠溶液滴定,计算含量。
CH 3COOH (冰醋酸)+KI → CH 3COOK +HIROOH +2HI → ROH +H 2O +I 2 I 2+2Na 2S 2O 3 → 2 NaI +2Na 2S 4O 6 相当于: ROOH +2KI -→ ROH +K 2O +I 2其大小反映了油脂的酸败程度(变值),即新鲜度。
由于ROOH 为油脂自动氧化的主要初始产物。
油脂氧化初期,POV 值随氧化程度加深而增高,而当油脂深度氧化时,ROOH 的分解速度超过其生成速度,导致POV 值下降。
GC-MS测定几种常用食用油中饱和脂肪酸和不饱和脂肪酸摘要建立气相色谱—质谱法测定食用植物油中饱和脂肪酸和不饱和脂肪酸的分析方法。
此方法测定了5常见食用植物油(①金龙鱼第二代食用调和油;②金龙鱼深海鱼油调和油;③鲤鱼牌压榨纯香菜籽油;③金龙鱼玉米油;⑤芝麻香油)中饱和脂肪酸和不饱和脂肪酸成分及其含量。
对植物油中的饱和脂肪酸和不饱和脂肪的测定,具有极其重要的意义和价值。
本实验中只测定出了少量的脂肪酸,还有一些有毒有害物质。
关键词食用植物油; 饱和脂肪酸; 气相色谱—质谱法不饱和脂肪酸食用油是食物的重要组成部分, 但目前对食用油中脂肪酸的成分了解较少。
食用油中最主要的成分是脂肪酸, 根据其结构特点可以分为饱和脂肪酸和不饱和脂肪酸两大类。
肪酸的组成及其配比在很大程度上决定了它的营养价值和保健功效,但由于人体无法合成不饱和脂肪酸, 只能从食物中摄取, 因此不饱和脂肪酸被称作“必需脂肪酸”。
亚油酸作为人体必需脂肪酸, 具有降低人体内血清中胆固醇含量,降血压作用,同时还可以防止动脉硬化症状。
DHA是组成磷脂、胆固醇酯的重要脂肪酸。
DHA勺体内来源是a -亚麻酸。
a -亚麻酸进入人体后,在同一种去饱和酶的作用下,在人体中衍生为DHA a -亚麻酸和DHA均属于Omega- 3脂肪酸。
许多科学家研究证明:Omega-3 有益于预防和治疗冠心病、糖尿病、类风湿、皮炎、癌症、抑郁症、神经分裂症、痴呆、过敏、哮喘、肾病和慢性阻塞性肺病等。
近年来,对不饱和脂肪酸的研究越来越多, 不饱和脂肪酸的作用受到了广泛关注。
本实验采用气相色谱-质谱联用法对①金龙鱼第二代食用调和油;②金龙鱼深海鱼油调和油;③鲤鱼牌压榨纯香菜籽油;③金龙鱼玉米油;⑤芝麻香油这 5 种食用油中的饱和脂肪酸和不饱和脂肪酸组成成分及含量进行定性的测定及分析。
1. 实验部分1.1 仪器、试剂与材料仪器:安捷伦7890A - 5975C型气相色谱-质谱联用仪(美国安捷伦科技公司),色谱柱为HP- 5MS (30 m x0. 25 mm x0. 25卩m)弹性石英毛细管柱,0.45卩m微孔过滤膜,试剂:正己烷(分析级),乙醚(分析级),石油醚60-90(分析级),无水硫酸钠(分析级),0.45卩m微孔过滤膜,食用油,索氏提取仪,恒温水浴锅,材料:食用油(共5种,分别为①金龙鱼第二代食用调和油;②金龙鱼深海鱼油调和油;③鲤鱼牌压榨纯香菜籽油;③金龙鱼玉米油;⑤芝麻香油),氦气(纯度99.999%),氮气(纯度99.999%)。
常用动、植物食用油中脂肪酸组成的分析一、本文概述油脂是人类膳食中不可或缺的重要营养素之一,它提供了人体所需的能量和必需脂肪酸。
动、植物食用油作为油脂的主要来源,其脂肪酸组成直接影响着油脂的营养价值和健康效应。
对常用动、植物食用油中脂肪酸组成的分析具有重要的现实意义。
本文旨在全面研究和分析常用动、植物食用油中脂肪酸的种类、含量及分布特征。
通过选取市面上常见的动、植物食用油作为研究对象,利用先进的化学分析技术,如气相色谱、液相色谱等,对油样中的脂肪酸进行定性和定量分析。
通过对数据的整理和分析,本文期望能够揭示不同油脂中脂肪酸的组成规律,为合理选择和健康使用油脂提供科学依据。
同时,本文还将对脂肪酸与健康的关系进行探讨,分析饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸对人体健康的影响,以期提高公众对油脂营养价值的认识,促进健康饮食的普及。
本文将对常用动、植物食用油中脂肪酸组成进行全面深入的分析和研究,旨在为油脂的健康利用和合理消费提供理论支持和实践指导。
二、动、植物食用油的来源与分类动、植物食用油是我们日常生活中不可或缺的营养来源,它们分别来源于动物和植物,各自具有独特的脂肪酸组成和营养价值。
了解这些食用油的来源与分类,对于我们合理选择食用油,平衡膳食,保持健康具有重要意义。
动物食用油的来源主要是动物脂肪,如猪油、牛油、羊油、鱼油等。
这些油脂通常富含饱和脂肪酸,如硬脂酸和棕榈酸,它们在高温下具有较好的稳定性,适合用于高温烹饪和煎炸。
过量摄入饱和脂肪酸可能增加心血管疾病的风险,因此应适量食用。
植物食用油的来源则更为广泛,包括大豆油、菜籽油、花生油、玉米油、葵花籽油、橄榄油、亚麻籽油、芝麻油等。
这些油脂的脂肪酸组成各异,如大豆油、菜籽油等主要含有多不饱和脂肪酸,如亚油酸和亚麻酸,对人体健康具有重要作用。
橄榄油和亚麻籽油则富含单不饱和脂肪酸,如油酸和亚麻酸,具有降低胆固醇、预防心血管疾病等功效。
根据脂肪酸组成的不同,动、植物食用油可分为饱和脂肪酸油、单不饱和脂肪酸油和多不饱和脂肪酸油。
油脂中八种脂肪酸的分析测定 黄龙娣1,郑建明2,姚维武3,张丹青4 (江苏天瑞仪器股份有限公司,江苏 昆山 215300) 摘要:油脂经氢氧化钾-甲醇溶液甲酯化后,生成的脂肪酸甲酯用DB-WAX毛细管柱进行分离,GC-FID进行检测。该方法的回收率在91.45%~112.53%,相对标准偏差小于8%,八种脂肪酸的检出限在0.29 μg/mL ~1.10 μg/mL之间。本方法准确度高,检出限低,能满足实际检测工作的需要。 关键词:脂肪酸;气相色谱法;油脂 Determination of 8 kinds of fatty acids in oils HUANG Long-di1,ZHENG Jian-ming2,YAO Wei-wu3,ZHANG Dan-qing4 (Jiangsu Skyray Instrument Co.,Ltd.,Jiangsu Kunshan,215300) Abstract:A method for the determination of 8 kinds of fatty acids in oils by GC-FID was developed.Fatty acids were methylated to fatty acid methyl ethers(FAMEs) by KOH in methanol.FAMEs were quantitively measured by DB-WAX capillary gas chromatography.The recoveries of fatty acids ranged from 91.45%~112.53% with relative standard deviations less than 8%,and the detection limits were in the range of 0.29μg/mL ~1.10μg/mL.With the high accurate and low detection limits,this metod could be used in many laboratory detectings. Key words:fatty acid;gas chromatography;oil
油脂是食物中3大产能营养素之一,其主要成分是高级脂肪酸(12个碳原子以上)的甘油酯,是人类从饮食中摄取能量的主要来源,具有重要的生理作用。油脂中所含的亚油酸、亚麻酸为必需脂肪酸,人体自身不能合成,只能由食物供给[1]。但是,在最近10年来,乡居民的膳食、营养状况有了明显改善,但仍面临营养失衡的情况。由于膳食营养比例失衡所导致的儿童发育不良、贫血,成人肥胖、高血压、糖尿病、血脂异常等慢性病现象,依然十分严重。因此,膳食营养摄入必需考虑各种脂肪酸的搭配,尤其是必须脂肪酸一定要有足够的量[2]。可见,对油脂中脂肪酸成分和含量进行分析,对于科学评价油脂的营养价值,指导人们合理安排膳食具有重要意义。 油脂中脂肪酸含量的测定方法主要是气相色谱法。脂肪酸的极性较强,虽然脂肪酸可以直接在极性固定相上进行分析,但是如果把脂肪酸衍生为脂肪酸甲酯就可以降低它们的沸点得到更为可靠和重复性的数据。常用的方法有三氟化硼法、三甲基氢氧化硫法、酯交换法等[3-6]。笔者采用氢氧化钾-甲醇进行甲酯化,用DB-WAX毛细管柱进行分离,优化了甲酯化的条件,对橄榄油、大豆油、花生油、菜籽油及猪油中的脂肪酸组成及含量进行了测定。 1 实验部分 1.1 仪器试剂 仪器:气相色谱仪(GC5400),江苏天瑞仪器股份有限公司;恒温水浴锅;氢气发生器(AYH-300),北京天雨泽科技有限公司;空气发生器(AYK-2000)北京天雨泽科技有限公司;微量进样器(10μL),安捷伦 试剂:正己烷(色谱纯),百灵威;氢氧化钾(分析纯),江苏强盛化工有限公司;甲醇(色谱纯),SANFO;脂肪酸甲酯标准品,AccuStandard公司 样品:橄榄油、大豆油、花生油、菜籽油、猪油均购自市场 1..2 脂肪酸甲酯混合标准溶液的配制 准确称取一定量的豆蔻酸甲酯、棕榈酸甲酯、棕榈油酸甲酯、硬脂酸甲酯、油酸甲酯、亚油酸甲酯、亚麻酸甲酯、花生酸甲酯标准品于同一容量瓶中,用正己烷溶解并定容至100mL,置于4℃冰箱保存备用。 1.3 样品处理 称取0.1000g左右(精确到0.001g)试样至具塞试管中,用移液管移取3mL正己烷溶解试样,再加入1.0mol/L KOH-CH3OH 溶液2mL,放入恒温水浴锅中衍生20min后取出冷却
至室温,加入2mL饱和氯化钠溶液,振摇1分钟,静置分层,取上清液过滤,用做气相色谱分析。 1.4 色谱条件 色谱柱为DB-WAX毛细管柱(3m×0.320 mm×0.25μm);载气为高纯氮气,1.40MPa,分流比10:1,柱温:200℃,进样口温度:250℃,检测器温度:280℃,进样量:1.0 μL。 2 结果与讨论 2.1 甲酯化条件的选择 2.1.1 甲酯化温度的选择 实验比较了甲酯化温度对反应的影响,选择30℃、40℃、50℃、60℃的甲酯化温度分别进行了实验。实验结果表明:甲酯化反应温度为50℃时,甲酯化反应效果相当,甲酯化反应温度为60℃时,正己烷易挥发影响实验结果的准确性,因此本实验选择甲酯化温度为50℃。 2.1.2 甲酯化时间的选择 任何反应都需要一定的时间,因此时间是影响甲酯化程度的一个重要因素,时间太短,甲酯化反应不完全;时间太长,则影响了实验效率。因此本实验对不同时间下的响应值进行了比较,其结果见表1。 表1 不同甲酯化时间的响应值 甲酯化时间 10min 20min 30min 40min 响应值(Mv) 411751 397385 364968 355626 从表1可以看出,随着甲酯化时间的增长,响应值越来越小,因此本实验选择甲酯化时间为10min。 2.1.3 甲酯化试剂浓度的选择 KOH-CH3OH的浓度是影响甲酯化程度的另一个重要因素,本实验对不同浓度的KOH-CH3OH溶液进行了比较,结果见表2。 表2 加入不同浓度KOH-CH3OH溶液时的响应值 KOH-CH3OH浓度(mol/L) 0.4 0.8 1.0 1.2 响应值(MV) 452349 482986 598519 589965 从表2可以看出,采用1.0mol/L KOH-CH3OH和1.2 mol/L KOH-CH3OH,甲酯化反应效果相当,因此本实验选择KOH-CH3OH溶液的浓度为1.0mol/L。 2.2 工作曲线 将1.2配制的脂肪酸甲酯混合标准溶液逐步稀释,在最优化色谱条件下注入气相色谱仪进行检测。以脂肪酸质量为横坐标,其相应的峰面积为纵坐标绘制标准曲线。各脂肪酸的线性方程、相关系数见表3。方法的检出限是依据线性最低浓度点,以3倍噪声比计算得出。 表3 八种脂肪酸的线性方程和相关系数
脂肪酸名称 线性范围(ng) 线性方程 相关系数 检出限 (μg/mL) 豆蔻酸 3.29~26.32 y=91.028x+125.72 0.9996 0.29 棕榈酸 2.85~22.8 y=97.232x+232.1 0.9995 0.38 棕榈油酸 3.32~26.56 y=73.061x+192.73 0.9995 0.48 硬脂酸 3.02~23.52 y=108.92x+215.3 0.9996 0.71 油酸 4.31~34.48 y=60.893x+140.17 0.9994 0.63 亚油酸 3.42~27.36 y=105.37x+258.32 0.9995 0.90 亚麻酸 4.26~34.08 y=52.9x+158.23 0.9995 1.00 花生酸 2.94~23.52 y=87.986x+68.4 0.9999 1.10 2.3 回收率与精密度 取橄榄油样品进行标准添加试验,每个添加量做3个平行实验,试验结果见表4。结果表明,脂肪酸的回收率在91.45%~107.55%之间,相对标准偏差小于1.12%~7.83%(n=3)之间。说明该方法是可行的。 表4 4种脂肪酸的加标回收实验结果 2.4 样品中八种脂肪酸含量的测定 在确定的色谱条件下,分别对标样和样品进行色谱分析,利用保留值定性,外标法定量,图1、图2分别为标样和样品的色谱分离图。油脂的定量结果见表5.
图1 标样色谱图 图2 猪油脂肪酸甲酯气相色谱分离图 注:(1)C14:0;(2)C16:0;(3)C16:1;(4)C18:0;(5)C18:1;(6)C18:2;(7)C18:3;
脂肪酸 名称 添加 量(mg) 添加水平1回收率 RSD% 添加 量(mg) 添加水平2回收率 RSD% 添加 量(mg) 添加水平3回收率 RSD%
豆蔻酸 1.645 97.47 3.55 3.29 107.55 3.89 4.93 91.45 5.67 棕榈油酸 1.66 106.62 7.83 3.32 101.47 1.12 4.98 103.52 6.47 亚油酸 1.71 93.76 3.48 3.42 101.005 4.99 5.13 98.42 4.23 花生酸 1.47 99.65 1.52 2.94 105.76 4.05 4.41 95.09 5.11