可注射水凝胶的研究进展.
- 格式:doc
- 大小:19.50 KB
- 文档页数:7

第22卷第3期2023年5月杭州师范大学学报(自然科学版)JournalofHangzhouNormalUniversity(NaturalScienceEdition)Vol.22No.3May2023收稿日期:2022 07 15 修回日期:2022 10 26基金项目:杭州高层次留学回国人员(团队)在杭创业创新项目(202011108);杭州师范大学“本科生创新能力提升工程”项目(cx20221058);杭州师范大学“星光计划”学生创新创业项目(2022026).通信作者:梁媛媛(1980—),女,副教授,博士,主要从事功能高分子材料研究.E mail:liangyy@hznu.edu.cn犱狅犻:10.19926/j.cnki.issn.1674 232X.2023.03.002基于壳聚糖的水凝胶用于伤口敷料的研究进展黄雨欣,王 伟,杨 涛,孙 俊,吴彦彤,梁媛媛(杭州师范大学材料与化学化工学院,浙江杭州311121)摘 要:伤口敷料具有促进创面愈合和保护创面不受感染的特点,广泛应用于临床治疗.以天然多糖壳聚糖为原料构筑的水凝胶材料具有独特的三维网络结构和促进伤口愈合能力,在伤口敷料的应用方面受到关注.文章从水凝胶伤口敷料的性能要求如生物相容性、抗菌性能、黏合性和强度、止血性能及抗氧化性等出发,对近年来基于壳聚糖的水凝胶伤口敷料的设计和制备研究进行了总结与概括,并对该类水凝胶伤口敷料的未来发展和应用前景进行了展望.关键词:壳聚糖;水凝胶;伤口敷料中图分类号:R318.08 文献标志码:A文章编号:1674 232X(2023)03 0233 07伤口敷料是一类用于创伤、烧伤、溃疡等伤口覆盖的医用材料,其主要作用是吸收渗出液防止渗液感染.常见的传统敷料如医用脱脂棉、无菌纱布等,只能起到简单的物理屏蔽作用,容易与伤口黏合而在换药时造成二次伤害,且其透气性不佳,易引发细菌滋生及伤口感染[1].目前临床上创口不及时处理带来的后果主要有3类[2],即外伤细菌炎症、血液循环障碍、免疫攻击组织损坏.外伤细菌炎症一般是指外伤后的伤口发炎,往往因异物或其他因素导致的局部细菌感染而引起.血液循环障碍是指外伤后创口局部组织血管内血液含量增多,发生水肿、充血、出血,以及血栓形成、栓塞、梗死.而当细菌或病原体进入人体后,诱发机体产生免疫应答,在杀伤、清除病原体的同时损害宿主的组织细胞,称为免疫攻击组织损坏.壳聚糖(chitosan,CS)是天然存在的唯一碱性多糖,具有生物相容性良好、价格低廉易得等优势.有研究表明,CS具有促进组织再生的能力,在伤口愈合过程中可降低炎症反应,促进新生血管形成,减少瘢痕产生,遏制血液循环[3].以CS为原料构筑的水凝胶材料可以为伤口愈合过程提供相对湿润的环境,避免二次感染,有效降低免疫系统对本体的伤害,并能有效吸收渗出的组织液,使得伤口快速愈合;同时CS水凝胶可以作为载体实现生物活性物质(如药物、抗原、抗体、生长因子、干细胞等)的控制释放.因此,CS基伤口敷料有着良好的应用前景.本文将从CS基水凝胶敷料的性能如生物相容性、抗菌性能、黏合性和强度、止血性能及抗氧化性等出发,对近年基于CS的水凝胶伤口敷料的设计和制备研究进行概括与总结.Copyright ©博看网. All Rights Reserved.1 壳聚糖基水凝胶的制备图1 甲壳素和壳聚糖的分子结构式犉犻犵.1 犛狋狉狌犮狋狌狉犪犾犳狅狉犿狌犾犪狊狅犳犮犺犻狋犻狀犪狀犱犮犺犻狋狅狊犪狀 CS是甲壳素的脱乙酰化产物,而甲壳素是从虾、蟹等甲壳类动物的外壳及菌类、藻类植物的细胞壁中提取出的天然高分子.一般将脱乙酰度为55%的甲壳素称为CS,其结构式如图1所示.由于CS上有丰富的基团,如氨基、羟基等,通常可使用物理交联、化学交联和酶交联等方法来制备水凝胶.1.1 物理交联物理交联主要通过非化学作用(即非共价键作用,包括氢键作用、静电作用、配位作用等)交联形成网络结构.由于非共价作用较弱,故物理交联状态下的水凝胶一般不稳定,力学性能较差,可通过构建多重物理交联网络改善其力学性能.且物理交联能大大减少有毒化学交联剂的使用,符合绿色化学的理念,形成的水凝胶往往具有一定的自修复能力,拥有较宽的使用范围.CS分子链中含有羟基、氨基,可与其他聚合物通过氢键作用形成水凝胶网络,如通过循环冻融法制备聚乙烯醇(polyvinylalcohol,PVA)/CS共混水凝胶(PVA/CS)[4].该工作利用冷冻过程中水的结冰排出作用,使PVA分子链发生富集而形成晶区结构,通过多次循环冻融,PVA晶区的结晶度不断提高,从而形成以晶区为物理交联点的PVA网络,而PVA又可与CS分子链段通过氢键作用形成PVA CS物理交联网络,因此获得的PVA/CS水凝胶具有双层网络结构,有良好的抗溶胀性能和力学性能.此外,CS作为天然碱性多糖,可以通过其质子化氨基与阴离子聚电解质之间的强静电作用构筑聚电解质复合水凝胶.鲁程程等[5]通过两步法制备出完全物理交联的CS Al3+/聚丙烯酸(poly(acrylicacid),PAA)双网络凝胶,其中PAA与CS通过静电作用形成第一交联网络,PAA与Al3+通过配位作用形成第二交联网络.为进一步提高凝胶的机械性能,采用饱和NaCl溶液诱导CS分子链发生亲水—疏水转变,通过形成CS链缠结微区来提高凝胶的交联密度,再加上物理交联网络具有重新缔合和自恢复能力,该复合水凝胶具有良好的机械稳定性.1.2 化学交联CS分子链段中含有—OH和—NH2,通常采用甲醛、戊二醛、京尼平、甘油醛等为交联剂构筑凝胶网络(图2),如利用醛类交联剂上的醛基与CS链上的氨基发生席夫碱反应获得三维水凝胶,这类化学交联过程不可逆,形成的水凝胶性质稳定.动态交联的水凝胶是通过动态共价键或非共价键交联形成的,在剪切力的作用下可屈服流动,外力撤销后,又能自修复损伤结构,故可用于注射型凝胶伤口敷料的构筑.常见的动态交联相互作用包括席夫碱键[6]、酰腙键[7]、可逆氢键[8]、硼酸酯键[9]、金属配位[10]、主体 客体[11]、阴阳离子[12]和疏水相互作用[13]等.Xu等[14]采用N 羧乙基壳聚糖(N carboxyethylchitosan,CEC)、双键壳聚糖改性聚吡咯(chitosan modifiedpolypyrrole,DCP)和双醛端基聚氨酯(aldehyde terminateddifunctionalpolyurethane,DFPU)制备了CEC/DCP/DFPU(CDD)水凝胶,该水凝胶分子结构中除了存在席夫碱键,还存在离子和氢键相互作用,其中离子相互作用在交联和自愈过程中发挥着重要作用,增强了凝胶自愈性和可注射性.研究表明,CDD水凝胶表现出优异的剪切稀释行为,在高剪切作用下可发生凝胶—溶胶的转变,所以能够通过内径80μm的针头实现皮下注射,是细胞和药物微创递送的合适载体.432杭州师范大学学报(自然科学版)2023年 Copyright ©博看网. All Rights Reserved.图2 壳聚糖常见化学交联反应犉犻犵.2 犆狅犿犿狅狀犮犺犲犿犻犮犪犾犮狉狅狊狊 犾犻狀犽犻狀犵狉犲犪犮狋犻狅狀狊狅犳犮犺犻狋狅狊犪狀光诱导的化学交联反应具有操作简单、反应速率快的优点,且光具有非侵入性,副产物有限,交联反应程度在二维和三维空间中均可控.CS分子本身不具光敏性,将光敏性基团接枝于CS分子中,可以赋予CS光敏特性,还可破坏CS自身分子间的氢键作用,改善其水溶性[15].如丁海昌[16]在壳聚糖C6羟基引入烯丙基,光引发剂经过UV辐照后产生自由基,自由基进攻CS链上的烯丙基双键产生卡宾(carbenes)结构,卡宾相互碰撞后发生偶联,自由基进行转移后继续进攻双键,如此循环往复形成具有交联结构的水凝胶.1.3 酶交联反应酶通常可以有效地催化生化反应,酶法催化交联采用生物相容性优异的酶催化交联,因此得到的水凝胶材料也具有优异的生物相容性.辣根过氧化物酶(horseradishperoxidase,HRP)在H2O2存在下,可催化羟基酚,产生苯氧自由基,这些自由基通过氧化自偶联作用促进酚类化合物的聚合.利用该反应,Ha等[17]使用HRP催化羟苯基丙酸修饰的CS与4 羟基苯乙胺修饰的聚乙二醇之间的交联聚合反应,获得了具有良好生物相容性的CS基水凝胶.微生物谷氨酰胺转氨酶(microbialtransglutaminase,MTG)能催化蛋白质分子内或蛋白质分子间的交联,Hu等[18]在羧甲基壳聚糖分子链中通过化学接枝反应引入胶原蛋白多肽(collagenpolypeptide,CP),通过MTG催化CP支链发生交联反应,实现了羧甲基壳聚糖分子的交联.Chen等[19]利用葡萄糖氧化酶催化葡萄糖氧化反应,制备了一种超分子级联反应器用于糖尿病性慢性伤口的治疗.该反应器由CS、磺基丁基 β 环糊精(SBE β CD)、铁离子(Fe2+)和葡萄糖氧化酶(glucoseoxidase,GOX)通过离子作用和配位作用获得.GOX催化糖尿病人伤口处的葡萄糖产生Fe2+介导Fenton反应所需的H2O2,最终产生羟基自由基(·OH).而·OH对体外耐药细菌具有较高抑制作用,并能引发聚乙二醇二丙烯酸酯的自由基聚合反应,在伤口表面原位形成交联的水凝胶网络结构,水凝胶的形成和·OH的抗菌作用可协同促进糖尿病患者慢性伤口愈合.2 壳聚糖水凝胶伤口敷料的性能要求2.1 生物相容性由于水凝胶敷料直接与组织和细胞相互接触以促进伤口愈合,其生物相容性是首要因素,因此其制备原料不应引起机体的不良免疫或异物反应等.CS作为天然来源的多糖,虽然自身具有良好的生物相容性,但其分子内的氢键作用力较强,导致CS不溶于水、醇等许多典型的溶剂,只有在偏酸性的条件下溶解性较好[20],故而在构筑凝胶过程中常使用有机溶剂,这对凝胶敷料的生物相容性造成负面影响.另外,CS分532 第3期黄雨欣,等:基于壳聚糖的水凝胶用于伤口敷料的研究进展Copyright©博看网. All Rights Reserved.子结构中含有丰富的氨基基团,可以与醛类物质生成席夫碱而形成三维网状结构,在化学交联中常常使用小分子二醛作交联剂,而凝胶中小分子醛类交联剂残余往往会引起严重的炎症反应.因此,需采用长时间透析等方式彻底去除有机溶剂及未反应的交联剂等,但长时间的透析不仅耗时,还会导致凝胶网络过度溶胀,凝胶敷料的内部结构被破坏.为克服上述问题,目前主要采用以下2种策略来实现水凝胶生物相容性的改善:一是选择低毒的天然来源的交联剂,如京尼平是植物杜仲中提取的栀子苷经过β葡萄糖苷酶水解的产物,但使用京尼平交联的CS凝胶呈蓝色,凝胶的透明度会受到一定程度的影响[21].二是对CS进行化学改性,改善其水溶性的同时引入其他官能团实现壳聚糖的交联,从而避免醛类小分子交联剂的使用.如陈凯等[22]采用水溶性良好的羧甲基化壳聚糖与PVA、海藻酸钠复合,通过组分间的氢键、席夫碱相互作用而获得的复合水凝胶对细胞生长无副作用,有良好的生物相容性;童泽鑫等[23]利用羧丁酰壳聚糖接枝小分子胶原蛋白肽,以氧化普鲁兰多糖为交联剂,通过席夫碱反应制备得到羧丁酰壳聚糖/氧化普鲁兰复合水凝胶,体外细胞实验结果表明该水凝胶具有良好的生物相容性.2.2 抗菌性伤口愈合过程中的主要障碍是细菌感染,受损的组织失去屏障的保护后极易受到金黄色葡萄球菌、大肠杆菌等的侵袭.因此,水凝胶中往往会加入抗生素等抗菌性物质,但抗生素容易使细菌产生耐药性.以CS为原料构筑的水凝胶具有良好的抗菌性,依据相互作用理论模型,CS分子中含有游离的氨基,易被H+质子化,质子化的氨基带有正电荷,会与菌体细胞壁表面带负电荷的蛋白质、磷脂等产生静电吸引,继而破坏细菌的细胞膜导致细胞内成分泄漏,或者通过改变细菌外膜的渗透性,阻碍细菌对营养物质的吸收,使细菌缺乏营养而死亡[24].但也有研究者提出了不同的观点,认为CS中自由氨基(非质子化氨基)含量越高,抑菌能力越强.如Lu等[25]将CS溶解于LiOH/KOH/尿素碱性溶液中,以含有醛基端基的四臂聚乙二醇为交联剂,通过席夫碱反应制备CS水凝胶,同时加入含有端氨基的四臂聚乙二醇,对交联网络结构进行调节.抑菌实验结果表明,相比用酸溶解,采用LiOH/KOH/尿素碱性溶液溶解的CS,由于溶解主要通过破坏CS分子间的氢键作用实现,而非因酸性下的氨基质子化实现,因此CS结构中自由氨基得以保留,在含端氨基的四臂聚乙二醇的协同作用下,该凝胶对大肠杆菌和金黄色葡萄球菌的抗菌率接近100%.李明等[26]以羧甲基壳聚糖、氧化淀粉和单宁酸为原料,利用席夫碱反应制备羧甲基壳聚糖复合水凝胶,证明羧甲基壳聚糖上的自由氨基可以与细菌结合,破坏细菌细胞壁的完整性,抑菌活性高.此外,Xue等[27]将CS分子改性成为壳聚糖季铵盐,同时提高了CS的水溶性和抗菌能力.一般认为,壳聚糖季铵盐中季铵阳离子可与细菌细胞壁表面的酸性高分子相互作用,进一步改变细胞膜通透性,从而阻止营养物质透过细胞壁,使细菌不能进行新陈代谢,达到抗菌的目的[28].2.3 黏合性和强度水凝胶作为伤口敷料需要与伤口组织直接接触,其黏合性是评价水凝胶伤口敷料性能的标准之一.水凝胶良好的黏合性不仅可以减少传统敷料缠绕四肢给患者带来的束缚感,还可以促进凝胶内部负载的活性物质如生长因子等与伤口之间的相互作用.Yang等[29]发现黏合缝合拓扑可进一步加强水凝胶与皮肤之间的黏合强度.他们在丙烯酸弹性体(VHB)表面加入CS酸性溶液,CS与VHB表面可形成亚胺键和离子键,随后利用NH2与OH官能之间的氢键作用,CS链段可进入水凝胶内部与聚丙烯酰胺原位形成网络拓扑结构,由于这种拓扑结构强度与皮肤强度相当,该水凝胶对皮肤表现出较高的黏合强度.此外,在水凝胶的黏合性设计上也需考虑不同的使用场景,如对大量出血或者存在大量体液的伤口,需考虑水凝胶在湿态下的黏合强度.Du等[30]将疏水改性壳聚糖乳酸酯与咖啡酸改性的壳聚糖整合,制备了组织黏合性水凝胶.疏水改性可以排除血液和体液对黏结的干扰,促进咖啡酸修饰的壳聚糖中邻醌基团与组织表面胺或硫醇基团生成共价键,实现对湿性伤口的黏合.对于脚踝、膝盖、腕部等关节部位的伤口敷料,还需要考虑关节频繁运动和弯曲对凝胶强度的要求,一般可以通过调整交联密度或交联方式来控制水凝胶的机械性能.而双网络结构(double network)由于具有双层交联的网络结构,可以有效改善凝胶的强度和韧性,常用于凝胶敷料的构筑.如Wang等[31]在儿茶酚改性的甲基丙烯酰壳聚糖和甲基丙烯酰壳聚糖形成的共价632杭州师范大学学报(自然科学版)2023年 Copyright ©博看网. All Rights Reserved.交联网络基础上,利用儿茶酚基团与Fe3+之间的鳌合作用,构筑了双网络结构,提高了水凝胶的机械强度,并且由于儿茶酚基团与组织表面基团(氨基、巯基和咪唑基团等)存在共价相互作用,水凝胶对组织有较好的黏合能力,其搭接剪切强度可达到18kPa,为商品化的胶原蛋白胶的6倍.2.4 止血性能CS与血液接触时,CS上的游离氨基可以和血浆蛋白或血细胞上的酸性基团相互作用引起血栓,该过程通常被理解为血浆蛋白在CS上吸附,促进了血小板的黏附和激活,导致血栓形成从而达到凝血效果[32].在实际应用中凝胶敷料要达到止血效果,需要与创口表面紧密黏附.从分子结构上看,CS是甲壳素N 脱乙酰基的产物,与组织间的静电作用较弱,因此依赖氨基阳离子实现组织黏附的CS水凝胶止血能力有限,研究者们主要通过在凝胶中引入可与组织发生共价作用的基团或电荷来改善其止血效果.Sundaram等[33]将纳米生物玻璃(nano bioglass,nBG)和CS溶液混合,通过溶胶 凝胶法制备了CS/nBG复合水凝胶.该水凝胶具有优秀的止血性能,这源于CS的质子化氨基基团与nBG释放的Si、Ca、P等元素成分(以离子或离子基团形式)发生协同作用,激活了不同类型的凝血因子从而达到快速止血的效果.张冬英[34]制备的儿茶酚功能化壳聚糖/牡蛎肽温敏水凝胶能够明显缩短体外凝血时间达到高效止血作用,其中儿茶酚功能化壳聚糖组分可以提高组织中蛋白质的合成效率,促进血管、肉芽组织生成,为创伤愈合提供合适环境.2.5 抗氧化性长时间的炎症反应会使机体产生大量的活性氧(reactiveoxygenspecies,ROS),当细胞无法抵抗高浓度的ROS时就会出现阻碍伤口愈合的情况,所以伤口修复时还需注意伤口微环境中的ROS浓度.因此功能性伤口敷料需要具有一定的抗氧化性及降低炎症作用的效果.李航婷等[35]以鳗鱼鱼鳔胶原蛋白、CS和海藻酸钠为原料与Ca2+交联制得水凝胶.该水凝胶材料含有鳗鱼鱼鳔胶原蛋白,具有较好的抗氧化活性,与对照组相比,实验小鼠血清内的炎症因子(白介素 6、白介素 1β、肿瘤坏死因子)含量均减少,表明该CS基水凝胶可以抑制炎症反应的发生,有效促进伤口的愈合.Bergonzi等[36]将α 生育酚(维生素E,VitE)与CS溶液反应制得含有VitE的CS基油墨,通过3D打印获得具有抗氧化活性的支架,以帮助慢性伤口愈合.该支架在具有优良机械特性的同时,能缓慢释放VitE,从而具有优良的自由基清除能力,为组织的再生创造了良好的环境.Hao等[37]以硼酸盐保护的二氮二醇酯修饰的壳聚糖(chitosanmodifiedbyboronate protecteddiazeniumdiolat,CS B NO)为原料制备了一种可注射的水凝胶,CS B NO可以响应ROS刺激而释放NO,从而调节缺血/再灌注(ischemia/reperfusioninjury,I/R)损伤后的ROS/NO失衡.结果表明,在小鼠心肌I/R损伤模型中,CS B NO与传统释放NO的水凝胶相比,能更有效地减轻心脏损伤,促进心脏修复并改善心脏功能.调节ROS/NO可激活抗氧化防御系统,从而调节Nrf2 Keap1通路来防止I/R损伤诱导的氧化应激,抑制NF κB信号转导通路的过度激活来减少炎症.2.6 活性物质负载在临床中,药物缓释系统是一类用于人体内部的可以定点、定向控制药物释放的技术.利用水凝胶通过物理包埋固定化技术携带药物后,可以在特定的时间和环境下,使药物在体内通过扩散缓慢释放,同时水凝胶的降解也会进一步释放药物,使药物利用率和功效大大提高.CS在生物组织工程中对细胞的生长和增殖具有良好的效果,将生长因子、抗生素、疫苗等包埋在CS水凝胶中,不仅可以实现负载药物释放和输送,还可以发挥CS本身的优良作用.韩佳岐等[38]制备了一种邻苯二酚改性的壳聚糖水凝胶用于血管内皮生长因子的负载,具有良好的药物释放能力和抗菌性.Tan等[39]将CS与羧甲基化西米纸浆(carboxymethylsagopulp,CMSP)通过电子束辐交联获得水凝胶,该水凝胶具有pH敏感性:在酸性介质中,CMSP中的羧酸基团和CS中的氨基基团被质子化,水凝胶不发生溶胀,可限制负载药物的释放;当pH为6.8时,CMSP的羧基基团和CS的氨基去质子化,凝胶发生溶胀,药物开始释放且缓释时间可达32h.3 结论与展望综上所述,水凝胶伤口敷料在应用中不仅需要满足止血、抗菌等基础性能要求,还需要满足促进皮肤再732 第3期黄雨欣,等:基于壳聚糖的水凝胶用于伤口敷料的研究进展Copyright ©博看网. All Rights Reserved.生、防止产生瘢痕等更加复杂的应用要求,如根据伤口愈合不同阶段(炎症、增生、成熟)的特点,有效结合伤口微环境变化,发展具有皮肤生理结构和生理微环境的CS基敷料.这对水凝胶敷料的生物相容性、机械强度、湿性环境的黏合性能等提出了更高的要求.目前,基于CS的伤口敷料研究大多停留在实验室阶段,鲜有研究涉及CS衍生物或CS基凝胶与伤口接触后的代谢物对伤口愈合过程的影响及潜在风险.探索绿色环保、安全性高、成本低廉、适应人体多种需求的CS基水凝胶敷料的设计及制备方法,并且逐渐实现从外敷向人体内部组织的应用,这是以CS为代表的天然抗菌性多糖基水凝胶材料研究的重要内容和长远目标.参考文献:[1]YONETANIY,KUROKAWAM,AMANOH,etal.Thewounddressinginfluencedeffectivenessofcryotherapyafteranteriorcruciateligamentreconstruction:case controlstudycomparinggauzeversusfilmdressing[J].Arthroscopy,SportsMedicine,andRehabilitation,2022,4(3):e965 e968.[2]GAOBB,GUOMZ,LYUK,etal.Microneedledressing:intelligentsilkfibroinbasedmicroneedledressing(i SMD)[J].AdvancedFunctionalMaterials,2021,31(3):2170018.[3]CHENWH,CHENQW,CHENQ,etal.Biomedicalpolymers:synthesis,properties,andapplications[J].ScienceChinaChemistry,2022,65(6):1010 1075.[4]KALANTARIK,MOSTAFAVIE,SALEHB,etal.Chitosan/PVAhydrogelsincorporatedwithgreensynthesizedceriumoxidenanoparticlesforwoundhealingapplications[J].EuropeanPolymerJournal,2020,134:109853.[5]鲁程程,于振坤,杨园园,等.聚丙烯酸 Al3+/壳聚糖复合双网络水凝胶的制备与性能[J].复合材料学报,2022,39(12):5912 5922.[6]YANGC,GAOLL,LIUXY,etal.InjectableSchiffbasepolysaccharidehydrogelsforintraoculardrugloadingandrelease[J].JournalofBiomedicalMaterialsResearch,2019,107(9):1909 1916.[7]HYUNAJ,SEUNGHYUNS.Programmablelivingmaterialsconstructedwiththedynamiccovalentinterfacebetweensyntheticpolymersandengineered犅.狊狌犫狋犻犾犻狊[J].ACSAppliedMaterials&Interfaces,2022,14(18):20729 20738.[8]WANGXY,SONGRJ,JOHNSONM,etal.Aninjectablechitosan basedself healablehydrogelsystemasanantibacterialwounddressing[J].Materials,2021,14(20):5956.[9]童艳萍,肖艳.双重动态化学键交联水凝胶的制备及性能[J].功能高分子学报,2020,33(3):305 312.[10]ZHANGJH,CAOLM,CHENYK.Mechanicallyrobust,self healingandconductiverubberwithdualdynamicinteractionsofhydrogenbondsandborateesterbonds[J].EuropeanPolymerJournal,2022,168:111103.[11]CAITT,HUOSJ,WANGT,etal.Self healabletoughsupramolecularhydrogelscrosslinkedbypoly cyclodextrinthroughhost guestinteraction[J].CarbohydratePolymers,2018,193:54 61.[12]HUANGG,TANGZF,PENGSW,etal.Modificationofhydrophobichydrogelsintoastronglyadhesiveandtoughhydrogelbyelectrostaticinteraction[J].Macromolecules,2022,55(1):156 165.[13]DINGCC,TIANMD,FENGR,etal.Novelself healinghydrogelwithinjectable,pH responsive,strain sensitive,promotingwound healing,andhemostaticpropertiesbasedoncollagenandchitosan[J].ACSBiomaterialsScience&Engineering,2020,6(7):3855 3867.[14]XUJP,WONGCW,HSUSH.Aninjectable,electroconductivehydrogel/scaffoldforneuralrepairandmotionsensing[J].ChemistryofMaterials,2020,32(24):10407 10422.[15]ABDUL MONEMMM,KAMOUNEA,AHMEDDM,etal.Light curedhyaluronicacidcompositehydrogelsusingriboflavinasaphotoinitiatorforboneregenerationapplications[J].JournalofTaibahUniversityMedicalSciences,2021,16(4):529 539.[16]丁海昌.UV交联壳聚糖水凝胶的可控合成与pH/温度响应性溶胀行为[D].哈尔滨:哈尔滨工业大学,2020.[17]HAYJ,PHUONGLT,KYUNG HEEH,etal.Tunableandhightissueadhesivepropertiesofinjectablechitosanbasedhydrogelsthroughpolymerarchitecturemodulation[J].CarbohydratePolymers,2021,261:117810.[18]HUWQ,LIUM,YANGXS,etal.Modificationofchitosangraftedwithcollagenpeptidebyenzymecrosslinking[J].CarbohydratePolymers,2019,206:468 475.[19]CHENL,CHENY,ZHANGR,etal.Glucose activatednanoconfinementsupramolecularcascadereaction犻狀狊犻狋狌fordiabeticwoundhealing[J].ACSNano,2022,16(6):9929 9937.[20]BOZUYUKU,DOGANNO,KIZILELS.DeepinsightintoPEGylationofbioadhesivechitosannanoparticles:sensitivitystudyforthekeyparametersthroughartificialneuralnetworkmodel[J].ACSAppliedMaterials&Interfaces,2018,10(40):33945 33955.[21]NERI NUMAIA,PESSOAMG,PAULINOBN,etal.Genipin:anaturalbluepigmentforfoodandhealthpurposes[J].TrendsinFoodScience&Technology,2017,67:271 279.832杭州师范大学学报(自然科学版)2023年 Copyright ©博看网. All Rights Reserved.[22]陈凯,柴琦,王丰艳,等.基于3D打印构建载银聚乙烯醇 羧甲基壳聚糖 海藻酸钠水凝胶伤口敷料及性能表征[J].复合材料学报,2022,39(12):5879 5891.[23]童泽鑫,徐海星,樊李红,等.羧丁酰壳聚糖/氧化普鲁兰复合水凝胶的制备及其性能[J].武汉大学学报(理学版),2021,67(4):346 352.[24]TANGRL,ZHANGY,ZHANGY,etal.Synthesisandcharacterizationofchitosanbaseddyecontainingquaternaryammoniumgroup[J].CarbohydratePolymers,2016,139:191 196.[25]LUJW,CHENY,DINGM,etal.A4arm PEGmacromoleculecrosslinkedchitosanhydrogelsasantibacterialwounddressing[J].CarbohydratePolymers,2022,277:118871.[26]李明,刘杨,龚浩,等.羧甲基壳聚糖复合水凝胶的制备及其性能研究[J].中国海洋药物,2022,41(2):19 27.[27]XUEH,HULC,XIONGY,etal.Quaternizedchitosan matrigel polyacrylamidehydrogelsaswounddressingforwoundrepairandregeneration[J].CarbohydratePolymers,2019,226:115302.[28]TANHL,MAR,LINCC,etal.Quaternizedchitosanasanantimicrobialagent:antimicrobialactivity,mechanismofactionandbiomedicalapplicationsinorthopedics[J].InternationalJournalofMolecularSciences,2013,14(1):1854 1869.[29]YANGJW,BAIRB,LIJY,etal.Designmoleculartopologyforwet dryadhesion[J].ACSAppliedMaterials&Interfaces,2019,11(27):24802 24811.[30]DUXC,LIUYJ,YANHY,etal.Anti infectiveandpro coagulantchitosan basedhydrogeltissueadhesiveforsuturelesswoundclosure[J].Biomacromolecules,2020,21(3):1243 1253.[31]WANGL,ZHANGXH,YANGK,etal.Anoveldouble crosslinking double networkdesignforinjectablehydrogelswithenhancedtissueadhesionandantibacterialcapabilityforwoundtreatment[J].AdvancedFunctionalMaterials,2020,30(1):1904156.[32]DINGCC,TIANMD,FENGR,etal.Novelself healinghydrogelwithinjectable,pH responsive,strain sensitive,promotingwound healing,andhemostaticpropertiesbasedoncollagenandchitosan[J].ACSBiomaterialsScience&Engineering,2020,6(7):3855 3867.[33]SUNDARAMMN,AMIRTHALINGAMS,MONYU,etal.Injectablechitosan nanobioglasscompositehemostatichydrogelforeffectivebleedingcontrol[J].InternationalJournalofBiologicalMacromolecules,2019,129:936 943.[34]张冬英.儿茶酚功能化壳聚糖/牡蛎肽温敏水凝胶的制备及其性能研究[D].湛江:广东海洋大学,2020.[35]李航婷,金明月,李诺营,等.鱼鳔胶原蛋白 壳聚糖 海藻酸钠水凝胶促小鼠皮肤伤口愈合研究[J].湖北农业科学,2022,61(10):127 131.[36]BERGONZIC,BIANCHERAA,REMAGGIG,etal.Biocompatible3Dprintedchitosan basedscaffoldscontainingα tocopherolshowingantioxidantandantimicrobialactivity[J].AppliedSciences,2021,11(16):7253.[37]HAOT,QIANM,ZHANGYT,etal.Aninjectabledual functionhydrogelprotectsagainstmyocardialischemia/reperfusioninjurybymodulatingROS/NOdisequilibrium[J].AdvancedScience,2022,9(15):2105408.[38]韩佳岐,田瑗,姜秋,等.负载血管内皮生长因子的邻苯二酚壳聚糖体外药物缓释性能及抗菌性研究[J].中国实验诊断学,2022,26(3):413 418.[39]TANLS,TANHL,DEEKONDAK,etal.Fabricationofradiationcross linkeddiclofenacsodiumloadedcarboxymethylsagopulp/chitosanhydrogelforentericandsustaineddrugdelivery[J].CarbohydratePolymerTechnologiesandApplications,2021,2:100084.犚犲狊犲犪狉犮犺犘狉狅犵狉犲狊狊狅犳犆犺犻狋狅狊犪狀 犫犪狊犲犱犎狔犱狉狅犵犲犾狊犳狅狉犠狅狌狀犱犇狉犲狊狊犻狀犵狊HUANGYuxin,WANGWei,YANGTao,SUNJun,WUYantong,LIANGYuanyuan(CollegeofMaterial,ChemistryandChemicalEngineering,HangzhouNormalUniversity,Hangzhou311121,China)犃犫狊狋狉犪犮狋:Wounddressingsarewidelyusedinclinicaltreatmentbecauseoftheircharacteristicsofpromotingwoundhealingandprotectingwoundsfrominfection.Hydrogelsbasedonnaturalpolysaccharidechitosan,whichhaveauniquethree dimensionalnetworkstructureforwoundhealing,haveattractedextensiveattentionsinapplicationofwounddressings.Basedontheperformancerequirementsofhydrogelwounddressings,suchasbiocompatibility,antibacterialproperties,adhesionandstrength,hemostaticpropertiesandantioxidantproperties,thispapersummarizedrelativeresearchesondesignandpreparationofchitosan basedhydrogelwounddressings,andlookedforwardtothefuturedevelopmentandapplicationprospectsonchitosan basedhydrogelwounddressings.犓犲狔狑狅狉犱狊:chitosan;hydrogels;wounddressings932 第3期黄雨欣,等:基于壳聚糖的水凝胶用于伤口敷料的研究进展Copyright ©博看网. All Rights Reserved.。

高分子多糖水凝胶功能材料研究与应用进展摘要:与传统高分子水凝胶材料相比,高分子多糖水凝胶因其具有环境友好型、生物相容性、特殊功能性、生物可降解性等优势而倍受重视。
综述了以植物多糖、海洋多糖、微生物多糖及其复合多糖为原料的多糖水凝胶功能材料的制备方法、功能特性和产品表征方法,介绍了多糖水凝胶材料在医药卫生、食品、化妆品、农业和环保等领域的应用情况,分析了多糖水凝胶在生物传感器、生物反应器、人工智能材料和抗菌材料等领域的应用前景,并指出提高材料性能与功能特性、分析凝胶形成机理和功能材料模拟等是未来多糖水凝胶研究的重点。
关键词:高分子多糖;水凝胶;功能材料;研究进展;应用多糖水凝胶是多糖利用的一个重要方面,水凝胶是一类具有三维交联网络结构,能够吸收并保持大量水分,而又不溶于水的功能高分子材料。
水凝胶自身的结构使其同时具备固体和液体的性质,即力学上表现出类固体性质,而在热力学上则表现出类液体行为[1-2]。
水凝胶因其具有低成本、多孔性、较高力学强度、光学透明性、生物可降解性、高溶胀率、生物相容性、刺激响应性等特性,被广泛应用于食品、化妆品、医药卫生、农业、环保等领域。
水凝胶按照制备原料的不同可分为天然高分子水凝胶和合成高分子水凝胶[3]。
用于制备水凝胶的天然高分子包括胶原/明胶、透明质酸、海藻酸盐、纤维素、黄原胶、魔芋葡聚糖、壳聚糖等[4-6]。
用于制备水凝胶的合成高分子包括聚丙烯酸、聚丙烯酰胺、聚乙二醇和聚乙烯醇等。
近年来,高分子多糖如纤维素、半纤维素、壳聚糖、海藻酸钠、黄原胶以及透明质酸等因其优越的生物相容性、天然可降解性以及丰富的来源等特点,越来越多地被用作制备水凝胶的原料,拓宽了多糖的应用领域。
多糖水凝胶材料包括互穿聚合物网络多糖胶、多糖类接枝共聚水凝胶、多糖类大孔冻凝胶和多糖类智能水凝胶。
其中多糖类智能水凝胶,通过在多糖类水凝胶中引入具有刺激响应性的化学基团,从而可以利用大分子链或链段的构象或基团的重排使其内部体积发生突变。
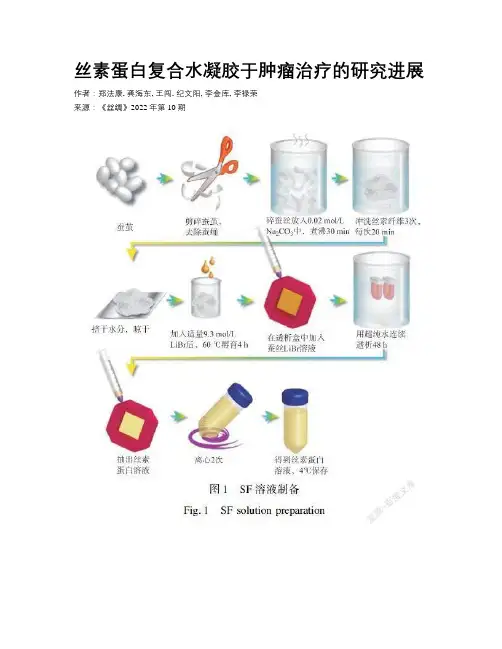
丝素蛋白复合水凝胶于肿瘤治疗的研究进展作者:郑法康, 龚海东, 王闯, 纪文阳, 李金库, 李禄荣来源:《丝绸》2022年第10期摘要:癌癥是世界上主要死因之一,但目前治疗方案仍以手术治疗为主,放疗、化疗等新兴技术治疗为辅。
为了克服放化疗对患者的全身副作用,局部靶向治疗可弥补传统化疗给药方式的局限性,减少药物的副作用,提高治疗效果,从而改善患者的存活率和生存质量。
丝素蛋白是一种来源广泛的天然高分子纤维蛋白,有良好的生物相容性和生物降解性及可修饰的机械性能等特点。
如今丝素蛋白水凝胶作为载药平台的相关研究已成为新型抗肿瘤治疗方法的研究热点,基于此本文对丝素蛋白水凝胶与化疗药物复合形成水凝胶后于肿瘤中的应用研究进展进行概述。
关键词:丝素蛋白;水凝胶;肿瘤;缓释;长效;药物载体;局部治疗中图分类号: TS102.33; R730.53文献标志码: A文章编号: 10017003(2022)10004108引用页码: 101106DOI: 10.3969/j.issn.1001-7003.2022.10.006肿瘤的发病率逐年上升,严重威胁着人类的健康,自1845年系统地报道了第一例恶性肿瘤病例开始,到最近几十年,人们才逐渐对癌症相关的生物学和病理学有了深入的研究[1-2]。
2021年美国预计新发癌症病例将达1 898 160例[3]。
丝素蛋白(Silk fibroin,SF)是美国食品药品监督管理局批准的天然高分子材料,由于在生物医学工程方面表现出杰出的优点,使其受到科研人员的广泛关注[4]。
在探索肿瘤治疗方法的过程中,局部化疗已被归为恶性肿瘤的常规治疗方法[5-6]。
SF水凝胶结合化疗药物在肿瘤局部化疗方面具有重要意义,它能够在相对较长的时间内保持肿瘤原位的高药物浓度,同时具有药物载体、药物缓释及非手术输送药物等优点[7]。
本文简要介绍了SF水凝胶的特点,包括SF水凝胶的性质、肿瘤相关应用和前景,并探讨了近年来SF水凝胶载药在抗肿瘤方面的研究进展,以期拓宽SF水凝胶的应用范围。

622化学试剂2021年5月DOI:10.13822/ki.hxsj.2021007946综述与进展化学试剂,2021,43(5) ,622〜631抗菌水凝胶在生物医学领域的研究进展张浩然,王士凡'朱文友,庄文昌,董黎明,堵锡华(徐州工程学院材料与化学工程学院,江苏徐州221018)摘要:细菌感染是阻碍伤口愈合的重要因素之一,同时也是生物医学领域面临的一个重要问题。
目前的抗菌水凝胶有着高抗菌活性、生物相容性以及可注射性等性能,并且其物理化学性质与生物组织相似,使得越来越多新型的抗菌水凝胶材料被用于治疗细菌感染。
综述了近几年抗菌水凝胶的研究进展,归纳总结了几种不同类型的抗菌水凝胶的制备方法,抗菌活性和生物相容性等。
重点阐述了抗菌水凝胶在伤口敷料、药物负载和传递以及组织工程等生物医学领域中的应用前景。
关键词:水凝胶;抗菌活性;生物相容性;生物医学;抑菌活性中图分类号:0063 文献标识码:A 文章编号:0258-3283( 2021 ) 05-0622-10P ro g re ss of A n tib ac terial H yd ro gel in Field of B iom edicine ZHANG Hao-ran ,WANG Shi-fan* yZHU Wen-you ,ZHUANG Wen-change DONG L i-m in g, DU Xi-hua( School of Materials and Chemical Engineering, Xuzhou Institute of Technology, Xuzhou 221018,China) ,Huaxue Shiji,2021 ,43(5),622-631A b stra c t: Bacterial infection is one of the important factors hindering wound healing, and it is also an important problem in biomedical field.The current antibacterial hydrogels have high antibacterial activity, biocompatibility and inject ability, and their physical and chemical properties are similar to those of biological tissues, making more and more new antibacterial hydrogel materials used to treat bacterial infections.The research progress of antibacterial hydrogels in recent years was reviewed,and preparation methods,antibacterial activity and biocompatibility of several kinds of antibacterial hydrogels were summarized.Furthermore, the application prospect of antibacterial hydrogels in wound dressings, drug loading and delivery, tissue engineering and other biomedical fields were emphasized.Key w ords: hydrogel ; antibacterial activity ; biocompatibility ; biomedicine; antibacterial activity抗菌水凝胶具有一定的生物相容性、可降解 性以及抗菌性等特点,因此人们将水凝胶开发应用到生物医学领域,如药物递送、伤口 /烧伤敷料、组织工程用支架等[|]。

木质素复合水凝胶性能及应用的研究进展一、本文概述木质素复合水凝胶作为一种新型的生物材料,近年来在科研领域引起了广泛关注。
其独特的结构和性能,使其在生物医药、农业、环保等多个领域具有广阔的应用前景。
本文旨在综述木质素复合水凝胶的性能及其在各领域的应用研究进展,以期为推动该材料的进一步发展提供参考。
本文将首先介绍木质素复合水凝胶的基本概念和制备方法,阐述其独特的结构和性能特点。
随后,将重点综述木质素复合水凝胶在生物医药、农业、环保等领域的应用研究进展,包括药物载体、组织工程、农业保水、重金属离子吸附等方面的应用。
还将对木质素复合水凝胶的改性方法和性能优化进行探讨,以期提高其在实际应用中的性能表现。
本文将总结木质素复合水凝胶的性能特点和应用前景,展望其未来的发展方向和潜在应用价值。
通过本文的综述,希望能够为木质素复合水凝胶的研究和应用提供有益的参考和指导。
二、木质素复合水凝胶的制备木质素复合水凝胶的制备是其在各种应用中使用的前提。
木质素因其独特的化学和物理性质,如良好的生物相容性、可再生性、环境友好性以及在多种溶剂中的溶解性等,成为了制备复合水凝胶的理想选择。
复合水凝胶的制备过程涉及多个步骤,包括原料的选取、预处理、混合、交联反应以及后续的成型和干燥等。
原料的选取是关键。
木质素来源广泛,可以从不同的植物或工业废弃物中提取,如木材、农作物废弃物等。
这些原料经过破碎、研磨和提取等预处理后,得到纯度较高的木质素。
将木质素与其他高分子材料或纳米材料进行混合。
这些材料可以是天然高分子,如壳聚糖、海藻酸钠等,也可以是合成高分子,如聚丙烯酰胺、聚乙二醇等。
混合过程可以通过溶液共混、熔融共混等方法进行。
接下来,通过交联反应使木质素与其他高分子之间形成化学键合。
这可以通过引入交联剂,如甲醛、戊二醛等,或者使用光引发、热引发等方法进行。
交联反应可以使木质素复合水凝胶具有更好的稳定性、机械性能和吸水性能。
通过成型和干燥等步骤得到最终的木质素复合水凝胶。

可注射RGD功能化的透明质酸果胶水凝胶促进体外成软骨的研究刘威;俞牧雨;于晓巍【摘要】目的研究基于透明质酸(HA)-己二酸二酰肼(ADH)/RGD寡肽功能化果胶(PAD)的可注射HA-ADH/PAD-RGD水凝胶体系的软骨形成作用.方法采用腙交联法合成水凝胶.通过分析HA-ADH与PAD-RGD不同质量比(8:2、6:4、4:6)HA-ADH/PAD-RGD水凝胶的形态学、凝胶时间、力学强度、降解时间、细胞增殖和软骨作用等因素,综合评价该水凝胶的特性.结果质量比从8:2减小到6:4和4:6时,水凝胶时间从(132.8±4.8)s分别增加到(188.7±10.1)s和(328.9±12.6)s(P<0.01),平衡溶胀比(ESR)从32.8±1.5分别依次增大到34.8±2.3和36.4±1.9(P<0.01).经过49 d降解后,8:2、6:4、4:6质量比组水凝胶的剩余质量比依次为85.3%、73.5%和55.9%.另外,随着质量比减小,水凝胶的力学强度不断减小.培养1 d后8:2、6:4、4:6质量比组水凝胶的dsDNA含量分别为(0.7±0.1)μg、(0.6±0.1)μg、(0.6±0.1)μg(P>0.05).培养21 d后,6:4组水凝胶dsDNA含量为(1.9±0.2)μg明显高于8:2组[(1.6±0.1)μg,P<0.05]和4:6组[(1.5±0.1)μg,P<0.05].6:4组水凝胶Ⅱ型胶原基因的表达为2.3±0.2明显高于8:2组(1.3±0.2,P<0.05)和4:6组(1.0±0.1,P<0.05).6:4组糖胺聚糖(GAG)产生量为(16.5±1.4)μg明显高于8:2组[(9.1±1.4)μg,P<0.05]和4:6组[(8.8±1.0)μg,P<0.05].包裹在6:4组水凝胶中软骨细胞胶原Ⅱ型免疫着色的细胞百分比为(83.7±15.7)%,明显高于8:2组[(53.3±9.2)%,P<0.05]和4:6组[(43.9±7.8)%,P<0.05].结论 HA-ADH/PAD-RGD 水凝胶具有适宜的凝胶时间,力学强度,良好的组织相容性和细胞相容性,并能增强软骨细胞增殖,维持软骨细胞表型.不同质量比HA-ADH/PAD-RGD水凝胶具有不同性质,6:4质量比水凝胶具有最好的物理化学和生物学性质.%Objective Toinvestigate the chondrogenic effect of injectable hydrogel system based on hyaluronic acid-adipicdihydrazide (HA-ADH)/G4 RGDS-aldehyde pectin (PAD-RGD)in vitro.Methods We synthesized the hydrogel byhydrazine cross-linking method.We evaluated the characteristics of hydrogel by analyzing the different properties such as morphology,gelationtime,mechanical strength, degradation time,the proliferation of cells and chondrogenic effect of different weight ratios (8:2,6:4,4:6)of HA-ADH/PAD-RGD. Results When the weight ratio decreased from 8:2 to 4:6,the hydrogel time increased from (132.8±4.8)s to (188.7±10.1)s and(328.9±12.6)s,respectively (P<0.01),and the equilibrium swelling ratio (ESR)increased from 32.8±1.5 to 34.8±2.3 and 36.4±1.9, respectively(P<0.01).After 49 days of degradation,the weight retention rate of the three kinds of hydrogel was 85.3%,73.5%,and 55 .9%,respectively.In addition,as the weight ratio decreased,the mechanical strength of the hydrogel decreased.After 1 day of culture,the dsDNA content of various gels was similar,and the values in the three groups were0.7±0.1μg,0.6±0.1μg and 0.6±0.1μg,respectively (P>0.05).After 21 days of culture,the dsDNA content in the 6:4 group was significantly higher than that in the 8:2 and 4:6 groups (1.9±0.2,1.6±0.1and 1.5±0.1)(P<0.05).The expression of type Ⅱ collagen gene in the 6:4 group was 2.3±0.2,which was significantly higher than that of the 8:2 and 4:6 groups (1.3±0.2 and1±0.1)(P<0.05).The production of Glycosaminoglycan (GAG)in the 6:4 group was 16.5±1.4μg,which was significantly higher than that in the 8:2 and 4:6 groups (9.1±1.4μg,8.8±1.0μg)(P<0.05).The percentage of collagentype Ⅱ immunostaining of chondrocytes encapsulated in the 6:4 hydrogel was 83.7±15.7,which was significantly higher than that of t he 8:2 and 4:6 groups (53.3±9.2,43.9±7.8)(P<0.05).Conclusion Our research showed that the hydrogel had the proper gelation time,mechanical strength and good histocompatibility and cytocompatibility.Moreover,it could enhance the proliferation and maintain the phenotype of chondrocytes.Different weight ratios of hydrogel exhibited different properties.Among the three weight ratios,HA-ADH/PAD-RGD at the 6:4 had the best physiochemical and biological properties.【期刊名称】《国际骨科学杂志》【年(卷),期】2018(039)003【总页数】7页(P180-186)【关键词】可注射水凝胶;组织工程;软骨再生【作者】刘威;俞牧雨;于晓巍【作者单位】200233, 上海交通大学附属第六人民医院骨科;200233, 上海交通大学附属第六人民医院内分泌科;200233, 上海交通大学附属第六人民医院骨科【正文语种】中文软骨细胞生长于高度水化的细胞外基质(ECM)中,通过分化簇抗原44(CD 44)和整合素等细胞表面受体与ECM不断相互作用。

温敏型可注射水凝胶的制备研究29卷6期2010年12月中国生物医学工程ChineseJournalofBiomedicalEngineeringV01.29No.6December2010温敏型可注射水凝胶的制备研究刘玲秀胡帼颖刘欣顾汉卿(天津医科大学生物医学工程系,天津300070)(天津市泌尿外科研究所,天津300211)摘要:为得到应用于软组织重建的新型可注射组织工程支架材料,将经交联合成的HA交联凝胶(XLHA),分别与降解性能不同的两种温敏型材料聚N.异丙基丙烯酰胺(PNIPAAm)凝胶和甲基纤维素(MC),在常温下共混合成XLHA—PNIPAAm与XLHA—MC可注射水凝胶,分析XLHA—PNIPAAm与XLHA—MC水凝胶的可注射性能,耐酶解性能,温敏性能和化学结构,并进行溶血试验与细胞毒性试验评价可注射凝胶的生物相容性.研究获得了XLHA—PNIPAAm的可注射水凝胶的制备条件,并证实了分别将不可降解材料PNIPAAm 与可降解材料MC和HA共混均能有效延缓HA的降解,且PNIPAAm延缓HA降解的效果更为显着.辐照剂量为5kGy,MBAAm/NIPAAm(M/M)=0.015,NIPAAm单体浓度为3%,制备的PNIPAAm与XLHA共混制备的XLHA—PNIPAAm可注射凝胶的耐酶解性能最佳.差示扫描量热仪(DSC)检测显示XLHA—PNIPAAm的温敏性较为稳定.两种复合凝胶的细胞毒性和溶血试验均合格,且XLHA—PNIPAAm水凝胶的生物相容性要好于XLHA.MC凝胶. 关键词:透明质酸;聚N一异丙基丙烯酰胺;甲基纤维素;可注射凝胶;组织工程中图分类号R3l8.O8文献标识码A文章编号0258-8021(2010)06-0901-08 StudyonPreparationofTemperature-SensitiveInjectableHydrogelLIULing.XiuHUGuo.YingLIUXinGUHan—Qing'. (BiomedicalErtgineeringCollege,TianjinMedicalUniversity,Tianjin300070,China) (TianjinInstituteofUrologicalSurgery,Tianjin30021l,China)Abstract:Inordertogetasortofnewscaffoldmaterialforsofttissuereconstruction,weprepare dXLHAPNIPAAmandXLHA-MCinjectablehydrogelsbyblendingcrosslinkedHA(XLHA)andt wotemperature?sensitivematerials,poly(N-isopropylacrylamide)(PNIPAAm)andMethylcellulose(MC) withdifferentdegradability,respectively.Theinjectablility,enzymaticbiodegradability,temperature—sensitivity,structurecytotoxicityandhemolysisofthemweretested.ThepreparationformulaofXLHA—PNIPAAminjectablehydrogelwasobtained,anditwasverifiedthataddingnon—degradablematerialPNIPAAmcouldpostponethedegradation ofHAmoreeffectivelythanthatofthedegradablematerialMC.PNIPAAm,preparedwith5k Gydoseradiation,MBAAm/NIPAAm(M/M)=0.015.monomerconcentration=3%.producedXLH A.PNIPAAmwiththeslowestenzymaticdegradationrate.DSC(DifferentialScanningCalorimetry)detection revealedthattemperature?sensitivityoftheXLHA—PNIPAAmwasmorestablethanthatofXLHA-MC.Twocomposite hydrogelswerequalifiedincytotoxicityandhemolysistests,andthebiocompatibilityofXL HA.PNIPAAmhydrogelwasbetterthanthatofXLHA—MChydroge1.Keywords:hyaluronan;poly(N—isopropylacrylamide);methylcellulose;injectablehydrogel;tissueengineeringdoi:10.3969/j.issn.0258?8021.2010.06.018收稿Et期:2010-04-23,修回日期:2010~6-12基金项目:国家重点基础研究发展(973)计划(2009CB930000)通讯作者.E-mail:**************中国生物医学工程引言软组织的修复和功能重建是现代医学面临的一大难题.将可注射水凝胶作为组织工程支架材料,实现体内的软组织重建,有望为细胞的新陈代谢提供良好的传输通道和的丰富水环境.此外,可注射水凝胶在体内与修复组织之间嵌合连接好,可塑性好,且能够实现原位注射达到微创目的,操作简单方便,近年来成为了组织工程领域的新热点卜.透明质酸(hyaluronan,HA)是广泛分布在软结缔组织细胞外基质中的主要蛋白多糖,具有良好的相容性和黏弹性,能促进机体软组织的修复与再生,因此,利用透明质酸作为支架材料是组织工程领域重要的研究内容,也是软组织重建的重要发展方向.然而,透明质酸应用于组织工程支架有降解速度快,体内停留时间短,机械强度低等不足,需进行交联改性,以提高其机械强度并减缓其在组织中的降解速度,更好地满足软组织重建的需求-4.就构建组织工程支架的可注射凝胶而言,材料的热力学可逆性至关重要,即常温下材料流动性较强,利于注射,而体温下材料固化,形成支架.透明质酸虽是促进组织生长的生物材料,但不具备热力学可逆性.N一异丙基丙烯酰胺(N-isopropylacrylamide, NIPAAm)交联后形成的水凝胶聚N.异丙基丙烯酰胺(poly(N?-isopropylacrylamide),PNIPAAm)则是一种典型的热缩温敏性材料,已被广泛应用于生物医学领域,如酶的固定,释放药物的温控开关功能等.我们的前期工作已经证实了PNIPAAm水凝胶是一种良好的热缩温敏性材料,其相转变温度大约为32℃,且具备良好的生物相容性.甲基纤维素(methylcellulose,MC)是一种非离子纤维素醚,在一定的甲基取代度范围内具有水溶性,其水溶液在温度升高到一定温度后,溶液将会发生完全可逆溶胶一凝胶相转变.这种温敏型MC水凝胶具有许多优越性能:高含水量,与组织相似的弹性和较好的生物相容性,在组织工程,药物释放等领域中有着许多潜在应用.国外已有报道将其与HA的结合作为治疗脊髓损伤的药物释放的可注射凝胶体系,凝胶除了能迅速凝胶化,还具有可降解,生物相容性好等优点.综上,为同时发挥HA的理化,生物学特性和PNIPAAm与MC的温敏特性,以期应用于软组织的组织工程重建,本研究尝试将HA与不可降解温敏型材料PNIPAAm制备出XLHA.PNIPAAm可注水射凝胶,并与文献[8]中的HAMC进行可注射性能,降解性能与生物相容性初步评价的比较.1材料与方法1.1材料采用的HA相对分子质量大约为1.8x10.Da;丁二醇缩水甘油醚(1,4-Butanedioldiglyeidylether, BDDE,购自于Aldrich),浓度为95%一97%; NIPAAm,分析纯,日本KOHJIN公司;N,N.亚甲基双丙烯酰胺(N,N-Methylenebisacrylamide, MBAAm),分析纯;甲基纤维素(methylcellnlose, MC),A15PREMLV,美国陶氏化学公司,原料均未经过其他处理.Co603,辐射源,天津市技术物理研究所.1.2方法1.2.1交联透明质酸衍生物的制备室温条件下,将HA粉末溶解于0.2MNaOH溶液中,配置成10%HA溶液.均匀搅拌30min,静置2h使其充分溶胀.取一定量的HA凝胶,按BDDE/HA(M/M)=1:1,加入BDDE,常温搅拌30min,充分混匀,将体系置于50℃水浴中反应6h,反应结束后,加人一定浓度的HC1溶液中和溶胀处理,形成4%的HA—BDDE水凝胶即XLHA凝胶.1.2.2聚N一异丙基丙烯酰胺的制备配制一系列浓度(1,3,5,8,10和15wt%)的NIPAAm水溶液,将交联剂MBAAm按MBAAm/ NIPAAm(M/M)=0,0.0075,0.015溶解在NIPAAm水溶液中,搅拌均匀,通氮气30min,封口. 常温下Co60源释放的射线辐照,剂量率为1kGy/h,总剂量大小分别为5,20和30kGy.将辐射制备的PNIPAAm水凝胶取出,浸于40℃水浴中,待凝胶均匀收缩后取出,25cI=水浴溶胀,反复漂洗去除单体,冷冻干燥.1.2.3PNIPAAm水凝胶的溶胀率测定用称重法测定PNIPAAm水凝胶在不同温度下的平衡溶胀率(SwellingRatio,SR).称取一定质量(Wd)干态凝胶,在25℃和37℃下将其浸泡于过量的磷酸盐缓冲溶液(PBS)中,溶胀24h,取滤纸吸于凝胶表面的水分,称重(Ws),依公式1计算25℃和37℃下凝胶的平衡溶胀率.6期刘玲秀等:温敏型可注射水凝胶的制备研究SR=×100%(1)1.2.4XLHA.PNIPAAm可注射水凝胶的制备将XLHA凝胶通过2.5mL的针管以恒定推进力匀化3遍.将PNIPAAm凝胶于37℃下充分溶胀,于室温下以恒定推进力通过2.5mL的针管匀化5遍.室温下,将上述两种匀化后的凝胶按质量比1:1搅拌30rain使其共混,静置3h.1.2.5XLHA.MC可注射水凝胶的制备以HA2%,MC7%配制XLHA—MC.将4%的XLHA与14%的MC凝胶分别进行匀化后,按质量比1:1共混搅拌30min,得到XLHA—MC可注射水凝胶.1.2.6可注射性能测试称取2gXLHA—PNIPAAm凝胶与XLHA-MC凝胶分别装入2.5mL的医用注射针管,针头为12#. 以一定推进力(首次l0N,每次增大5N)推压针管10S,称量挤出的凝胶质量并记录.计算切应力与凝胶流速,绘制切应力-速率曲线.1.2.7体外降解实验37℃,15mL离心管装入2mL500UHAse溶液,1g凝胶注射人管底.培养1,2,4,7,10和14d 时,加9mL无水乙醇,与降解产物摇晃均匀,离心, 弃上清液.产物冷冻干燥,用式(2)量化降解程度: 降解率%=×100%(2)wa(o)是初始的聚合物干重,Wd(t)为时间为t时的聚合物干重.1.2.8傅立叶红外光谱(FTIR)检测将HA,XLHA,NIPAAm,PNIPAAm,XLHA—PNIPAAm,MC,XLHA-MC真空冷冻干燥后研磨粉碎,以KBr压片,采用傅立叶红外光谱仪(FTIR)进行红外光谱分析.1.2.9DSC检测用差示扫描量热仪(DifferentialScanning Calorimetry,DSC)对充分溶胀的凝胶样品(10mg) 进行扫描分析,升温范围为2O℃~5O℃,升温速率为2cI=/min.1.2.10细胞毒性实验取凝胶2.0g,加10mLRPMI1640培养液于37℃浸提72h.使用L929细胞,采用琼脂覆盖法, 中性红染色后光镜观察每皿材料周围和材料下脱色区的范围及细胞的崩解情况.材料细胞毒性的大小以区域指标z和细胞溶解指标£表示.1.2.11溶血实验取凝胶5g,加10mL生理盐水,置于(37±1)℃的恒温水浴锅中保温30min,加稀释过的抗凝兔血0.4mL,轻轻振荡混匀,恒温水浴60min.吸出管内液体(无固形物),离心1000r/min,10min,得清亮上清液.722分光光度计调试波长为545 nm,参比为生理盐水,测上清液的吸光度(opticaldensity,OD)并记录结果.计算材料的溶血率.2结果与讨论2.1PNIPAAm的制备目前PNIPAAm凝胶主要用化学方法合成,但产物中残余引发剂的清除是个比较棘手的问题. 我们采用辐射法合成PNIPAAm凝胶,操作简单,交联度可控,不需要添加引发剂等,有效克服了残留引发剂对生物相容性的不良作用.本课题组在以往研究中将NIPAAm的水溶液经^y辐照合成PNIPAAm水凝胶,采用的辐射条件为辐射剂量5—8kGy,辐射剂量率为700Gy/h,单体浓度为3%.本实验中采用的剂量率增至1kGy/h,所需的剂量为5kGy,得到的凝胶弹性和硬度与上述报道接近.2.2PNIPAAm的溶胀特性在其它制备条件不变的情况下,随着辐射剂量的增加,PNIPAAm凝胶的粘性减少,脆性增加;凝胶的溶胀率减少.以5kGy组来分析单体浓度及交联剂含量对凝胶溶胀率的影响,其中,单体浓度为1% 所获得辐射产物由于交联度太低,25cc与37℃下均呈流质态,不符合本实验要求,未测其溶胀率.析水率(SR析)定义为凝胶25℃与37℃下的溶胀率之差,SR析=SR:℃一SR,℃.数值上等同于单位质量的干态凝胶于25℃下充分溶胀后置于37℃环境中所析出的水的质量.溶胀率测试结果如图1所示.25℃下的凝胶的溶胀率直观地反应了凝胶辐射交联情况.从形态上观察,凝胶随交联剂含量,单体浓度,辐射剂量增大而粘性减弱,脆性增强,长链分子形成的网络结构越发结实密集,即凝胶的交联程度增加.人体体温下(37oC)凝胶的溶胀特性是考察的重点.由图1分析可知,凝胶的溶胀率随着辐射剂量交联剂含量的增大而呈现减小的趋势.凝胶的溶胀率的最大值出现在NIPAAm单体浓度3%~8%时.析水率的大小初步反映凝胶对温度的敏感中国生物医学工程29卷摹褂当臻单体浓度/%图15kGy剂量组的溶胀特性.I交联剂含量:A,B,C分别代表MBAAm/NIPAAm(M/M)=0,0.0075,0.015)Fi窖.1Swellingratioofhydrogels(5kGy).(A:MABAAm/NIPAAm(M/M)=0,B:MABAAm /NIPAAm(M/M)=0.0075,C:MABAAm/NIPAAm(M/M)=0.015)程度.为保证注射后凝胶在体内不过多的析出水而破坏人体组织的等渗环境,考虑将室温下注射的凝胶的含水量控制在37℃下的溶胀率所能达到的含水量水平.2.3XLHA-PNIPAAm的可注射性普遍来讲,随着辐照剂量的增加,凝胶的粘性较弱,脆性增加.20kGy与30kGy组辐照合成PNIPAAm均较脆,按本实验方法难以进行匀化.5kGy条件下合成的PNIPAAm,随单体浓度和辐照时间的变化,产物形态差异较大,注射性能结果如表1所示.表15kGy剂量制备的XLHA-PNIPAAm的各组凝胶25℃下的形态及注射性能Tab.1Themorphologyandinjectalityofhydrogelswith5 kGyDoseat25~C注:A,B,C分别代表MBAAm/NIPAAm(M/M):0,0.0075,0.015 25cI=条件下,可注射凝胶XLHA.PNIPAAm与XLHA—MC的可注射性能结果如图2所示.由表1与图2可知,图中各组复合凝胶均具备一定的可注射性.其中XLHA.PNIPAAm(B.5%)的可注射凝胶注射性能最佳.切应力大于500kPa图2可注射水凝胶25℃经12#针头注射时流速随剪切应力的变化Fig.2Therelationbetweenthevelocityof hydrogelsandshearstress(at25℃J时,凝胶能顺利通过12#针头.本实验的可注射凝胶属于非牛顿流体中的假塑性流体,其特点是切应力小于某一数值时,凝胶不能流动,大于.后凝胶才开始流动;且粘度随着剪切速率的增加而减小,即体现"剪切变稀"的特性.由上图可看出,XLHA—PNIPAAm(B一5%)的剪切变稀效果最明显.可注射凝胶的这种特性与凝胶里HA的成分有密切关系.袁靖军等研究了HA的流变学特性,发现HA溶液的粘度随剪切速率的增加而减小,具有明显的"剪切变稀"特性.37℃下PNIPAAm凝胶的溶胀率的大小可能直接反映XLHA-PNIPAAm凝胶的可注射性.可注射实验也证实了37℃下,辐射剂量为5kGy,单体浓度为5%,MBAAm/NIPAAm(肘/):0.0075条件下6期刘玲秀等:温敏型可注射水凝胶的制备研究的PNIPAAm与XLHA共混得到的可注射凝胶溶胀率最高,且可注射性最佳.同样的,将凝胶置于37℃环境下并对其进行了可注射性能实验.研究发现,所有的XLHA—PNIPAAm凝胶组均呈现白色固体小颗粒状,不具备可注射性能.这说明,XLHA-PNIPAAm凝胶在生理温度下流动性小,满足我们可注射水凝胶体内下固化成组织工程支架的要求.2.4体外降解实验将HA,XLHA分别与前面可注射性实验中筛选出的PNIPAAm凝胶以1:1(w/w)共混做体外酶降解实验,14d内各组凝胶中HA的降解情况所得结果如图3所示.图3失重法稠得凝胶中透明质酸的降解翠随时间的变化Fig.3ThedegradationofHAinhydrogels determinedbythechangeofdrymassovertime由图3分析可知,各组凝胶在前4d降解速率较大,之后逐渐缓慢.在500U透明质酸酶环境下,未交联的HA在4d时已经完全降解,HA—PNIPAAm共混凝胶在7d时降解率大约为80%左右,在14d时几乎完全降解,其中HA—PNIPAAm(c. 5%)组降解最慢.而XLHA—PNIPAAm各组的降解速率显着低于HA—PNIPAAm和HA组,其中XLHA. PNIPAAm(c一5%)降解最慢,14d时降解率仅为37.5%,远远低于单纯的XLHA组(84%).因此,PNIPAAm的加入能延缓HA的降解,且其中PNIPAAm(C-5%)延缓降解作用最明显;而交联改性能更大程度地延缓HA的降解,故将HA交联并与PNIPAAm共混是延缓HA降解的有效方法.上述耐酶解性能最佳的XLHA.PNIPAAm(C.5%)与XLHA—MC的凝胶的降解性能如图4所示.由图4可知,3组凝胶的整体降解率排序如下:XLHA>XLHA—MC>XLHA—PNIPAAm,说明透明质酸与温敏性材料PNIPAAm,MC共混,凝胶的降解速图4可注射凝胶整体随时间的降解情况Fig.4Degradationofinjectablehydroge~overtime率减慢,且XLHA—PNIPAAm凝胶降解速率最慢.这与共混材料的降解性能有关,MC是一种降解性材料,XLHA.MC两组分均发生降解;而PNIPAAm是一种非降解性材料,故XLHA—PNIPAAm只有XLHA组分发生降解.2.5红外光谱分析HAXLHANIPAAm,PNIPAAm,XLHA-PNIPAAm的红外光谱图,如图5所示.图5各单体及聚合物凝胶的FITR图谱.(1为HA;2为HA?BDDE;3为NIPAAm;4为PNIPAAm;5为XLHA- PNIPAAm;6为MC;7为XLHA—MC)Fig.5FITRspectrumofmonomersandpolymers.(1isHA;2isHA-BDDE;3isNIPAAm;4isPNIPAAm;5isXLHA-PNIPAAm;6isMC;7isXLHA-MC)由图5可知,HA.BDDE在3400cm处的一OH振动峰比HA增强,说明交联后HA的OH缔合度提高.HA—BDDE反应条件为碱性,交联产物在中国生物医学工程1050cm~,603cm处的醚键吸收峰有不同程度的增强,说明R—O—R的结构比例增加.但是由于BDDE分子内存在大量的醚键,因此1050em~,603 cm处的醚键吸收峰增强较大,所以交联反应导致的HA化学结构变化在红外光谱上并不明显.由图5分析可知,PNIPAAm在3400~3470cm为一NH伸缩振动峰;1655cm处为酰胺中羰基C—O的伸缩振动峰,1538cm处为仲酰胺吸收峰,l458cm处为一CH3一cH2的吸收峰.聚合物双键吸收峰(1618cm~,1407cm~,992cm~,919cm)等消失;聚合后分子链增长,所有震动吸收增强,特别是3433cm~,655cmN—H振动吸收峰变宽,但强度变化不大.这与以往报道¨.."中化学合成的PNIPAA凝胶的红外光谱结果基本一致. XLHA-PNIPAAm可注射凝胶,两组分结构并观察到未发生明显变化.XLHA—MC可注射凝胶,两组分结构并未观察到发生明显变化.2.6DSC检测结果PNIPAAM及其与HA及XLHA复合凝胶的DSC检测结果如图6所示.图6PNIPAAm,HA-PNIPAAm与XLHA- PNIPAAm的DSC图Fig.6DSCofPNIPAAm,HA-PIPAAm,XLHA-PNIPAAm从图6可看出,HA与XLHA的加入,凝胶的LCST并无显着性变化.按本研究的方法获得复合凝胶的两组分HA(XLHA)与PNIPAAm之间或许存在轻微的氢键,但氢键的作用还不足以改变PNIPAAm中亲水/疏水比例,以致来影响PNIPAAm 的LCST.MC与XLHA.MC的DSC检测结果如图7所示.图7MC,HA-MC与XLHA-MC的DSC图Fig.7DSCofMC.HA-MC.XLItA?MC由图7可以看出,本研究中测得的MC的LCST为67.5℃左右,而XLHA-MC在温度范围内并未检测到明显的吸热峰.说明HA(XLHA)的加入对MC 的LCST影响非常大.可能是共混凝胶的中(HA) XLHA的比例较大,严重破坏了MC中亲水/疏水比例,使得(HA)XLHA—MC水凝胶在我们的检测温度范围内不具备温敏性.由上述分析可知,本研究中采用的两种温敏性材料PNIPAAm与MC中,PNIPAAm的温敏性受外界影响小,较稳定.2.7细胞毒性试验细胞和材料接触培养24h后细胞形态与生长情况倒置显微镜下观察如图8所示.材料的细胞毒性的大小以着色区域指标z和细胞溶解指标表示,见表2.据图7与表2可知材料XLHA-PNIPAAm(浓度为5%;剂量为5kGy,剂量率为1kGy/h;MBAAm/ HA(M/M)=0.0075)的细胞毒性为0.3级,XLHA—MC的细胞毒性为1.3级;依据国家标准二者细胞毒性试验合格,XLHA.PNIPAAm的细胞毒性显着6期刘玲秀等:温敏型可注射水凝胶的制备研究(b)图8可注射凝胶琼脂覆盖法实验接种24h光镜下观察(400×).XLHA.MC(c)(a)阴性对照;(b)XLHA-PNIPAAm;Fig.8Theinjectablehydrogelsoberservedundermicroscopeafter24hwithagaroverlaytest{ 400×)?(a)Negative;(b)XLHA?PNIPAAm;{e)XLHA-MC表2可注射凝胶的细胞毒性结果Tab.2Resultsofcytotoxicityofinjectablehydrogels低于XLHA—MC.2.8溶血试验可注射凝胶溶血试验结果如表3所示,溶血率见图9.表3可注射凝胶的溶血试验结果Tab.3Resultsofhemolyticofinjectablehydrogels.I/一XLHAXLHA—PNIPAAmXLHA.MC受试样品图9可注射凝胶的溶血率Fig.9Hemolyticrateofthehydrogels由上述结果可知,XLHA-PNIPAAm与XLHA—MC凝胶的溶血率均小于5%,依据国家标准¨溶血试验合格.其中XLHA.PNIPAAm组凝胶的溶血率要低于XLHA—MC组凝胶.3结论本研究成功得到了XLHA-PNIPAAm可注射凝胶的制备条件,并证实了不可降解温敏性材料PNIPAAm与可降解温敏性料MC的加入均能有效延缓透明质酸的降解.辐照剂量为5kGy,MBAAm/ NIPAAm(M/M)=O.015,NIPAAm单体浓度为3%制备的PNIPAAm与XLHA共混制备的XLHA- PNIPAAm可注射凝胶的耐酶解性能最佳,且优于XLHA—MC.PNIPAAm的温敏性较稳定,受XLHA的影响小;而MC的温敏性受环境的影响较大,本实验中XLHA的加入会显着削弱MC的温敏性.两种温敏型材料与XLHA制备得到的复合凝胶细胞毒性和溶血试验均合格,其XLHA—PNIPAAm 的溶血率与细胞毒性均低于XLHA-MC凝胶组.研究初步发现,PNIPAAm在37℃下的溶胀率对凝胶的可注射性和降解性有直接的关系,溶胀率越低,越能延缓透明质酸的降解,凝胶却越难注射.后续研究中,将对凝胶的温敏性,流变学性质和凝胶组分XLHA与PNIPAAm的分子间相互作用做进一步的分析研究.5432●O述脊目嚣I中国生物医学工程29卷参考文献[2][3][4][5][6]LeeKY,MooneyDJ.Hydrogelsfortissueengineering[J]. ChemRev,2OO1,101(7):1869—1879.GutowskaA,JeongB,JasionowskiM.Injectablegelsfortissueengineering[J].AnatRec,2001,263(4):342—349. GraySD,TitzeIR,ChanR,eta1.V ocalfoldproteoglycansand theirinfluenceonbiomechanics[J].Laryngoscope,1999,109 (6):845—854.LaurentTC.Thechemistry,biologyandmedicalapplicationsof hyaluronananditsDerivatives[M].London:PortlandPress Ltd.1998.205—217.IchikawaH,ArimotoM,FukumofiY.Designofmierocapsules withhydrogelasamembranecomponentandtheirpreparationby aspoutedbed[j].PowderTechnology,2003,130(1—3): 189—192.张琰.新型温敏性微凝胶的制备与表征[D].合肥:安徽大学,2002.[7][8]【9][1O][11][12][13]张莉.温度敏感性水凝胶的辐射合成及其对细胞培养和脱附的研究[D】.天津:天津医科大学,2007.GuptaD,TatorCH,ShoichetMS.Fast—gellinginjectableblend ofhyaluronanandmethylcelluloseforintrathecal,localized deliverytotheinjuredspinalcord[J].Biomaterials,2006,27 (11):2370—2379.袁靖军,徐政,顾其胜.透明质酸溶液的流变性能初步研究[J].上海生物医学工程杂志,2003,24(3):15—18.V argheseJM,IsmailYA,LeeCK,eta1.Thermoresponsivehydrogelsbasedonpay(N—isopropylacrylamide)/ehondroitin sulfate[J].Senso~andActuatorsB:Chemical,2008,135 (1):336—341.李志军.聚N.异丙基丙烯酰胺共聚物及其互穿网络的制备及性能研究[D】.上海:上海大学,2006.GB/T16886.4-1997医疗器械生物学评价一第5部分:细胞毒性试验[S].北京:中国标准出版社,1999.GB/T16886.1—2003医疗器械生物学评价一第4部分:血液相互作用试验选择[S].北京:中国标准出版社,2003.。

水凝胶在药物递送系统中的应用研究水凝胶是一种具有三维网络结构且能够在水中吸收大量水分的高分子材料,具有极大的潜力在药物递送系统中得到广泛应用。
随着生物技术和纳米技术的进步,逐渐受到重视。
水凝胶在药物递送系统中的应用研究对于提高药物的生物利用度、减少药物的毒性和副作用、延长药物作用时间等方面具有重要意义。
研究表明,水凝胶在药物递送系统中的应用有多种形式。
其中,最常见的是将药物包裹在水凝胶颗粒中,通过控制水凝胶的释放速度来实现药物的缓释。
通过改变水凝胶的交联度、孔径大小、表面性质等参数,可以实现对药物释放速度的精确控制。
另外,还可以将药物直接溶解在水凝胶中,通过体外或体内注射的方式将药物释放到目标部位,达到治疗效果。
除了作为药物缓释载体外,水凝胶还可以通过与药物之间的物理或化学相互作用,实现药物的靶向输送。
一些研究表明,通过修饰水凝胶的表面,可以实现对特定药物受体的识别,从而将药物有选择性地输送到目标细胞或组织内。
这种靶向输送方式可以提高药物的治疗效果,减少对健康组织的损伤。
此外,水凝胶还可以作为生物传感材料在药物递送系统中发挥重要作用。
通过将生物传感分子与水凝胶结合,在药物递送过程中监测体内的生物环境变化,实现对药物释放的动态调控。
这样一来,可以根据患者的具体情况,调整药物的释放速度和剂量,提高治疗效果。
在药物递送系统中,水凝胶的应用还涉及到一些新兴领域,如仿生药物递送系统、微纳米药物递送系统等。
这些新兴领域的研究为水凝胶在药物递送系统中的应用带来了更广阔的发展空间。
例如,利用仿生药物递送系统可以模拟人体的生理过程,实现更加准确和有效的药物递送。
微纳米药物递送系统则可以实现对微小目标区域的高效输送,适用于治疗一些微小器官疾病。
梳理一下本文的重点,我们可以发现,水凝胶在药物递送系统中的应用研究已经取得了一些重要的进展,但仍然面临着一些挑战。
例如,如何进一步提高水凝胶的药物负载量和释放速度,如何减少水凝胶与药物之间的非特异性相互作用等问题亟待解决。

科技创新 2017年第8期l科技创新与应用 医用壳聚糖水凝胶研究进展
刘璐 (国家知识产权局专利局专利审查协作广东中心,广东广州510530)
摘要:文章主要探讨了医用壳聚糖水凝胶领域的研究情况,具体分析了医用壳聚糖水凝胶在药物释放、医用敷料和组织工程支 架等细分领域的研究现状,收集了近年医用壳聚糖水凝胶的研究成果和发展趋势。 关键词:壳聚糖;水凝胶;组织工程;药物释放;医用敷料
甲壳素,又被称为几丁质,因其自身含有大量氨基多糖称为唯 一的天然阳离子多糖,主要从甲壳生物的外壳或昆虫的外骨骼中提 取得到。甲壳素为由N一乙酰一2一氨基一2一脱氧一D一葡萄糖通过B一1,4 糖苷键形成多糖,即N一乙酰一D一葡萄糖胺的聚糖。壳聚糖是甲壳素 上的氨基的脱乙酰化产物,反应活性和溶解性均比甲壳素强。壳聚 糖在自然界中的含量位列第二位,仅低于纤维素,并且能够实现可 循环利用,是理想的生物医用材料。壳聚糖具有许多优良特性:对环 境无污染,生物相容性和可降解性高,来源广泛,以及具备黏膜黏附 性、抗菌活性等。 水凝胶是由水溶性高分子经过交联后形成的,交联网络结构能 在水中膨胀但会分散,能够保持含水量高但并不溶剂的状态,可以 达到几十甚至几百倍的吸水率,是很强的吸水材料,其中的液体水 被固定于高分子三维网络结果当中,整个水凝胶体系可以保持良好 的稳定性。水凝胶质地柔软,与活体组织质感相近,具有良好的生物 相容性使得它在生物医药领域具有广阔的应用前景,如,可作为药 物缓释材料、蛋白质电泳、隐形眼镜、人造血浆和皮肤、组织填充材 料、组织工程支架等。 壳聚糖水凝胶具有低毒性和高生物相容性,作为智能水凝胶是 还具有pH或温度的敏感性,并且不影响药物本身的药效发挥,在用 作药物缓释材料、组织工程支架、医用敷料等领域具有良好的应用 前景。[11 1医用壳聚糖水凝胶药物释放体系 药物释放系统包括有药物固定和药物的控制释放过程,凝胶本 身因其网络结果能够很好的实现药物的存储固定,同时溶胀度的变 化过程能够控制药物的释放速率,还容易在体内降解代谢。因此,水 凝胶在口服、口腔、鼻腔、阴道、直肠、眼部、注射等给药途径具有较 大的应用潜力。 药物释放用水凝胶主要包括温度敏感水凝胶和pH敏感水凝 胶,对于温度敏感性的凝胶,当处于人体温环境(37℃)时,凝胶发生 亲水膨胀,网络结构由紧变松,从而释放出药物;对于pH敏感的水 凝胶,当处于肠道内较高pH环境中时,凝胶膨胀释放药物,而在pH 较低的胃环境时并不释放药物,从而避免强酸性胃液对于药物效果 的影响。 Dnmitfiu等研究了一种壳聚糖/黄原胶复合水凝胶,通过将黄原 胶与碱性药物复合,并在酸性条件下逐步释放,通过调节壳聚糖的 脱乙酰度,可以对凝胶的理化性质进行调整。天津大学姚康德等将 壳聚糖、明胶和果胶复配并利用戊二醛作为交联剂共交联制备得到 了壳聚糖基凝胶,该水凝胶具有pH灵敏性可用于药物释放体系,可 作为口服抗酸、治疗胃肠疾患的滞留型控释制剂,可以减少药物突 释造成的毒副作用,并且具有良好的生物相容性和生物降解性能。 中国海洋大学刘成圣[31等将壳聚糖脂肪酸酯复合物和 ,B一甘油磷 酸钠复配,制备得到温敏水凝胶负载抗肿瘤药物,用于原位注射局 部治疗的药物载体。通过与酯化改性提高了壳聚糖的温度灵敏性和 稳定性,对于肿瘤的治疗具有广阔的应用前景。 2医用壳聚糖水凝胶敷料 水凝胶质地柔软,可以实现与伤口的充分接触,并且能为伤口 提供一个良好的湿润环境,进而促进伤口的愈合。利用壳聚糖水凝 胶制备得到的医用敷料具有柔软、舒适与创面的贴合性好的优点, 并且能够缓解疼痛和抑制出血,同时部分水凝胶还具有抗菌消炎的 功效。此外,在病患伤口的愈合、自身皮肤生长的过程中,壳聚糖水 凝胶敷料能自行降解并被机体吸收,免除了揭除时病人的痛苦,还 会促进皮肤再生,对治疗高热创伤特别有效。 德州海利安生物股份有限公司研究一种医用胶体敷料及其应 用,该敷料主要包括水溶性甲壳素和醋酸氯己定,具有镇痛、抑菌、 抗炎、促进创面愈合、抑制瘢痕增生、提高创面修复质量的作用,对 手术切口、烧伤创面、烫伤创面、溃疡创面的治疗和修复具有显著疗 效。 3医用壳聚糖水凝胶组织工程支架 水凝胶具有三维网络结果,网络中填充有大量水,便于营养物 质和代谢产物的运输,并有助于保护细胞。此外,水凝胶还可以通过 注射方式植入体内,手术创伤小,并在体内环境改变下可以原位胶 凝,由于发生胶凝的条件温和对负载药物的影响较小,是实现生长 因子或药物递送非常适宜的载体材料。因此,水凝胶制备组织工程 支架具有天然的优势。 壳聚糖由于其具有氨基而带有大量正电荷,可以吸引带有负电 的细胞壁,有利于细胞的附着;其降解后的产物具有良好的生物相容 性;此外壳聚糖还具有杀菌、防黏连、维持体内生态平衡等许多功效 协同组织的修复。因此,壳聚糖是制备组织工程支架的优良材料。日 Bio Syntech Canada公司研发了包含有壳聚糖和甘油磷酸二钠 盐的温度响应水凝胶,该水凝胶在室温状态下位液态,在体温附近 成胶,因此可在液体状态下直接注射入所需部位原位成胶。该水凝 胶的制备无需使用有机溶剂和交联剂,可降低凝胶的生物毒性并提 高其生物相容性,可用于药物递送、眼部组织植入、骨或软骨填充材 料并用于组织工程领域。中国人民解放军军事医学科学院基础医学 研究所王常勇等研究了一种基于可注射温敏性壳聚糖水凝胶的组 织工程产品,将壳聚糖、甘油磷酸钠和羟乙基纤维素混合制备得到 可携带促血管生长因子的可注射水凝胶,将水凝胶注射到动物心肌 梗死模型特定区域后观察其修复心肌梗死区域的情况,注射携带生 长因子的壳聚糖水凝胶的实验组明显提高了血管密度,降低了纤维 化程度,存活的心肌数量也有所增加。 4结束语 壳聚糖水凝胶因其具有的生物相容性、抗菌性、温度响应性、pH 相应性在生物医学领域应用广泛,在上述药物释放、医用敷料、组织 工程支架领域的研究已经取得了实质性的进展。中国在该领域的研 究处于世界领先水平,但在产业化中的推广仍有待加强。 参考文献 [1]舒静,李小静,赵大飙.壳聚糖智能水凝胶研究进展[J].中国塑料, 2010,24(9):6-10. f21孔立红,王洋岗,刘本.壳聚糖温敏水凝胶的制备及体外药物释放 的研究『J1.湖北中草药大学学报,2012,44(6):24—26. f31王玉杰,党奇峰,万辉琴,等.注射型壳聚糖温敏相变复合材料的 制备及性能研究『J1.功能材料,2014,45(S1):117—121. 『4]王华明,王江.壳聚糖伤13'敷料的研究进展fJ].华南热带农业大学 学报,2007,13(2):48—53. f5】符旭东,郭家平.壳聚糖类水凝胶在组织工程领域的研究进展[J]. 中国医院药学杂志,2010,30(15):1308—1310.
可注射水凝胶的研究进展一、水凝胶定义水凝胶是一类能够吸收并保有大量水分的具有交联网络结构的聚合物, 在聚合物网络结构中含有亲水基团或亲水的链段, 它们在水环境中能够与水结合, 从而形成水凝胶结构,这种水凝胶结构使得亲水的小分子能够在其中进行扩散。
原位可注射水凝胶是近年来出现的新型水凝胶体系。
通过注射的方法将具有一定流动性的生物材料植入体内, 因此很容易充满整个具有不规则形状的缺损部位, 手术创伤非常微小。
该体系可由酸碱度、温度的变化或者多价离子的存在而产生溶液 -凝胶相转变,或通过共价键而形成水凝胶。
二、水凝胶分类根据水凝胶对外界刺激的应答情况, 可以分为两类化合物:一类是传统的水凝胶高分子材料, 这类水凝胶对环境的变化相对不是很敏感; 而另外一类则是对外界条件非常敏感的水凝胶高分子材料, 这类水凝胶高分子材料由于对于不同的环境条件具有不同的应答表现, 因此可以作为一种新型的智能材料来使用, 具有良好的科研和市场应用前景。
智能型水凝胶是一种可以进行传感、处理并且具有执行功能的高分子材料, 作为一种新型的智能材料, 在诸多领域有着重要的用途。
根据对外界环境条件的刺激表现出不同的响应情况可以分为:温度敏感性的水凝胶高分子材料、对于 pH 敏感性的水凝胶高分子材料、对光敏感的水凝胶高分子材料、对压力敏感的水凝胶高分子材料、对于生物分子敏感的水凝胶高分子材料、对于电场敏感的水凝胶高分子材料等。
1、温度敏感性水凝胶这一类水凝胶高分子材料的溶胀与收缩性, 对于温度的变化具有非常高的敏感度,具体表现为在较低温度下溶胀度较高,在相对较高温度下溶胀度比较低。
该凝胶具有最低临界共溶温度 (LCST , 即溶胀度的变化和温度的变化并不是线性的,在某一温度下水凝胶的体积表现为突然的收缩和膨胀。
2、 pH 敏感性水凝胶水凝胶高分子材料对于 pH 的敏感性是指其溶胀或消溶胀作用是随着 pH 值的不同而进行变化。
具有 pH 响应性的水凝胶都是通过交联而形成大分子网络, 网络中含有酸性或碱性基团,随着介质 pH 值、离子强度改变,这些基团发生电离,导致网络内大分子链段间氢键的解离,引起不连续的溶胀体积变化。
3、光敏感性水凝胶水凝胶高分子材料的光敏感性是指水凝胶在受到光照的刺激下而发生的一种体积相互转变的现象。
除此之外还有磁性水凝胶、压力敏感性凝胶以及聚合物水凝胶等。
三、制备水凝胶的材料凡是水溶性或亲水性的高分子, 通过一定的化学交联或物理交联, 都可以形成水凝胶。
理想的材料都应具备以下条件:①良好的生物相容性。
②适当的生物降解性。
③具有三维立体多孔结构, 孔隙率最好达 90%以上, 且有很高的面积体积比。
④具有可塑性和较好的力学强度。
⑤材料表面微环境利于细胞黏附、增殖, 能激活细胞特异基因表达,维持细胞正常表型表达。
常用材料根据来源不同可分为天然材料、合成材料和复合材料。
1、天然材料天然材料往往是生物衍生的聚合物, 一般生物相容性良好。
天然高分子材料有淀粉、纤维素、甲壳素、壳聚糖、胶原、弹性蛋白、透明质酸盐、纤维素、海藻酸盐、葡聚糖、琼脂糖和明胶等。
但天然材料的质量会因产地及来源的不同而有所差异,存在着天然产品在批次之间性能和质量的重现性波动很大的缺陷。
(1纤维素衍生物(Cellulose derivatives低浓度(1~10wt%下,纤维素衍生物水溶液可在加热后形成凝胶。
甲基纤维素在40~50℃间时可形成不透明凝胶。
羟丙基甲基纤维素(HPMC 则在 75~90℃时发生相转变。
他们的相转变温度可通过物理或化学改性来降低。
比如, NaCl 的加入可以使甲基纤维素的相转变温度降低至 32~34℃。
同样,通过降低 HPMC 的羟丙基取代度,可以使它的转变温度降低到大约 40℃。
(2木葡聚糖(Xyloglucan木葡聚糖在特定条件下溶于水后可形成温敏型凝胶。
它主要由 (1, 4 -β-D-葡聚糖主链构成,支链为(1, 6 -α-D-木糖,部分为(1, 2 -β-D-乳糖所取代。
当木葡聚糖被β-半乳糖苷酶部分水解后,终产物在水溶液中可发生热可逆凝胶化, 而天然木葡聚糖则不会出现这种现象。
只有当半乳糖移除率达到 35%以上时才会发生凝胶化。
转变温度与聚合物分子浓度及半乳糖移除率成反相关。
(3壳聚糖(Chitosan壳聚糖的化学名称为聚葡萄糖胺 (1-4-2-氨基 -B-D 葡萄糖,在一般情况下, 壳聚糖只溶于酸性溶液中, 但是壳聚糖溶液中加入含羟基聚合物、碱性盐或是对壳聚糖为母体进行加成反应、衍生化和接枝反应,可得到具有温度敏感型或 pH 敏感型的壳聚糖基物理水凝胶; 其中温敏型水凝胶表现的特点是在生理 pH (7.4 及室温下保持溶液状态,而在温度升到 37℃时体温固化,原位形成凝胶。
壳聚糖具有良好的生物相容性、微生物可降解性和促进伤口愈合的功效, 广泛应用于生物医用领域。
壳聚糖作为生物材料在细胞培养方面可以增加细胞的粘附性, 当植入体内后可以促进分子聚集在移植物内。
由于壳聚糖的机械性能比较差,常常与其他材料复合才可以达到预期的目的。
2、合成材料合成材料大部分为生物可降解型合成高分子材料, 包括丙烯酸及其衍生物类(聚丙烯酸,聚甲基丙烯酸,聚丙烯酰胺,聚 N-聚代丙烯酰胺等、聚乙醇酸 (PGA、聚乳酸 (PLA以及它们的共聚物 PLGA 、聚己内酯 (PCL、聚羟基烷基酸酯 (PHA、聚酸酐、聚磷睛等。
合成材料可根据需求来进行分子设计,且性能的重现性好,可批量生产。
但同天然材料相比,其生物相容性较差。
聚 N-异丙基丙烯酰胺水凝胶,是一种典型的温度敏感性水凝胶,其低临界溶解温度(LCST 约在 32℃, LCST 可通过与其他单分子的共聚作用来调节。
这一高分子体系中存在两种氢键 : 水分子与高分子链之间的氢键和高分子链之间的氢键。
当外界温度低于 LCST 时 , 两种氢键的相互协调作用使得疏水基团周围形成一个稳定的束缚水分子的水合结构。
随着温度升高 , 水合结构破坏 , 疏水作用占主导 , 使凝胶中的束缚水变成自由水分子并向外扩散 , 凝胶发生相分离 , 内部结构塌陷 , 体积剧烈收缩 , 即水凝胶的温敏性相转变是由交联网络的亲 /疏水性平衡受外界变化而引起的。
3、复合材料各种天然材料、合成高分子材料、生物衍生材料既可单独用作支架材料,也可相互搭配或组合形成大量性质各异的复合材料。
复合材料可以很好地避开单一材料的缺点, 实现优势互补。
材料的生物活性取决于材料的组分。
水凝胶材料科学的组合、合适的成分对种子细胞的粘附、生长、分化及自身的活性等都极为关键。
四、水凝胶的形成机理水凝胶的形成主要有物理交联和化学交联两种主要途径。
物理交联型水凝胶是指由于分子缠结和离子、氢键、疏水相互作用的存在而形成的网络结构。
大致可分为离子交联型和温度响应型两种。
形成物理交联水凝胶的条件之一就是体系中物理交联点的形成。
物理交联点的形成可以通过多种方式,如离子间的相互作用、疏水相互作用、结晶及氢键作用等。
化学交联型水凝胶是运用传统合成的方法或光聚合、辐射聚合等技术, 引发共聚或缩聚反应产生共价键而形成的共价交联网络。
化学交联水凝胶结构比较稳定,强度较高,反应可控制性较好,易于操作,但由于需其它物质参与,并伴有化学反应,因此会对细胞的影响较大。
五、水凝胶的检测参数在选择或合成适当的水凝胶支架材料时, 应综合考虑物理性能、传质性能和生物相互作用,这些性能或设计参数由支架的用途和植入部位的环境来决定。
实验中测定的参数有:(1傅里叶红外光谱法 (FTIR采用红外光谱仪,用 KBr 压片技术分析原料及合成材料的主要特征官能团及化学键的变化和相互作用。
(2内部结构测定采用扫描电镜观察水凝胶内部网络状结构的分布等结构特征。
(3孔隙率和孔径的测定采用溶液替代法计算不同水凝胶的孔隙率。
选用体积为 10mL 的离心管, 装满乙醇。
首先测量水凝胶的体积和干重, 然后将干样放于盛有等体积乙醇的离心管中,一定时间后取出水凝胶样品称重 ,计算水凝胶的孔隙率。
从水凝胶扫描电镜图中选择尽量不同的孔径,采用平均值的方法计算该水凝胶的表面孔径。
(4机械强度的测定采用电子万能材料试验机来测量水凝胶的压缩载荷和弹性模量。
首先将溶胶放于 10mL 的离心管中在 37℃条件下制备成一定直径一定长度的圆柱状水凝胶进行抗压试验。
(5凝胶时间的测定采用试管倒置的方法检测凝胶时间。
将配好的溶胶离心管中, 放于恒温金属浴或水浴锅中, 使用秒表计时, 凝胶时间为溶胶在离心管中流动至离心管倒置后不流动之间的时间。
在不同的温度梯度范围内检测该水凝胶的形成时间。
(6细胞毒性实验MTT 比色法实验是评价水凝胶体系中的浸提液有无潜在的细胞毒性。
MTT 商品名是噻唑蓝。
MTT 法又称 MTT 比色法, 是一种检测细胞相对存活率的方法。
用酶联免疫检测仪在 490nm 波长处测定外源性 MTT 被活细胞线粒体中琥珀酸脱氢酶还原后的甲瓒, 其光吸收值, 可间接反映活细胞数量。
在一定细胞数范围内, MTT 结晶形成的量与细胞数成正比。
CCK-8(cell-counting kit-8检测试剂盒是应用 WST-8取代 MTT 被还原, 在电子耦合试剂存在的情况下, 可以被线粒体内的一些脱氢酶还原生成橙黄色的甲瓒。
WST-8产生的甲瓒易溶解,且 WST-8化学性质更稳定, 因此实验结果相对更加稳定。
此外, WST-8相比于 MTT 线性范围较宽,灵敏度更高。
当细胞增殖越多、越快,则甲瓒产生量越多,颜色越深;反之,当内外因造成的细胞毒性越大, 则颜色越浅。
对于同样的细胞, 颜色的深浅和细胞数目呈线性关系。
应用酶标仪测定吸光值并进行统计学计算便可以获得细胞增殖(活性相关数据。
(7体外降解实验配制 50%的 I 型胶原酶和 0.25%胰蛋白酶液,干燥后的水凝胶材料称重紫外照射,在无菌操作条件下分别置于相同体积的酶液中,放于 37℃细胞培养箱中, 定期取样,真空冷冻干燥机干燥后称重。
(8体内组织相容性实验水凝胶材料的制备必须在无菌操作条件下,而且每种原材料必须是无菌的。
因此将制备好的材料用 1mL 的注射器注射入小鼠皮下,定期取样用中性甲醛固定。
① H&E染色将固定好的组织材料经过组织脱水后包埋、切片、 H&E染色等一系列的处理,然后置于光学显微镜下进行组织学观察。
②免疫组化免疫组化是应用免疫学基本原理即抗原抗体的反应 (抗原与抗体特异性结合的原理 ,通过化学反应来使标记抗体的显色剂(酶、荧光素、同位素、金属离子显色来确定组织细胞内抗原(蛋白质和多肽 ,并对抗原进行定位、定性及定量的研究, 称为免疫组织化学技术或免疫细胞化学技术。
通过免疫组化实验可以对组织进行一个更精确的形态学判断。