糖尿病动物模型
- 格式:docx
- 大小:10.67 KB
- 文档页数:5

糖尿病大鼠模型的建立101实验动物SD大鼠,体重200-250克,8周龄。
02实验试剂1)STZ(链脲佐菌素)无色固体2-8℃干燥避光保存,115℃可分解为气体水溶液不稳定,溶于双蒸水或盐溶液。
但在低温下pH4-4.5是较为稳定。
2)柠檬酸钠,柠檬酸用于调制缓冲溶液。
03实验器材1ml注射器,大鼠固定器。
04试剂配制1)柠檬酸-柠檬酸钠缓冲溶液(pH=4.5.0.1mol/L)配制0.1mol/L柠檬酸钠溶液,在用柠檬酸和氢氧化钠调节pH至4.5。
2)称量140mgSTZ溶解于10ml柠檬酸-柠檬酸钠缓冲溶液,配制成14mg/mlSTZ溶液。
05动物分组及造模1)大鼠自由摄食,饮水,动物房保持室温20-25℃,并维持一定的光照。
三天后,将大鼠随机分为实验组和对照组。
2)所有大鼠实验开始前12小时开始禁食但不禁水,禁食时间可根据情况顺延至18小时,但不要超过24小时。
3)将配置好的STZ溶液用锡箔纸包裹做避光处理并保存在冰水中,并在配制成功后30分钟内完整注射造模。
4)称量大鼠体重,采用腹腔注射给药进行造模,剂量为70mg/kg。
对照组注射等量的柠檬酸-柠檬酸钠缓冲溶液。
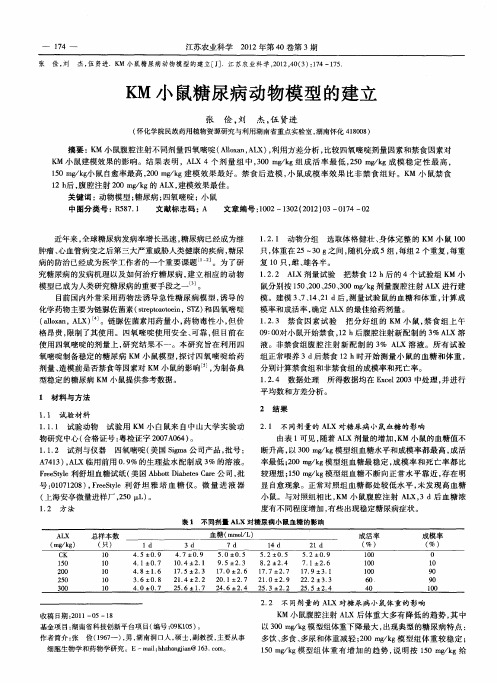
06模型指标检测血糖测定:实验过程中腹腔注射STZ 48小时和72小时分段测定大鼠血糖并记录,采用剪尾采血法,使用血糖试纸进行检测。
※两次检测血糖浓度均高于16.8mmol/ml,即可认为造模成功。
07后期饲养糖尿病大鼠会有很明显的“三多一少”症状,所以尽量分笼饲养,勤换垫料,并保证足够的饲料和饮水供给。
糖尿病大鼠慢性溃疡伤口模型201实验动物SD糖尿病大鼠(八周以上大鼠,并糖尿病造模时间超过1周并少于2周)普通SD大鼠(八周以上,时间相近)。
02实验试剂1)水合氯醛(或戊巴比妥钠)用于麻醉实验大鼠。
2)医用酒精,表层消毒。
3)龙胆紫(或苦味酸,碘酊)创口标记染液。
4)试纸,标记创口,提前裁成直径为2cm的小圆片,并浸入标记染液中。

糖尿病动物模型研究进展王瑶:贵州中医药大学第一附属医院通讯作者:秦学维:贵州中医药大学第一附属医院摘要:糖尿病是全球高发的慢性病,可引起多种并发症,糖尿病动物模型对于我们研究其发病机制、病程及治疗具有重要意义。
T1DM以及T2DM是最常见的糖尿病类型,本文主要对这两种类型的糖尿病动物模型进行综述,以期为糖尿病动物模型的制作提供更多的参考。
关键词:糖尿病,糖尿病并发症,动物模型Abstract: Diabetes is a chronic disease with high incidence in the world, which can cause a variety of complications. Animal models of diabetes are of great significance for us to study its pathogenesis, course and treatment. T1DM and T2DM are the most common types of diabetes. This article mainly reviews these two types of diabetes animal models in order to provide more references for the production of diabetes animal models.Key words: diabetes, diabetes complications, animal models糖尿病的患病率和病死率逐年增加,在我国是继心血管疾病和肿瘤之后位列第三位的多发病和慢性非传染性疾病[1]。
美国糖尿病协会2022年糖尿病指南将糖尿病分为四个大的类型(T1DM、 T2DM、由于其他原因导致的特定类型的糖尿病、妊娠期糖尿病(GDM))。
然而T1DM以及T2DM仍是最常见的糖尿病类型。


目录目录I型糖尿病模型建立 (1)链脲佐菌素 (4)四氧嘧啶 (5)II型糖尿病模型建立 (6)建模方法 (6)胰岛素抵抗动物模型 (7)参考文献 (8)糖尿病动物模型建立摘要:本文通过收集相关文献总结糖尿病模型的建立方法。
关键词:糖尿病模型,鼠前言:在生物医学研究的进展过程中常常依赖于使用动物模型作为实验假说和临床假说两者的试验基础,主要有以下几个优点:1.避免了在人身上进行试验所带来的风险,包括伦理学上的相关问题2.可以严格控制实验条件,增强实验材料的可比性4.可以简化实验操作和样品收集。
从实用性出发,本文重点介绍大鼠诱发性糖尿病模型的建立。
科技前沿:日本东京大学的研究人员在新研究中发现一种名为AdipoRon化合物,它能够减轻吃高脂肪食物的小鼠和遗传性肥胖小鼠的胰岛素抗性和葡萄糖耐受不良[8]。
中科院:发现了2型糖尿病重要的早期生物标记物[9],也有学者认为可以用果蝇制作人体糖尿病模型,不过相关报道较少[11], 乌克坦(Yucatan)[14]小型猪(亦称墨西哥无毛猪)也是糖尿病研究中一个很好的动物模型,只需一次静脉注射水合阿脲(alloxan monohydrate)200 mg/kg体重,就可以产生典型的急性糖尿病。
其临床体征包括高血糖、剧渴、多尿和酮尿等。
[12]灵长类动物猕猴,主要用于病因学、遗传学、神经系统、细胞生化及药物鉴定等方面研究,这样的动物模型,研究人类糖尿病会更接近自然,结果也比较理想,但因价格昂贵,难以得到,国内较少使用。
[13]Ⅰ型糖尿病模型建立1.1手术切除胰腺手术切除胰腺后,动物缺乏胰岛素而出现高血糖。
全部切除胰腺,可制成无胰性糖尿病动物模型,需补充外源性胰酶。
全部切除胰腺,除可引起高血糖外,并可致酮症酸中毒和死亡,故一般主张切除75%~90%的胰。
1.2病毒诱导胸心肌炎病毒D变异体和M变异体均致糖尿病肾病的作用,对其敏感的的动物品系有DBA及DBA/2小鼠,其作用机制与其感染动物后破坏胰岛β细胞有关。

糖尿病视网膜病变的动物模型435500湖北黃梅眼科医院关键词糖尿病视网膜病变动物模型模型制作方法及病理特征自发性遗传性动物模型:①OLETF大鼠:OLETF大鼠可自发性产生糖尿病,发病率有性别差异,25周龄雄性大鼠一般100%。
5个月时,可观察到内核层细胞由3~4排减少为2排,感光细胞层细胞由8排减少到3~6排,色素上皮层细胞高度降低,基底膜周折发育迟缓,视网膜毛细血管基底膜增厚,并可观察到毛细血管内皮细胞的损害。
②STD大鼠:STD大鼠是Ⅱ型糖尿病动物模型,它是SD大鼠的亚型,能自然发生糖尿病,在鼠龄20周左右时发病,不用胰岛素治疗也能存活很长一段时间。
眼底的并发症有新生血管形成、牵拉性视网膜脱离等类似于人类增殖性视网膜病变。
55周龄时可观察到血管异常和糖尿病性牵拉性视网膜脱离的发生,但视网膜出血不常见;电镜检查发现视网膜基底膜增厚。
③GK大鼠:通过对大鼠进行口服葡萄糖耐量实验并筛选高血糖的个体培育而来,为Ⅱ型糖尿病动物模型。
Matsubara等【sup】[1]【/sup】对GK大鼠的电生理研究表明,从4周开始糖尿病GK大鼠的a波、b波及Ops振幅下降,a波潜伏期延长,提示糖尿病早期感光细胞即受到损伤,但未观察到视网膜病变。
药物诱发性动物模型:①ALX诱导的动物模型:使用ALX诱导的犬糖尿病视网膜病变的过程,实验犬可出现视网膜血流速度下降和代谢改变。
出现糖尿病5年后,犬糖尿病视网膜病变在形态上与糖尿病患者非常相似,都表现出毛细血管瘤、非细胞性毛细血管形成和周细胞鬼影等。
②STZ诱导的动物模型:STZ 可采用静脉或腹腔注射。
Hammes等【sup】[2]【/sup】观察到STZ诱导SD鼠24周时视网膜毛细血管数量显著增多,而周细胞数较正常鼠减少47%,至56周上述改变更为明显,且毛细血管基底膜显著增厚,而血管瘤最早在32周出现。
讨论诱导型动物模型糖尿病视网膜病变程度与胰岛素缺乏有关,发病严重程度不易控制,但优点是造模简便,发病迅速。
Ⅱ型糖尿病动物模型研究进展摘要: 糖尿病是以高血糖为主要标志的内分泌代谢性疾病,是严重威胁人类健康的主要慢性病之一,而Ⅱ型糖尿病占糖尿病总数的90%~95%左右。
建立合适的Ⅱ型糖尿病动物模型是阐明其发病机制的前提条件。
因此,该文综述了目前国内外糖尿病研究中常用的动物模型,对发展新型Ⅱ型糖尿病动物模型的研究提供参考价值。
关键词:Ⅱ型糖尿病;动物模型;模型构建Research Progress about the Construction of TypeⅡ Diabetic Animal ModelLIU Shu—Yun(Lab of Transplant Engineering and Immunology West China Hospital,Sichuan University 2013224070006)Abstract: Diabetes mellitus,the endocrine and metabolic diseases,is characterized by hyperglycemia. It is one of the most prevalent chronic diseases that threat to human health,and type 2 diabetes accounted for 90% -95% of the total diabetes. The animal model of type 2 diabetes provide the important precondition to many scholars in study of the pathogenesis and mechanism of diabetes.Therefore,this article reviews a number of animal models of T2DM commonly used according to the articles that have been published both inside country and abroad,which will provide reference for the development of type II diabetic animal models.Key Words:Type Ⅱ Diabetes Mellitus, Animal model,Model construction糖尿病( Diabetes mellitus,DM) 是以高血糖为主要标志的内分泌代谢性慢性疾病,其严重威胁着人类健康。
糖尿病(diabetes mellitus ,DM)已成为严重危害人类健康的公共卫生问题,DM及其并发症不仅严重影响糖尿病患者的生活质量,同时也是致残、致死的重要原因。
因此,建立合适的糖尿病动物模型,阐明DM及其并发症的发病机制就显得尤为重要。
目前,DM动物模型制备方法主要有:①手术切除胰腺;②化学药物诱导;③自发性糖尿病动物模型;④转基因动物等。
【切除胰腺的DM模型】常采用狗、猫和大鼠等造模,全部或大部分切除实验动物的胰腺,但保存胰十二指肠动脉吻合弓。
如果连续两天血糖值超过11.1mmol/L或行葡萄糖耐量试验120min时的血糖值仍未恢复到注射前水平则认为DM造模成功。
其机制是全部或大部分切除胰腺后,β细胞缺如而产生永久性DM。
【化学药物诱发的DM模型】采用链脲佐菌素腹腔注射或四氧嘧啶静脉注射可诱发DM,常用动物有小鼠、大鼠、家兔和狗。
链脲佐菌素(streptozotocin STZ)的参考剂量为50~150mg/kg;四氧嘧啶(alloxan)的参考剂量为60~110mg/kg。
STZ是一种含亚硝基的化合物,进入体内可通过以下机制特异性地破坏胰岛β细胞:①STZ直接破坏胰岛β细胞:主要见于注射大剂量STZ后。
STZ注射后可引起β细胞内辅酶I(NAD)的浓度下降,NAD依赖性能量和蛋白质代谢停止,导致β细胞死亡。
②通过诱导一氧化氮(NO)的合成,破坏胰岛β细胞;③STZ激活自身免疫过程,进一步导致β细胞的损害:小剂量注射STZ可破坏少量胰岛β细胞,死亡的胰岛β细胞可作为抗原被巨噬细胞吞噬,产生TH1刺激因子,使TH1细胞系占优势而产生IL-2及IFN-γ,在胰岛局部促使炎性细胞浸润,并活化释放IL-1、TNF-α、IFN-γ、NO 和H2O2等物质杀伤细胞。
死亡细胞又可作为自身抗原,再次递呈给抗原递呈细胞进行处理,释放细胞因子,放大细胞损伤效应,最终诱发DM[1]。
四氧嘧啶进入体内后能迅速被胰岛β细胞摄取,影响细胞膜的通透性和细胞内ATP的产生,抑制葡萄糖介导的胰岛素分泌。
链脲佐菌素(Streptozocin,STZ )诱发糖尿病动物模型的原理:STZ对一定种属动物的胰岛β细胞有选择性破坏作用,能诱发许多动物产生糖尿病,一般采用大鼠和小鼠制造动物模型。
国外有学者报道选用雄性大鼠制造模型的成模率明显高于雌性大鼠。
1型糖尿病与2型糖尿病动物模型的制备与STZ注射的剂量有关系:大剂量注射时,由于直接引起胰岛β细胞的广泛破坏,可造成1型糖尿病模型;而注射较少量STZ时,由于只是破坏一部分胰岛β细胞的功能,造成外周组织对胰岛素不敏感,同时给予高热量饲料喂养,两者结合便诱导出病理、生理改变都接近于人类2型糖尿病的动物模型。
造膜前的喂养:Ⅰ型糖尿病模型成模比较快,通常大鼠在普通饲料适应性喂养2周后即可开始造模。
Ⅱ型糖尿病模型:高脂饮食诱导加小剂量STZ。
造模前喂以高脂(高糖)饲料,诱发出胰岛素抵抗。
高脂(高糖)饲料:高脂(高糖)饲料成分:其中含10蔗糖,10猪油,5胆固醇。
由基础鼠饲料加蔗糖、炼猪油和蛋黄按比搭配制作高脂高糖饲料:其比例为猪油18 ,蔗糖20 ,蛋黄3 ,基础饲料59 。
预实验的重要性:很重要。
实验时STZ的给药量应参照预实验的结果,尽量不要盲目按照文献上或他人的给药量来直接使用,鼠均重和空腹(低糖状态)抗药力、禁食时长、注射选时、以及之前饲养过程、测糖选时等都不相同,通过预实验来确定符合自己实验鼠的给药计量,才是最科学的。
常用给药剂量:Ⅰ型糖尿病模型:大鼠剂量为70~65mg/KgⅡ型糖尿病模型:高糖高脂喂养1~2 个月的大鼠,STZ 剂量在25~40mg/Kg 。
或参考文献(鼠均重不同,本剂量以200克均重为例)。
配置STZ液:柠檬酸缓冲液的配制:柠檬酸(FW:210.14) 2.1g加入双蒸水100mL中配成A液;柠檬酸钠(FW:294.10)2.94g加入双蒸水100mL中配成B液。
用时将A、B液按一定比例混合(1:1.32也有按1:1的),PH计测定ph值,调节ph=4.2-4.5,即是所需配置STZ的柠檬酸缓冲液。
糖尿病的动物模型摘要:综述糖尿病动物模型研究进展,并对目前科研中常用的糖尿病动物模型制备方法、机制进行综述,并简略评价其优缺点。
目前国内外糖尿病动物模型的制备方法很多,各有其特点,大体可以分为实验性糖尿病动物模型、自发性糖尿病模型等。
其研究的不断进展,为深入探讨糖尿病病因、病机及其药物治疗提供了借鉴。
关键词:糖尿病动物模型自发性目前国内为研究人类糖尿病的预防与治疗,通过多种方法获得糖尿病的模型动物,自Minkowshi 等用切除狗胰腺的方法建立糖尿病动物模型已经有多年的历史,目前糖尿病动物模型通常分诱发性和自发性2类,主要用于药物筛选、病理改变等方面研究[1]。
1.实验性糖尿病动物模型1.1利用化学物致胰岛细胞损伤1.1.1 四氧嘧啶:能选择性破坏多种属动物的胰岛β细胞,引起实验性糖尿病。
将四氧嘧啶用生理盐水新鲜配制成浓度为1%~3%溶液,实验大鼠空腹12 h尾静脉1次注射40 mg·kg-1,血糖值可出现3个时限变化,注射后2~4 h为初期高血糖相,约6 h左右为低血糖,12 h后出现持续高血糖伴多饮、多尿等,并且血糖达16.7 mmol·L-1以上,稳定2周后可作为成功模型,造模最初成功率约85%;最终成功率约60%[2]。
1.1.2 链尿佐菌素:链尿佐菌素是一种药效强大的烷化剂,能干扰葡萄糖的转运,影响葡萄糖激酶的功能,诱导DNA双链的断裂[3]。
1.2病毒感染:利用脑心肌炎病毒(EMC—M)病毒及柯萨奇病毒接种小鼠可以引起β细胞脱颗粒而致糖尿病。
为1型糖尿病原型。
但此模型成功率低,目前较少采用。
1.3 注射激素诱发糖尿病:给动物注射糖皮质激素、生长激素、甲状腺素、胰高血糖素等拮抗胰岛素的作用,可制备内分泌性糖尿病动物模型[4]。
糖皮质激素和胰高血糖素促进糖原异生,抑制外周组织葡萄糖的利用即降低胰岛素的效能;生长激素使外周组织利用葡萄糖发生障碍,对胰岛素敏感性降低,刺激β细胞过度分泌,终致衰竭产生糖尿病。
糖尿病动物模型
糖尿病是一种终生的
长期性的, 以不能维持正常血糖稳态为特点的代 谢性疾病。糖尿病分类繁
多,但最主要的有 I 型糖尿病和 II 型糖尿 病(Type 2 Diabetes
Mellitus , T2DM。目前认为II型糖尿病的 基本机制是B细胞分泌胰岛素相
对或绝对不足。 动物模型被越来越多
地用于研究T2DM但是糖尿病动物模型众多,各有优劣。选择合适 的动物模型
对糖尿病研究至关重要。
在动物选择上 ,主要以哺乳动物为主 ,啮齿鼠类使用量最大 ,应用最广 , 主
要用于药物筛选、 病理改变等方面研究。 家兔主要用于糖尿病性高 脂血症
等方面。近年来,小型猪产生兴趣,如Yucatan小型猪越来越受 到重视 , 因
为其消化系统的器官功能更接近人类 , 且具有自发性糖尿 病倾向,只需单次
注射四氧嘧啶200mg,常能诱发隐性遗传为显性遗传, 发病 1 年内可产生眼
底微血 管增殖型改变等。
1.
动物选择
主要以哺乳动物为主。啮齿鼠类使用量最大,应用最广;家兔主要用 于糖尿
病性高脂血症等方面的研究。 近年来, 如 Yucatan 小型猪因其 与人类更加
接近的消化系统而越来越受到重视, 且小型猪有自发性糖 尿病倾向。
2.
几种常用的啮齿类动物模型
2.1.
肥胖模型
2.1.1.
瘦素相关基因改变诱导的动物模型
ob/ob
2.1.1.1.
Lep 小鼠
背景为C57BL/6J,为位于6号染色体的Lepob等位基因突变 形成自发
性的纯合子糖尿病小鼠。 该小鼠从 4 周开始呈现出肥 胖,之后体重
急速增加。出现肥胖后,该小鼠饮食过量,呈现 高血糖、高胰岛素血
症、妊娠能力低下、代谢低下等特征。
db/db
2.1.1.2.
Lep 小鼠
背景为 C57BLKS/J, 为位于 4号染色体的 Lerpdb 等位基因突 变形
成自发性的纯合子糖尿病小鼠。 该小鼠从 3-4 周开始呈现 出肥胖体
征 . ,血胰岛素从 10-14 天开始增加,血糖值从 4-8 周开始急速增
加。呈现出多饮,多食,多尿的临床表现。血糖 开始上升后,胰岛的
分泌胰岛素的B细胞消耗严重。 这类小鼠
平均寿命约 10 个月,末梢神经系统, 心血管系统, 免疫系统, 糖
尿病性肾病等多个系统均可观察到病理变化。
2.1.1.3.
Zucker 肥胖大鼠 /Zucker 肥胖糖尿病大鼠
由Merck M-strain 和sherman大鼠杂交而来的大鼠。其染色
体的 Leprfa 等位基因突变形成自发性的纯合子糖尿病大鼠。 4 周开
始呈现出肥胖, 10 周开始体重急速增加,多伴有多食。 该大鼠还有
高脂血症、 高胰岛素血症、 高瘦素血症、 妊娠能力 低下代谢低下
等临床特征。 该大鼠模型的脂肪细胞的数量和体 积增加,限制食物
量也可以导致体重过度增加和过度的脂肪堆 积。空腹时,血糖值一般
在正常范围内
2.1.2.
多基因诱导的模型
2.1.2.1.
KK-A 小鼠
KK-A
Y
小鼠是典型的自发性II型糖尿病模型小鼠,具有过量饮 食、肥
胖、高血糖、高胰岛素血症、胰岛素抵抗、脂质代谢紊 乱、葡萄糖不
耐受等临床特点。
2.1.2.2.
TallHo/Ing 小鼠
2.1.2.3.
Otsuka Long Evans Tokushima Fat rat
Long-Evans系大鼠建立的自发性2型DM莫型动物。该大鼠有 多食、
肥胖、多饮和多尿等临床特征, 能缓慢地自然产生 2 型
DM自8周起血清甘油三酯、胆固醇和餐后血糖身高,随着年 龄的增
长,血清甘油三酯和餐后血糖不断升高。从 12周起出 现明显的胰岛
素抵抗。尿蛋白自 30 周龄起明显增多,且随年 龄的增加而迅速增
加,该模型大鼠胰腺呈进行性纤维化。在
22 周龄时,可出现肾小球基底膜增厚;以上胰腺和肾脏不同
阶段的病理变化,与临床2型DM患者的病理表现极为相似。
2.1.3.
饮食诱导的模型
饮食也可诱导出糖尿病模型。比如,通过长期用含果糖饮食喂 养大
鼠,可制成糖尿病模型,大鼠会出现体重上升,血中胰岛 素上升,糖
耐量受损,及胰岛素耐受实验呈阳性。
B
细胞功能/数量改变导致的糖尿病模型
Goto-Kakizaki (GK 大鼠
GK大鼠自3〜4周龄起开始发生明显的高血糖。在高血糖发生 前,常有
一段血糖正常时期,类似人类的 DM前期。此期具有葡 萄糖刺激的胰岛
素分泌受损、B细胞数目减少、胰岛素的敏感 性降低、胰岛素抵抗等特
征。GK大鼠血压也较正常wistar大 鼠高。此外,该模型大鼠具有与人
类2型DM微血管并发症相似 的改变如运动神经传导速率减慢、神经纤
维有节段性脱髓鞘、 轴突变性、视网膜血管内皮生长因子(VEGF表达增
加、视网 膜局部血流减少、白蛋白尿、肾小球基底膜增厚、肾小球肥
大 和硬化等改变。
链脲佐菌素诱导的糖尿病
用链脲佐菌素腹腔注射或四氧嘧啶静脉注射可诱发糖尿病,常 用动物
有小鼠、大鼠、家兔和狗。四氧嘧啶进入体内后能迅速 被胰岛B细胞
摄取,影响细胞膜的通透性和细胞内 ATP的产生, 抑制葡萄糖介导的
胰岛素分泌。四氧嘧啶主要通过产生氧自由 基破坏B细胞结构,导致
细胞的损伤及坏死,从而阻碍胰岛素 的分泌,使血清胰岛素水平降
低。因为四氧嘧啶导致糖尿病的
同时也造成肝、肾组织中毒性损害并且部分采用四氧嘧啶制造
2.2.
2.2.
2.2.2
的DM动物模型可自发缓解,因此目前已经很少应用。
2.2.3.
Pancreatectomy
切除全部或大部分胰腺,到保存胰十二指肠动脉吻合弓,可制
作出糖尿病模型。其机制是切除胰腺后,B细胞缺失而产生永
久性糖尿病。