2020新突破化学选修三人教版第1章第二节第1课时原子结构与元素周期表Word版含解析
- 格式:doc
- 大小:521.00 KB
- 文档页数:18

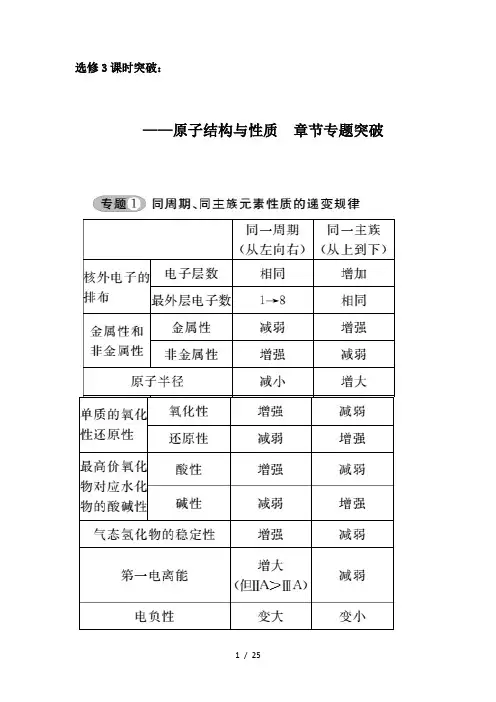
选修3课时突破:——原子结构与性质章节专题突破【例1】已知某元素原子的下列结构或性质,能确定其在周期表中位置的是( )A.某元素原子的第二电子层电子排布图为↑↓B.某元素原子在某种化合物中的化合价为+4C.某元素的原子最外层上电子数为6D.某元素原子的外围电子排布式为5s25p1【解析】A项错误,所给的第二电子层为充满结构,不能确定其第二层以外是否还有电子;B项错误,仅凭化合价不能确定元素所在的周期和族;C项错误,据最外层电子数为6仅能确定该元素所在主族,不能确定其所在周期;D项已明确给出了原子的外围电子排布,即可顺利找到元素所在的周期和族,这是铟(In)元素。
【答案】 D专题2 元素的原子半径、离子半径大小的比较规律1.原子半径大小的比较(1)同周期元素的原子半径随原子序数的递增逐渐减小(稀有气体除外)。
如第三周期元素的原子半径由大到小的顺序为:Na>Mg>Al>Si>P>S>Cl。
(2)同主族元素的原子半径随原子序数的递增逐渐增大。
如ⅠA 主族元素的原子半径由大到小的顺序为:Cs>Rb>K>Na>Li。
2.原子半径、离子半径大小的比较阳离子半径总比原子半径小,阴离子半径总比原子半径大。
如Na+<Na,S2->S。
3.离子半径大小的比较(1)同周期元素的阳离子半径随原子序数的递增逐渐减小(稀有气体除外),如第三周期元素:Na+>Mg2+>Al3+;阴离子半径随原子序数的递增也逐渐减小。
如第三周期元素:P3->S2->Cl-。
(2)同主族元素的阳离子半径、阴离子半径随原子序数的递增都逐渐增大。
如ⅠA元素:Cs+>Rb+>K+>Na+>Li+;ⅦA元素:F-<Cl-<Br -<I-。
(3)电子层结构相同的离子半径随原子序数的递增而减小。
如S2->Cl->K+>Ca2+,F->Na+>Mg2+>Al3+。




姓名,年级:时间:课时作业3 原子结构与元素周期表[练基础]1.关于元素周期律和元素周期表的下列说法中正确的是()A.目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现B.按原子的电子排布,可将周期表分为5个区C.俄国化学家道尔顿为元素周期表的建立作出了巨大贡献D.同一主族的元素从上到下,金属性呈周期性变化2.某元素位于周期表中第四周期ⅤA族,则该元素的名称和价电子排布式均正确的是()A.砷,4s24p3B.溴,4s24p5C.磷,4s24p3 D.锑,5s25p33.元素周期表中,非金属元素存在的区域为( )A.只有s区B.只有p区C.s区,d区和ds区 D.s区和p区4.下列各组元素属于p区的是( )A.原子序数为1、2、7的元素B.O、S、PC.Fe、Ar、ClD.Na、Li、Mg5.下列说法中正确的是( )A.所有金属元素都分布在d区和ds区B.最外层电子数为2的元素都分布在s区C.元素周期表中ⅢB族到ⅡB族10个纵列的元素都是金属元素D.s区均为金属元素6.如下图所示是元素周期表的一部分(表中数字和X代表原子序数),其中X的电子排布式为[Ar]3d104s24p5的是( )7.最活泼的金属、最活泼的非金属、常温下呈液态的金属(价电子排布为5d106s2)分别位于下面元素周期表中的()A.s区、p区、ds区B.s区、p区、d区C.f区、p区、ds区D.s区、f区、ds区8.具有以下结构的原子,一定属于主族元素的是() A.最外层有1个电子的原子B.最外层电子排布为n s2的原子C.最外层有3个未成对电子的原子D.次外层无未成对电子的原子9.某元素的最外层电子数为2,价电子数为5,并且是同族中原子序数最小的元素,关于该元素的判断错误的是( ) A.电子排布式为1s22s22p63s23p63d34s2B.该元素为ⅤC.该元素为ⅡA族元素D.该元素位于d区10.具有下列电子层结构的原子,其对应的元素一定属于同一周期的是( )A.两种元素原子的电子层上全部都是s电子B.3p能级上只有一个空轨道的原子和3p能级上只有一个未成对电子的原子C.最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子D.原子核外的M层上的s、p能级上都填满了电子,而d 轨道未排电子的两种原子11.钛号称“崛起的第三金属”,因具有密度小、强度大、无磁性等优良的机械性能,被广泛应用于军事、医学等领域。





第一章原子结构与性质一。
原子结构1、能级与能层2、原子轨道3、原子核外电子排布规律(1)构造原理:随着核电荷数递增,大多数元素的电中性基态原子的电子按右图顺序填入核外电子运动轨道(能级),叫做构造原理。
能级交错:由构造原理可知,电子先进入4s轨道,后进入3d轨道,这种现象叫能级交错.(说明:构造原理并不是说4s能级比3d能级能量低(实际上4s能级比3d能级能量高),而是指这样顺序填充电子可以使整个原子的能量最低。
)(2)能量最低原理原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理.(3)泡利(不相容)原理:一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓"表示),这个原理称为泡利原理。
(4)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特规则。
比如,p3的轨道式为,而不是。
洪特规则特例:当p 、d 、f 轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。
即p0、d0、f0、p3、d5、f7、p6、d10、f14时,是较稳定状态.前36号元素中,全空状态的有4Be 2s22p0、12Mg 3s23p0、20Ca 4s23d0;半充满状态的有:7N 2s22p3、15P 3s23p3、24Cr 3d54s1、25Mn 3d54s2、33As 4s24p3;全充满状态的有10Ne 2s22p6、18Ar 3s23p6、29Cu 3d104s1、30Zn 3d104s2、36Kr 4s24p6。
4、基态原子核外电子排布的表示方法(1)电子排布式①用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式,例如K :1s22s22p63s23p64s1.②为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的元素符号外加方括号表示,例如K :[Ar]4s1。
元素周期律学习·理解1.以下关于原子序数的说法正确的是( )A.原子序数与原子核电荷数一定相等B.原子序数与微粒的核外电子数一定相等C.原子序数相同的原子是同一种原子D.原子序数为16,核外电子数也为16的原子,其质量数为32答案 A解析A正确;B错误,微粒不一定是原子,它可以是阴离子、阳离子或原子团;C错误,有同位素存在;D错误,质量数是质子数和中子数之和。
2.下列关于元素周期律的叙述正确的是( )A.随着元素原子序数的递增,原子最外层电子数总是从1到8重复出现B.随着元素原子序数的递增,同周期从左到右原子半径从小到大(稀有气体元素除外)发生周期性变化C.随着元素原子序数的递增,元素最高化合价从+1到+7、最低化合价从-7到-1重复出现D.元素原子核外电子排布的周期性变化是导致原子半径、元素主要化合价和元素性质周期性变化的主要原因答案 D解析从第2周期开始,随着元素原子序数的递增,原子最外层电子数是从1到8重复出现,但在第一周期,随着元素原子序数的递增,原子最外层电子数是从1到2,A错误;随着元素原子序数的递增,同周期从左到右原子半径从大到小(稀有气体元素除外)发生周期性变化,B错误;随着元素原子序数的递增,一般情况下同周期主族元素的最高化合价从+1到+7、最低化合价从-4到-1重复出现,C错误;元素性质的周期性变化是元素原子核外电子排布周期性变化的必然结果,D正确。
3.已知N、O、Si、S四种元素原子的半径数据如下表:A.80 pm B.110 pmC.120 pm D.70 pm答案 B解析同周期主族元素随原子序数增大,原子半径减小,同主族元素自上而下原子半径增大,故原子半径:S<P<Si,则P原子半径可能为110 pm。
4.下列有关结构和性质的说法中正确的是( )A.金属元素的化合价均不会超过+4B.同一横行元素随着原子序数的递增,原子半径逐渐减小C.元素原子的最外层电子数越多,越容易得电子,非金属性越强D.核外电子排布相同的简单离子,核电荷数越大,离子半径越小答案 D解析元素的化合价与最外层电子数有关,因此金属元素的化合价可以超过+4,例如Sb 的最高价是+5价,A错误;同周期主族元素随着原子序数的递增,原子半径逐渐减小,B错误;元素原子的最外层电子数越多,不一定越容易得电子,非金属性不一定越强,例如Br原子最外层电子数为7,O为6,但非金属性:O>Br,C错误;核外电子排布相同的简单离子,离子半径随原子序数的增大而减小,即核电荷数越大,离子半径越小,D正确。
第二节 原子结构与元素的性质 第1课时 原子结构与元素周期表 学业要求 素养对接 1.知道元素周期表中分区、周期和族的元素原子核外电子排布特征,了解元素周期表的应用价值。 2.能从原子价电子数目和价电子排布的角度解释元素周期表的分区、周期和族的划分。
模型认知:建构元素周期表模型,并利用模型分析和解释一些常见元素的性质。 微观探析:从微观角度解释元素周期表的分区、周期和族的划分。
[知 识 梳 理] 一、元素周期表的结构 1.周期(横行)
短周期
第一周期:2种元素第二周期:8种元素第三周期:8种元素
长周期
第四周期:18种元素第五周期:18种元素第六周期:32种元素第七周期:32种元素 2.族(纵行)
主族;ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA共七个主族副族:ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB共七个副族第Ⅷ族:三个纵行(8、9、10),位于ⅦB与ⅠB之间0族:稀有气体元素 3.元素的分区 (1)按电子排布,把周期表里的元素划分成5个区,分别为s、p、d、f、ds。 (2)元素周期表共有16个族,其中s区包括ⅠA、ⅡA族,p区包括ⅢA~ⅦA、0族,d区包括ⅢB~ⅦB族及Ⅷ族(镧系、锕系除外),ds区包括ⅠB、ⅡB族,f区包括镧系元素和锕系元素。 【自主思考】 1.由碱金属元素在周期表中的位置和价电子排布式,可以看出碱金属元素所在的周期与电子层数有何关系? 提示 碱金属元素的周期数=电子层数。 二、元素周期系 1.碱金属元素基态原子的核外电子排布 碱 金属 原子 序数 周期 基态原子的 电子排布式 基态原子的 电子排布图
锂 3 二 1s22s1或[He]2s1
钠 11 三 1s22s22p63s1或 [Ne]3s1
钾 19 四 1s22s22p63s23p64s1或[Ar]4s1
铷 37 五 1s22s22p63s23p63d104s24p65s1或 [Kr]5s1 —
铯 55 六 [Xe]6s1 — 2.元素周期系形成的原因 元素周期系的形成是由于元素的原子核外电子的排布发生周期性的重复。随着元素原子的核电荷数递增,每到出现碱金属,就开始建立一个新的电子层,随后最外层上的电子逐渐增多,最后达到8个电子,出现稀有气体;然后又开始由碱金属到稀有气体,如此循环往复——这就是元素周期系中的一个个周期。 三、元素周期表的分区 1.按电子排布式中最后填入电子的能级符号可将元素周期表分为s、p、d、f四个区,而ⅠB、ⅡB族的元素的核外电子因先填满(n-1)d能级而后再填充ns能级而得名ds区。如下图:
2.元素周期表中,非金属元素处于元素周期表的右上角位置,金属性强的元素处于元素周期表的左下方位置。 【自主思考】 2.结合元素周期表,分析各族元素的族序数与价电子排布的关系。 提示 主族元素的价电子排布为ns1~2或ns2np1~5,族序数等于价电子数;零族元素的价电子排布为ns2np6(He除外);过渡元素ⅠB~ⅡB族元素的价电子排布为(n-1)d10ns1~2,族序数与最外层电子数相等,ⅢB~ⅦB族元素的价电子排布为(n-1)d1~5ns1~2,族序数等于价电子数。 [自 我 检 测] 1.判断正误,正确的打“√”;错误的打“×”。 (1)每一周期都是从活泼金属元素开始,以稀有气体元素结束。( ) (2)元素周期表中,7个横行是7个周期,18个纵行就是18个族。( ) (3)周期表中ⅢB族~ⅡB族为过渡元素,全部为金属元素。( ) (4)s区元素都是金属元素,p区元素都是非金属元素。( ) (5)最外层电子排布为ns1或ns2的元素一定是为金属元素。( ) (6)元素原子的价电子不一定是最外层电子。( )
(7)有同学总结出如下规律:当某元素的电子层数最外层电子数≥1时,该元素是金属元素。( ) 答案 (1)× (2)× (3)√ (4)× (5)× (6)√ (7)× 2.下列说法中正确的是( ) A.所有非金属元素都分布在p区 B.最外层电子数为2的元素都分布在s区 C.元素周期表中第ⅢB族到第ⅡB族10个纵行的元素都是金属元素 D.同一主族元素从上到下,金属性呈周期性变化 解析 非金属元素中氢在s区,其余非金属元素均分布在p区,A项错误;最外层电子数为2的元素可能在s区(如Mg)、p区(如He)或d区(如Ti、Fe)等,B项错误;同主族元素从上到下,金属性增强,非金属性减弱,属性质递变而不是周期性变化,D项错误。 答案 C 3.最活泼的金属元素、最活泼的非金属元素、常温下呈液态的金属(价电子排布为5d106s2)元素分别位于下面元素周期表中的( )
A.s区、p区、ds区 B.s区、p区、d区 C.f区、p区、ds区 D.s区、f区和ds区 解析 最活泼的金属元素在ⅠA族,s区;最活泼的非金属元素(是氟)在ⅦA族,p区;汞的价电子排布为5d106s2,在ⅡB族,ds区。 答案 A
学习任务一 原子结构与元素周期表的关系 【合作交流】 原子结构早在初中就以微观形式出现过,但受到学生当时知识能力的限制,并没能对原子结构有深层次的理解。在高中化学教材中,通过原子结构与元素周期表性质的介绍,进一步阐明了其规律性。 1.主族元素从左到右外围电子排布有何特点? 提示 主族元素从左到右外围电子排布从ns1~ns2np5。 2.外围电子排布为5s25p1的元素,在元素周期表中处于什么位置?据此分析元素的外围电子排布与周期表位置有何关系? 提示 该元素位于第五周期第ⅢA族。元素能级中最高能层序数=周期序数,主族元素原子的外围电子数=该元素在周期表中的主族序数。 3.某元素位于周期表中第四周期ⅤA族,你能否据此书写出该元素的价电子排布式、电子排布式? 提示 元素的价电子排布式为4s24p3,电子排布式为1s22s22p63s23p63d104s24p3。 【点拨提升】 核外电子排布与族的关系 (1)主族元素的价电子排布 主族序数 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 价电子排布 ns1 ns2 ns2np1 ns2np2 ns2np3 ns2np4 ns2np5 ①主族元素的族序数=价电子总数=最高正价(O、F除外)。 ②同主族元素原子的价电子排布相同,价电子全部排布在ns或nsnp轨道上。 (2)稀有气体的价电子排布为1s2或ns2np6。 (3)过渡元素(副族和Ⅷ族)(第四周期为例)的价电子排布 族序数 价电子排布 ⅢB (n-1)d1ns2 ⅣB (n-1)d2ns2 ⅤB (n-1)d3ns2 ⅥB (n-1)d5ns1 ⅦB (n-1)d5ns2 Ⅷ (n-1)d6~8ns2 ⅠB (n-1)d10ns1 ⅡB (n-1)d10ns2 ①ⅢB→ⅦB族:族序数=价电子数=原子最外层ns电子数+次外层(n-1)d电子数=最高正价。 ②Ⅷ族:原子最外层ns电子数+次外层(n-1)d电子数之和分别为8、9、10。 ③ⅠB和ⅡB的族序数=原子最外层电子数。 (4)0族最外层电子排布为1s2或ns2np6。 【例1】 某元素位于周期表中第四周期第ⅤA族,则该元素的名称和该元素原子价电子排布式均正确的是( ) A.砷,4s24p3 B.溴,4s24p5 C.磷,4s24p3 D.锑,5s25p3 解析 由于该元素为主族元素,价电子数=主族序数,故价电子数为5,排除B项;又因周期数=电子层数,排除D;由元素在周期表中的位置可知:元素原子的价电子排布式为4s24p3,电子排布式为1s22s22p63s23p63d104s24p3,该元素为33号元素砷,故A项正确。 答案 A
原子结构与元素在周期表中的位置是有一定的关系的。 (1)原子核外电子层数决定所在周期数;周期数=最大能层数(钯除外,46Pd:[Kr]4d10,最大能层数是4,但是在第五周期)。 (2)外围电子总数决定排在哪一族。如:29Cu:3d104s1,10+1=11尾数是1且有d轨道,所以是Ⅰ B族。 (3)每周期起始元素和结束元素的价电子排布为ns1和ns2np6(第一周期为1s2)。 【变式训练】 1.原子的价电子排布式为3d104s1的元素在周期表中位于( ) A.第五周期第ⅠB族 B.第五周期第ⅡB族 C.第四周期第ⅦB族 D.第四周期第ⅠB族 解析 该元素原子的核外电子排布式为1s22s22p63s23p63d104s1,即该原子含有4个能层,位于第四周期,其价电子排布式为3d104s1,属于第ⅠB族元素,所以该元素位于第四周期第ⅠB族,故选D。 答案 D 2.已知某元素+2价离子的电子排布式为1s22s22p63s23p6,则该元素在周期表中属于( ) A.第ⅤB族 B.第ⅡB族 C.第Ⅷ族 D.第ⅡA族 解析 根据核外电子排布规律,可知该元素的原子最外层只有2个电子,而且应该排布在第四电子层上,该元素在周期表中的位置应该是第四周期第ⅡA族。 答案 D 3.某元素原子最外层只有1个电子,最高电子层n=4。问: (1)符合上述条件的元素,可以有________种;原子序数分别为________。 (2)写出相应元素原子的简化电子排布式,并指出在周期表中的位置。 _______________________________________________________ _______________________________________________________。