初三化学下学期化学实验操作-浙教版
- 格式:ppt
- 大小:679.50 KB
- 文档页数:21
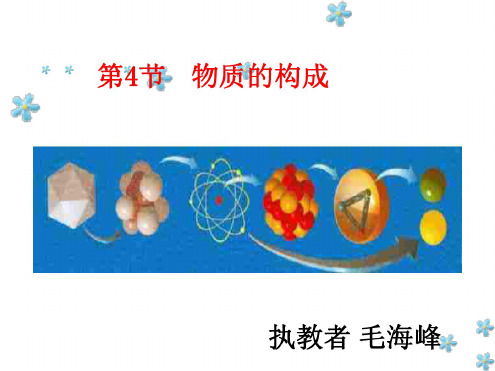


浙教版初中化学知识点总结一、化学基本概念1. 物质的组成- 物质由原子和分子组成。
- 原子是物质的基本单位,由原子核和电子构成。
- 分子是由两个或更多原子通过化学键结合而成的。
2. 元素与化合物- 元素是由相同类型的原子组成的纯物质。
- 化合物是由两种或更多不同元素的原子以固定比例结合而成的纯物质。
3. 物质的分类- 混合物:由两种或更多物质混合而成,各组成部分保持其原有性质。
- 纯净物:由单一物质组成,具有固定的化学性质和物理性质。
4. 化学反应- 化学反应是原子重新排列形成新物质的过程。
- 反应物和生成物是化学反应的输入和输出。
- 化学方程式用于表示化学反应的过程和物质的变化。
二、化学实验基础1. 实验仪器- 常用仪器包括试管、烧杯、滴定管、酒精灯等。
- 仪器的使用方法和注意事项需要严格遵守。
2. 实验操作- 实验操作应遵循安全原则,如穿戴防护装备、使用防护眼镜等。
- 实验中常见的操作包括溶解、过滤、蒸发、蒸馏等。
3. 实验安全- 了解化学品的性质和危险性,正确处理化学品。
- 熟悉实验室紧急情况的处理方法,如火灾、化学品泄漏等。
三、元素及其化合物1. 常见元素- 金属元素:如铁、铜、锌等,具有良好的导电性和延展性。
- 非金属元素:如氧、氢、碳等,性质多样,包括气体、液体和固体。
2. 酸碱盐- 酸是能够提供氢离子(H+)的物质。
- 碱是能够提供氢氧根离子(OH-)的物质。
- 盐是由阳离子(通常是金属离子)和阴离子(通常是非金属离子)组成的化合物。
3. 氧化还原反应- 氧化还原反应是电子转移的过程,包括氧化和还原两个半反应。
- 氧化是失去电子的过程,还原是获得电子的过程。
四、物质的量1. 摩尔概念- 摩尔是物质的量的单位,表示含有一定数目粒子的任何物质。
- 阿伏伽德罗常数是每摩尔物质中所含粒子数的常数。
2. 物质的量计算- 通过化学方程式可以计算反应物和生成物的摩尔比。
- 质量、体积和物质的量之间的关系用于计算物质的量。
初三浙教版必备化学精品讲义一、引言化学作为一门自然科学,研究物质以及物质之间的转化和变化。
它在日常生活中扮演着重要的角色,无论是探索自然界、解决环境问题、还是促进工业发展,都离不开化学的应用和贡献。
为了帮助初三学生更好地理解和学习化学知识,我们为大家准备了一份浙教版必备化学精品讲义,下面将为大家逐一介绍。
二、物质的分类与性质1. 纯净物与混合物纯净物是由相同种类的物质组成,其特点是具有确定的化学成分和固定的比例。
混合物由不同种类的物质组成,其特点是不固定的化学成分和比例。
2. 物质的状态与状态变化物质可以存在于固体、液体和气体三种不同的状态。
固体具有固定的形状和体积,液体具有固定的体积但没有固定的形状,气体既没有固定的形状也没有固定的体积。
物质在不同条件下会发生状态变化,如固体升华为气体、液体沸腾为气体等。
三、常见元素与化合物1. 常见元素氢、氧、碳、氮、硫、金、银等是我们日常生活中常见的元素,它们具有不同的化学性质和用途。
2. 化合物的命名和性质化合物是由两种或更多种元素以一定的化学比例结合而成的物质。
不同的化合物有不同的命名方法,常见的有离子化合物和共价化合物。
离子化合物由正离子和负离子组成,如氯化钠(NaCl);共价化合物则是由共用电子配对而成,如水(H2O)。
四、化学反应与化学方程式1. 化学反应的定义与类型化学反应是指物质之间发生的变化和转化。
常见的化学反应类型有:合成反应、分解反应、置换反应以及氧化与还原反应。
2. 化学方程式的撰写和平衡化学方程式是用化学式表示化学反应的过程,包括反应物和生成物。
在撰写化学方程式时,需要考虑物质的物质的状态、化学式及它们之间的摩尔比例。
化学方程式应该符合质量守恒和电荷守恒的原理,因此需要进行平衡。
五、溶液与离子反应1. 溶液的定义和性质溶液是由溶质和溶剂混合形成的可均匀混合物。
其中,溶质是指被溶解的物质,溶剂是指溶解溶质的物质。
在溶液中,溶质会完全或部分离解形成离子。