实验十四 氯化铵生成焓的测定
- 格式:doc
- 大小:31.50 KB
- 文档页数:2

实验1 溶解焓的测定【实验目的】1.学会用量热法测定盐类的积分溶解焓;2.掌握雷诺图解法求真实温度的原理和方法;3.熟悉数字贝克曼温度计的使用方法。
【实验原理】盐类溶解通常包含晶格破坏和离子溶剂化两个过程。
前者吸热,后者放热,两个过程热效应的总和就是盐类溶解过程的热效应。
等压下1mol溶质溶解过程的热效应称为该物质的溶解焓,单位为J·mol-1。
温度、压力、溶质和溶剂的性质以及用量都会影响溶解焓数值。
溶解焓分为积分溶解焓和微分溶解焓。
摩尔积分溶解焓是指在一定温度、压力下把1mol溶质溶解于一定量溶剂中(通常指200 mL水)形成一定浓度的溶液时所吸收或放出的热量。
由于此过程中溶液浓度是连续变化的,故又称积分溶解焓为变浓溶解焓。
微分溶解焓是指在温度、压力及溶液组成不变的条件下,向溶液中加入溶质后的热效应,也可理解为将1mol溶质溶解于无限大量的某一定溶液中所产生的热效应,由于此过程中,溶液浓度只有微小的变化或者可以视为不变,故微分溶解焓又称为定浓溶解焓。
它是溶液组成的函数。
在绝热容器中测定积分溶解焓的方法大致有两种:一种是先用标准物质测出热量计的热容,然后再测定待测物质溶解过程的温度变化,从而可求出待测物质的积分溶解焓;另一种是测定溶解过程中温度的降低,然后由电热法使该体系恢复到起始温度,根据所耗电能计算出热效应。
本实验拟采用第一种方法测定NH4Cl溶于水的积分溶解焓。
取一定量溶剂于量热计(绝热)中,等压条件下,将定量溶质溶解于量热计内的溶剂中,用数字式贝克曼温度计测定溶解过程的温度变化。
根据绝热系统热效应为零可求得该物质的溶解焓:()[]22211m TM C C m C m m sol ∆++-=H ∆热量计的热容是指除溶液外,使系统升温1K 所需的热量/J·K -1,可通过测定已知积分溶解焓的标准物质KCl 的T ∆,标定出C 值。
不同温度下KCl 在水中的溶解焓见教材表1.1。


氯化铵的制备实验报告
实验题目:氯化铵的制备实验
实验目的:通过反应制备氯化铵,并掌握氯化铵的制备和性质。
实验原理:
氯化铵是由氨气和盐酸反应得到的,反应方程式如下:
NH3(g) + HCl(aq) → NH4Cl(s)
实验设备与试剂:
1. 烧杯
2. 锥形瓶
3. 滴管
4. 毛细管
5. 加热设备
6. 氯化氢(盐酸)溶液
7. 氨气溶液
8. 冰块
实验步骤:
1. 在烧杯中加入适量的氯化氢(盐酸)溶液。
2. 将锥形瓶放入烧杯中,锥形瓶的底部放入冰块中。
3. 用滴管滴加氨气溶液到锥形瓶中,同时观察反应的变化。
4. 当反应结束,生成白色固体氯化铵时,停止滴加氨气溶液。
实验注意事项:
1. 实验操作过程中要戴好防护眼镜和实验手套。
2. 氨气溶液具有刺激性气味,操作时应小心避免吸入。
3. 氯化铵为易溶于水的化合物,制备后应立即用滤纸将其捞出。
实验结果与分析:
通过氨气和氯化氢(盐酸)溶液反应,实验制备到了固体氯化铵,并观察到生成的白色固体。
实验结论:
通过实验,通过氨气和氯化氢(盐酸)溶液的反应制备了氯化铵。
实验过程中观察到反应产物为固体氯化铵,实验目标完成。
实验改进与展望:
1. 可以尝试用其它方法制备氯化铵,如将氨气通过稀盐酸溶液或氢氯酸溶液中,观察其反应产物。
2. 可以进一步研究氯化铵的性质及其在化学实验中的应用。

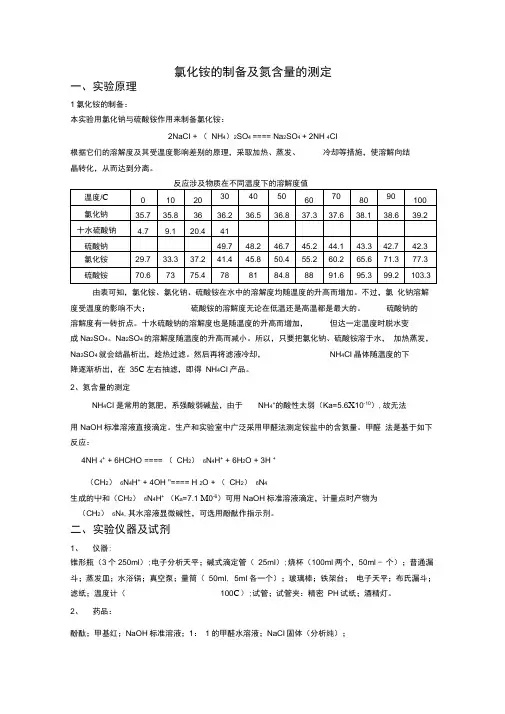
氯化铵的制备及氮含量的测定集团文件版本号:(M928-T898-M248-WU2669-I2896-DQ586-M1988)氯化铵的制备及氮含量的测定一、实验原理1、氯化铵的制备:本实验用氯化钠与硫酸铵作用来制备氯化铵:2NaCl +(NH 4)2SO 4 ==== Na 2SO 4 + 2NH 4Cl根据它们的溶解度及其受温度影响差别的原理,采取加热、蒸发、冷却等措施,使溶解向结晶转化,从而达到分离。
由表可知,氯化铵、氯化钠、硫酸铵在水中的溶解度均随温度的升高而增加。
不过,氯化钠溶解度受温度的影响不大;硫酸铵的溶解度无论在低温还是高温都是最大的。
硫酸钠的溶解度有一转折点。
十水硫酸钠的溶解度也是随温度的升高而增加,但达一定温度时脱水变成Na 2SO 4。
Na 2SO 4的溶解度随温度的升高而减小。
所以,只要把氯化钠、硫酸铵溶于水,加热蒸发,Na 2SO 4就会结晶析出,趁热过滤。
然后再将滤液冷却,NH 4Cl 晶体随温度的下降逐渐析出,在35℃左右抽滤,即得NH 4Cl 产品。
2、氮含量的测定NH 4Cl 是常用的氮肥,系强酸弱碱盐,由于NH 4+的酸性太弱(Ka=5.6×10-10),故无法用NaOH 标准溶液直接滴定。
生产和实验室中广泛采用甲醛法测定铵盐中的含氮量。
甲醛法是基于如下反应:4NH 4+ + 6HCHO ====(CH 2)6N 4H + + 6H 2O + 3H +(CH 2)6N 4H ++ 4OH ˉ ==== H 2O +(CH 2)6N 4生成的H +和(CH 2)6N 4H +(K a =7.1×10-6)可用NaOH 标准溶液滴定,计量点时产物为(CH 2)6N 4,其水溶液显微碱性,可选用酚酞作指示剂。
二、实验仪器及试剂 1、仪器:锥形瓶(3个250ml );电子分析天平;碱式滴定管(25ml );烧杯(100ml 两个,50ml 一个);普通漏斗;蒸发皿;水浴锅;真空泵;量筒(50ml ,5ml 各一个);玻璃棒;铁架台;电子天平;布氏漏斗;滤纸;温度计(100℃);试管;试管夹:精密PH 试纸;酒精灯。
氯化铵的制备及氮含量的测定一、实验原理1氯化铵的制备:本实验用氯化钠与硫酸铵作用来制备氯化铵:2NaCI + (NH4)2SO4 ==== Na2SO4 + 2NH 4CI根据它们的溶解度及其受温度影响差别的原理,采取加热、蒸发、冷却等措施,使溶解向结晶转化,从而达到分离。
由表可知,氯化铵、氯化钠、硫酸铵在水中的溶解度均随温度的升高而增加。
不过,氯化钠溶解度受温度的影响不大;硫酸铵的溶解度无论在低温还是高温都是最大的。
硫酸钠的溶解度有一转折点。
十水硫酸钠的溶解度也是随温度的升高而增加,但达一定温度时脱水变成Na2SO4。
Na2SO4的溶解度随温度的升高而减小。
所以,只要把氯化钠、硫酸铵溶于水,加热蒸发,Na2SO4就会结晶析出,趁热过滤。
然后再将滤液冷却,NH4CI晶体随温度的下降逐渐析出,在35C左右抽滤,即得NH4CI产品。
2、氮含量的测定NH4CI是常用的氮肥,系强酸弱碱盐,由于NH4+的酸性太弱(Ka=5.6X10-10),故无法用NaOH标准溶液直接滴定。
生产和实验室中广泛采用甲醛法测定铵盐中的含氮量。
甲醛法是基于如下反应:4NH 4+ + 6HCHO ==== (CH2)6N4H+ + 6H2O + 3H +(CH2)6N4H+ + 4OH "==== H 2O + (CH2)6N4生成的屮和(CH2)6N4H+(K a=7.1 M0-6)可用NaOH标准溶液滴定,计量点时产物为(CH2)6N4,其水溶液显微碱性,可选用酚酞作指示剂。
二、实验仪器及试剂1、仪器:锥形瓶(3个250ml);电子分析天平;碱式滴定管(25mI);烧杯(100ml两个,50ml - 个);普通漏斗;蒸发皿;水浴锅;真空泵;量筒(50mI, 5mI各一个);玻璃棒;铁架台;电子天平;布氏漏斗;滤纸;温度计(100C);试管;试管夹:精密PH试纸;酒精灯。
2、药品:酚酞;甲基红;NaOH标准溶液;1:1的甲醛水溶液;NaCI固体(分析纯);(NH4)2SO4固体(分析纯)。

宁德师范学院化学系设计性实验报告课程名称分析化学实验实验名称HCl和NH4Cl混合液中HCl与NH4Cl的测定院系化学系专业应用化学指导教师谢丹华报告人严晓庭学号 B2013062210 班级 2化学系制实验十HCl和NH4Cl混合液中HCl与NH4Cl的测定一、实验目的1. 运用酸碱滴定法的原来设计HCl-NH4Cl各组分含量的分析方案并具体实施。
2. 进一步掌握标准溶液的配制和标定方法,掌握指示剂及其它试剂的配制和使用方法。
3. 进一步巩固酸碱滴定基本原理和操作技能。
二、实验原理通过用NaOH溶液测定盐酸-氯化铵混合溶液中各组分的含量。
掌握配制NaOH标准溶液的方法,学会用甲醛法进行弱酸的强化,掌握分步滴定的原理与条件。
其中HCl为一元强酸,NH4Cl为强酸弱碱盐,两者Ka之比大于105,固可分步滴定。
根据混合酸连续滴定的原理,盐酸是强酸,第一步可直接对其滴定,用NaOH滴定,以甲基红为指示剂。
氯化铵是弱酸,其Cka≤10-8,但可用甲醛将其强化,加入酚酞指示剂,再用NaOH标准溶液滴定。
通过两次滴定可分别求出HCl与NH4Cl的浓度。
该方法简便易行且准确度高,基本符合实验要求。
1. 0.10mol·L-1NaOH标准溶液的配制和溶度的标定NaOH溶液浓度的标定:邻苯二甲酸氢钾(KHP),易制得纯品,空气中不吸水,,容易保存,摩尔质量大,是较好的基准物质。
反应产物为是二元弱碱,其水溶液显微碱性(即计量点时溶液显微碱性),可以选用酚酞作指示剂。
2. HCl和NH4Cl混合液中各组分含量测定原理HCl-NH4Cl混合液中的HCl是强酸,可以用标准NaOH溶液滴定,当滴定到HCl的计量点时,溶液中剩余的NH4Cl呈弱酸性。
NH4+的Ka=5.6×10-10 cKa>20Kw,c/Ka>400pH=5.3故应用甲基红(pH=4.4—6.2)作为滴定HCl的指示剂。
溶液中还剩下NH4+由于其酸性太弱,无法用NaOH直接滴定,可用甲醛法滴定。

盐酸氯化铵各组分含量的测定实验报告实验目的:本实验旨在通过对盐酸氯化铵各组分含量的测定,了解化学反应中物质的定量关系,并掌握常用化学实验操作技能。
实验原理:盐酸氯化铵的化学式为NH4Cl,其分解反应式为:NH4Cl → NH3 + HCl。
实验中将盐酸氯化铵样品加热至蒸发,使其分解为氨和氢氯酸,通过氨水的滴加,使氢氯酸与氨反应生成氯化铵,并收集氨水滴加过程中所生成的气体,从而计算盐酸氯化铵中氨和氯化铵的含量。
实验步骤:1.称取一定质量的盐酸氯化铵样品,并记录质量。
2.将样品加入烧杯中,加少量水溶解,并加入几滴甲基橙指示剂。
3.将烧杯加热至水浴中,使盐酸氯化铵样品分解为氨和氢氯酸,收集生成的气体。
4.在加热的同时,滴加氨水,使氢氯酸与氨反应生成氯化铵,直至甲基橙指示剂由红色变为黄色。
5.关闭加热,冷却烧杯,并加入少量水,使氯化铵溶解。
6.用稀盐酸滴定氨水中未反应的氨。
7.用氯化铵标准溶液滴定上述溶液中的氯化铵。
8.重复以上步骤,取平均值。
实验结果:通过实验,我们得到了盐酸氯化铵样品的质量为1.23g。
在加热分解过程中,我们收集到了37.5mL的气体。
在氨水滴加过程中,我们共滴加了20mL的氨水。
用稀盐酸滴定氨水,得到氨水中未反应的氨的体积为3.8mL。
用氯化铵标准溶液滴定上述溶液中的氯化铵,得到其体积为16.3mL。
实验计算:根据氨的体积,可以计算出氨的物质量为0.0014mol。
根据氨与氢氯酸生成的化学反应式,可以知道样品中氢氯酸的物质量也为0.0014mol。
根据氨与氯化铵生成的化学反应式,可以知道样品中氯化铵的物质量为0.0028mol。
根据盐酸氯化铵的化学式,可以知道样品中盐酸氯化铵的物质量为0.0056mol。
因此,盐酸氯化铵样品中氨和氯化铵的质量分别为0.017g和0.121g。
实验结论:通过本实验,我们成功地测定了盐酸氯化铵样品中氨和氯化铵的含量,并计算出其质量分数。
本实验的结果表明,盐酸氯化铵样品中氨和氯化铵的含量为1.38%和9.82%。

反应焓的测定实验报告反应焓的测定实验报告引言:反应焓是热力学中的重要概念,它描述了化学反应过程中的能量变化。
测定反应焓对于理解化学反应的性质和动力学有着重要意义。
本实验旨在通过测定一系列反应的焓变,探究反应焓的测定方法以及其对于反应热力学的应用。
实验方法:1. 实验器材准备:烧杯、温度计、量筒、搅拌棒等。
2. 实验药品准备:盐酸、氢氧化钠溶液等。
3. 实验步骤:a. 在烧杯中加入一定量的盐酸。
b. 用温度计测量盐酸的初始温度。
c. 在另一个烧杯中加入一定量的氢氧化钠溶液。
d. 用温度计测量氢氧化钠溶液的初始温度。
e. 将氢氧化钠溶液缓慢加入盐酸中,同时用搅拌棒搅拌。
f. 记录溶液的最终温度。
实验结果与分析:根据实验步骤所获得的数据,可以计算出反应的焓变。
根据热力学原理,反应的焓变可以通过以下公式计算得出:ΔH = mcΔT其中,ΔH表示焓变,m表示反应物质的摩尔数,c表示反应物质的摩尔热容量,ΔT表示温度变化。
通过实验数据的分析,我们可以得到反应的焓变值。
根据实验步骤中所使用的反应物质的摩尔数和摩尔热容量,可以计算出反应的焓变值,并对其进行比较和讨论。
通过比较不同反应的焓变值,可以了解反应的热力学性质,进而推断反应过程中的能量变化。
实验结论:通过本次实验,我们成功测定了一系列反应的焓变,并计算出了相应的反应焓。
根据实验结果,我们可以得出以下结论:1. 反应焓是描述化学反应过程中能量变化的重要物理量。
2. 通过测定反应焓,可以了解反应的热力学性质和动力学特征。
3. 反应焓的测定方法简单可行,可以广泛应用于化学实验中。
实验的局限性与改进:1. 本实验仅测定了一系列反应的焓变,对于更复杂的反应系统可能不适用。
2. 实验中未考虑反应过程中的压力变化对焓变的影响,可以进一步改进实验方法以考虑压力变化。
总结:本实验通过测定一系列反应的焓变,探究了反应焓的测定方法以及其对于反应热力学的应用。
通过实验结果的分析与讨论,我们对反应焓的概念和测定方法有了更深入的理解,并对化学反应的能量变化有了更清晰的认识。
实验十四 氯化铵生成焓的测定
实验内容
一、 量热计热容量的测定
二、 NH3·H2O与HCl中和热的测定
三、 三、NH4Cl溶解热的测定
四、 记录和结果
实验目的
利用量热计测定NH4Cl生成焓,加深对盖斯定律的理解。
基本原理
热力学标准状态下由稳定单质生成一摩尔化合物时的反应焓变称为该化合物
的标准摩尔生成热焓。标准摩尔生成热焓一般可通过测定有关反应热间接求得。
本实验就是分别测定氨水和盐酸的中和反应热和氯化铵固体的溶解热,然后利用
氨水和盐酸的标准生成热焓,通过盖斯定律计算而求得氯化铵固体的标准生成热
焓。
NH3(aq)十HCl(aq) →NH4Cl(aq) ΔH中和
NH4Cl (s)→NH4Cl(aq) ΔH溶解
中和热和溶解热可采用简易量热计来测量。当反应在量热计中进行时,反应放出
或吸收
的热量将使量热计系统温度升高或降低,因此,只要测定量热计系统温度的改变
值ΔT以及量热计系统的热容量C,就可以利用下式计算出反应的热效应:
量热计系统的热容量C是指量热计系统温度升高1K时所需的热量。测定量热
计系统的热容量有多种方法,本实验是采用化学反应标定法,即利用盐酸和氢氧
化钠水溶液在量热计内反应,测定其系统温度改变值ΔT后,根据已知的中和反
应热(ΔH⊙=一57.3kJ·mol
-1
)可求出量热计系统的热容量C。
(注:虽然各种盐溶液的热容略有差别,但在本实验可不予考虑。)
实验器材
量热计(由保温杯,一支1/10K刻度的温度计和一支环状搅拌棒组成),秒
表,量筒。
实验步骤
一、量热计热容量的测定
简易量热计装置如图1所示。量取50cm
31.0 mol·dm-3
aOH溶液于量热计中,
盖好杯盖并搅拌,至温度变化基本不变。量取50 cm
31.0mol·dm-3
HCl溶液
于一个150 cm3烧杯中,用一支校正过的温度计测量酸的温度,要求酸碱温度
基本一致,若不一致,可用手温热或用水冷却。实验开始每隔30s记录一次
NaOH溶液的温度,并于第5min打开杯盖,把酸一次加入量热计中,立即盖
好杯盖并搅拌,继续记录温度和时间,直到温度上升至最高点后继续观察5min。
作出温度—时间关系图,按图2用外推法求ΔT,并计算量热计系统的热容量。
二、NH3·H2O与HCl中和热的测定
洗净量热计,以1.5 mol·dm
-3 NH2·H2O代替1.0 mol·dm-3
NaOH,1.5
mol·dm-3HCl代替1.0 mol·dm-3HCl重复上述实验。作图求ΔT,并计算中和
反应热ΔH中和。
三、NH4Cl溶解热的测定
在干净的量热计中加入100 cm3蒸馏水,搅拌使体系温度趋于稳定后记录时间
—温度数据(30s记一次),于第5min加入适量的NH4Cl固体(如何确定其用
量?),立即盖好杯盖并搅拌。继续记录时间—温度数据(10min),作图求ΔT,
计算NH
4
Cl溶解热ΔH溶解。.
四、记录和结果
1.分别列表记录有关实验的时间—温度数据。
2.作温度—时间图。用图2外推法求ΔT。
3.计算量热计热容量、中和热、溶解热和NH4Cl (s)生成热。
问题思考
1.怎样利用盖斯定律计算NH3(aq)的生成焓和HCl (aq)的生成焓?
2.如果实验中有少量HCl溶液或NH4Cl固体粘附在量热计器壁上,对实
验结果怎样影响?
实验注意事项
1.量热计每次用完后要清洗干净才能继续下一个实验,否则会影响实验的
结果。
2.当加入NH4Cl固体并盖好杯盖时,可适当摇荡量热计以加促NH4Cl的
溶解。