物理化学实验
- 格式:docx
- 大小:232.72 KB
- 文档页数:7


物理化学实验所有课后习题和思考题答案Revised final draft November 26, 2020实验一燃烧热的测定1. 在本实验中,哪些是系统哪些是环境系统和环境间有无热交换这些热交换对实验结果有何影响如何校正提示:盛水桶内部物质及空间为系统,除盛水桶内部物质及空间的热量计其余部分为环境,系统和环境之间有热交换,热交换的存在会影响燃烧热测定的准确值,可通过雷诺校正曲线校正来减小其影响。
2. 固体样品为什么要压成片状萘和苯甲酸的用量是如何确定的提示:压成片状有利于样品充分燃烧;萘和苯甲酸的用量太少测定误差较大,量太多不能充分燃烧,可根据氧弹的体积和内部氧的压力确定来样品的最大用量。
3. 试分析样品燃不着、燃不尽的原因有哪些提示:压片太紧、燃烧丝陷入药片内会造成燃不着;压片太松、氧气不足会造成燃不尽。
4. 试分析测量中影响实验结果的主要因素有哪些本实验成功的关键因素是什么提示:能否保证样品充分燃烧、系统和环境间的热交换是影响本实验结果的主要因素。
本实验成功的关键:药品的量合适,压片松紧合适,雷诺温度校正。
5. 使用氧气钢瓶和氧气减压器时要注意哪些事项?提示:阅读《物理化学实验》教材P217-220实验二凝固点降低法测定相对分子质量1. 什么原因可能造成过冷太甚若过冷太甚,所测溶液凝固点偏低还是偏高由此所得萘的相对分子质量偏低还是偏高说明原因。
答:寒剂温度过低会造成过冷太甚。
若过冷太甚,则所测溶液凝固点偏低。
根据公式和可知由于溶液凝固点偏低,T f偏大,由此所得萘的相对分子质量偏低。
2. 寒剂温度过高或过低有什么不好?答:寒剂温度过高一方面不会出现过冷现象,也就不能产生大量细小晶体析出的这个实验现象,会导致实验失败,另一方面会使实验的整个时间延长,不利于实验的顺利完成;而寒剂温度过低则会造成过冷太甚,影响萘的相对分子质量的测定,具体见思考题1答案。
3. 加入溶剂中的溶质量应如何确定加入量过多或过少将会有何影响?答:溶质的加入量应该根据它在溶剂中的溶解度来确定,因为凝固点降低是稀溶液的依数性,所以应当保证溶质的量既能使溶液的凝固点降低值不是太小,容易测定,又要保证是稀溶液这个前提。

物化实验思考题实验一液体饱和蒸气压的测定1.试分析引起本实验误差的因素有哪些?答:①判断液面是否相平的标准;②液面相平时压力和温度的读数会有误差。
2.为什么AB弯管中的空气要排干净?怎样操作?答:AB弯管空间内的压力包括两部分:一是待测液的蒸气压;另一部分是空气的压力。
测定时,必须将其中的空气排除后,才能保证B 管液面上的压力为液体的蒸气压,检漏之后要关闭阀1,防止外界空气进入缓冲气体罐内。
3.试说明压力计中所读数值是否为纯液体的饱和蒸气压?答:不是,纯液体的饱和蒸气压等于外界大气压加上所测得的压差值。
4.为什么减压完成后必须使体系和真空泵与大气相通才能关闭真空泵?答:真空泵在关闭之前,因系统内压力低,先通大气,以防油泵中的油倒流使真空泵损坏。
实验二氨基甲酸铵分解反应平衡常数的测定1.该实验的实验目的是什么呢?答:①掌握低真空操作技术;②掌握静态法测定平衡压力的原理和方法;③计算氨基甲酸铵分解反应的标准平衡常数及其有关的热力学函数。
2.氨基甲酸铵分解反应平衡常数与哪些因素有关呢?答:温度。
3.该实验需要获得哪些实验数据呢?答:不同温度下的分解压。
4.该实验是如何测定氨基甲酸铵分解反应平衡常数的?答:测定出不同温度下的分解压之后,利用公式求出平衡常数。
5.该实验成功的关键是什么呢?为了获得准确的实验结果,实验中应该注意什么呢?答:打开放空阀时一定要缓慢进行,小心操作。
若放空气速度太快或放气量太多,易使空气倒流,即空气将进入到氨基甲酸铵分解的反应瓶中,此时实验需重做。
6.实验中温度是如何测定的?答:使用恒温槽调节温度。
7.压力计的读数是否是体系的压力?是否代表分解压?答:不是,不是。
8.缓冲储气罐有何作用?答:缓冲,防止管内液体倒流,使供气更加稳定,减少空压机的频繁启动。
9.使用真空泵应注意什么?为什么减压完成后必须使体系和真空泵与大气相通才能关闭真空泵?答:启动真空泵前要仔细检查各连接处及焊口处是否完好,泵的排气口胶塞是否打开。
实验1 燃烧热的测定1. 实验目的1.1掌握氧弹量热计的使用;用氧弹量热计测定萘的燃烧热;1.2掌握氧气钢瓶的使用。
2. 实验原理称取一定量的试样置于氧弹内,并在氧弹内充入1.5 ~ 2.0MPa的氧气,然后通电点火燃烧。
燃烧时放出的热量传给水和量热器,由水温的升高(△T)即可求出试样燃烧放出的热量:Q=K·△T式中K为整个量热体系(水和量热器)温度升高1℃所需的热量。
称为量热计的水当量。
其值由已知燃烧热的苯甲酸(标样)确定。
K =Q /△T式中△T应为体系完全绝热时的温升值,因而实测的△T须进行校正。
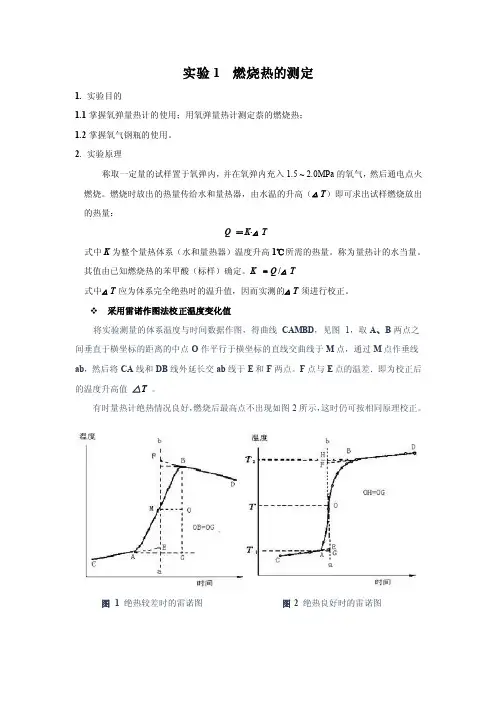
采用雷诺作图法校正温度变化值将实验测量的体系温度与时间数据作图,得曲线CAMBD,见图1,取A、B两点之间垂直于横坐标的距离的中点O作平行于横坐标的直线交曲线于M点,通过M点作垂线ab,然后将CA线和DB线外延长交ab线于E和F两点。
F点与E点的温差.即为校正后的温度升高值△T。
有时量热计绝热情况良好,燃烧后最高点不出现如图2所示,这时仍可按相同原理校正。
图 1 绝热较差时的雷诺图图2 绝热良好时的雷诺图3. 仪器与试剂3.1试剂:分析纯苯甲酸(QV=26480 J·g-1);待测样;引火丝(Ni-Cr丝,QV=8.4 J·cm -1)3.2仪器:HR-15A数显型氧弹量热计一台;压片机(苯甲酸和萘各用一台);精密贝克曼温差温度计(精确至0.01 ℃,记录数据时应记录至0.002 ℃);台秤一台;分析天平一台。
4. 实验步骤4.1水当量的测定(1)打开控制箱预热。
(2)量取10 cm引火丝并准确称重。
(3)在台秤上粗称试样1 g ~ 1.2 g;用压片机压片,同时将燃烧丝压入。
准确称重,减去引火丝重量后即得试样重量。
注意压片前后应将压片机擦干净;苯甲酸和待测试样不能混用一台压片机。
(4)将氧弹盖放在专用架上,将点火丝两端固定在氧弹电极上点火丝切勿接触坩锅,以防短路。
(5)取少量(~2 mL)水放入氧弹中(吸收空气中的N2燃烧而成的HNO3),盖好并拧紧弹盖,接上充气导管,慢慢旋紧减压阀螺杆,缓慢进气至表上指针为1.5 ~ 2.0 MPa。


目录绪论.......................................... 错误!未指定书签。
第一节物理化学实验的目的与要求................. 错误!未指定书签。
第二节误差分析................................ 错误!未指定书签。
第三节物理化学实验数据的表达方法.............. 错误!未指定书签。
热力学部分实验一硫酸铜溶解热的测定 ........................ 错误!未指定书签。
实验二液体饱和蒸汽压的测定———静态法........... 错误!未指定书签。
实验三完全互溶双液系气-液平衡相图———最低恒沸点的测定错误!未指定书签。
电化学部分实验四电导法测定弱电解质的电离常数............... 错误!未指定书签。
实验五原电池电动势的测定——对消法............... 错误!未指定书签。
动力学部分实验六蔗糖水解转化的动力学研究................... 错误!未指定书签。
表面化学部分实验七溶液表面张力的测定——最大气泡法........... 错误!未指定书签。
实验八液体粘度测定及恒温槽的性能测定............. 错误!未指定书签。
绪论第一节物理化学实验的目的与要求物理化学实验的主要目的是使学生初步了解物理化学的实验研究方法,掌握物理化学的基本实验技术。
通过正确测量、记录实验数据,运用物理化学基本理论,正确处理实验数据,分析实验现象和实验结果,加深对物理化学基本理论的理解,增强解决实际化学问题的能力。
物理化学实验课程,对培养学生独立从事科学研究工作能力具有重要的作用。
为了达到学习该课程的目的与要求,保证课程质量,对学生物理化学实验课程学习的基本要求如下。
一、实验前的预习学生在实验前应认真仔细阅读实验内容,了解实验的目的、原理、所用仪器的构造和使用方法,了解实验操作过程。

物理化学实验报告实验名称溶解热的测定一.实验目的及要求1.了解电热补偿法测定热效应的基本原理。
2.通过用电热补偿法测定硝酸钾在水中的积分溶解热;用作图法求硝酸钾在水中的微分冲淡热、积分冲淡热和微分溶解热。
3.掌握电热补偿法的仪器使用要点。
二.实验原理1.物质溶解于溶剂过程的热效应称为溶解热。
它有积分(或变浓)溶解热和微分(或定浓)溶解热两种。
前者是1mol溶质溶解在nomol溶剂中时所产生的热效应,以Qs表示。
后者是1mol溶质溶解在无限量某一定浓度溶液中时所产生的热效应。
即溶剂加到溶液中使之稀释时所产生的热效应称为稀释热。
它也有积分(或变浓)稀释热和微分(或定浓)稀释热两种。
前者是把原含1mol溶质和nomol溶剂的溶液稀释到含溶剂nogmol时所产生的热效应,以Q。
表示,显然。
后者是1mol溶剂加到无限量某一定浓度溶液中时所产生的热效应2.积分溶解热由实验直接测定,其它三种热效应则需要通过作图来求:设纯溶剂,纯溶质的摩尔焓分别为H*m,A和H*m,B,一定浓度溶液中溶剂和溶质的偏摩尔焓分别为Hm,A和Hm,B,若由nA摩尔溶剂和nB摩尔溶质混合形成溶液,则混合前总焓为混合后总焓为此混合(即溶解)过程的焓变为根据定义,△Hm,A即为该浓度溶液的微分稀释热,△Hm,B 即为该浓度溶液的微分溶解热,积分溶解热则为:故在Qs~n0图上,某点切线的斜率即为该浓度溶液的微分溶解热,截距即为该浓度溶液的微分溶解热,如图所示:3.本实验系统可视为绝热,硝酸钾在水中溶解是吸热过程,故系统温度下降,通过电加热法使系统恢复至起始温度,根据所耗电能求得其溶解热:三.实验仪器及药品1.仪器:NDRH-2S型溶解热测定数据采集接口装置(含磁力搅拌器、加热器、温度传感器)1套;计算机1台;杜瓦瓶1个;漏斗1个;毛笔1支;称量瓶8只;电子天平1台;研钵1个。
2.药品:硝酸钾(分析纯)。
四.实验注意事项1.杜瓦瓶必须洗净擦干,硝酸钾必须在研钵中研细。


物化实验注意事项及思考题70.(1)数字贝克曼温度计温差测量范围:±19.999℃,作温差测量时,为保证测量准确,“基温选择”在一次实验中不宜换档。
(2)实验完毕后,一定要将热敏电阻感温元件从恒温水浴中取出,以免生锈或损坏。
(1 )简要回答恒温水浴主要由哪些部件组成?恒温原理是什么?(2)恒温水浴内各处的温度是否相等?为什么?(3)欲提高恒温浴的灵敏度,可从哪些方面进行改进?71.1、压片不能太紧或太松。
2、点火丝一定要和式样片接触,不能和金属器皿相接触。
3、氧弹内不要忘记加水。
4、氧气钢瓶在开总阀前要检查减压阀是否关好;实验结束后要关上钢瓶总阀,注意排净余气,使指针回零。
1、固体样品为什么要压成片状?2、在氧弹里加10mL蒸馏水起什么作用?3、本实验中,那些为体系?那些为环境?实验过程中有无热损耗,如何降低热损耗?4、为什么实验测量得到的温差值要用雷诺图解法校正?5、使用氧气钢瓶和减压阀时有那些注意事项?6、欲测定液体样品的燃烧热,你能想出测定方法吗?72.1、坩埚一定要清理干净,否则埚垢不仅影响导热,杂质在受热过程中也会发生物理化学变化,影响实验结果的准确性。
2、样品必须研磨得很细,否则差热峰不明显,但也不宜太细。
一般差热分析样品研磨到200目为宜。
3、双笔记录仪的两支笔并非平行排列,为防二者在运动中相碰,制作仪器时,二者位置上下平移一段距离,称为笔距差。
因此,在差热图上求转化温度时应加以校正。
1、如何应用差热曲线来解释物质的物理变化及化学变化过程?2、差热曲线的形状与哪些因素有关?影响差热分析结果的主要因素是什么?3、DTA和简单热分析(步冷曲线法)有何异同?4、试从物质的热容解释差热曲线的基线漂移?5、在什么情况下,升温过程与降温过程所得到的差热分析结果相同?在什么情况下,只能采用升温或降温方法?73.1、搅拌速度的控制是做好本实验的关键,每次测定应按要求的速度搅拌,并且测溶剂与溶液凝固点时搅拌条件要完全一致。

物化实验-附答案物理化学实验预习题温度1. 对热电偶材料的基本要求是(A )物理、化学性能稳定(B )热电性能好,热电势与温度要成简单函数关系(C )电阻温度系数⼤,导电率⾼(D )有良好的机械加⼯性能2. 恒温槽的灵敏度是指 ------------------------------------------- ()(A )介质的最⾼温度与最低温度之差的⼀半(B )介质的最⾼温度与最低温度之差(C )温控仪的温度显⽰数据与介质中精密温度计读数之差(D )介质的温度与环境温度之差3、⽤热电偶测量温度时,为保持冷端温度的稳定,须将它 _______ 放⼊冷阱 ____________ ;常将⼏组热电偶串联使⽤,⽬的是提⾼灵敏度,增⼤温差电势,增加测量精度,串联成热电堆的温差电势等于各个热电偶电势之和。
4、在恒温槽⽔浴中,⽔银接点温度计的作⽤是 ________ 控温 ___________________ 。
(A )既测温⼜控温(B )测温(C )控温(D )既⾮测温⼜⾮控温5 ?超级恒温槽中,电接点温度计的作⽤是 _________ 。
A.测定恒温介质的温度 B.作为控温的部件之⼀ C .即可测温⼜可控温D.测定恒温介质与环境之间的温差6 ?⽤最⼩分度为0.1度的⽔银温度计测定⼀体系的温度,其温度范围⼤约在的有效数字位数是 ______________ 。
实验常识1、采⽤流动法进⾏实验研究时,当流动体系达到稳定状态后,实验或测定成功的关键是(A 、保持温度不变但压⼒可变B 、保持压⼒不变但温度可变C 温度、压⼒、浓度都可变D、保持体系处于稳定状态2、处于临界点的CQ 是()。
D 具有共同参数.(p |V , T )的物质,因⽽不能区别此时的.CQ 是⽓态还是液态80?100 C 之间,则其测量值A.根据测定值⽽定B. 2位C. 3位 D . 4位7 ?某⼀实验测定需在温度为95 C 的恒温槽内进⾏,恒温槽的恒温介质可选⽤A.⼄醇⽔溶液B .⽢油⽔溶液C.⽔D .固体CQA 、⽓体、液体、既是⽓体,也是液体3、⼀般情况下汞温度计浸在被测物体中需要多长时间才能达到热平衡?()。

实验一燃烧热的测定1.搅拌太慢或太快对实验结果有何影响答案:搅拌的太慢,会使体系的温度不均匀,体系测出的温度不准,实验结果不准,搅拌的太快,会使体系与环境的热交换增多,也使实验结果不准。
2.蔗糖的燃烧热测定是如何操作的燃烧样品蔗糖时,内筒水是否要更换和重新调温答案:用台秤粗称蔗糖克,压模后用分析天平准确称量其重量。
操作略。
内筒水当然要更换和重新调温。
3.燃烧皿和氧弹每次使用后,应如何操作答案:应清洗干净并檫干。
4.氧弹准备部分,引火丝和电极需注意什么答案:引火丝与药片这间的距离要小于5mm或接触,但引火丝和电极不能碰到燃烧皿,以免引起短路,致使点火失败。
5.测定量热计热容量与测定蔗糖的条件可以不一致吗为什么答案:不能,必须一致,否则测的量热计的热容量就不适用了,例两次取水的量都必须是升,包括氧弹也必须用同一个,不能换。
6.实验过程中有无热损耗,如何降低热损耗答案:有热损耗,搅拌适中,让反应前内筒水的温度比外筒水低,且低的温度与反应后内筒水的温度比外筒高的温度差不多相等。
7.药片是否需要干燥药片压药片的太松和太紧行不行答案:需要干燥,否则称量有误差,且燃烧不完全。
不行。
8.如何确保样品燃烧完全答案:充氧量足够,药品干燥,药片压的力度适中其他操作正常。
9.充氧的压力和时间为多少充氧后,将如何操作答案:,充氧时间不少于30S。
用万用电表检查两电极是否通路(要求约3至10);检漏。
10.搅拌时有摩擦声对实验结果有何影响答案:说明摩擦力较大,由此而产生的热量也较多,使结果偏大(数值)。
11.本实验中,那些为体系那些为环境答案:氧弹、内筒、水为体系;夹套及其中的水为环境。
12.压片时,压力必须适中,片粒压的太紧或太松对实验结果有何影响答案:片粒压的太紧,使燃烧不完全,结果偏小(数值)。
片粒压的太松,当高压充氧时会使松散药粉飞起,使得真正燃烧的药品少了,结果偏小(数值)。
13.写出萘燃烧过程的反应方程式蔗糖和氧气反应生成二氧化碳和水的反应方程式答案:C 10H 8(s )+12O 2(g )→10CO 2(g )+4H 2O (l )14.内桶中的水温为什么要选择比外筒水温低低多少合适为什么答案:为了减少热损耗,因反应后体系放热会使内筒的温度升高,使体系与环境的温度差保持较小程度,体系的热损耗也就最少。
恒温槽装配和性能测试1. 如何设计一套控制温度低于环境温度的恒温装置?选择合适的制冷器.2.什么是恒温槽加热器的最佳功率,如何确定最佳加热功率的控温曲线?适当调节温度控制器输出电压(亦即改变加热器加热功率),使温度控制器上加热指示灯和停止加热指示灯的亮、熄间隙时间间隔大致相等,记录加热电压和电流,并由此计算加热功率,该值即为此温度下的最佳加热功率。
3. 对于具有如图2.1-2中曲线(3)和(4),是否可用计算tE 以衡量恒温槽的控温精度?为什么?曲线(3),(4)对设定温度的偏差如何?不能。
(课本P50)tmax 和tmin 是恒温槽控温曲线上的最高点与最低点的温度值。
tE 描述了实际温度与设定温度间的最大偏离值,因而可以tE 描述恒温槽的恒温精度。
然而对于图2.1-2中曲线(3)和(4)所示控温曲线的恒温槽,由于控温曲线的不对称性,用上式计算tE 是无意义的。
)(21min max t t t E -±=4. 调试时,若温度控制器绿灯(加热通)一直亮着,温度却无法达到设定值,分析可能的原因。
搅拌太快,散热快;加热器功率小,散热快等。
饱和蒸汽压的测定1、正常沸点与沸腾温度有何区别?正常沸点是指在P θ下物质的沸腾温度,而沸腾温度是指外压与液体的饱和蒸气压相等时的沸腾温度。
2、系统放空后,有时测得的沸腾温度大于100˚C ,分析可能的原因。
P 大气> P θ3、打开和关闭机械泵时,为什么总要先将其放空?机械泵的进气口前应安装一个三通活塞,开始抽气前应先打开电源,使真空泵先空运转一段时间(即与大气相通)再与抽气系统相通;停止抽气时应使机械泵与抽空系统隔开而与大气相通,再关闭电源,这样既可保持系统的真空度,又避免泵油倒吸。
4、简述福廷式气压计的使用注意事项。
(1)福廷式气压计必须垂直放置。
在调节时,先拧松气压计底部圆环上的三个螺旋,令气压计铅直悬挂,再旋紧这三个螺旋,使其固定。
(2)慢慢旋转底部的汞面调节螺旋,使汞槽内的汞面升高。
物理化学实验思考题答案物理化学实验思考题答案(精心整理)(精心整理)实验11.1.不能,不能,因为溶液随着温度的上升溶剂会减少,溶液浓度下降,蒸气压随之改变。
2.2.温度越高,液体蒸发越快,蒸气压变化大,导致误差愈大。
温度越高,液体蒸发越快,蒸气压变化大,导致误差愈大。
实验3实验5 T----X 图1蒸馏器中收集气相冷凝液的袋状部的大小对结果有何影响?答:答:若冷凝管下方的凹形贮槽体积过大,若冷凝管下方的凹形贮槽体积过大,若冷凝管下方的凹形贮槽体积过大,则会贮存过多的气相冷凝液,则会贮存过多的气相冷凝液,则会贮存过多的气相冷凝液,其贮量超其贮量超过了热相平衡原理所对应的气相量,过了热相平衡原理所对应的气相量,其组成不再对应平衡的气相组成,其组成不再对应平衡的气相组成,其组成不再对应平衡的气相组成,因此必然因此必然对相图的绘制产生影响。
对相图的绘制产生影响。
2若蒸馏时仪器保温条件欠佳,在气相到达平衡气体收集小槽之前,沸点较高的组分会发生部分冷凝,则T —x 图将怎么变化?图将怎么变化?答:答:若有冷凝,若有冷凝,若有冷凝,则气相部分中沸点较高的组分含量偏低,则气相部分中沸点较高的组分含量偏低,则气相部分中沸点较高的组分含量偏低,相对来说沸点较低的组相对来说沸点较低的组分含量偏高了,则T 不变,不变,x x 的组成向左或向右移(视具体情况而定)3 3 在双液系的气在双液系的气在双液系的气--液平衡相图实验中,所用的蒸馏器尚有那些缺点?如何改进? 答:答:蒸馏器收集气相、蒸馏器收集气相、蒸馏器收集气相、液相的球大小没有设计好,液相的球大小没有设计好,液相的球大小没有设计好,应根据实验所用溶液量来设计应根据实验所用溶液量来设计球的规格;球的规格;温度计与电热丝靠的太近,温度计与电热丝靠的太近,温度计与电热丝靠的太近,可以把装液相的球设计小一点,可以把装液相的球设计小一点,可以把装液相的球设计小一点,使温度计使温度计稍微短一点也能浸到液体中,增大与电热丝的距离;橡胶管与环境交换热量太快,可以在橡胶管外面包一圈泡沫,减少热量的散发。
凝固点的测定(物化试验得好好做)一、实验目的(1)明确溶液凝固点的定义及获得凝固点的正确方法。
(2)掌握凝固点降低法测分子量的原理,加深对稀溶液依数性的理解。
(3)掌握贝克曼温度计的使用。
(4)测定环己烷的凝固点降低值,计算萘的相对分子质量。
二、实验原理物质的相对分子质量是了解物质的一个最基本而且重要的物理化学数据,其测定方法有多种。
凝固点降低法成的物质的相对分子质量是一个简单又比较准确的方法。
凝固点降低是稀溶液的一种依数性,这里的凝固点是指在一定压力下,溶液中纯溶剂开始析出的温度。
由于溶质的加入,使固态纯溶剂从溶液中析出的温度f T 比纯溶剂的凝固点*f T 下降,其降低值f f T T T -=∆*f 与溶液的质量摩尔浓度成正比,即f T ∆=m K f式中,f T ∆为凝固点降低值;m 为溶质质量摩尔浓度;f K 为凝固点降低常数,它与溶剂的特性有关。
表1给出了部分的溶剂凝固点降低常数值。
表1 几种溶剂的凝固点降低常数值若称取一定量的溶质B W (g)和溶剂A W (g ),配成稀溶液,则此溶液的质量摩尔浓度B m 为3AB BB 10W M W m ⨯=mol/kg式中,B M 为溶质的相对分子质量。
则3Af Bf B 10W T W K M ⨯∆=g/mol若已知某溶剂的凝固点降低常数f K 值,通过实验测定此溶液的凝固点降低值f T ,即可计算溶质的相对分子量B M 。
通常测定凝固点的方法是将溶液逐渐冷却,使其结晶。
但是,实际上溶液冷却到凝固点,往往并不析出晶体,这是因为新相形成需要一定的能量,故结晶并不析出,这就是所谓过冷现象。
然后由于搅拌或加入晶种促使溶剂结晶,由结晶放出的凝固热,使体系温度回升。
从相律看,溶剂与溶液的冷却曲线形状不同。
对纯溶剂,固-液两相共存时,自由度f =1-2+1=0,冷却曲线出现水平线段。
对溶液,固-液两相共存时,自由度f =2-2+1=1,温度仍可下降,但由于溶剂凝固时放出凝固热,使温度回升,回升到最高点又开始下降,所以冷却曲线不出现水平线段,此时应加以校正。
[标签:标题]篇一:物理化学实验思考题及参考答案实验七十恒温水浴组装及性能测试1. 简要回答恒温水浴恒温原理是什么?主要由哪些部件组成?它们的作用各是什么?答:恒温水浴的恒温原理是通过电子继电器对加热器自动调节来实现恒温的目的。
当恒温水浴因热量向外扩散等原因使体系温度低于设定值时,继电器迫使加热器工作,到体系再次达到设定温度时,又自动停止加热。
这样周而复始,就可以使体系的温度在一定范围内保持恒定。
恒温水浴主要组成部件有:浴槽、加热器、搅拌器、温度计、感温元件和温度控制器。
浴槽用来盛装恒温介质;在要求恒定的温度高于室温时,加热器可不断向水浴供给热量以补偿其向环境散失的热量;搅拌器一般安装在加热器附近,使热量迅速传递,槽内各部位温度均匀;温度计是用来测量恒温水浴的温度;感温元件的作用是感知恒温水浴温度,并把温度信号变为电信号发给温度控制器;温度控制器包括温度调节装置、继电器和控制电路,当恒温水浴的温度被加热或冷却到指定值时,感温元件发出信号,经控制电路放大后,推动继电器去开关加热器。
2. 恒温水浴控制的温度是否是某一固定不变的温度?答:不是,恒温水浴的温度是在一定范围内保持恒定。
因为水浴的恒温状态是通过一系列部件的作用,相互配合而获得的,因此不可避免的存在着不少滞后现象,如温度传递、感温元件、温度控制器、加热器等的滞后。
所以恒温水浴控制的温度有一个波动范围,并不是控制在某一固定不变的温度,并且恒温水浴内各处的温度也会因搅拌效果的优劣而不同。
4. 什么是恒温槽的灵敏度?如何测定?答:TS为设定温度,T1为波动最低温度,T2为波动最高温度,则该恒温水浴灵敏度为:S??测定恒温水浴灵敏度的方法是在设定温度温度-时间曲线(即灵敏度曲线)分析其性能。
5. 恒温槽内各处温度是否相等?为什么?T2?T12下,用精密温差测量仪测定温度随时间的变化,绘制答:不相等,因为恒温水浴各处散热速率和加热速率不可能完全一致。
6. 如何考核恒温槽的工作质量?答:恒温水浴的工作质量由两方面考核:(1)平均温度和指定温度的差值越小越好。
实验三 纯液体饱和蒸气压的测定1 目的要求(1)明确气液两相平衡的概念和液体饱和蒸气压的定义,了解纯液体饱和蒸气压与温度之间的关系。
(2)测定环己烷在不同温度下的饱和蒸气压,并求在实验温度范围内的平均摩尔汽化热。
(3)熟悉和掌握真空泵、恒温槽和气压计的构造和使用。
2 基本原理(1)饱和蒸气压、正常沸点和平均汽化热:液体在密闭的真空容器中蒸发,当液体上方蒸汽的浓度不变时,即气液两相平衡时的压力,称为饱和蒸气压或液体的蒸汽压。
当液体的饱和蒸气压与大气压相等时,液体就会沸腾,此时的温度就叫该液体的正常沸点。
而液体在其它各压力下的沸腾温度称为沸点。
当纯液体与其蒸汽之间建立平衡X (l) X (g) (p,T ) (2.3.1)热力学上可以证明,平衡时p 与T 有如下关系:VS dT dp ∆∆= (2.3.2) 式中 dp 和 dT 表示由纯物质组成的两相始终呈平衡的体系中 p 和 T 的无限小变化;而△S 和△V 系指在恒定的 p 和 T 下由一相转变到另一相时 S 和 V 的变化。
因相变(2.3.1)是恒温恒压可逆过程,△G 为零,故△S 可用△H /T 代替VT H dT dp ∆∆= (2.3.3) 式(2.3.2)和式(2.3.3)均称为克拉贝龙(Clapeyron)方程式。
当在讨论蒸气压小于101.325kPa 范围内的气液平衡时,可以引进两个合理的假设:一是液-体的摩尔体积V l 与气体的摩尔体积V g 相比可略而不计,则△V =V g ;二是蒸气可看成是理想气体,则△H v 与温度无关,在实验温度范围内可视为常数。
由此得到R H pV RT R H T d p d TV H dT dp v g v gv ∆-=⋅∆-=∆=)/1(ln (2.3.4)式(2.3.4)不定积分后得克劳修斯—克拉贝龙(Clausius Clapeyron)方程式C T R H p v +⋅∆-=1303.2lg (2.3.5)式中,p 为液体在温度T (K)时的饱和蒸气压,C 为积分常数。
乙酸乙酯皂化反应速率常数的测定一、实验目的
1.用电导法测定乙酸乙酯皂化反应速率常数及活化能。
2.了解二级反应的特点。
3.了解电导率仪的构造,掌握其使用方法。
二、实验原理
乙酸乙脂皂化反应属二级反应,其计算公式:
k t=1/(atk)×(k0-k t)+ k∞,
以k t对(k0-k t)/t作图可得一直线,其斜率等于1/(ak)。
由此可求得反应速率常数k。
当把电导仪的输出与记录仪连接,就可自动记录电导的变化。
这时记录纸上的峰高将与电导成正比。
因此用峰高代替电导代入上式同样可求得k值。
三、实验步骤
1.将电导仪的记录输出与记录仪相连。
2.为了选择好电导率仪的量程和记录笔的合适位置,可先将稀释一倍的NaOH溶液20mL置于电导管中,插入电极,调节电导率仪选择开关和校正调节器,使记录笔在8mv左右。
(记录仪要先调零,量程置于10mv),走纸速度为8mm/min。
3.将混合反应器置于20℃恒温槽中,用移液管取20mL 0.02 mol L-1NaOH 标准溶液置于1池中,再取20ml 0.02 mol L-1乙酸乙酯溶液置于2池中,将电导电极插入2池,恒温10min。
4.待记录笔正好走在记录纸的某一横线处时,迅速用洗耳球使1、2池中的溶液混合均匀,约20min即可停止实验。
5.将混合反应器置于30℃恒温槽中,用移液管取20mL 0.02 mol L-1 NaOH 标准溶液置于1池中,再取20ml 0.02 mol L-1 乙酸乙酯溶液置于2池中,将电导电极插入2池,恒温10min。
6.待记录笔正好走在记录纸的某一横线处时,迅速用洗耳球使1、2池中的溶液混合均匀,约20min即可停止实验。
7.实验完毕,清洗玻璃仪器,关闭电源,整理实验台。
四、数据处理
1.将记录纸剪下。
横坐标走纸速度确定反应时间。
纵坐标可取任意标度,用来代表电导变化。
将曲线外推至起始混合得时间求得k0值。
从图上取各时间相应得纵坐标值填入记录表格中。
2.k t对(k0-k t)/t作图。
由所得直线斜率求反应速率常数k。
如果所得线性关系不好,则可能是外推k0不正确,可重推k0再作图计算。
3.或按物化实验室电脑上的CAI来处理,或自己编程处理数据。
五、讲课重点
1.用电导法测定乙酸乙酯皂化反应速率常数及活化能的原理。
2.二级反应的特点。
3.电导率仪的构造及其使用方法。
4.数据处理。
六、讲课难点
1.用电导法测定乙酸乙酯皂化反应速率常数及活化能的原理。
2.电导率仪的构造及其使用方法。
3.数据处理。
七、思考题
氯化铵生成焓的测定
一、实验目的
1、学习用热量计测定物质生成焓的简单方法。
2、加深对有关热化学知识(盖斯定律)的理解。
二、实验原理
本实验用热量计分别测定NH4Cl(s)的溶解热和NH3(aq)与HCl(aq)反应的中和热,再利用NH3(aq)和HCl(aq)的标准摩尔生成焓数据,通过Hess 定律计算NH4Cl(s)的标准摩尔生成焓。
NH 3(aq)+HCl(aq) NH4Cl(aq)
Δr H mө中和= Δf H mө(NH4Cl,aq)-Δf H mө(HCl,aq)-Δf H mө(NH3,aq)
NH 4Cl(s) NH4Cl(aq)
Δr H mө溶解= Δf H mө(NH4Cl,aq)-Δf H mө(NH4Cl,s)
Δf H mө(NH4Cl,aq)=Δr H mө中和+Δf H mө(HCl,aq)+Δf H mө(NH3,aq)
=Δr H mө溶解+Δf H mө(NH4Cl,s)
Δf H mө(NH4Cl,s)=Δr H mө中和+Δf H mө(HCl,aq)+Δf H mө(NH3,aq)-Δr H mө溶解热量计是用来测定反应热的装置。
本实验采用保温杯式简易量热计测定反应热。
化学反应在热量计中进行时,放出(或吸收)的热量会引起热量计和反应物质的温度升高(或降低)。
Δr H mө中和=-(cmΔT+C pΔT)/n
Δr H mө溶解=-(cmΔT+C pΔT)/n
式中:Δr H mө中和——中和热,J/mol
Δr H mө溶解——溶解热, J/mol
m ——物质的质量,g;
c ——物质的比热容,J•g-1•K-1;
ΔT——反应终了温度与起始温度之差,K;
C p——热量计的热容,J•K-1;
n ——反应物质的摩尔数,mol。
由于反应后的温度需要一段时间才能升到最高值,而实验所用简易热量计不是严格的绝热系统,在这段时间,热量计不可避免地会与周围环境发生热交换。
为了校正由此带来的温度偏差,需用图解法确定系统温度变化的最大值,即以测得的温度为纵坐标,时间为横坐标绘图,按虚线外推到开始混合的时间(t=0),求出温度变化最大值(ΔT),这个外推的ΔT值能较客观地反映出由反应热所引起的真实温度变化。
热量计的热容是使热量计温度升高1K所需要的热量。
确定热量计热容的方法是:在热量计中加入一定质量m(如50g)、温度为T1的冷水,再加入相同质量温度为T2的热水,测定混合后水的最高温度T3。
已知水的比热容为4.184J•g-1•K-1,设热量计的热容为C p,则
热水失热=4.184J•g-1•K-1m(T2-T3)
冷水得热=4.184J•g-1•K-1m(T3-T1)
量热计得热=C p(T3-T1)
热水失热=冷水得热+量热计得热
C p=4.184J•g-1•K-1m[(T2-T3)-(T3-T1)] /(T3-T1)
三、仪器、药品及材料
仪器:保温杯,1/10℃温度计,台秤,秒表,烧杯(100ml),量筒(100ml)。
药品:HCl溶液(1.5mol•L-1),NH3H2O溶液(1.5mol•L-1),NH4Cl(s)。
四、数据记录与处理
实验中的NH4Cl溶液浓度很小,作为近似处理可以假定:①溶液的体积为100ml;②中和反应热只能使水和热量计的温度升高;③NH4Cl(s)溶解时吸热,只能使水和热量计的温度下降。
由相应的温差(ΔT)和水的质量(m)、比热容(c)及热量计的热容(C p),即可分别计算出中和反应热和溶解热。
已知NH3(aq)和HCl(aq)的标准摩尔生成焓分别为-80.29kJ·mol-1和-167.159 kJ·mol-1,根据Hess定律计算NH4Cl(s)的标准摩尔生成焓,并对照查得的数据计算实验误差(如操作与计算正确,所得结果的误差可小于3%)。
五、实验内容及数据处理
1. 量热计热容的测定
(1)用量筒量取50.0mL去离子水,倒入量热计中,盖好后适当摇动,待系统达到热平衡后(约5~10min),记录温度T1(精确到0.1℃)。
(2)在100ml烧杯中加入50.0 mL去离子水,加热到高于T1 30℃左右,静置1~2min,待热水系统温度均匀时,迅速测量温度T2(精确到0.1℃),尽快将热水倒入热量计中,盖好后不断地摇荡保温杯,并立即计时和记录水温。
每隔30s记录一次温度,直至温度上升到最高点,再继续测定3min。
将上述实验重复一次,取两次实验所得结果,作温度-时间图,用外推法求最高温度T3,并计算热量计热容C p的平均值。
2. 盐酸与氨水的中和热及氯化铵溶解热的测定
(1)用量筒量取50.0mL 1.5mol·L-1HCl溶液,倒入烧杯中备用。
洗净量筒,再量取50.0mL 1.5mol·L-1 NH3·H2O,倒入热量计中,在酸碱混合前,先记录氨水的温度5min(间隔30s,温度精确到0.1℃,以下相同)。
将烧杯中的盐酸加入热量计,立刻盖上保温杯顶盖,测量并记录温度-时间数据,并不断地摇荡保温杯,直至温度上升到最高点,再继续测量3min。
依据温度-时间数据作图,用外推法求ΔT。
(2)称取4.0g NH4Cl(s)备用。
量取100mL去离子水,倒入热量计中,测量并记录水温5min。
然后加入NH4Cl(s)并立刻盖上保温杯顶盖,测量温度-时间数据,不断地摇荡保温杯,促使固体溶解,直至温度下降到最低点,再继续测量3min。
最后作图用外推法求ΔT。
简而言之,需要做一下几个内容:
①分别列表记录有关实验的时间—温度数据。
②作温度—时间图。
用外推法求ΔT。
③计算量热计热容量、中和热、溶解热和NH4Cl (s)生成热。
六、思考题
1.为什么放热反应的温度-时间曲线的后半段逐渐下降,而吸热反应则相反?
2.NH3(aq)和HCl(aq)反应的中和热和NH4Cl(s)的溶解热之差,是哪一个反应的热效应?
3.实验产生误差的可能原因是什么?
4.如果实验中有少量HCl溶液或NH4Cl固体粘附在量热计器壁上,对实验结果怎样影响?
七、实验注意事项
1.量热计每次用完后要清洗干净才能继续下一个实验,否则会影响实验的结果。
2.当加入NH4Cl固体并盖好杯盖时,可适当摇荡量热计以加促NH4Cl的溶解。