第一章 催化剂反应性能的测试
- 格式:ppt
- 大小:71.00 KB
- 文档页数:13

化学技术中如何进行催化剂性能测试化学技术中催化剂的性能测试是确保催化剂有效性的重要一环。
催化剂在化学反应中起着关键作用,可以加速(或减缓)反应速率,提高产品产率,或选择性地产生所需产物。
因此,对催化剂的性能进行准确的测试和评估是非常关键的。
催化剂性能测试的第一步是确定测试反应。
测试反应的选择取决于催化剂应用的具体领域和目标。
例如,在石油工业中,常用的测试反应包括加氢、催化裂化和重整等反应。
而在环保领域,催化剂的测试反应可能涉及废气处理、水处理或有毒物质的转化等。
选择合适的测试反应是确保催化剂性能测试有效性的基础。
测试反应确定后,接下来需要设计实验条件。
实验条件包括反应温度、压力、催化剂负载量等。
这些条件的选择需要考虑到催化剂的稳定性、活性以及反应的最佳条件。
此外,还需要确定反应的起始条件,例如初始反应物浓度和反应物的比例等。
这些实验条件的选择应该是被大量实验结果支持的,并且需要遵循化学反应的基本原理。
在设计实验条件后,需要进行催化剂的预处理。
预处理过程可以包括催化剂的还原、活化、酸碱处理等。
预处理是为了去除催化剂表面的杂质和不稳定物质,并恢复其活性。
此外,也可以通过预处理过程改变催化剂表面的化学性质,以提高其催化活性和选择性。
完成预处理后,可以开始进行催化剂性能的实际测试。
测试可以采用不同的方法,比如流动反应器、批量反应器或固定床反应器等。
测试过程中,需要注意控制反应的条件和实时监测产物生成速率和选择性。
这可以通过在线色谱分析、质谱分析或红外光谱等技术来进行。
这些实时监测的数据可以提供有关催化剂活性和选择性的定量信息。
除了实际测试,催化剂性能的评估还包括对催化剂的寿命和稳定性的研究。
这可以通过长时间的反应持续性测试来实现。
反应持续性测试可以模拟实际使用条件下的催化剂寿命和稳定性,从而评估催化剂的可靠性和经济性。
综上所述,催化剂性能测试是化学技术中重要的研究内容。
通过选择合适的测试反应、设计合理的实验条件、进行催化剂的预处理以及实际测试和持续性测试,可以对催化剂的活性、选择性、稳定性和经济性进行全面评估。

催化作用原理《催化作用基础》课程名称:《催化作用基础》或《催化作用原理》或《催化剂与催化作用》绪论第一章催化剂与催化作用的基本知识第二章催化剂的吸附、表面积和孔结构第三章金属催化剂及其催化作用第四章半导体催化剂及其催化作用第五章酸碱催化剂及其催化作用第六章配位络合物催化剂及其催化作用第七章催化剂的评价及失活与再生第八章催化剂的设计和制备专题讲座: 1. 择形催化与高选择性催化分子筛材料2. 芳胺N-烷基化反应及其催化剂研究3. 钛硅(TS-1)分子筛的合成及催化应用4. 催化新材料:MCM-41等#现代物理测试手段与催化剂的表征:XRD,SEM,IR,NMR,UV-Vis,UV-Raman,NH3-TPD等——催化剂及其催化作用的基础研究参考书目1.王桂茹主编,王祥生审,《催化剂与催化作用》,2000年8月第1版大连理工大学出版社出版[王桂茹,李书纹编(大连工学院石油化工教研室)(讲义) 1986年] 2.吉林大学化学系《催化作用基础》编写组编,《催化作用基础》 1980年科学出版社出版3.黄开辉,万惠霖编(厦门大学化学系),《催化原理》 1983年科学出版社出版4.顾伯锷,吴震霄编,《工业催化过程导论》 1990年高等教育出版社出版5.王文兴编,《工业催化》 1982年化学工业出版社出版6.闵恩泽著,《工业催化剂的研制与开发——我的实践与探索》,1997年中国石化出版社出版7.陈连璋编著,《沸石分子筛催化》 1990年大连理工大学出版社出版8.徐如人,庞文琴,屠昆岗等著,《沸石分子筛的结构与合成》1987年吉林大学出版社出版9.天津大学编,〈〈多相催化作用原理〉〉10.高滋主编,何鸣元,戴逸云副主编,《沸石催化与分离技术》,中国石化出版社,1999年11月第1版;* 讲述内容;学习方法:学什么?怎么学?绪论一.催化剂与催化作用的重要性1.使用催化剂的工业部门现代化学工业、石油炼制、石油化学工业、食品工业、环境保护等2.没有现代催化科学的发展和催化剂的广泛使用就没有现代化的化学工业。

催化反应速率的测量实验方法与结果分析催化反应速率测量是化学研究中重要的一项实验。
准确测量催化反应速率,对于理解催化反应机理、优化反应条件以及合成高效催化剂具有重要意义。
本文将介绍催化反应速率的测量实验方法,并对实验结果进行分析。
一、实验方法1. 催化反应装置的搭建在催化反应速率测量实验中,需要建立合适的反应装置。
一般包括反应釜、温控设备、搅拌器和观察装置等。
根据具体的反应类型和条件,选择合适的装置和材料。
2. 催化剂的制备与处理催化剂是催化反应速率测量实验中重要的组成部分。
催化剂的制备需要研究其合成方法和物性表征。
而在实际测量中,催化剂的处理也是必不可少的步骤,以确保其表面活性中心的暴露和稳定。
3. 反应物浓度的选择反应物浓度对于催化反应速率的测量有较大影响。
根据反应机理和理论计算,选择适当的反应物浓度范围,以保证实验结果的可靠性和准确性。
4. 实验条件的控制温度、压力、搅拌速度等实验条件的控制对于催化反应速率的测量至关重要。
在实验过程中,需要根据催化反应的特性和前期研究,选择适当的实验条件,并进行综合考虑和调节。
二、结果分析催化反应速率的测量实验通常需要记录反应物浓度随时间的变化。
通过对实验数据进行处理和分析,可以得到催化反应速率的相关信息。
1. 反应物浓度-时间曲线将实验数据绘制成反应物浓度-时间曲线,可以直观地观察到反应过程的动态变化。
根据曲线的斜率变化,可以得到反应速率的大小和趋势。
2. 阶段反应速率的计算根据实验数据中曲线的不同阶段,可以计算出不同阶段的反应速率。
比如在催化反应的初期和稳态阶段,反应速率可能存在差异。
计算阶段反应速率有助于理解催化反应动力学。
3. 反应机理的推测通过对催化反应速率的测量和分析,可以对反应机理进行一定程度的推测。
根据实验结果和已有的理论知识,可以初步确定可能的反应途径和速控步骤。
4. 催化剂活性的评估催化反应速率的测量实验也是评估催化剂活性的重要手段。
通过对不同催化剂活性的比较研究,可以了解不同催化剂对反应速率的影响,为催化剂设计和选择提供参考。



人教版高二上学期化学(选择性必修一)《第一章化学反应的热效应》单元测试卷-带答案一、单选题1.以太阳能为驱动力,在介导上产生空穴+h (空穴是指共价键上流失一个电子,最后在共价键上留下空位的现象),在室温条件下可将氮气转化为氨气,其工作原理如下。
下列说法错误的是A .该过程中能量变化是光能转化为化学能B .该工艺可能生成副产物氢气C .生成氨气的总反应:22322N +6H O4NH +3O 光催化D .VB 上产生+3 mol h ,CB 上产生3NH 11.2 L (标准状况)2.在一定温度和压强下,由指定的单质生成1mol 纯物质的热效应为生成热,可以用物质生成热表示物质的相对能量。
几种物质的生成热如表所示。
物质()2F g ()2S g ()4SF g ()6SF g生成热()()1ΔH /kJ mol-⋅0 128 775- 1209-已知键能是指气态分子中1mol 化学键解离成气态原子所吸收的能量。
F F -键能为1157kJ mol -⋅,假设()()46SF g SF g 、中S F -键能相等。
下列叙述正确的是A .()2S s 的生成热大于1128kJ mol -⋅B .()()()1224S g 4F g 2SF g ΔH 1678kJ mol -+==+⋅C .稳定性:()()46SF g SF g >D .上述物质中,S F -键能为1295.5kJ mol -⋅ 3.下列说法中正确的是。
A .放热反应都不需要加热,吸热反应都需要加热B .常温下。
反应()()()2C s CO g 2CO g +=不能自发进行,则该反应的H 0∆>C .若()()()()4222CH g 2O g CO g 2H O g +=+ 812.3kJ mol H ∆=-,则甲烷的燃烧热为812.3kJ molD .若()()2242NO g N O g 56.9kJ mol H ∆=-,则将()22mol NO g 置于密闭容器中充分反应放出的热量为56.9kJ4.2003年10月15日,我国“神舟”五号载人飞船成功发射,航天飞船是用铝粉与高氯酸铵的混合物燃料,点燃时铝粉氧化放热引发高氯酸铵反应:2NH 4ClO 4(s)△N 2(g)+4H 2O(1)+Cl 2(g)+2O 2(g)△H <0。

催化剂检测标准
一、催化剂活性检测
催化剂的活性是指其在化学反应中促进反应的能力。
检测催化剂活性的主要方法包括:
1.1测定催化剂对反应物转化率的提高;
1.2测定催化剂促进反应速率的提高;
1.3测定催化剂对反应条件要求的改善。
二、催化剂稳定性检测
催化剂的稳定性是指其在长期使用过程中保持活性的能力。
检测催化剂稳定性的主要方法包括:
2.1在反应条件下,检测催化剂活性的衰减;
2.2测定催化剂在反应条件下的使用寿命;
2.3测定催化剂在重复使用过程中的活性变化。
三、催化剂寿命检测
催化剂的寿命是指其在达到预期性能之前可用的时间。
检测催化剂寿命的主要方法包括:
3.1记录催化剂从投入使用到失去活性所需的时间;
3.2测定催化剂在使用过程中的活性变化趋势;
3.3结合反应效率和催化剂稳定性评估催化剂寿命。
四、催化剂中毒性检测
催化剂的毒性是指其对反应物或产物的敏感度,以及在接触这些物质时可能发生的性能变化。
检测催化剂中毒性的主要方法包括:
4.1在接触有毒物质时,观察催化剂活性的变化;
4.2测定有毒物质在反应条件下对催化剂活性的影响;
4.3测定有毒物质在重复使用过程中的对催化剂活性的影响。
五、催化剂磨损性检测
催化剂的磨损性是指其在运输、装卸和使用过程中,因物理或化学作用而产生的质量损失或形态变化。
检测催化剂磨损性的主要方法包括:
5.1测定催化剂在物理或化学作用下质量的变化;
5.2观察催化剂在使用过程中形态的变化;
5.3结合使用条件和催化剂物理性能评估催化剂的磨损性。
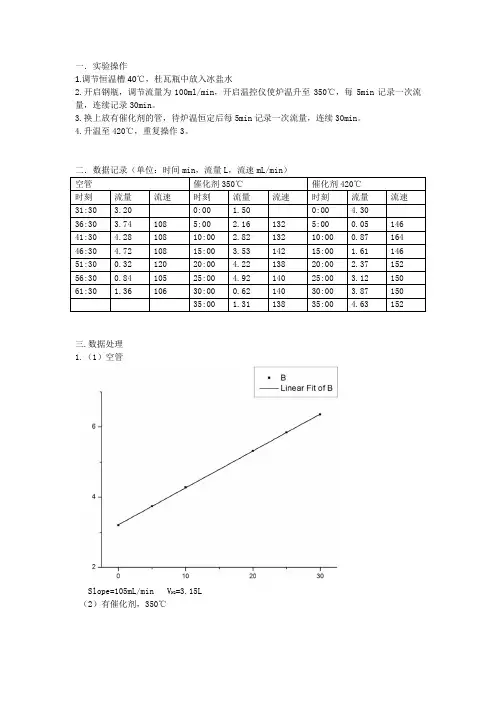
一.实验操作1.调节恒温槽40℃,杜瓦瓶中放入冰盐水2.开启钢瓶,调节流量为100ml/min,开启温控仪使炉温升至350℃,每5min记录一次流量,连续记录30min。
3.换上放有催化剂的管,待炉温恒定后每5min记录一次流量,连续30min。
4.升温至420℃,重复操作3。
二.数据记录(单位:时间min,流量L,流速mL/min)空管催化剂350℃催化剂420℃时刻流量流速时刻流量流速时刻流量流速31:30 3.20 0:00 1.50 0:00 4.3036:30 3.74 108 5:00 2.16 132 5:00 0.05 146 41:30 4.28 108 10:00 2.82 132 10:00 0.87 164 46:30 4.72 108 15:00 3.53 142 15:00 1.61 146 51:30 0.32 120 20:00 4.22 138 20:00 2.37 152 56:30 0.84 105 25:00 4.92 140 25:00 3.12 150 61:30 1.36 106 30:00 0.62 140 30:00 3.87 15035:00 1.31 138 35:00 4.63 152三.数据处理1.(1)空管Slope=105mL/min V N2=3.15L(2)有催化剂,350℃Slope=139.5mL/min V H2+CO =30*139.5-V N2=1.03L (3)有催化剂,420℃Slope=150.5mL/min V H2+CO =30*150.5-V N2=1.365L2.p(CH 3OH)=35091Pa p(大气压)=101.55Kpa=p(CH 3OH)+p (N 2) p (N 2)=66459Pa mol RTV N N 0880.0p n 222N ==CH3OHN2OH3CH N2n n p p =n (CH 3OH )=0.0465molm (CH 3OH )=1.488g3.(1)350℃mol 0144.05.17273*314.886.34RT V *p n CH3OH =+==)(’大气压m ’=0.461g(2)420℃ mol 0191.05.17273*314.821.46RT V *p n CH3OH =+==)(’大气压m ’=0.611g4.(1)350℃ 74.7m 100*n n ZnO==’催化活性 (2)420℃ 27.10m 100*n n ZnO==’催化活性 四.1.V H2+CO 是通过有无催化剂时的流量差求得的,所以必须保持氮气流量不变2.使未反应的甲醇冷凝,从而可以测量V H2+CO3.(1)操作简单,便于在不同温度下测量,催化剂可重复利用 (2)实验设施复杂,易造成误差4.相同:都可以测定流量不同:毛细管流量计在管路支线,而湿式流量计在管路主线。



实验一 催化剂在化学反应中的作用验证1、 实验目的(1) 通过实验了解温度、浓度和催化剂对化学反应速率的影响,加深对活化能的理解,并练习反应速率常数的求算方法和根据实验数据作图求活化能的方法。
(2) 通过活化能的求算,加深对催化剂对于催化反应作用的认识,加深对催化剂通过降低反应活化能加快反应速率概念的理解。
2、 实验原理在实验中,过二硫酸氨与碘化钾发生如下反应:3424248224)(3)(KI SO K SO NH KI O S NH ++=+○1 反应式○1的反应速率与反应物浓度的关系,可用下式来表示:)()()(282282---⋅=∆∆-=I c O S kc tO S c v n m式中,v 为平均速率,△c (S 2O 82-)为S 2O 82-在△t 时间内物质的量浓度的改变值;c (S 2O 82-)、c (I -)分别为两种离子的初始浓度;k 为反应的速率常数;m 与n 之和为反应级数。
为了能够测出在一定时间(△t )内△c (S 2O 82-),在混合(NH 4)2S 2O 8和KI 的同时,加入一定体积已知浓度并含有淀粉的Na 2S 2O 3溶液,这样在反应○1进行的同时,也进行着如下反应:----+=+I O S I O S 322643232○2 反应○2进行得非常快,几乎瞬间完成。
而反应○1生成的I 2立即与S 2O 32-作用,生成无色的S 4O 62-和I -。
在开始的一段时间内,看不到碘与淀粉作用而显蓝色。
但是,一旦Na 2S 2O 3耗尽,由反应○1继续生成的I 3-离解生成的微量的碘就立即与淀粉反应而使溶液显出特有的蓝色。
从反应式○1和○2的关系可以看出,c (S 2O 82-)减少量总是等于c (S 2O 32-)的减少量的一半,即2)()(232282--∆=∆O S O S c ,由于在△t 时间内S 2O 32-全部耗尽,浓度最后为零,所以△c (S 2O 32-)的绝对值实际上就是反应开始时Na 2S 2O 3的浓度。
催化反应速率的测量实验方法与结果分析催化反应速率的测量对于理解催化剂的性能和反应机理具有重要意义。
本文将介绍常见的催化反应速率测量实验方法,并对实验结果进行分析和解读。
一、表面法表面法是一种常见的催化反应速率测量方法,它通过测量催化剂表面上反应产物的形成速率来确定反应速率。
实验步骤如下:1. 准备催化剂:选择合适的催化剂样品,并在适当温度和气氛下预处理。
2. 进行反应:将催化剂样品放置在反应装置中,加入反应物质,并控制反应条件(如温度、压力等),使反应在催化剂表面发生。
3. 采集产物:通过适当的分析方法,采集并测量反应产物的形成速率。
4. 数据处理与分析:根据测量结果,计算出反应速率,并进行进一步数据分析。
二、比色法比色法是一种常用的催化反应速率测量方法,它通过测量反应溶液中某种物质浓度随时间的变化来确定反应速率。
实验步骤如下:1. 准备反应溶液:将反应物质溶解在适当的溶剂中,制备出反应溶液。
同时,选择合适的指示剂或染料,使其能与反应产物发生显色反应。
2. 进行反应:将反应溶液放置在反应装置中,并控制反应条件(如温度、pH等),使反应在一定时间范围内进行。
3. 比色测量:利用分光光度计或比色计测量反应溶液中某种物质的吸光度或颜色强度随时间的变化。
4. 数据处理与分析:根据测量结果,计算出反应速率,并进行进一步数据分析。
三、质谱法质谱法是一种高灵敏度的催化反应速率测量方法,它通过测量反应溶液中某些物质的质谱信号强度随时间的变化来确定反应速率。
实验步骤如下:1. 准备反应溶液:将反应物质溶解在适当的溶剂中,制备出反应溶液。
同时,选择合适的质谱离子源和检测器,使其能够对反应物质进行质谱测量。
2. 进行反应:将反应溶液放置在质谱仪中,并控制反应条件(如温度、压力等),使反应在质谱仪中进行。
3. 质谱测量:利用质谱仪对反应溶液中某些物质的质谱信号进行实时监测,并记录其强度随时间的变化。
4. 数据处理与分析:根据测量结果,计算出反应速率,并进行进一步数据分析。
催化材料智慧树知到课后章节答案2023年下南开大学南开大学第一章测试1.吸附和脱附过程属于催化学科研究的范畴。
()A:错 B:对答案:对2.合成氨催化剂可能会用到铁。
()A:错 B:对答案:对3.以下说法不正确的是()。
A:催化科学形成比较早,古人从酿酒和制醋的方法就体现出来了 B:绿色化学符合“碳达峰、碳中和”的理念 C:催化剂的外型对催化性能有影响 D:催化科学是一门交叉学科答案:催化科学形成比较早,古人从酿酒和制醋的方法就体现出来了4.非均相催化中最本质的一步是反应物吸附在催化剂表面,对吗?()A:对 B:错答案:错5.催化学科需要用到以下哪些学科?()A:表面科学 B:金属有机化学 C:物理化学 D:化学工程答案:表面科学;金属有机化学;物理化学;化学工程第二章测试1.以下对吸附位能曲线描述不正确的是()A:吸附位能曲线是来描述化学吸附过程的 B:化学吸附热一定大于物理吸附热C:吸附热的大小可以衡量吸附强弱的程度 D:分子在催化剂表面解离需要吸收能量答案:吸附位能曲线是来描述化学吸附过程的2.下列对吸附机理认识正确的是()A:对于单原子的吸附,如果反键轨道被电子占据,可能会削弱吸附过程 B:催化剂一般只有一种活性中心,对特定的反应物起作用 C:电子会优先占据所以成键轨道,再依次占据反键轨道 D:表面覆盖度只能用来描述气体在催化剂上的吸附过程答案:对于单原子的吸附,如果反键轨道被电子占据,可能会削弱吸附过程3.对吸附态的表征有哪些()。
A:低能电子衍射 B:电子顺磁共振技术 C:红外光谱技术 D:光电子能谱答案:低能电子衍射;电子顺磁共振技术;红外光谱技术;光电子能谱4.电子顺磁共振技术可以研究物质的磁性。
()A:错 B:对答案:对5.在数值上,脱附活化能等于吸附活化能与化学吸附热之和。
()A:错 B:对答案:对第三章测试1.下列对固体酸的活性与选择性说法正确的是()A:烷基化反应需要酸浓度高的固体酸催化剂 B:氢转移反应有利于降低产物中烯烃含量,也导致积碳 C:酸中心太强往往容易导致积碳发生 D:正碳离子中的正电荷受烷基的分散作用越大,正碳离子就越不稳定答案:氢转移反应有利于降低产物中烯烃含量,也导致积碳;酸中心太强往往容易导致积碳发生2.烷基化油能减少废气排放,提高空气质量。
化工催化剂的质量标准及检验方法化工催化剂是一类特殊的化学物质,它能够加速化学反应的速率,提高反应的选择性和产率。
催化剂在化工生产中起着至关重要的作用,但其质量控制也是非常重要的。
本文将介绍化工催化剂的质量标准及检验方法。
化工催化剂的质量标准通常包括以下几个方面:1. 成分纯度:催化剂的纯度是影响其催化性能的关键因素之一。
对于主要成分来说,其纯度应达到99%以上。
此外,在催化剂中其他可能存在的杂质也需要控制在一定范围内,以确保催化剂在实际应用中的性能和稳定性。
2. 活性中心含量:催化剂中的活性中心是发挥催化作用所必需的组分。
因此,催化剂的质量标准中通常会规定活性中心的含量要求。
活性中心的含量一般以摩尔百分比表示,通常在1%-30%之间,具体取决于催化剂的应用和性质。
3. 物理形状和颗粒大小:催化剂的物理形状和颗粒大小对于反应过程的影响很大。
因此,质量标准通常要求催化剂颗粒的形状和大小均匀一致,以确保催化剂在反应中的传质和传热性能。
4. 表面特性:催化剂的表面特性,如比表面积和孔隙结构,直接影响其催化活性。
通常,催化剂的比表面积要求在50-500 m2/g之间。
而对于孔隙结构,催化剂通常需要具备一定的孔隙体积和孔径分布,以提供足够的催化活性中心和表面积。
对于化工催化剂的检验方法,主要分为原料检验和成品检验两个环节。
以下是常用的检验方法:1. 原料检验:原料检验通常包括对催化剂的成分纯度、物理形状和颗粒大小等进行检验。
其中,纯度可以通过高效液相色谱法(HPLC)或气相色谱法(GC)等分析方法进行测定。
物理形状和颗粒大小则可以通过显微观察或粒度分析仪进行测量。
2. 成品检验:成品检验主要是通过一系列实验方法来评估催化剂的催化性能和稳定性。
常见的检验方法包括活性测试、催化反应动力学研究、比表面积和孔隙结构测量等。
其中,活性测试可以采用标准反应体系和设备进行,例如,在液相催化反应中,可以通过检测产物浓度的变化来评估催化剂的活性。
催化剂性能的评价、测试和表征 概述主要内容• 活性评价和动力学研究• 催化剂的宏观物理性质测定 • 催化剂微观性质的测定和表征工业催化剂性能评价的目的①为应用提供依据②为开发制备提供判别的标准 ③基础研究的需要 评价内容① 使用性能活性,选择性,寿命 ②.宏观性能:比表面积,孔结构,形状与尺寸 ③.微观性能:晶相组成,表面酸碱性• 工业催化剂的性能要求及其物理化学性质4催化剂测试• 催化剂的物理性质的测定 ,包括宏观物理性质(孔容、孔径分布、比表面等)及微观物理性质(催化剂的晶相、晶格缺陷、微观粒径尺寸等) 几个基本概念评价(evaluation ),对催化剂的化学性质考察和定量描述; 测试(test ),对工业催化剂物理性质(宏观和微观)的测定; 表征(Characterization ),综合考察催化剂的物理、化学的性质和内在联系,特别是研究活性、选择性、稳定性的本质原因。
第一节.活性评价和动力学研究活性测定方法:流动法和静态法,流动法用得最多(一般流动法、流动循环法、催化色谱法) 本质上是对工业催化过程的模拟流动循环法、催化色谱法多用于反应动力学和反应机理 活性测试的目的a )由催化剂制造商或用户进行的常规质量控制检验b )快速筛选大量催化剂,以便为特定的反应确定一个催化剂评价的优劣。
c )更详尽的比较几种催化剂d )测定在特定催化剂上反应的详尽动力学,包括失活或再生动力学。
e )模拟工业反应条件下催化剂的连续长期运转 活性的表示方法• 转化率(X A)活性的表示方法• 选择性(S)%100⨯=的起始摩尔数反应物已转化的摩尔数反应物A A X A %100⨯=摩尔数已转化的某一反应物的所得目的产物的摩尔数S收率(Y)Y=X A ×S• 时空得率(STY ):每小时、每升催化剂所得产物的量关于时空得率:指在一定条件(温度、压力、进料空速)下,单位体积或单位质量催化剂所得到产物量,多用于工业生产和工业设计,可直接计算出量产。