高致病性猪蓝耳病JXA1-R株活疫苗免疫效果初步监测试验
- 格式:pdf
- 大小:252.34 KB
- 文档页数:3

畜牧兽医Xu m u s h o u yi1高致病性蓝耳病诊断1.1临床症状当生猪感染高致病性蓝耳病病毒后,其体温将会明显升高,高达41℃以上,眼睑出现水肿现象,同时伴随着咳嗽、气喘等呼吸道症状;此外,部分病猪后驱无力,无法站立;仔猪患上高致性蓝耳病的发病率为100%,而仔猪的死亡率已经超过了50%;而成年猪同样会出现死亡的状况。
1.2剖检变化脾脏边缘或者表面出现梗死灶,如若在显微镜下进行观察,则发现出血性梗死;并且肾脏呈现出土黄色,表面可见针尖至小米粒大出血斑点、肝脏、膀胱、心脏、肠道、扁导体、皮下等均可见出血点和出血斑。
显微镜下肾间质性炎,膀胱、肝脏、心脏出血性、渗出性炎等病变;此外,部分病例可见胃肠道出血、溃疡等。
1.3诊断分析在高致病性猪蓝耳病的诊断,可以根据临床症状以及病理变化而定,但是这种方式只能够作为初步诊断。
要想实现对高致病性猪蓝耳病进行确定,就必须通过实验室对其病毒进行分离鉴定,或者反转录聚合酶链式反应(RT-PCR)检测,如果检测鉴定结果为阳性,则最终判定为高致病性猪蓝耳病。
2高致病性蓝耳病防控策略2.1杜绝病源引入在高致病性蓝耳病的防控过程中,控制传染源是当前最有效的预防方式,并且能够取得较为显著性的成效。
为了从根本上达到高致病性蓝耳病的目的,就需要从选种着手,做好猪种的引进与管理工作。
在种猪的引进过程中,需要对引进的种猪进行PRRSV检测,以此来杜绝病源的引入,避免对养殖户造成不必要的经济损失。
此外,养殖户需要将引进的种猪进行隔离检疫3-4周左右,只有经过检疫过关的种猪才能够混群饲养,进而降低其存在的风险。
2.2加强饲养管理在生猪的养殖过程中,需要贯彻落实全进全出的制度,养殖户尽可能的减少猪群转栏次数,减少应激。
同时养殖户要做好生猪养殖管理,选择科学的饲养方式,为生猪加强营养,饲养全价配合饲料,增加猪的免疫力,提高生猪抵抗疾病的能力。
尤其在高温季节,养殖户需要做好猪舍的通风与降温工作,定时为生猪提供充足的饮用水。

基础母猪≥200头调查结果
齐鲁动保技术服务团队共调查了82个基础母猪≥200头的猪场,共涉及了15个省市,其中免疫蓝耳疫苗的猪场比例为68.29%,不免疫猪场比例为31.71%;而基础母猪≥5 000头的12个猪场,免疫蓝耳疫苗的猪场比例为75%,不免疫猪场比例为25%;猪场免疫蓝耳共涉及了7个毒株,其中以VR2332株免疫率最高,其次是TJM-F92株、CH-1R株、JXA1-R株;而基础母猪≥5 000头,依然是VR2332株免疫率最高,其次是JXA1-R株、TJM-F92株;随着养殖规模的扩大,免疫
基础母猪≥5000头调查结果
68
齐鲁动保检测中心共收到了8 500个血清,来自于15个省市,蓝耳平均抗体合格率为78.05%;15个省市抗体合格率变动范围在54.72%~97.14%;其中甘肃、天津、安徽因为送检样品数量较少,其结果的代表性相对较差。
而送检样品较多的省份为山东、山西、河北、黑龙江、辽宁、四川、江西,其抗体合格率分别为80.53%、83.49%、78.09%、74.5%、66.23%、62.54%、87.55%,抗体合格率变动范围在62.54%~87.55%。
(2)免疫群体与不免疫群体检测结果与分析
由于该送检血清既有免疫猪场又有不免疫猪场,按照平均值分析抗体合格率确实很难反馈临床真实的免疫水平。
因此把免疫群体与不免疫群体分类汇总比较,免
共检测了种公猪、后备母猪、妊娠母猪、产房母猪、空怀母猪、哺乳仔猪、保育猪、育肥期共8个阶段,整体在62.71%-89.21%范围波动,以保育猪抗体合格率最。

猪瘟蓝耳这俩疫苗到底能不能一起免?研究证实,猪蓝耳病弱毒疫苗会降低猪瘟抗体水平猪蓝耳病与猪瘟仍是我们养猪业最常见的2种病毒性疾病,在生产实践中,猪蓝耳病、猪瘟混合感染的情况也越来越多,同时2种疾病都有可能引起猪高热病综合症,现已成为危害我国养猪业的最重要疾病,是疫病防控的重点。
当前,针对这2种疾病的防治主要是以疫苗免疫为主,但这2种疾病免疫时间较接近,且蓝耳病病毒的感染可引起机体的免疫抑制。
为探索猪蓝耳病弱毒苗对猪瘟抗体水平的影响,对广东某1600头基础母猪规模猪场进行了为期1年的抗体水平监测。
了解其在免疫了猪蓝耳病弱毒株JXA1-R后对猪瘟抗体水平的影响。
1、试验材料与方法1.1试验材料1.1.1试验动物广东某1600头基础母猪群规模猪场,每次随机抽取100份血清样品检测。
1.1.2检测试剂猪瘟抗体检测ELISA试剂盒、蓝耳病抗体检测ELISA试剂盒(均为美国IDEXX公司产品)。
1.1.3主要试验仪器微量加样器;Elx800型酶标仪。
1.1.4试验用疫苗猪瘟弱毒疫苗(传代细胞源);高致病性猪蓝耳病弱毒疫苗(JXA1-R株)1.2 试验方法蓝耳与猪瘟疫苗采用普免的方式:3个月1次,一年4次。
全场公、母猪1月份、4月份、7月份和10月份的第一周免疫猪瘟弱毒疫苗2头份,全场公、母猪2月份、5月份、8月份和11月份的第一周免疫蓝耳弱毒疫苗JXA1-R株2头份。
小猪2周龄免疫蓝耳弱毒苗1头份,4周龄与9周龄分别免疫猪瘟疫苗1头份与2头份。
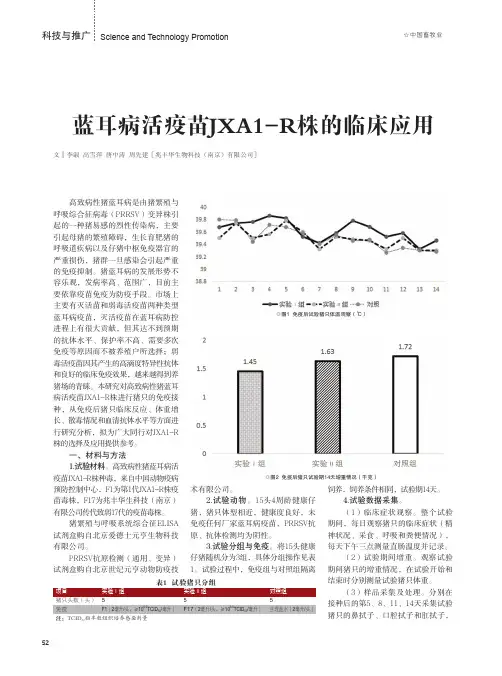
本试验从2012年的11月份首次全场免疫了蓝耳弱毒疫苗后,2013年的1月份、4月份、 7月份和10月份的25号检测蓝耳与猪瘟抗体水平,对猪场内的30头公猪全部进行采血检测,经产母猪随机抽取100头进行检测,7周龄与12周龄小猪随机抽取50头进行检测。
2013年该猪场重胎母猪出现流产比例达到8%,产出的胎儿中死胎比例达到12%,保育猪消瘦,咳嗽,死亡率达到15%。
1.3 ELISA试验方法及判断标准ELISA试验方法及判断标准,参照IDEXX公司试剂盒的说明和标准执行。

猪高致病性蓝耳病的诊断和治疗彭焕文(山东省诸城市畜牧兽医管理局山东潍坊262200)摘要:高致病性猪蓝耳病是猪的常见病。
此病会导致母猪出现生殖障碍,仔猪呼吸异常等疾病。
本文从其临床症状、病理变化等方面介绍诊疗过程,并提出具体的防治措施。
为蓝耳病的治疗和诊断提供依据。
关键词:高致病性蓝耳病;诊断;治疗高致病性猪蓝耳病是由猪繁殖与呼吸综合征病毒变异株引起的一种急性高致死性疾病[1],一年四季均有可能发生,尤其是在高温季节。
仔猪的发病率可达到100%,死亡率50%以上;母猪患病后,流产率30%以上。
1流行病学高致病性猪蓝耳病是一种高接触性的传染病,其发病呈现地方性流行。
传染源主要是患病的以及带毒的猪只。
此病可以通过接触、空气以及精液传播[2]。
2临床症状高致病性猪蓝耳病发病快,死亡率高。
患病猪只精神沉郁,食欲减退或废绝,高热,咳嗽,呼吸急促,耳缘发绀,皮下出血[3]。
有些患病猪只还出现神经症状,腹泻,眼结膜充血,发红等。
母猪患病2~3d 后会出现流产,死胎,产下的仔猪在2~3d内死亡率95%以上。
3病理变化解剖可见脾脏边缘或表面出现梗死灶,显微镜下可见出血性梗死。
肾脏表面有点状出血,肠道和颌淋巴结肿大。
皮下扁桃体、心脏、膀胱和肠道均可见出血点和出血斑。
部分病例可见胃肠道出血、溃疡坏死。
肺部呈现暗红色,支气管内有大量泡沫样血[3]。
肾小球淤血明显,囊腔中会出现红细胞,肾小管内有红色物质。
脾脏梗死,淋巴细胞充血与出血。
4防治措施4.1治疗方法此病无特效药可用,主要使用头孢类、黄芪多糖注射液和抗病毒药物。
如果出现高热症状,可以加入氨基比林。
此外,可以适时补充能量合剂、肌酐、VC和三磷酸腺苷。
治疗病猪时,应同时应用抗生素,防止继发感染。
4.2预防措施4.2.1保持环境卫生此病主要经胎盘传播,应禁止从疫区引入种猪,同时,严格控制饲料品质,给猪提供营养全面的饲料,增加维生素、矿物质的用量,注意饮水卫生。
定期消毒圈舍,及时消灭病原。

高致病性猪蓝耳病监测计划(一)监测目的掌握猪高致病性猪蓝耳病流行情况,分析病毒遗传变异特征和规律;发现疫病传播风险因素;评估免疫效果,掌握群体免疫状况。
(二)监测对象猪。
重点对种猪场、规模猪场、生猪屠宰场和发生过疫情地区的猪进行监测。
(三)监测时间上、下半年各进行一次集中监测,分别在5月底前和11月底前完成。
发现可疑病例,随时采样,及时检测。
(四)监测分工和数量1. 市动物疫病预防控制中心负责全市原种猪场、生猪屠宰场,以及XX农场生猪养殖场免疫抗体监测和/或病原学监测。
对病原学阳性样品,及时送国家猪繁殖与呼吸综合征参考实验室进行进一步分析。
原种猪场血清样品每场每次不少于30头份,猪扁桃体或全血每场每次不少于15头份,精液每场每次不少于5份;XX农场生猪养殖场血清样品每场每次不少于15头份,猪扁桃体或全血每场每次不少于5头份;采集5个生猪屠宰场血清样品和猪肺脏或扁桃体或颌下淋巴结样品,每场每次各不少于30份。
2. 各区动物疫病预防控制机构负责辖区内规模猪场、家庭农场免疫抗体监测和病原监测。
XX区采集5个规模猪场血清样品和全血样品(每场每次各不少于30份),其余区采集所有规模猪场血清样品和全血样品(每场每次各不少于30份);XX区采集5户家庭农场血清样品和全血样品(每场每次各不少于30份)。
3. 临床病例报告。
任何单位和个人发现监测对象中出现临床异常情况且诊断为临床病例的,应及时按规定报告。
高致病性猪蓝耳病监测采样可与猪口蹄疫、猪瘟监测采样相结合。
(五)检测方法1. 血清学检测采用ELISA方法进行检测。
2. 病原学检测活体采集全血或扁桃体,采用RT-PCR或荧光RT-PCR 方法进行检测。
屠宰场可采集猪肺脏、扁桃体、颌下淋巴结样品进行病原检测。
(六)判定标准1. 免疫合格个体活疫苗免疫28天后,猪蓝耳病ELISA抗体检测阳性判定为合格。
2. 确诊阳性个体采用病原学方法检测,排除疫苗免疫阳性,结果为阳性的。



安徽省绩溪县高致病性猪繁殖与呼吸综合征活疫苗免疫效果评价胡嘉彦【摘要】某猪场使用政府指定的高致病性猪繁殖与呼吸综合征活疫苗(JXAI-R株)对3窝断奶仔猪进行免疫,并对其免疫抗体水平进行监测,以了解该疫苗的免疫效果.结果表明,采用高致病性猪繁殖与呼吸综合征活疫苗(JXAI-R株)一次免疫后抗体有效期达11周以上,且无不良反应.初步说明政府指定的高致病性猪繁殖与呼吸综合征活疫苗(JXAI-R株)具有较好的安全性和有效性.由此可见,该疫苗的使用有利于高致病性猪繁殖与呼吸综合征的防控.【期刊名称】《畜牧与饲料科学》【年(卷),期】2016(037)005【总页数】2页(P107-108)【关键词】猪繁殖与呼吸综合征;活疫苗;免疫;抗体;合格率【作者】胡嘉彦【作者单位】安徽省绩溪县畜牧兽医水产局,安徽绩溪245300【正文语种】中文【中图分类】S858.28;S852.4猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒引起的病毒性疾病[1],1996 年郭宝清[2]等首次从国内发病猪群中分离出该病毒,从而证实了我国猪群存在该病的发生。
在我国,猪繁殖与呼吸综合征又称为猪蓝耳病,其变异株病毒引起的猪蓝耳病又叫“高致病性猪蓝耳病(HP-PRRS)”,同时,世界动物卫生组织(OIE)将该病列入必须报告的动物疫病,我国将其列为一类动物疫病。
目前,应用疫苗接种是防控该病的主要措施之一[3]。
安徽省绩溪县生猪养殖是农业主导产业之一,多数规模场和散养户均使用政府采购的高致病性猪繁殖与呼吸综合征活疫苗(JXAI-R株)进行免疫,为评估该疫苗免疫效果,选择某自繁自养猪场不同批次育肥猪进行跟踪监测。
试验对断奶仔猪猪繁殖与呼吸综合征母源抗体水平进行检测,以确定该猪场首次免疫时间;并使用高致病性猪繁殖与呼吸综合征活疫苗(JXAI-R株)免疫,对免疫抗体水平进行不同阶段监测,以期了解高致病性猪繁殖与呼吸综合征活疫苗(JXAI-R株)的安全性和有效性,为预防和控制上述疾病提供参考,为该猪场制定合理的免疫程序提供科学依据。

湖北畜牧兽医2014年2仔猪抗体检测结果由表1可知,仔猪使用弱毒活苗的检测得到的抗体阳性率均高于灭活疫苗产生抗体水平。
而进口活疫苗免疫检测得到的阳性率为25%,高于国产活疫苗20%。
灭活疫苗当中,高致病性蓝耳病活疫苗免疫测得到的阳性率为15%高于普通灭活苗10%。
3讨论3.1不同种类猪蓝耳病疫苗的比较目前,猪蓝耳病疫苗的种类大致分为2种,即:弱毒疫苗和灭活苗。
猪蓝耳病弱毒疫苗是使猪蓝耳病病毒致病力减弱但仍具有活力的完整病原疫苗。
该疫苗的优点是病原可在免疫动物体内繁殖,用量小,免疫原性好,免疫期长,成本低,使用方便。
缺点是弱毒株的毒力易返强,对一些极易感动物存在一定的危险性,目前,市场上应用的活疫苗大多为弱毒疫苗。
猪蓝耳病灭活苗既可以是蛋白质疫苗,也可以是多糖疫苗。
该疫苗常需多次接种,接种1剂不产生具有保护作用的免疫,仅仅是“初始化”免疫系统。
必须接种第2剂或第3剂后才能产生保护性免疫。
猪蓝耳病疫苗具体可分为:猪蓝耳病普通灭活疫苗(CH-1a 株),高致病性猪蓝耳病灭活疫苗(NVDC-JXA1株),国产猪蓝耳病弱毒疫苗(CH-1R 株),进口猪蓝耳病弱毒疫苗(ATCC VR-2332株),其中高致病性猪蓝耳病灭活疫苗(NVDC-JXA1株)作为国家强制免疫疫苗[4]。
该疫苗因为是死疫苗,所以其安全性好,但其也有一定的缺点,即:免疫剂量大、免疫次数多、产生免疫所需的时间较长。
在实际养殖过程中,我们应该如何选择疫苗,这应根据猪群PRRS 感染情况而定,对于尚未感染猪只,使用灭活疫苗即可。
3.2防治措施目前,蓝耳病的免疫机理尚不明确,该病毒的抗原多样,随着在动物体内的演变,抗原也在逐步变异,这使得对猪蓝耳病的防治变得较为困难。
我国在面对猪蓝耳病问题上,主要采取以下措施:首先,养殖场定期做好消毒、灭鼠、杀虫工作,建立完整的防疫制度。
其次,施行封闭养殖模式,对外来引进的猪只做好监测工作,严禁将带病猪只引入,加强饲养管理。