全湿法从锰钴镍渣中回收钴、镍的试验研究
- 格式:pdf
- 大小:262.13 KB
- 文档页数:3

湿法炼锌新型除钴剂净化除钴实验研究杨茂峰;陶政修;陈光耀;张小宁【摘要】文章介绍了利用一种新型除钴剂ZAC在湿法炼锌过程中进行净化除钴的实验研究,实验表明,新型除钴剂能在较低温度约60~70℃下实现深度除钴同时能净化铜、镉、铁等杂质,按硫酸锌液所含Cu+Cd×0.6+Co+Fe合计质量含量的30倍加入除钴剂,反应1.5 h,溶液中钴浓度可降至0.5mg/L以下,且其余Cu、Cd、Fe均满足电积锌的要求.【期刊名称】《大众科技》【年(卷),期】2017(019)006【总页数】3页(P46-48)【关键词】湿法炼锌;新型除钴剂;除钴;净化【作者】杨茂峰;陶政修;陈光耀;张小宁【作者单位】来宾华锡冶炼有限公司,广西来宾 546115;来宾华锡冶炼有限公司,广西来宾 546115;来宾华锡冶炼有限公司,广西来宾 546115;来宾华锡冶炼有限公司,广西来宾 546115【正文语种】中文【中图分类】TF03目前,湿法炼锌是世界上最主要的炼锌方法,占锌总产量的80%以上,而且随着技术的发展呈不断增长的趋势。
来冶公司即是典型的湿法炼锌工艺,锌精矿经焙烧、浸出之后,锌以离子形式进入到溶液中,但其它杂质元素如铜、镉、钴、镍、砷、锑、锗等也会进入硫酸锌浸出液中。
如果这些杂质含量过高对锌电积技术经济指标和电积锌质量有很大影响,严重时会导致生产不能正常进行。
为了达到锌电积的要求,硫酸锌浸出液中的铜、镉、钴、镍、砷,锑、锗等有害杂质必须净化到规定的标准以下,同时在这一过程中使铜、镉、钴、镍等有价金属得到很好的富集,以便于回收利用。
因此净化是湿法炼锌最重要的工序之一。
目前硫酸锌浸出液的净化过程中,所采用的除钴方法有多种,归纳起来有两类,一类是锌粉置换(加添加剂)法,另一类是特殊化学品净化法。
现今来冶公司使用的是四段锑盐净化法的流程:第一段在低温(40~65℃)下加锌粉除铜、镉,第二段在高温(80~90℃)下加锌粉和锑盐除钴,第三段在中温(60~70℃)下加锌粉和锑盐除钴、镉、镍及其它一些微量的杂质元素,为了保证新液达标,再进行第四段低温除残镉。
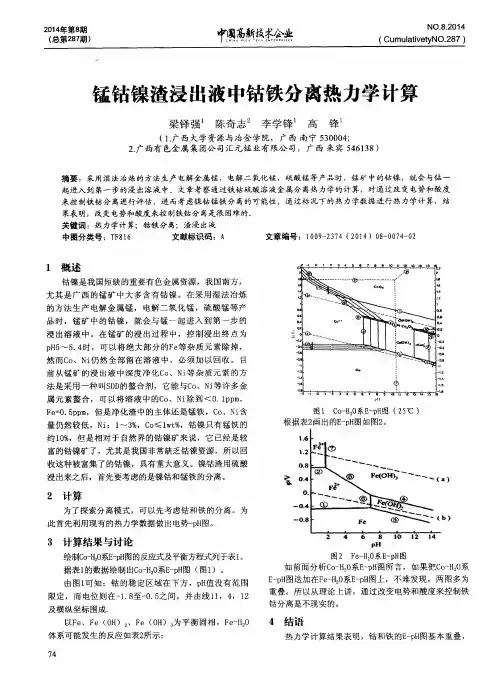


第26卷第2期2006年4月桂林工学院学报Journal of Guilin University of Technol ogyVol126No12Ap r12006文章编号:1006-544X(2006)02-0271-05湿法炼锌除钴锌渣硫酸浸出液中高锰酸钾氧化沉钴热力学分析欧 俊1a,1b,蓝德均2(11桂林工学院a1有色金属材料及其加工新技术省部共建教育部重点实验室,b1材料与化学工程系,广西桂林 541004;21四川大学材料科学与工程学院,成都 610064)摘 要:锌湿法冶金生产中除钴产出的锌渣尚含有大量的锌钴等有色金属资源,这种渣用硫酸浸出后锌钴等有色金属进入浸出液中,可用高锰酸钾等氧化剂将钴氧化沉淀而从含锌溶液中分离出来.用电极电势理论和能斯特方程对此除钴过程进行了热力学分析,结果表明:高锰酸根的氧化对溶液中杂质Fe2+、Mn2+、Co2+的去除是可行的,可以达到工业生产对杂质的浓度要求;对于N i2+只能进行部分氧化.氧化过程中溶液pH对钴的沉淀效果具有决定性影响,pH低于4时沉淀效果将显著降低.关键词:湿法炼锌;除钴锌渣;高锰酸钾;能斯特方程;热力学中图分类号:TF80312 文献标志码:A钴基本上为一种伴生的稀散元素,常常夹在铜、镍、锰、锌等的矿物原料中成为杂质[1].现有的锌湿法工艺是将硫化物进行氧化焙烧后再用硫酸浸出,矿物原料中的钴也将随锌一起进入硫酸浸出液中,其对锌电积的不利影响是钴有可能在阴极上被电积,与析出的金属锌形成微电池,使已析出的锌反溶解,从而降低锌电积电流效率[2].因此湿法炼锌工业中对硫酸锌溶液中钴的净化十分重视,使用了诸如黄药净化法、萘酚法、锌粉置换法等钴净化工艺.用得最多的还是锌粉置换法,为增加除钴效果,又进一步发展了添加剂锌粉法,包括砷盐锌粉、锑盐锌粉、铅锑合金锌粉等.然而,锌粉除钴产生出了大量主要含锌的钴净化渣,虽然通过控制pH,硫酸浸出[3,4]能回收这种锌渣中大部分锌,但剩余残渣中锌的含量仍然较大,还需要解决渣中钴资源的回收问题.蓝德均等人[5]提出了一种适合于此类除钴锌渣、切合现有锌湿法的处理新工艺,将渣用常规稀硫酸全浸出后的浸出液用高锰酸钾氧化除钴,其产生的后续溶液完全可并入冶锌工艺主流程的除钴段进料液中进行相应的净化处理.本文对此除钴方法进行热力学方面的分析,试图充分描述过程中的现象,找出进一步改进的方向.1 基本热力学理论由于该反应体系是有难溶物生成的液相氧化还原反应,因此热力学方面的分析宜采用电极电势理论和能斯特方程,其中所使用的体系中离子的浓度为离子活度.111 能斯特方程元素的不同氧化态物种之间存在电势差,因而可以构成一个电对,其标准电极电势定义为当此电对构成半电池时,反应中各物种活度为1时,其与标准氢电极构成的原电池的电动势(标准氢电极的电极电势定义为零).当电池体系未处于标准态时,其电极电势可以用能斯特方程进行计算 E=E0+21303R TnFlg[氧化态][还原态].(1)式中:E0为标准电极电势;R=81314J/(mol・K),为气体常数;F=96494,为法拉弟常数;T为绝对温度(K). 收稿日期:2005-09-29 基金项目:广西科学基金资助项目(桂科青0229034) 作者简介:欧 俊(1963-),男,博士研究生,研究方向:化工冶金与生物材料.112 溶液中离子的活度活度也可称为有效浓度,是为了在实际溶液中应用由理想溶液得出的一系列理论而引入的一种量,在处理实际溶液的平衡问题时,最好能用活度进行.由于实际溶液的复杂性,溶液中离子活度的计算仍然存在不少的困难.文献[6]提出了一个半经验的“普遍方程”作为实用公式,用在200多种以上的电解质高浓溶液(1~6mol/kg 水),包括混合电解质,得出了和实验符合得很好的计算结果.2 除钴锌渣硫酸浸出液中高锰酸钾氧化沉钴的热力学分析根据文献[5]中所给出除钴锌渣硫酸浸出液的成分(表1)和上述基本理论对浸出液中高锰酸钾的沉钴热力学进行分析.211 浸出液中离子活度系数的计算由于溶液中离子活度与溶液的离子强度密切相关,因此根据下式对溶液的离子强度进行计算 I=12∑im i z2i.(2)式中:mi是i离子的真实质量摩尔浓度,若是弱电解质,其真实浓度用它的浓度与电离度相乘而得;Zi 是i离子的价数.离子强度的计算及348K下浸出液中各金属离子的活度系数列于表1中.计算结果表明,浸出液中高电解质浓度形成了很强的溶液离子环境,即高的离子强度.无论这种高离子强度是由哪种离子造成的,溶液中存在的所有离子的活度都会受其影响,这种结果直接导致了溶液中离子极低的活度.212 Co、M n、Fe、N i相应电极电势的计算除钴锌渣硫酸浸出液中这4种元素的价态都是二价的,处于易氧化态.Co2+的氧化产物一般为CoOOH,M n2+则为M nO2,Fe2+为Fe(OH)3,而N i2+则为N i O OH.其在高锰酸钾存在下,且在偏酸环境中的反应方程式如下3Co2++Mn O-4+4H2O=3Co OOH+Mn O2+5H+,(3) 3M n2++2M nO-4+2H2O=5M n O2+4H+,(4) 3Fe2++Mn O-4+7H2O=3Fe(OH)3+Mn O2+5H+,(5) 6N i2++2Mn O-4+5H2O=3N i2O3+2Mn O2+10H+.(6)由上述4式可写出体系中各相关电对的半电池方程,进而可推出它们各自的能斯特表达式.在能斯特式中,根据表1所得到的溶液中各离子活度及溶液的pH值,可计算体系中各电对所具有的电势值(表2).CoOOH+3H++e=Co2++2H2O,E0CoOOH/Co2+;(7) MnO2+4H++2e=M n2++2H2O, E=1.229-0.0296lg[M n2+]-0.1183pH;(8)表1 溶液成分及活度计算结果Table1 Soluti on concentration and the calculated results of activity of i ons元 素Zn Cd Co Mn Fe N i Cu价态 2.000 2.000 2.000 2.000 2.000 2.000 2.000浓度/(g・L-1)92.12024.820 2.5760.2200.9900.8200.003活度/(mol・(kg溶剂)-1) 1.3100.2050.0410.0040.0160.0130.000离子强度/(mol・kg-1) 5.2380.8210.1630.0150.0660.0520.000总离子强度/(mol・kg-1) 6.355 6.355 6.355 6.355 6.355 6.355 6.355γMe0.0370.0230.0250.0240.0240.0240.055活度3/(mol・(kg溶液)-1)0.048470.0047150.0010250.0000960.0003840.00031200表2 浸出液中各离子电对电极电势计算结果(pH=510)Table2 Calculated results of potentials of ions in the leaching soluti on(pH=510)电对CoOOH/Co2+MnO2/Mn2+Fe(OH)3/Fe2+N i2O3/N i2+MnO-4/MnO2E0/V 1.714 1.229 1.057 1.753 1.701活度①/(mol・L-1)0.0011020.0001030.0004130.000335 3.00025E-12 E298K/V 1.001510.7554930.370506 1.071835 1.08活度②/(mol・kg-1) 3.62988E-07 3.89E-07 3.83E-07 3.64E-077.46615E-063 E/V 1.2057500750.8262930.547869 1.245145 1.206 注:活度①为表1中活度3以mol・(kg溶液)-1(用此单位表示便于进行活度计算)表示的浓度换算成mol・L-1后的值;活度②为体系中物种表观浓度为1mol・L-1时计算得到的值;第6列(MnO-4/MnO2)为MnO-4在热力学平衡条件下所得值272桂 林 工 学 院 学 报 2006年 Fe(OH)3+3H++e=Fe2++3H2O, E=1.057-0.1773pH-0.0591lg[Fe2+];(9) N i2O3+6H++2e=2N i2++3H2O, E=1.753-0.1773pH-0.0591lg[N i2+];(10) M n O-4+4H++3e=MnO2+2H2O, E=1.701+0.0197lg[Mn O-4]-0.0788pH.(11)由于式(7)中的标准电极电势未有已知值,下面将对其值进行推导.在体系中,可以有下列半电池反应和溶解平衡: Co3++e=Co2+,E0Co3+/Co2+=+1182V;(12) CoOOH+H2O=Co3++3OH-, KSP=[Co3+][OH-]3;(13) Co(OH)3=Co3++3OH-, KSP=[Co3+][OH-]3=116×10-44.(14)由(13)或(14)可得: aCo3+=K SP[OH-]3.(15)假设CoOOH的KSP 比Co(OH)3的KSP还小,则将前者的值取为后者的值不会影响对问题的解释.这是因为从后面的推导可以看到,若前者的值小则由此推出的标准电位值将会更小,它与氧化剂高锰酸钾的反应将会更容易.但如果前者的值比后者的大,在体系中将会实际存在溶解平衡式(14),体系中的Co3+浓度由式(14)所决定.因此,尽管缺乏CoOOH的KSP 数据,采用Co(OH)3的KSP也可以进行分析.所以,E CoOOH/Co2+=E0Co3+/Co2+-R TFlna Co3+a Co3+=E0Co3+/Co2+-R TFlna Co2+×a3OH-K SP=E0Co3+/Co2+-R TFln a Co2+-3R TFln a OH-+R TFln K SP=E0Co3+/Co2+-R TFln a Co2+-3R TFlnK Wa H++R TFln K SP=E0Co3+/Co2+-R TFln a Co2+-3R TFln K W+3R TFln a H++RTFln K SP=E0Co3+/Co2+-R TFln a Co2+-6.9079R TFlog K W+6.9078R TF log a H++R TFln K SP=E0Co3+/Co2+-6.9078R TFlog K W+R TFln K SP-6.9078R TF pH-R TFln a Co2+.(16)当体系处在aH+=110,即pH=0和a Co2+=110的标准态时,E CoOOH/Co2+=E0Co3+/Co2+-6.909R TFlog K WR TFln K SP=E0CoOOH/Co2+.(17)而E0CoOOH/Co2+是与温度有关的,但与温度的确切关系还没有详细的数据,因此以298K下的数据进行估算.将298K下的3项数据代入,得E0CoOOH/Co2+(298)=11714V.因此E CoOOH/Co2+=11714-011774pH-010591lg[Co2+].(18)表2的结果表明,除钴锌渣硫酸浸出液中各氧化还原电对具有不同的电势水平,并存在较大差异,具有最低电势的电对控制着溶液整体的电位.当体系中引入强氧化剂时,就体系中单个电对来讲,具有最低电位的电对将被优先氧化,其电位将逐渐上升,而氧化剂电位(如果引入量一定)将下降.当原来具有最低电位的离子电位上升至与其它离子电位一样,那么其它离子将开始被氧化.随着反应的进行,溶液体系中可氧化离子电对电位和氧化剂电对电位将趋于平衡,即体系中氧化剂的电位和可氧化离子电位相等,反应结束.因此,最先被氧化的将是Fe2+离子,随后是M n2+离子,并且只有当溶液中Fe(OH)3/Fe2+和M nO2/M n2+的电位等于CoOOH/Co2+电位时,Co2+才会开始被高锰酸根氧化.而N i2+则是溶液中最难被氧化的可氧化离子.但达到N i2O3/N i2+电位时所需的氧化剂高锰酸根的活度也是很小的,当溶液中其它可氧化离子电位达到N i2O3/N i2+电位时,N i2+仍然将开始被氧化.工业生产中一般要求硫酸锌溶液中的钴浓度小于1mg/L,此时要求溶液中高锰酸根的浓度应维持在大于7146615×10-6mol/kg(表2中带3号数字),此值正好是高锰酸根电对电位与1mg/L浓度相对应的钴电位相等时的高锰酸根浓度.而如果要将溶液中镍的浓度降至1mg/L以下,则要求的最低高锰酸根浓度在0105mol/kg以上,此即为814g/L,此浓度较大,不具有实用性.因此,欲通过高锰酸根氧化的方法除去溶液中的N i2+是不可行的.298K时Co(OH)3的溶度积为10-4318,在298~373K范围内,它和水的离子积的数量级变化一般为1,因此在式(17)第3项中R T/F的系数ln Ksp372第2期 欧 俊等:湿法炼锌除钴锌渣硫酸浸出液中高锰酸钾氧化沉钴热力学分析(≈100)要比其第2项的系数61909l og K w (≈96)略大,而第1项随温度的变化不大,故R T /F 随温度的上升是减小的.实际上当溶液体系中物质的活度和pH 不变时,式(11)和(18)中各系数是随温度而变化的,使CoOOH /Co 2+和M nO -4/M nO 2的电位随温度的升高而下降,但它们随温度变化的趋势并不一样.前者随温度升高而降低的趋势更陡,后者则更缓和,因此当温度升高时这2个电对之间的电位差将拉大,增加了氧化反应的推动力;另一方面,温度升高反应速率将大增.故而温度升高对该反应的效果将是有利于促进高锰酸根氧化沉钴的进行,使溶液中钴的除去效果更好(图1).图1 锰钴电位随温度的变化趋势Fig 11 Temperature dependence of the electricpotential of Mn and Co式(7)~(11)、(18)还显示出了另外一个影响高锰酸根氧化沉钴的重要因素:溶液pH 值.由式(3)~(6)可知,溶液中高锰酸根对各可氧化物种的氧化是一个产酸反应,如果不加控制,所产生的酸将足以抑制反应的继续进行.根据半电池反应(11)和(7),以及方程(18)具体地分析这个现象.式(7)和(11)中75℃下的标准电位分别为:11699和11712V;设高锰酸根和二价钴离子的浓度分别为11401、41186mmol/L.将以上数值代入电位pH 方程中,可计算得到在此条件下的pH 为1188,也就是溶液中的氢离子浓度为01013mol/L;当溶液pH 等于215时,E MnO-4/MnO 2=11416V ,E CoOOH /Co2+=11345V.此时,高锰酸钾能氧化二价钴离子,不过它们的电势相差还没有达到012V ,氧化还原反应还不能以很显著的速度进行.当令溶液的pH 为513时,它们的电位分别为11158和01765V ,电位差达到了0139V ,可以预计反应能以很显著的速度进行.从计算中也可以看出,随着溶液pH 的升高,它们的电位都在下降,但钴的电位下降得更快.而实际上在碱性条件下,二价的氢氧化钴非常容易氧化成三价.下面,以这两个方程为基础,通过绘图来说明在给定pH 、温度条件下反应达到平衡时溶液中残余的二价钴离子和高锰酸根离子的浓度.溶液中钴和高锰酸钾浓度的变化按方程式(3)的当量关系对应,以此绘出溶液中电对电位随其各自浓度而变化的关系曲线(图2)(溶液pH 为410).图2表明随着反应的进行,溶液中涉及反应的物种浓度也随之而变化,高氧化电势和低氧化电势的电对的电位各自朝着相反的方向移动:电势高的将向着电势低的方向移动,而电势低的则与之相反.当由于反应的推进使它们各自的浓度降低从而它们的电位也与之相应地变化,最终溶液中两个电对的电位将相等,表明此时氧化还原反应已达到平衡,表观上来看反应将不再进行.图2中也表明当反应中两个电对的电位相等时,有关物种的浓度可以相等也可以不一样.如果氧化剂一开始加入过量,则体系中Co2+的浓度将降低至图2中两曲线相交点之左的某个点上,而氧化剂的浓度将还在交点之右,这两个点在反应平衡时处于同一水平直线上.若反应之初钴和高锰酸钾的浓度是按方程式(3)加入的,则在平衡时它们的浓度将相等,此时溶液中钴的浓度约为015mg/L.若考虑高锰酸钾的自分解,在此情况中实际反应体系里的平衡钴浓度将远不止此值.按照上述图解计算的过程(设反应物质按式(3)的关系加入),将在不同反应pH 下的平衡钴浓度计算于表3中.由表3可见溶液pH 对高锰酸钾氧化沉钴效果有很大影响.pH 每变化一个单位,溶液理想平衡钴浓度将有2~3个数量级的变化.所以若要有良好的沉钴效果,必须严格控制溶液的pH.图2 钴、锰电对电位随各自浓度的变化Fig 12 Concentration dependence of the electricpotential of Mn and Co472桂 林 工 学 院 学 报 2006年表3 60℃时不同pH 溶液的理论平衡钴浓度Table 3 Theoretical equilibrium concentration of Co at different pH and at 60℃溶液pH123456平衡钴浓度/(mg ・L-1)2898.989.170.0299.17×10-52.9×10-79.17×10-103 结 论能斯特方程给出了除钴锌渣硫酸浸出液中可氧化离子的被氧化顺序:Fe 2+、M n 2+、Co 2+、N i 2+.以高锰酸钾为氧化剂,可以将Co 2+除至1mg/L 以下,这是工业生产中对硫酸锌溶液中杂质钴的浓度要求,并可以同时将Fe 2+、M n 2+除至很低的水平,但对N i 2+只能进行部分氧化.当氧化反应进行时,体系pH 对高锰酸根氧化沉钴的影响是至关重要的:pH 过低反应将不会发生,并存在pH =4的阈值.参考文献:[1]乐颂光,夏忠让,吕让华,等.钴冶金[M ].北京:冶金工业出版社,1987:25-34.[2]梅光贵.湿法炼锌学[M ].长沙:中南大学出版社,2001:364-391.[3]宁模功,张允恭.处理湿法炼锌净化钴镍渣的试验研究[J ].有色金属(冶炼部分),2001(1):10-13,19.[4]宁模功,王玉棉,王开群.钴镍渣处理的中试和扩试[J ].甘肃有色金属,1999(1/2):1-7.[5]蓝德均,张旭,沈庆峰.锌湿法冶金产高钴渣的处理新方法研究[J ].四川有色金属,2002(4):24-27.[6]杨显万,邱定蕃.湿法冶金[M ].北京:冶金工业出版社,1998:22-25.Ther m odynam i c ana lysis on coba lt re m ova l by pot a ssi um permangana teox i d i za ti on i n leach i n g soluti on by sulfur i c ac i d of z i n c resi duecon t a i n i n g coba lt i n z i n c hydro m et a llurgyOU Jun1a,1b,LAN De 2jun2(11a 1Key L abora tory of N onferrousM aterials and N e w P rocessing Technology of M inistry of Education,Guilin U 2niversity of Technology,b 1D epart m ent of M a terials and Che m istry Engineering,Gu ilin 541004,China;21D epa rt m en t of M aterials Science and Engineering,S ichuan U niversity,Chengdu 610064,Ch ina )Abstract:Zinc residue,containing cobalt fr om cobalt re moving in zinc hydr ometallurgy,is a byp r oduct diffi 2cult t o treat because of containing much nonferr ous metals res ource including zinc,cobalt,etc .The treat m ent for res ource recycle of the residue is much concerned .After leached in sulfuric acid s oluti on,bivalent cobalt could be oxidized by potassium per manganate t o re move fr om leaching s oluti on .Ther modyna m ic analysis of co 2balt re moving p r ocess was carried out according t o electr ode potential theory and Nernst equati on and p r oves that the re moval of Fe2+,M n2+,Co2+i m purities in the s oluti on is possible thr ough oxidizati on by potassiu m per man 2ganate t o reduce the concentrati on level requested by industrial p r oducti on,but not app lied t o N i 2+.During oxi 2dizing,s oluti on pH p resents an effect on cobalt re moving ,in which cobalt purifying effect can be decreased drastically at pH l ower than 4.Key words:zinc hydr ometallurgy;zinc residue containing cobalt;potassium per manganate;Nernst equati on;ther modyna m ics572第2期 欧 俊等:湿法炼锌除钴锌渣硫酸浸出液中高锰酸钾氧化沉钴热力学分析。



从废旧锂电池中分离提取锰钴镍的方法研究一、方法研究概述本研究提出一种新型的从废旧锂电池中分离回收钴镍锰的工艺。
该工艺采用物理擦洗−稀酸搅拌浸出的方法分离集流体与活性物质,采用H2SO4+H2O2为浸出剂对活性物质进行浸出,然后采用黄钠铁矾法去除浸出液中的铁,再采用N902萃取分离铜,通过水解沉淀法除铝最后采用碳酸盐共沉淀法制备镍钴锰碳酸盐前躯体。
结果表明:最优浸出条件为液固比10:1、H2SO4浓度2.5 mol/L、H2O2加入量2.0 mL/g(粉料)、温度85 ℃、浸出时间120 min;在此条件下,钴、镍和锰的浸出率分别达到97%、98%和96%;除去浸出液中的铁、铜和铝后,钴、镍和锰的损失率分别为1.5%、0.57%和4.56%;总体来说,废旧锂离子电池中钴、镍和锰的回收率均可以达到95%。
二、锂电池的历史沿革锂电池自1990年实现商业化以来,以其具有能量密度大、质量轻、寿命长且无记忆性等诸多优点,被广泛应用于移动电话、笔记本电脑和照相机等便携式电子设备中。
据统计,2000年全球锂离子电池生产量达到5亿只,预计2010年产量将超过46亿只[1]。
由于技术和经济等方面的原因,目前锂电池回收率很低,大量废旧锂电池被遗弃,给环境造成巨大威胁和污染,同时对资源也是一种浪费,分析表明:锂电池中含钴5%~20%、锂5%~7%、镍5%~10%。
因此,如何在治理“电池污染”的同时,实现废旧电池有色金属资源尤其是钴的综合循环回收,已成为社会关注的热点难题。
目前,世界各国对锂电池中有价金属钴的回收与电池材料的再生工艺研究很多,LI等先用超声清洗分离集流体与活性物质,并使用高浓度盐酸浸出,沉淀回收钴;LIU等[5]采用有机溶剂浸泡极片,使集流体与活性材料分离,通过高温固相法重新合成LiCoO2;LEE等[6]使用两级热处理两级过筛后高温煅烧的方法预选活性物质,分别采用HNO3 和HNO3-H2O2 体系对筛后活性物质浸出;WANG等采用盐酸浸出,高锰酸钾氧化沉锰,丁二酮肟萃取镍,氢氧化钠沉淀回收钴。