水通道蛋白9的研究进展
- 格式:pdf
- 大小:202.29 KB
- 文档页数:3

水通道在雄性生殖系统表达的研究进展关键字:生殖系统摘要水通道属于主体内在蛋白家族成员,散布普遍,参与细胞液体代谢进程,其大体结构是一个单肽链,含有特点性的重复串联序列。
至少有两种水通道在睾丸的曲细精管中有丰硕的表达,提示水通道在生精进程及至受精进程中的重要作用。
睾丸输出小管的非纤毛细胞的刷状缘和基底膜及附属性腺上皮存在水通道说明:水通道在生精小管原初分泌液体的重吸收方面有作用,也对精子的成熟与浓缩产生间接的阻碍。
另外,水通道也可能参与了雌激素对大鼠输出小管液体吸收功能和输出小管和睾丸网进一步生长发育的调剂进程。
关键词水通道睾丸精细胞水是活细胞及其周围环境的重要组成部份,水的跨膜转运具有重要的生物学和生理学意义。
例如:肾对渗透压和水代谢的调剂;胃肠道、呼吸道和生殖道上皮细胞液体的分泌和吸收;脑脊液的形成;汗液的分泌等,在参与上述进程细胞的细胞膜上都有水通道的表达。
水通道蛋白的发觉令人们从头熟悉水转动的生理和病理生理进程。
本文对最近几年来水通道的研究进展,专门是其在生殖系统表达的研究作一综述。
一、水通道家族成员水通道属于主体内在蛋白家族(majorintrinsicprotein’MIP),迄今为止,已在细菌、酵母、植物、昆虫和脊椎动物中发觉至少50余种水通道。
世界上第一个哺乳动物的水通道是由Agre等于1988年发觉的,1991年确信了其反向转录脱氧核糖核酸(cDNA)顺序[1],随后进行了功能鉴定,证明了其协助细胞转运水的作用。
AQP0(MIP26)[2]要紧表达在眼晶状体,其基因变异可致使白内障。
AQP1(CHIP28)[3]散布极为普遍,在肾、肺、眼、血管、生殖道、消化道等上皮都有表达。
AQP2[4]只局限于肾集合管主细胞内,并受血管加压素的调剂。
AQP3[5]在肾等多种组织有表达,其特点是不仅能够转运水,也能转运甘油。
AQP4[6]要紧表达在脑,但在肾及呼吸道等多种组织亦有表达。
AQP5[7]只见于唾液腺、泪腺等腺体组织。


影响椎间盘退变的水通道蛋白研究进展唐杰综述,王文军审校(南华大学附属第一医院脊柱外科,湖南衡阳421001)【关键词】椎间盘;治疗;蛋白质类;椎间盘退变;水通道蛋白doi:10.3969/j.issn.1009-5519.2013.01.035文献标识码:A文章编号:1009-5519(2013)01-0066-03腰背部疼痛是困扰人类的重大疾病,而椎间盘的退变是其发病的主要原因之一,退变可导致椎间盘突出、椎管狭窄、脊柱节段失稳等。
椎间盘退变而引起腰腿痛的患病率可高达60%~ 80%[1]。
Nerlich等[2]研究发现,人类在2岁时其椎间盘软骨终板就开始发生退变,而在10岁以后发生髓核退变,椎间盘退变的一个重要特征表现是含水量减少,椎间盘髓核的含水量在幼年时可达到80%以上,而到了老年时则降低到70%。
虽然国内外对椎间盘退变的因素做了大量研究,但机制仍未完全阐明,其主要包括分子生物学因素、遗传学因素、营养因素、生物力学因素等,但哪种因素是导致椎间盘退变的关键因素,至今仍没有统一意见,这可能由于椎间盘退变是由多种因素共同作用的结果,很难确定哪个是始动因素,但椎间盘退变的一个共同特性便是退变椎间盘水分含量的减少。
因此,有必要研究导致水分减少的原因及其在椎间盘中所起到的作用。
椎间盘是人体最大的无血供组织,其中央区域没有直接的血液供应,椎间盘中央区域细胞的营养物质以及废物交换依赖于椎体上下终板的扩散,而周围营养和水的代谢依赖于纤维环周围血管和终板扩散的协同作用。
随着机体逐渐老化,供应椎间盘周围的血管数量逐渐减少。
有研究表明,从胎儿到儿童末期,椎间盘外周纤维环中的血管逐步减少。
Liu等[3]提出退变椎间盘的血液供应比正常的椎间盘少14%。
由此可见,发生退变的椎间盘由于血液供应的减少,此时由椎体上下终板的扩散来提供椎间盘营养的途径便显得更为重要。
过去研究多认为,水分及多数营养物质是通过弥散出入椎间盘,自从水通道蛋白(aquaporins,AQPs)发现后,此观点得到修正及加强。

第39卷第6期2020年12月电㊀子㊀显㊀微㊀学㊀报JournalofChineseElectronMicroscopySocietyVol 39ꎬNo 62020 ̄12文章编号:1000 ̄6281(2020)06 ̄0779 ̄08㊀㊀植物水通道蛋白PIPs亚细胞定位转运的研究进展鲁雨晴1ꎬ2ꎬ崔亚宁1ꎬ2ꎬ张㊀原1ꎬ2ꎬ姚小敏1ꎬ2ꎬ李晓娟1ꎬ2∗(1.北京林业大学林木分子设计育种高精尖创新中心ꎬ北京100083ꎻ2.北京林业大学生物科学与技术学院ꎬ林木育种国家工程实验室ꎬ北京100083)摘㊀要㊀㊀水通道蛋白是一种水分选择性跨膜运输的特异性孔道ꎬ介导水分子和小的不带电荷的溶质进行快速的跨膜运输ꎮ植物细胞可以调节水通道蛋白基因的表达㊁蛋白的翻译后修饰以及蛋白的亚细胞定位ꎬ通过多种方式调节细胞的水分运输能力从而响应逆境信号ꎮ定位在细胞质膜的水通道蛋白亚家族PIPs是植物水通道蛋白最大的亚家族成员ꎬ对维持植物水分状态起着重要作用ꎮ本文重点介绍了PIPs蛋白的亚细胞定位㊁胞吞和胞吐循环以及蛋白质降解的调控机制ꎮ关键词㊀㊀水通道蛋白ꎻ亚细胞定位ꎻ胞吐ꎻ胞吞中图分类号:Q946㊀㊀文献标识码:A㊀㊀doi:10 3969/j.issn.1000 ̄6281 2020 06 020收稿日期:2020-02-06ꎻ修订日期:2020-04-14基金项目:国家自然科学基金资助项目(No.31622005).作者简介:鲁雨晴(1993-)ꎬ女(汉族)ꎬ山东人ꎬ研究生.E ̄mail:luyuqing@bjfu.edu.cn∗通讯作者:李晓娟(1981-)ꎬ女(汉族)ꎬ山东人ꎬ教授.E ̄mail:lixj@bjfu.edu.cn㊀㊀自从1920年发现磷脂双分子层以来ꎬ水分的吸收和在亚细胞区室间的转运被认为是通过自由扩散的方式穿透脂质双分子层ꎮ然而ꎬ哺乳动物的分泌途径和植物的气孔开度调节需要快速的水分运输ꎬ简单的扩散方式不足以解释这些生理过程ꎮ为了解释这些过程ꎬJohnsen等在1953年提出水分是通过特定的孔隙来进行跨膜运输[1]ꎮ随后ꎬAgre等在1988年分离纯化红细胞膜上的Rh血型抗原时ꎬ发现了一种分子量为28kDa疏水性跨膜蛋白ꎬ并将此蛋白命名为CHIP28[2]ꎬ该蛋白是细胞膜上转运水分的特异性通道蛋白ꎮ1993年ꎬMaurel等通过在非洲爪蟾(Xenopuslaevis)卵母细胞中表达拟南芥液泡膜内在蛋白(AtTIP1ꎻ1)并验证其功能ꎬ首次证实植物中存在水通道蛋白[3]ꎮ1997年人类基因组命名委员会将CHIP28蛋白正式命名为Aquaporin ̄l(AQPl)ꎮ水通道蛋白能促进水分子的快速跨膜运输ꎬ还可以运输少量离子和小分子溶质ꎬ从而调节植物细胞渗透势ꎬ是细胞功能正常发挥不可或缺的ꎮ此外ꎬ近年来的研究还发现ꎬ水通道蛋白通过与其他蛋白的相互作用ꎬ调控植物对环境的应答ꎮZhang等研究发现ꎬ缺水条件下RhPIP2ꎻ1的丝氨酸残基发生磷酸化修饰ꎬ诱导质膜上的MYB类转录因子RhPTM进入细胞核ꎬ降低了碳水化合物合成相关基因的表达ꎬ最终导致植株生长缓慢甚至进入休眠状态[4]ꎮ由此可见ꎬPIPs不仅是水分跨膜运输的通道ꎬ也可作为快速响应水分胁迫信号的调节蛋白ꎬ在抗逆调控机理中发挥功能ꎮ1㊀植物水通道蛋白1 1㊀植物水通道蛋白的分类水通道蛋白属于高度保守的膜蛋白超家族ꎬ这类蛋白称为主要内在蛋白(majorintrinsicproteinsꎬMIPs)ꎮ目前ꎬ在细菌㊁酵母㊁原生动物㊁古细菌㊁昆虫㊁哺乳动物和植物中已鉴定出超过800个MIPsꎮ水通道蛋白不仅能够促进水分㊁CO2以及不带电的小的溶质分子进行被动扩散[5]ꎬ还可运输甘油㊁尿素㊁NH3和活性氧等[6]ꎮAQPs对H2O2的转运是动植物发生免疫反应的重要信号ꎮ研究发现ꎬ植物对细菌病原体丁香假单胞菌的免疫力以及脱落酸触发的气孔关闭都需要AQPs转运H2O2[7]ꎮ根据底物特异性㊁蛋白质序列同源性以及亚细胞定位ꎬ植物中的水通道蛋白分为7类ꎬ包括质膜内在蛋白(plasmamembraneintrinsicproteinsꎬPIPs)㊁液泡膜内在蛋白(tonoplastintrinsicproteinsꎬTIPs)㊁类NOD26膜内在蛋白(NOD26 ̄likeintrinsicproteinsꎬNOD26ꎬNIPs)㊁小的碱性膜内在蛋白(smallbasicintrinsicproteinsꎬSIPs)㊁类GlpF膜内在蛋白质㊀㊀电子显微学报㊀J.Chin.Electr.Microsc.Soc.第39卷(GlpF ̄likeintrinsicproteinsꎬGIPs)㊁混合膜内在蛋白(hybridintrinsicproteinsꎬHIPs)和未分类的X膜内在蛋白(uncategorizedXintrinsicproteinsꎬXIPs)ꎮPIPs可以根据C端和N端的序列特征进一步分为不同的亚型ꎬ例如ꎬ高等植物的水通道蛋白PIPs被划分为PIP1㊁PIP2和PIP3ꎮ与PIP1相比ꎬPIP2具有较短的N端结构域和较长的C端结构域以及胞外的A环ꎮ植物中的水通道蛋白多样性高于动物ꎮ例如ꎬ在哺乳动物中仅有13种AQPs[8]ꎬ而在拟南芥(Arabidopsisthaliana)㊁毛果杨(Populustrichocarpa)㊁大豆(Glycinemax)和陆地棉(Gossypiumhirsutum)中分别有35㊁55㊁66和71个成员[9]ꎮ在拟南芥和玉米(Zeamays)中均发现了13种不同的PIP亚型ꎬPIP1有5种(PIP1ꎻ1 ̄PIP1ꎻ5)ꎬPIP2有8种(PIP2ꎻ1 ̄PIP2ꎻ8)ꎻ水稻(Oryzasativa)中有11种不同的PIP亚型ꎬPIP1有3种(PIP1ꎻ1 ̄PIP1ꎻ3)ꎬPIP2有8种(PIP2ꎻ1 ̄PIP2ꎻ8)[5]ꎬ水通道蛋白几乎分布在植物的所有器官中ꎮ1 2㊀植物水通道蛋白的结构水通道蛋白是一种小而高度疏水的膜整合蛋白ꎬ其单体蛋白分子量在23~34kDa左右ꎬ具有高度保守的氨基酸序列ꎮAQPs的典型特征包括六个α-跨膜螺旋(TM-1 TM-6)ꎬ五个亲水环(LoopA ̄E)ꎬN-末端的AEF(Ala ̄Glu ̄Phe)或AEFXXT基序[10]ꎮ高度保守的B环和E环上各带有天冬酰胺-脯氨酸-丙氨酸结构域(NPAmotifs:asparagine ̄proline ̄alanineꎬNPAs) NPA盒ꎮ关于水通道蛋白的三维拓扑模型(图1)ꎬ目前被人们广泛接受的是 沙漏模型 ꎬ含有NPA结构域的B环和E环折向磷脂双分子层ꎬ同时水通道蛋白对称的两半部分相对角度为180ʎ[11]ꎮ两个NPA盒在磷脂双层中间形成了一个亲水通道ꎬ仅能容纳单个水分子通过ꎮNPA盒一侧的由H2和H5的2个残基和E环上的残基组成芳香族/精氨酸(aromatic/arginineꎬAr/R)区域能够对底物进行过滤筛选ꎮ保守的NPA盒有助于水分子的选择性ꎬNPA盒在植物PIPs和TIPs中都高度保守ꎬ而在NIP或SIP中仅发现替代基序[12]ꎮ每个水通道蛋白单体可以作为一个独立运输水分的功能单位ꎬ但大部分水通道蛋白在生物膜上以四聚体形式存在ꎬ少数以单体或二聚体形式存在ꎮ可以是同型水通道蛋白形成同源四聚体ꎬ也可以是异型水通道蛋白形成异源四聚体ꎮ通过亲和层析纯化证明ꎬ在非洲爪蟾卵母细胞中共表达㊀㊀㊀ZmPIP1ꎻ2和ZmPIP2ꎻ5ꎬ在其形成的异源四聚体中可以检测到同源二聚体和异源二聚体ꎮ参考SoPIP2ꎻ1的晶体结构ꎬ利用软件模拟了ZmPIP1ꎻ2和ZmPIP2ꎻ5形成的异源四聚体ꎬ通过生物计量和结构模拟等方法发现ꎬ在PIP2ꎻ5和PIP1ꎻ2中分别存在5个和6个肯能与蛋白异源作用相关氨基酸残基ꎮ进一步的点突变功能验证结果显示ꎬZmPIP1ꎻ2跨膜结构域5中的Phe220Ala突变ꎬ可以激活ZmPIP1ꎻ2的水通道活性ꎬ同时抑制同一异源四聚体中的ZmPIP2ꎻ5的活性[13]ꎮ由此可见ꎬ水通道蛋白聚合体的形成和功能调控机制非常复杂ꎮ1 3㊀水通道蛋白功能的调控水通道蛋白的功能调控存在多种模式ꎬ包括转录调控㊁翻译后修饰ꎮ在缺水条件下ꎬ某些PIPs基因的表达上调以促进水的运输并维持正常的生理活动ꎬ而其他一些PIPs基因的表达可能下调以降低水分的渗透性ꎬ从而避免植物过多的水分流失ꎮPou等研究发现ꎬ高盐胁迫下AtPIP2ꎻ7的表达在转录水平被快速抑制ꎬ导致AtPIP2ꎻ7的mRNA水平显著下调[14]ꎮ在水稻中超表达TsPIP1ꎻ1能够调节水分运输ꎬ提高水稻的抗盐性[15]ꎮ盐胁迫下ꎬ紫花苜蓿(Medicagosativa)MsPIP2ꎻ2的过表达提高了种子萌发率㊁存活率㊁脯氨酸含量和抗氧化防御活性ꎬ降低了细胞膜损伤和活性氧的积累[16]ꎮ通过qRT ̄PCR检测了丛枝菌根共生植物根系AQPs的表达量ꎬ在干旱条件下PtPIPs表达量下调ꎬ表明宿主植物中菌根介导的耐旱性可能与AQPs转录水平的复杂调控有关[17]ꎮ以往大多数研究报道了磷酸化调控水孔的门控机制ꎬ例如菠菜质膜内在蛋白SoPIP2ꎻ1的X射线晶体结构表明ꎬSoPIP2ꎻ1的氨基端和羧基端存在磷酸化位点ꎬ磷酸化会破坏分子间的作用力ꎬ使D环变得松弛而开启水孔开放的构象[18]ꎮ最新的研究表明ꎬBvPIP2ꎻ2中的Leu206参与了细胞酸化引发的门控过程ꎬ其残基能够阻挡水分运输[19]ꎮ磷酸化不仅参与PIPs的转运ꎬ而且能够控制质膜的靶向性ꎮAtPIP2ꎻ1靶向质膜需要Ser283发生磷酸化[20]ꎬ在哺乳动物细胞中发现AQP2从囊泡转运到质膜的过程中也受到磷酸化的影响[21]ꎮ此外ꎬ胁迫条件下AtPIP2ꎻ1的胞吞也受到不同程度的影响ꎮ最近ꎬ越来越多的研究揭示亚细胞转运在调节AQPs功能和植物水分运输方面发挥了重要作用ꎮ087㊀第6期鲁雨晴等:植物水通道蛋白PIPs亚细胞定位转运的研究进展㊀㊀图2㊀PIPs在细胞内的转运途径ꎮFig.2㊀Transportpathwayofplasmamembraneintrinsicproteins(PIPs)withinthecell.图1㊀水通道蛋白的结构和 沙漏模型 的示意图(根据参考文献[11]修改)ꎮFig.1㊀SchematicdiagramofanAQPandtheHourglassmodel(modifiedaccordingtoreference[11]).2㊀植物PIPs蛋白的亚细胞转运2 1㊀植物PIPs蛋白的胞吐胞吐途径是蛋白 顺行 方向转运的主要路径(图2)ꎬ新合成的蛋白质靶向内质网膜再流向到高尔基体ꎬ随后依次流向质膜或细胞外基质[7]ꎮPIPs定位到质膜并发挥功能的胞吐途径需要多种元件的协助ꎮ在玉米和拟南芥中ꎬ定点突变的结果揭示PIP2s依靠其内部序列基序定向转运到质膜[22]ꎮ进一步的研究揭示ꎬ位于PIP2s氨基末端尾部的双酸性元件与COPII分选途径相互作用并严格控制PIP2s从内质网的输出[23]ꎮ随后ꎬ从内质网输出的蛋白经过高尔基体并依靠突触融合蛋白的作用使PIPs靶向质膜ꎮ2 1 1㊀PIPs从内质网到高尔基体的转运过程新合成的PIPs蛋白通过共翻译转运途径插入内质网腔中ꎬ错误折叠的蛋白质将被重新折叠或标记进行降解ꎮPIPs作为非内质网驻留蛋白ꎬ会积累在ER膜的特定区域中ꎬ该聚集区域也被称为内质网输出位点(ERexportsitesꎬERESs)[24-25]ꎮ之后ꎬCOPII的组分介导ER输出的囊泡出芽过程ꎮ前人在酵母和动植物细胞中的研究表明蛋白中的双酸性元件(Diacidicmotifs或D/ExD/E)是蛋白质由ER输出的信号[26]ꎮ在玉米中表达ZmPIP2ꎻ4和ZmPIP2ꎻ5时ꎬ可以观察到它们定位于质膜ꎮ然而ꎬ将它们的双酸性元件DIE突变后ꎬ这两种蛋白质会驻留在内质网上[22]ꎮ此后ꎬ研究人员将AtPIP2ꎻ1的DVE双酸性元件突变后ꎬAtPIP2ꎻ1也驻留在内质网而不能正确定位到质膜[23]ꎮ由此可见ꎬPIPs转运到质膜的过程中会需要双酸性元件ꎮ但是ꎬ进一187㊀㊀电子显微学报㊀J.Chin.Electr.Microsc.Soc.第39卷步的研究显示它们并不是调节这个过程的唯一元素ꎮ将含有DIE双酸性元件的ZmPIP2ꎻ5的N-末端部分与ZmPIP1ꎻ2融合后发现ZmPIP1ꎻ2没有定位到质膜上ꎬ表明ZmPIP1ꎻ2可能存在较强的内质网驻留信号[22]ꎮ此外ꎬZmPIP2ꎻ1能够正确的定位到质膜上ꎬ但它不包含任何双酸性元件ꎬ推测可能有其他的内质网输出信号ꎻZmPIP1s的N端存在多个双酸性元件(EED㊁DKD或EKD)ꎬ然而当ZmPIP1s在叶肉原生质体单独表达时ꎬ仍然在内质网驻留[7]ꎮPIPs向质膜的转运也涉及到其他的结构域ꎬ例如ꎬZmPIP1ꎻ2和ZmPIP2ꎻ5的TM3结构域内氨基酸残基的定点突变结果显示ꎬZmPIP2ꎻ5的Leu127和Ala131残基是蛋白在胞吐途径中的顺行运输所必需的ꎻ进一步的研究发现ꎬPIP2s的TM3结构域中存在一个高度保守的基序LxxxAꎬ能够调控蛋白从ER中输出ꎬ这些研究揭示了TM3结构域是影响ZmPIPs向质膜定位的关键区域[27]ꎮ2 1 2㊀PIPs从TGN到质膜上的转运过程新合成的质膜蛋白通常在高尔基体和反面高尔基体管网结构(Trans ̄GolginetworkꎬTGN)内加工后运到质膜ꎮ在玉米叶肉原生质体中观察到高尔基体标记蛋白ST ̄mYFP和mCFP ̄ZmPIP2ꎻ5的共定位ꎬ表明PIPs的运输经过了高尔基体ꎮ同时ꎬZmPIP2ꎻ5还与TGN标记蛋白VTI12共定位ꎬ进一步证明PIPs的亚细胞转运经过了反面高尔基体管网结构[28]ꎮ此外ꎬPIPs向质膜的运输受到SNAREs(solubleN ̄ethylmaleimide ̄sensitivefactorproteinattachmentproteinreceptorꎬSNAREs)复合体的调控ꎬSNAREs复合体可以介导内膜系统的膜泡与靶膜融合[29]ꎮSNAREs复合体中的突触融合蛋白SYP121是定位于质膜的可溶性N-乙基马来酰亚胺-敏感因子结合蛋白受体ꎬ起到将膜结构融合的作用ꎮBesserer等利用亲和层析纯化㊁双分子荧光互补和FRET等一系列实验证明了ZmPIP2ꎻ5定位到质膜需要与SYP121相互作用[30]ꎮ对拟南芥中水通道蛋白的研究显示ꎬAtPIP2ꎻ7的转运与两个突触融合蛋白有关ꎬSYP61和SYP121发生特异性相互作用形成一个SNAREs复合物ꎬ使AtPIP2ꎻ7定位到质膜上[31]ꎮ鉴于SNAREs具有广泛的亚细胞定位ꎬ人们很容易推断不同的SNAREs复合体可能在运输的不同阶段调控水通道蛋白的转运ꎮVAMP721和VAMP722是两个密切相关的R ̄SNAREsꎬ通过TGN或早期内涵体区室参与质膜分泌运输ꎮ在vamp721vamp722双突变体中ꎬPIP2ꎻ1 ̄GFP在质膜的定位受到严重破坏ꎬ而液泡膜水通道蛋白TIP1ꎻ1 ̄GFP的定位与野生型相比没有受到影响ꎬ由此可见SNAREs复合体对不同水通道蛋白成员的调控机制不同ꎮ虽然VAMP721或VAMP722是否与PIPs直接相互作用仍有待确定ꎬ但已有研究显示其对PIPs定位的调控并不需要二者之间发生物理互作[32]ꎮ2 2㊀植物PIPs蛋白的胞吞真核生物的内吞作用ꎬ也称胞吞作用ꎬ是指质膜内陷将所摄取的物质进行包裹ꎬ逐渐形成小泡㊁脂双层融合㊁断裂㊁脱离质膜进入细胞内的过程ꎬ是细胞物质运输的逆行路径也可以作为回收机制[33]ꎮ2 2 1㊀PIPs蛋白的胞吞方式植物中研究最为深入的胞吞方式是由网格蛋白包被膜泡(Clathrin ̄coatedvesiclesꎬCCVs)介导的ꎮ网格蛋白介导的胞吞需要接头复合物AP-2的m2亚基与货物蛋白YxxØ胞吞基序间的相互作用[34]ꎮ所有PIPs的C末端都存在YxxØ基序ꎬ虽然现有研究并未检测到PIPs的YxxØ基序与m2亚基的直接相互作用ꎬ但使用TyrphostinA23(可以阻止网格蛋白AP-2接头复合物的m2亚基与货物蛋白YxxØ胞吞基序间的相互作用)处理时ꎬAtPIP2ꎻ1的胞吞被减弱ꎮ在网格蛋白重链缺失的突变体中检测PIP2ꎻ1胞吞进一步证实ꎬPIPs由网格蛋白介导的途径进行胞吞[35]ꎮ同时ꎬ为深入研究在不同条件下PIP2ꎻ1的胞吞途径ꎬ荧光互相关光谱技术(fluorescencecross ̄correlationspectroscopyꎬFCCS)被用来对蛋白之间的相互作用进行量化分析[36]ꎮ有趣的是在高渗胁迫条件下ꎬAtPIP2ꎻ1不仅通过网格蛋白介导的途径胞吞ꎬ也会通过不依赖网格蛋白的胞吞途径内化进入细胞ꎬ表明质膜蛋白进行胞吞时可以有多条胞吞途径ꎬ这些胞吞途径的选择取决于植物所面临的环境条件[37]ꎮ2 2 2㊀PIPs蛋白胞吞后循环回膜PIPs胞吞进入细胞后可以与分选微管连接蛋白(sortingnexin1ꎬSNX1)共定位ꎬ说明PIPs被分选进入SNX1区室ꎮSNX1区室属于TGN和多泡体的中间区域[38]ꎮTGN成熟的同时也会分泌囊泡ꎬ分泌泡最终靶向质膜[39-40]ꎮ在TGN中发现的PIPs主要通过分泌膜泡和CCVs直接循环到质膜或在SNX1区室中转运ꎬ也可以运输到多泡体中进行循环利用或降解ꎮ布雷菲德菌素A(BrefeldinAꎬBFA)是一种真287㊀第6期鲁雨晴等:植物水通道蛋白PIPs亚细胞定位转运的研究进展㊀㊀菌毒素ꎬ可抑制ARF ̄GEF(某些腺苷核糖基化因子小GTP酶)ꎬ如GNOMꎬ从而抑制再循环内涵体转运至质膜的过程ꎮ因此ꎬBFA处理可以引发一些蛋白的聚集ꎬ形成BFAbodyꎮ用BFA处理拟南芥观察到PIPs出现在BFAbody中ꎬ表明PIPs的组成型循环经由ARF ̄GEF介导的途径[41]ꎮ最近一项基因筛查发现一种新蛋白BEX5ꎬ可调节PIP从TGN到质膜的运输[42]ꎮ与野生型相比ꎬ在bex5-1突变体中ꎬ经BFA处理并洗脱后由PIP2ꎻ1 ̄GFP形成的BFAbody仍然存在ꎬ表明BEX5参与了PIPs从TGN循环到质膜的胞吐[42]ꎮAtPIP2ꎻ1从质膜的组成型胞吞是由网格蛋白介导的ꎬ而在盐胁迫条件下ꎬtyrphostinA23不能完全抑制PIPs的胞吞作用ꎬ但BFA仍会阻碍胞吐作用[43]ꎬ说明胁迫条件下PIPs的胞吞存在多条途径ꎮ2 2 3㊀PIPs蛋白的降解在干旱㊁盐碱和高温等恶劣环境下ꎬ陆生植物自身的水分平衡调节是保证其正常生长的必要条件ꎮ植物为了应对环境的变化ꎬ通过改变自身组织中PIPs的表达和活性来调节水分平衡ꎮ膜蛋白能够通过被泛素化靶向蛋白酶体或自噬体途径被输送到液泡进行降解[44]ꎮ研究发现环膜锚定E3泛素连接酶Rma1H1和AtPIP2ꎻ1发生相互作用ꎮRma1H1定位在内质网膜中ꎬ能够抑制AtPIP2ꎻ1从ER转运到质膜ꎬ导致泛素化的AtPIP2ꎻ1通过蛋白酶体途径降解[45]ꎮHachez等在拟南芥的研究中确定了水通道蛋白降解和细胞内转运之间的一种非常新颖的联系[46]ꎮTSPO是一种富含色氨酸的转运蛋白ꎬ它作为多应激调节器能够调控AtPIP2ꎻ7的表达量[47]ꎮ通过BiFc实验证明AtPIP2ꎻ7与TSPO在内质网和高尔基体发生相互作用[48]ꎮ随后利用自噬体途径将复合物定向到液泡降解ꎬ这一过程受到脱落酸诱导[46]ꎮ因此ꎬ植物细胞在水分胁迫下可以通过多种途径降解水通道蛋白ꎬ从而调节细胞膜的渗透性ꎮ3㊀PIPs蛋白的亚细胞定位用经典的激光共聚焦显微镜观察时ꎬ正常条件下PIPs ̄GFP的荧光信号在质膜上是连续分布的ꎻ而有些膜蛋白ꎬ例如钾离子通道蛋白KAT1会定位于质膜的点状结构中[30]ꎮ利用荧光漂白后恢复技术对AtPIP2ꎻ1的侧向迁移率进行分析ꎬ发现ER驻留的AtPIP2ꎻ1突变体在ER膜上的侧向迁移率较高ꎬ而质膜定位的野生型AtPIP2ꎻ1在正常生长条件下显示出相对低的侧向迁移率[49]ꎮ应用全内反射显微术(totalinternalreflectionfluorescencemicroscopyꎬTIRFM)结合单颗粒追踪(singleparticletrackingꎬSPT)对AtPIP2ꎻ1的动态进行高时空分辨率分析ꎬ发现AtPIP2ꎻ1在植物活细胞中表现出高度异质性的膜扩散动力学特征[37]ꎬ也证明了AtPIP2ꎻ1在膜筏微域中的定位ꎮ膜筏微域是细胞质膜上富含固醇类和鞘脂类的微结构域ꎬ大小为10~200nm高度动态的结构[50]ꎮ此前ꎬ蛋白质组学结果显示ꎬ在抗去垢剂抽提膜微域(膜筏)中可以鉴定到PIPs蛋白[51]ꎮ利用固醇染色剂filipin和膜筏标记蛋白flot1与AtPIP2ꎻ1共定位研究显示ꎬAtPIP2ꎻ1定位在质膜上时ꎬ在膜筏和非膜筏区域呈现动态分布[37]ꎮ值得注意的是ꎬAtPIP2ꎻ1和拟南芥其他膜白的低侧向迁移率与很多因素有关ꎬ例如蛋白质相互作用㊁细胞骨架以及细胞壁等都会影响膜定位蛋白的侧向位移[52]ꎮ虽然大多数植物的质膜AQPs在细胞膜上是相对均匀的分布ꎬ但也有少数亚型存在极性定位ꎮZmPIP2ꎻ5优先在玉米根表皮细胞的外表面表达ꎬ而OsPIP2ꎻ1和OsPIP2ꎻ5则优先表达于水稻根内胚层细胞的内表面[53]ꎮPIPs的亚细胞定位还与蛋白的寡聚化有关ꎮ之前的研究证明ꎬZmPIP1ꎻ2和ZmPIP2ꎻ5在玉米细胞中单独表达时ꎬZmPIP1ꎻ2驻留在内质网ꎬZmPIP2ꎻ5则定位在质膜上ꎬ而ZmPIP1ꎻ2和ZmPIP2ꎻ5的共表达时ZmPIP1ꎻ2定位到质膜[22]ꎮ4㊀展望近年来ꎬ植物水通道蛋白的研究取得了快速进展ꎬ其生物学功能以及参与的生理过程受到越来越多的关注ꎮ迄今为止ꎬ人们对植物水通道蛋白的分类㊁亚细胞定位㊁胞吞胞吐和翻译后修饰有了较为深入的了解ꎬ然而仍有一些问题需要继续研究ꎬ例如在PIPs转运过程中是否存在其他的内质网输出信号ꎻSNAREs蛋白与PIPs的精确转运机制ꎻRma1H1是否直接抑制PIP2ꎻ1的转运ꎬ诸多问题都尚未得到明确证实ꎮ利用先进的技术深入探究水通道蛋白复杂的调控网络ꎬ系统阐明PIPs的转运动态ꎬ对于了解植物细胞如何调节细胞膜的水分渗透性具有重要意义ꎮ参考文献:[1]㊀KOEFOED ̄JOHNSENVꎬUSSINGHH.ThecontributionsofdiffusionandflowtothepassageofD2Othroughlivingmembranesꎻeffectofneurohypophyseal387㊀㊀电子显微学报㊀J.Chin.Electr.Microsc.Soc.第39卷hormoneonisolatedanuranskin[J].ActaPhysiolScandꎬ1953ꎬ28(1):60-76.[2]㊀DENKERBMꎬSMITHBLꎬKUHAJDAFPꎬetal.IdentificationꎬpurificationꎬandpartialcharacterizationofanovelMr28ꎬ000integralmembraneproteinfromerythrocytesandrenaltubules[J].JBiolChemꎬ1988ꎬ263(30):15634-15642.[3]㊀MAURELCꎬREIZERJꎬSCHROEDERJIꎬetal.Thevacuolarmembraneproteingamma ̄TIPcreateswaterspecificchannelsinXenopusoocytes[J].EMBOJꎬ1993ꎬ12(6):2241-2247.[4]㊀ZHANGSꎬFENGMꎬCHENWꎬetal.InroseꎬtranscriptionfactorPTMbalancesgrowthanddroughtsurvivalviaPIP2ꎻ1aquaporin[J].NatPlantsꎬ2019ꎬ5(3):290-299.[5]㊀HACHEZCꎬBESSERERAꎬCHEVALIERASꎬetal.Insightsintoplantplasmamembraneaquaporintrafficking[J].TrendsPlantSciꎬ2013ꎬ18(6):344-352.[6]㊀MAURELCꎬBOURSIACYꎬLUUDTꎬetal.Aquaporinsinplants[J].PhysiolRevꎬ2015ꎬ95(4):1321-1358.[7]㊀RODRIGUESOꎬRESHETNYAKGꎬGRONDINAꎬetal.AquaporinsfacilitatehydrogenperoxideentryintoguardcellstomediateABA ̄andpathogen ̄triggeredstomatalclosure[J].ProcNatlAcadSciUSAꎬ2017ꎬ114(34):9200-9205.[8]㊀VERKMANASꎬANDERSONMOꎬPAPADOPOULOSMC.Aquaporins:importantbutelusivedrugtargets[J].NatRevDrugDiscovꎬ2014ꎬ13(4):259-277. [9]㊀SUTKAMꎬAMODEOGꎬOZUM.Plantandanimalaquaporinscrosstalk:whatcanberevealedfromdistinctperspectives[J].BiophysRevꎬ2017ꎬ9(5):545-562. [10]㊀HOVERMꎬBHAVEM.Plantaquaporinswithnon ̄aquafunctions:decipheringthesignaturesequences[J].PlantMolBiolꎬ2011ꎬ75(4/5):413-430. [11]㊀KAPILANRꎬVAZIRIMꎬZWIAZEKJJ.Regulationofaquaporinsinplantsunderstress[J].BiolResꎬ2018ꎬ51(1):4.[12]㊀ISHIBASHIK.AquaporinsubfamilywithunusualNPAboxes[J].BiochimBiophysActaꎬ2006ꎬ1758(8):989-993.[13]㊀BERNYMCꎬGILISDꎬROOMANMꎬetal.Singlemutationsinthetransmembranedomainsofmaizeplasmamembraneaquaporinsaffecttheactivityofmonomerswithinaheterotetramer[J].MolPlantꎬ2016ꎬ9(7):986-1003.[14]㊀POUAꎬJEANGUENINLꎬMILHIETTꎬetal.Salinity ̄mediatedtranscriptionalandpost ̄translationalregulationoftheArabidopsisaquaporinPIP2ꎻ7[J].PlantMolBiolꎬ2016ꎬ92(6):731-744.[15]㊀LIWꎬQIANGXJꎬHANXRꎬetal.EctopicexpressionofathellungiellasalsugineaaquaporingeneꎬTsPIP1ꎻ1ꎬincreasedthesalttoleranceofrice[J].IntJMolSciꎬ2018ꎬ19(8):2229.[16]㊀LISXꎬLIUJLꎬANYRꎬetal.MsPIP2ꎻ2ꎬanovelaquaporingenefromMedicagosativaꎬconferssalttoleranceintransgenicArabidopsis[J].EnvironExpBotꎬ2019ꎬ165:39-52.[17]㊀ZOUYNꎬWUHHꎬGIRIBꎬetal.Mycorrhizalsymbiosisdown ̄regulatesordoesnotchangerootaquaporinexpressionintrifoliateorangeunderdroughtstress[J].PlantPhysiolBiochemꎬ2019ꎬ144:292-299. [18]㊀FRICKAꎬJARVAMꎬTORNROTH ̄HORSEFIELDS.StructuralbasisforpHgatingofplantaquaporins[J].FEBSLettꎬ2013ꎬ587(7):989-993.[19]㊀FORTUNAACꎬPALMAGZDꎬCARLAꎬetal.Gatinginplantplasmamembraneaquaporins:theinvolvementofleucineintheformationofaporeconstrictionintheclosedstate[J].FEBSJꎬ2019ꎬ286(17):3473-3487.[20]㊀BOURSIACYꎬBOUDETJꎬPOSTAIREOꎬetal.Stimulus ̄induceddownregulationofrootwatertransportinvolvesreactiveoxygenspecies ̄activatedcellsignallingandplasmamembraneintrinsicproteininternalization[J].PlantJꎬ2008ꎬ56(2):207-218.[21]㊀MOELLERHBꎬOLESENETꎬFENTONRA.Regulationofthewaterchannelaquaporin-2byposttranslationalmodification[J].AmJPhysiolRenalPhysiolꎬ2011ꎬ300(5):F1062-1073.[22]㊀ZELAZNYEꎬMIECIELICAUꎬBORSTJWꎬetal.AnN ̄terminaldiacidicmotifisrequiredforthetraffickingofmaizeaquaporinsZmPIP2ꎻ4andZmPIP2ꎻ5totheplasmamembrane[J].PlantJꎬ2009ꎬ57(2):346-355.[23]㊀SORIEULMꎬSANTONIVꎬMAURELCꎬetal.Mechanismsandeffectsofretentionofover ̄expressedaquaporinAtPIP2ꎻ1intheendoplasmicreticulum[J].Trafficꎬ2011ꎬ12(4):473-482.[24]㊀DASILVALLꎬSNAPPELꎬDENECKEJꎬetal.EndoplasmicreticulumexportsitesandGolgibodiesbehaveassinglemobilesecretoryunitsinplantcells[J].PlantCellꎬ2004ꎬ16(7):1753-1771. [25]㊀HANTONSLꎬMATHESONLAꎬCHATRELꎬetal.DynamicorganizationofCOPIIcoatproteinsatendoplasmicreticulumexportsitesinplantcells[J].PlantJꎬ2009ꎬ57(6):963-974.[26]㊀YANGHꎬKREBSMꎬSTIERHOFYDꎬetal.487㊀第6期鲁雨晴等:植物水通道蛋白PIPs亚细胞定位转运的研究进展㊀㊀CharacterizationoftheputativeaminoacidtransportergenesAtCAT2ꎬ3&4:thetonoplastlocalizedAtCAT2regulatessolubleleafaminoacids[J].JPlantPhysiolꎬ2014ꎬ171(8):594-601.[27]㊀CHEVALIERASꎬBIENERTGPꎬCHAUMONTF.AnewLxxxAmotifinthetransmembraneHelix3ofmaizeaquaporinsbelongingtotheplasmamembraneintrinsicproteinPIP2groupisrequiredfortheirtraffickingtotheplasmamembrane[J].PlantPhysiolꎬ2014ꎬ166(1):125-138.[28]㊀MATHESONLAꎬHANTONSLꎬBRANDIZZIF.TrafficbetweentheplantendoplasmicreticulumandGolgiapparatus:totheGolgiandbeyond[J].CurrOpinPlantBiolꎬ2006ꎬ9(6):601-609.[29]㊀GREFENCꎬBLATTMR.SNAREs ̄moleculargovernorsinsignallinganddevelopment[J].CurrOpinPlantBiolꎬ2008ꎬ11(6):600-609.[30]㊀BESSERERAꎬBURNOTTEEꎬBIENERTGPꎬetal.SelectiveregulationofmaizeplasmamembraneaquaporintraffickingandactivitybytheSNARESYP121[J].PlantCellꎬ2012ꎬ24(8):3463-3481. [31]㊀HACHEZCꎬLALOUXTꎬREINHARDTHꎬetal.ArabidopsisSNAREsSYP61andSYP121coordinatethetraffickingofplasmamembraneaquaporinPIP2ꎻ7tomodulatethecellmembranewaterpermeability[J].PlantCellꎬ2014ꎬ26(7):3132-3147.[32]㊀ZHANGLꎬZHANGHꎬLIUPꎬetal.ArabidopsisR ̄SNAREproteinsVAMP721andVAMP722arerequiredforcellplateformation[J].PLoSOneꎬ2011ꎬ6(10):e26129.[33]㊀邢晶晶ꎬ刘海娇ꎬ范路生ꎬ等.植物细胞胞吞途径及其研究方法[J].电子显微学报ꎬ2014ꎬ33(5):449-460.[34]㊀BANBURYDNꎬOAKLEYJDꎬSESSIONSRBꎬetal.TyrphostinA23inhibitsinternalizationofthetransferrinreceptorbyperturbingtheinteractionbetweentyrosinemotifsandthemediumchainsubunitoftheAP-2adaptorcomplex[J].JBiolChemꎬ2003ꎬ278(14):12022-12028.[35]㊀DHONUKSHEPꎬANIENTOFꎬHWANGIꎬetal.Clathrin ̄mediatedconstitutiveendocytosisofPINauxineffluxcarriersinArabidopsis[J].CurrBiolꎬ2007ꎬ17(6):520-527.[36]㊀曲绍峰.FCS/FCCS技术及其在植物细胞生物学中的应用[J].电子显微学报ꎬ2014ꎬ33(5):461-468. [37]㊀LIXꎬWANGXꎬYANGYꎬetal.Single ̄moleculeanalysisofPIP2ꎻ1dynamicsandpartitioningrevealsmultiplemodesofArabidopsisplasmamembraneaquaporinregulation[J].PlantCellꎬ2011ꎬ23(10):3780-3797.[38]㊀STIERHOFYDꎬVIOTTICꎬSCHEURINGDꎬetal.Sortingnexins1and2alocatemainlytotheTGN[J].Protoplasmaꎬ2013ꎬ250(1):235-240.[39]㊀VIOTTICꎬBUBECKJꎬSTIERHOFYDꎬetal.EndocyticandsecretorytrafficinArabidopsismergeinthetrans ̄Golginetwork/earlyendosomeꎬanindependentandhighlydynamicorganelle[J].PlantCellꎬ2010ꎬ22(4):1344-1357.[40]㊀KANGBHꎬNIELSENEꎬPREUSSMLꎬetal.ElectrontomographyofRabA4b ̄andPI-4Kbeta1 ̄labeledtransGolginetworkcompartmentsinArabidopsis[J].Trafficꎬ2011ꎬ12(3):313-329.[41]㊀PACIOREKTꎬZAZIMALOVAEꎬRUTHARDTNꎬetal.Auxininhibitsendocytosisandpromotesitsowneffluxfromcells[J].Natureꎬ2005ꎬ435(7046):1251-1256.[42]㊀FERARUEꎬFERARUMIꎬASAOKARꎬetal.BEX5/RabA1bregulatestrans ̄Golginetwork ̄to ̄plasmamembraneproteintraffickinginArabidopsis[J].PlantCellꎬ2012ꎬ24(7):3074-3086.[43]㊀LUUDTꎬMARTINIEREAꎬSORIEULMꎬetal.FluorescencerecoveryafterphotobleachingrevealshighcyclingdynamicsofplasmamembraneaquaporinsinArabidopsisrootsundersaltstress[J].PlantJꎬ2012ꎬ69(5):894-905.[44]㊀玉猛ꎬ宋雨桐ꎬ雷爱梅ꎬ等.植物细胞膜受体胞吞及其功能的研究进展[J].电子显微学报ꎬ2017ꎬ36(2):180-186.[45]㊀LEEHKꎬCHOSKꎬSONOꎬetal.Droughtstress ̄inducedRma1H1ꎬaRINGmembrane ̄anchorE3ubiquitinligasehomologꎬregulatesaquaporinlevelsviaubiquitinationintransgenicArabidopsisplants[J].PlantCellꎬ2009ꎬ21(2):622-641.[46]㊀HACHEZCꎬVELJANOVSKIVꎬREINHARDTHꎬetal.TheArabidopsisabioticstress ̄inducedTSPO ̄relatedproteinreducescell ̄surfaceexpressionoftheaquaporinPIP2ꎻ7throughprotein ̄proteininteractionsandautophagicdegradation[J].PlantCellꎬ2014ꎬ26(12):4974-4990.[47]㊀VANHEECꎬZAPOTOCZNYGꎬMASQUELIERDꎬetal.TheArabidopsismultistressregulatorTSPOisahemebindingmembraneproteinandapotentialscavengerofporphyrinsviaanautophagy ̄dependentdegradationmechanism[J].PlantCellꎬ2011ꎬ23(2):785-805. [48]㊀GUILLAUMOTDꎬGUILLONSꎬDEPLANQUETꎬetal.TheArabidopsisTSPO ̄relatedproteinisastressandabscisicacid ̄regulatedꎬendoplasmicreticulum ̄Golgi ̄localizedmembraneprotein[J].PlantJꎬ2009ꎬ60(2):587㊀㊀电子显微学报㊀J.Chin.Electr.Microsc.Soc.第39卷242-256.[49]㊀KLEINE ̄VEHNJꎬWABNIKKꎬMARTINIEREAꎬetal.RecyclingꎬclusteringꎬandendocytosisjointlymaintainPINauxincarrierpolarityattheplasmamembrane[J].MolSystBiolꎬ2011ꎬ7:540.[50]㊀曹阳阳ꎬ玉猛ꎬ鲁良ꎬ等.植物SPFH超家族蛋白及其生物学功能研究进展[J].电子显微学报ꎬ2019ꎬ38(3):294-302.[51]㊀BORNERGHꎬSHERRIERDJꎬWEIMARTꎬetal.Analysisofdetergent ̄resistantmembranesinArabidopsis.Evidenceforplasmamembranelipidrafts[J].PlantPhysiolꎬ2005ꎬ137(1):104-116.[52]㊀MARTINIEREAꎬLAVAGIIꎬNAGESWARANGꎬetal.Cellwallconstrainslateraldiffusionofplantplasma ̄membraneproteins[J].ProcNatlAcadSciUSAꎬ2012ꎬ109(31):12805-12810.[53]㊀SAKURAI ̄ISHIKAWAJꎬMURAI ̄HATANOMꎬHAYASHIHꎬetal.Transpirationfromshootstriggersdiurnalchangesinrootaquaporinexpression[J].PlantCellEnvironꎬ2011ꎬ34(7):1150-1163.㊀㊀∗㊀CorrespondingauthorAdvancesinresearchonsubcellularredistributionofplantplasmamembraneaquaporinLUYu ̄qing1ꎬ2ꎬCUIYa ̄ning1ꎬ2ꎬZHANGYuan1ꎬ2ꎬYAOXiao ̄min1ꎬ2ꎬLIXiao ̄juan1ꎬ2∗(1.BeijingAdvancedInnovationCenterforTreeBreedingbyMolecularDesignꎬBeijing100083ꎻ2.NationalEngineeringLaboratoryforTreeBreedingꎬCollegeofBiologicalSciencesandTechnologyꎬBeijingForestryUniversityꎬBeijing100083ꎬChina)Abstract㊀㊀Aquaporinsarespecificporeforwaterselectivetransmembranetransportꎬwhichmediatetherapidtransmembranetransportofwatermoleculesandsmallunchargedsolutes.Plantcellscanregulatetheexpressionofaquaporingenesꎬpost ̄translationalmodificationofproteinsandsubcellularlocalizationofproteinsꎬandregulatethewatertransportcapacityofcellsinvariouswaystorespondtostresssignals.PIPsꎬasubfamilyofaquaporinslocatedinplasmamembraneꎬarethelargestsubfamilyofaquaporinsinplantsandplayanimportantroleinmaintainingplantwaterstatus.ThisreviewsummarizedthesubcellularlocalizationofPIPsꎬendocytosisandexocytosisrecyclingꎬandtheregulationmechanismofproteindegradation.Keywords㊀㊀aquaporinꎻsubcellularlocalizationꎻexocytosisꎻendocytosis687。

中医药关于水通道蛋白表达的研究进展李雷兵;张琦【摘要】水液代谢紊乱可影响多个脏腑的功能并导致多种临床疾病,而中医药对水液代谢失常类疾病具有很好的疗效.水通道蛋白(AQP)作为多种细胞膜上存在的特异性转运水分子的蛋白通道,在机体水液代谢中发挥着重要的作用.近年来,中医药关于水通道蛋白表达的研究有了较大的进展,其中通过调节水通道蛋白的表达是诸多中医方药治疗水液代谢失常类疾病的机制之一.故将对近年研究概况加以分析和总结,为今后的研究提供借鉴.【期刊名称】《中国中医基础医学杂志》【年(卷),期】2015(021)009【总页数】3页(P1194-1195,封4)【关键词】中药;水通道蛋白;研究进展【作者】李雷兵;张琦【作者单位】成都中医药大学基础医学院,成都 611137;成都中医药大学基础医学院,成都 611137【正文语种】中文【中图分类】R2-03水是维持人体正常生命活动所必需的重要物质之一,水液的代谢调控正常是所有生命形式的一个基本条件。
中医学很早就对体内水的转运和代谢进行了描述,并认为其与肺脾肾三脏密切相关,对于人体水液代谢失常所形成的湿邪、痰饮等多种病理产物所导致的多种疾病形成了系统的诊治措施。
水通道蛋白在20世纪90年代被发现,其在人体水液代谢中发挥不可替代的作用,目前发现的共有13个亚型,分别是AQP0-AQP20。
水通道蛋白的发现不仅为现代医学的水液代谢相关性疾病提供了新的研究靶点,同时也为中医药在水液代谢失常疾病的研究治疗提供了新的方向。
本文概述了中医药关于水通道蛋白的研究进展以求发现当中的不足并为今后的研究提供了一定的借鉴。
病因病机作为中医药的重要组成部分,其是中医诊断、用药治疗的依据。
抓住病机便可确立治疗方案从而处方、用药。
因此明确病因病机与水通道蛋白表达的关系,对于中医药治疗与水通道蛋白表达异常所导致的水液代谢失常相关疾病必不可少。
王哲等[1-2]发现,肺气虚证模型大鼠结肠组织AQP2表达减少,肾组织AQP2表达增强。

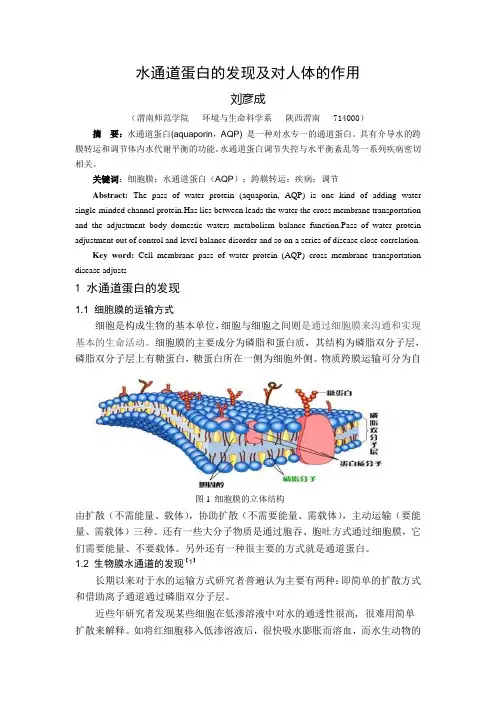
水通道蛋白的发现及对人体的作用刘彦成(渭南师范学院环境与生命科学系陕西渭南 714000)摘要:水通道蛋白(aquaporin,AQP) 是一种对水专一的通道蛋白。
具有介导水的跨膜转运和调节体内水代谢平衡的功能。
水通道蛋白调节失控与水平衡紊乱等一系列疾病密切相关。
关键词:细胞膜;水通道蛋白(AQP);跨膜转运;疾病;调节Abstract:The pass of water protein (aquaporin, AQP) is one kind of adding water single-minded channel protein.Has lies between leads the water the cross membrane transportation and the adjustment body domestic waters metabolism balance function.Pass of water protein adjustment out of control and level balance disorder and so on a series of disease close correlation.Key word:Cell membrane pass of water protein (AQP) cross membrane transportation disease adjusts1 水通道蛋白的发现1.1 细胞膜的运输方式细胞是构成生物的基本单位,细胞与细胞之间则是通过细胞膜来沟通和实现基本的生命活动。
细胞膜的主要成分为磷脂和蛋白质,其结构为磷脂双分子层,磷脂双分子层上有糖蛋白,糖蛋白所在一侧为细胞外侧。
物质跨膜运输可分为自图1 细胞膜的立体结构由扩散(不需能量、载体),协助扩散(不需要能量、需载体),主动运输(要能量、需载体)三种。
还有一些大分子物质是通过胞吞、胞吐方式通过细胞膜,它们需要能量、不要载体。

⽔通道蛋⽩的发现和研究过程教学反思:有时让学⽣熟悉相关的科技发展热点,可以帮助学⽣理解有关的情境材料,更能解决相关的问题。
由于教材的关系,很多学⽣⽆法解决2012年北京⾼考题,因为不熟悉⽔通道蛋⽩相关的知识。
(2012年北京⾼考试题)科学家为了研究蛋⽩A的功能,选⽤细胞膜中缺乏此蛋⽩的⾮洲⽖蟾卵母细胞进⾏实验,处理及结果见下表。
实验组号在等渗溶液中进⾏的处理在低渗溶液中测定卵细胞的⽔通透速率(cm/s×10-4)Ⅰ向卵母细胞注⼊微量⽔(对照)27.9Ⅱ向卵母细胞注⼊蛋⽩A的mRNA210.0Ⅲ将部分Ⅱ细胞放⼊含HgCl2的等渗溶液中80.7Ⅳ将部分Ⅲ细胞放⼊含试剂M的等渗溶液中188.0(1)将I组卵母细胞放⼊低渗溶液后,⽔分⼦经⾃由扩散(渗透)穿过膜的____________进⼊卵母细胞。
(2)将蛋⽩A的mRNA注⼊卵母细胞⼀定时间后,该mRNA____________的蛋⽩质进⼊细胞膜,使细胞在低渗溶液中体积____________。
(3)与II组细胞相⽐,III组细胞对⽔的通透性____________,说明HgC12对蛋⽩A的功能有________作⽤。
⽐较III、IV组的结果,表明试剂M能够使蛋⽩A的功能____________。
推测HgC12没有改变蛋⽩A的氨基酸序列,⽽是破坏了蛋⽩A的____________。
(4)已知抗利尿激素通过与细胞膜上的____________结合,可促进蛋⽩A插⼊肾⼩管上⽪细胞膜中,从⽽加快肾⼩管上⽪细胞对原尿中⽔分⼦的____________。
(5)综合上述结果,可以得出____________的推论。
【答案】(1)磷脂双分⼦层(2)翻译迅速增⼤(3)明显降低抑制部分恢复空间结构(4)受体重吸收(5)蛋⽩A是⽔通道蛋⽩⼀、⽔通道蛋⽩的发现过程1988年Agre(阿格雷)(阿格雷)等在分离纯化红细胞膜上的等在分离纯化红细胞膜上的Rh多肽时,发现了⼀个28 kD的疏⽔性跨膜蛋⽩,称为形成通道的整合膜蛋⽩28(CHIP28),他们很快分离得到了这种蛋⽩质,并没出了氨基酸序列,1991年完成了其cDNA克隆,并发现这种蛋⽩质在吸⽔能⼒很强的肾脏和红细胞中含量特别⾼。


水通道蛋白的研究进展
宁巧明;王祥瑞
【期刊名称】《国际麻醉学与复苏杂志》
【年(卷),期】2005(026)005
【摘要】水通道蛋白在体内广泛分布,具有特殊的分子结构和生物学特性.受诸多因素的调节,如蛋白激酶C、pH值、睾丸激素、温度等.其中水通道蛋白4(AQP4)与脑水肿关系密切.水通道蛋白使水代谢的研究跃入了一个全新的阶段,它的发现使我们能够在分子水平研究水的运动,将会阐明许多系统疾病的发病机制,并予以相应的干预,对于临床及实际工作具有重要的指导意义.
【总页数】4页(P271-274)
【作者】宁巧明;王祥瑞
【作者单位】200127,上海第二医科大学附属仁济医院麻醉科;200127,上海第二医科大学附属仁济医院麻醉科
【正文语种】中文
【中图分类】R3
【相关文献】
1.参苓白术散加减方对结肠黏膜组织水通道蛋白4、水通道蛋白8表达的影响 [J], 康楠;王凤云;陈婷;王晓鸽;朱恩林;唐旭东
2.黄芪对急性肺损伤模型大鼠肺组织水通道蛋白-1和水通道蛋白-5表达的影响[J], 刘毅;梅荣;杨明会;李绍旦;王文明
3.中西医结合治疗对急性胰腺炎患者水通道蛋白5、水通道蛋白6表达的影响 [J],
赵园园;吴成明
4.水通道蛋白磁共振分子成像与水通道蛋白4表达的相关性研究 [J], 陈秋雁;吴富淋;彭晓澜;李春丽;江敏;陈婷婷;魏鼎泰
5.水通道蛋白的功能及水通道蛋白4与脑水肿关系的研究进展 [J], 顾永锋;刘文忠因版权原因,仅展示原文概要,查看原文内容请购买。

Journal of Physiology Studies 生理学研究, 2014, 2, 19-32 Published Online November 2014 in Hans. /journal/jps /10.12677/jps.2014.24004The Physiological Functions of AquaporinsXiaoqiang Geng, Baoxue Yang *Department of Pharmacology, School of Basic Medical Sciences, Peking University, Beijing Email: ****************, ****************.cn Received: Jan. 20th , 2015; accepted: Feb. 2nd , 2015; published: Feb. 5th , 2015 Copyright © 2014 by authors and Hans Publishers Inc. This work is licensed under the Creative Commons Attribution International License (CC BY). /licenses/by/4.0/AbstractThe aquaporins (AQPs) are a family of 13 small hydrophobic integral transmembrane water channel proteins involved in transcellular and transepithelial water movement and fluid transport. The study of aquaporins has experienced from discovery to the exploration of their physiological func-tions. It has been found that aquaporins are expressed in various tissues and organs and they have different physiological functions, including urine concentration, exocrine gland secretion, hydra-tion of brain, transduction of neuronal signaling and metabolism. The studies on aquaporins can provide novel ideas to the mechanism and therapy of related diseases. This review article dis-cusses the recent researches on the physiological functions of AQPs in different tissues and or-gans. KeywordsAquaporin, Integral Transmembrane Protein, Water Channel, Water Transport水通道蛋白生理学功能的研究进展耿晓强,杨宝学*北京大学基础医学院药理学系,北京 Email: ****************, ****************.cn收稿日期:2015年1月20日;录用日期:2015年2月2日;发布日期:2015年2月5日*通讯作者。
水通道蛋白研究进展
蒲春霞
【期刊名称】《成都大学学报(自然科学版)》
【年(卷),期】2010(029)002
【摘要】水通道蛋白广泛存在于生物体中的各组织部位,影响着生物机体水代谢的过程,随着分子生物学技术的进步,对水通道蛋白的基础研究已经比较深入和成熟.对水通道蛋白的研究情况进行概要综述,目的在于利用水通道蛋白研究的基础成果,阐释临床水代谢障碍类疾病的发病机理及提供可能的解决思路.
【总页数】3页(P104-106)
【作者】蒲春霞
【作者单位】成都大学,医护学院,四川,成都,610017
【正文语种】中文
【中图分类】R329
【相关文献】
1.参苓白术散加减方对结肠黏膜组织水通道蛋白4、水通道蛋白8表达的影响 [J], 康楠;王凤云;陈婷;王晓鸽;朱恩林;唐旭东
2.黄芪对急性肺损伤模型大鼠肺组织水通道蛋白-1和水通道蛋白-5表达的影响[J], 刘毅;梅荣;杨明会;李绍旦;王文明
3.中西医结合治疗对急性胰腺炎患者水通道蛋白5、水通道蛋白6表达的影响 [J], 赵园园;吴成明
4.水通道蛋白磁共振分子成像与水通道蛋白4表达的相关性研究 [J], 陈秋雁;吴富
淋;彭晓澜;李春丽;江敏;陈婷婷;魏鼎泰
5.水通道蛋白的功能及水通道蛋白4与脑水肿关系的研究进展 [J], 顾永锋;刘文忠因版权原因,仅展示原文概要,查看原文内容请购买。
doi:10.3969“.issn.1008—9632.2009.05.063植物水通道蛋白生理功能的研究进展刘迪秋,王继磊,葛锋,李文娴(昆明理工大学生命科学与技术学院,昆明650224)摘要:自1992年第一个水通道蛋白AQPl被人们认识以来,从植物中分离得到了大量AQPs基因。
AQPs在植物体内形成选择性运输水及一些小分子溶质和气体的膜通道,参与介导多个植物生长发育的生理活动,如细胞伸长、气孔运动、种子发育、开花繁殖和逆境胁迫等。
就植物水通道蛋白的生理功能进行概述。
关键词:水通道蛋白;跨膜运输;生理功能;植物;水分中图分类号:Q945.17+1文献标识码:A文章编号:1008—9632(2009)05—0063—04水是生物体的主要组成部分,对生命至关重要,活细胞都含有80%以上的水分。
水在细胞和组织问的进出是生命代谢的基本过程。
尽管多细胞生物经过长期的进化,特化了一些对水流障碍很微弱的专门组织,但是水分子跨膜转运仍然是水分运输的一个主要步骤。
植物种子萌发以及花粉管伸长时,细胞体积增大与水分快速吸收相伴发生;动物的红细胞和肾上皮细胞运输水分的速度非常快。
细胞膜上存在特异转运水的通道,美国约翰・霍普金斯大学医学院化学家Agre从血红细胞中克隆了第一个水通道蛋白cHIP28(channel—foming—integralmembranepmtein),并用实验证明了cHIP28蛋白具有允许水分子进入的功能。
其后,科学家陆续从哺乳动物、植物、微生物中鉴定出各种水通道蛋白,统称为“Aqu印orins(AQPs)”,从此水跨细胞膜转运的生物学研究进入了一个崭新阶段。
近年来在拟南芥、烟草、玉米、豌豆、水稻、向日葵、油菜等多种植物中都发现了AQPs的存在。
AQPs属于古老的通道蛋白MIP(majorintrinsicproteins)成员,与动物和微生物相比,植物AQPs的类型显得更为丰富,并具有更大的多样性。
中国牛业科学2014,4O(4):39—41 China Cattle Science 综 述
水通道蛋白9的研究进展 张婧敏 ,张春雷 ,陈 宏 ,房兴堂 (1.上海农林职业技术学院,上海松江201600;2.江苏师范大学生命科学学院,江苏徐州221116)
摘 要:水通道蛋白9在机体内许多器官组织中表达,它对水、尿素、甘油等分子均有通透 性,其基因结构、染色体定位、蛋白质结构、组织分布和生理功能也已得到了较为深入的研 究。本文对水通道蛋白9基因的结构特点、分子结构、分布和生理功能作一综述,以期为相 关疾病诊治和生产实践提供理论依据。 关键词:水通道蛋白9;基因结构;组织分布;生理功能 中图分类号:S811.6 文献标识码:A 文章编号:1001—9111(2O14)04—0039—03
水通道蛋白(Aquaporin,AQP)又叫水孔蛋白, 它是存在于细胞膜上快速转运水的特异性孔道,已 发现的水通道蛋白有AQPo ̄AQP12_1],共13个成 员。水通道蛋白普遍存在于微生物、植物及动物界。 整个家族在水解平衡中起着关键性的作用。水通道 蛋白分子家族成员的一级结构中都含有一种高度保 守的特征性序列,即天冬酰胺一脯氨酸一丙氨酸 (NPA)序列。其二级结构包含6个跨膜的疏水a一 螺旋和5个包含NPA环区的反向平行I3一折叠,即 包括6个跨膜结构域的疏水性膜内在蛋白和分别在 膜两侧形成的五个环结构。这些j3一折叠片伸入到磷 脂双层中,从而在质膜上形成孔道。它们结构的任 何变异都会改变其水通道活性。其空间结构是由单 体肽链跨越细胞膜6次而围绕形成的腔型结构(图 1),中间是直径约为6埃的水分子通道l_3],该结构被 称为特征性的“沙漏”晶体模型_4 ]。 按照对物质转运的专一性将水通道蛋白分为两 个亚家族,一类为经典的水通道蛋白,它们只允许水 分子通过,另一类为水一甘油通道蛋白(Aquaglycer— oporin),主要有AQP3、AQP7、AQP9和AQP10,除 对水分子通透外,对中性小分子如尿素、嘌呤、甘油 等成分也具有通透性,尤其是甘油。水一甘油通道蛋 白在脂肪组织、肝脏、脑组织、皮肤等不同部位参与 脂类代谢,其缺失会引发肥胖、糖尿病等。
C 图1水通道蛋白的分子结构(引自参考文献L2J) 1 AQP9基因的结构特点 AQP9是1997年Kuriyame等 在进行人类脂 肪组织基因序列系统分析过程中发现的,其分子结构 以及对水的通透性与其他的水通道蛋白类似。人 AQP9基因由6个外显子,5个内含子组成,大小约为
收稿日期:2o14—05-05修回日期:2014—05—20 基金项目:上海高校青年教师培养资助项目(ZZnlz12004);江苏省高校科研成果产业化推进工程项目(JHB2012—32);徐 州市科技计划项目(xF12c052);江苏高校优势学科建设工程。 作者简介:张婧敏(1986一),女,江苏镇江人,硕士,助教,主要从事动物生物化学与分子生物学研究。 *通讯作者:房兴堂(1963一),男,江苏沛县人,教授,硕导,主要从事动物遗传资源及利用。 40 中国牛业科学 第40卷 25个kh。人AQP9基因外显子、内含子数目与 AQP3、AQP7基因相同,但AQP9基因内含子的大小 从1.5 kb到1O kb以上,比AQP3、AQP7基因的内含 子大9O至3 500 bp。外显子6含有一个终止密码和 一个聚腺苷酸信号(A觚 AA)。以牛AQP9基因为 例,其位于牛的第10号染色体上,长度为48 678 bp, 也包含6个外显子,编码295个氨基酸(图2)。
NC 007308.3 _.codi】 fegi∞ ● untra ̄lated region 图2牛AQP9基因结构(引自NCBI数据库) 2 AQP9的分布与功能 AQP9在神经、消化和生殖系统等多种器官组 织中都有分布,其分子结构和对水的通透性与其他 的水通道蛋白类似。 2.1 AQP9与神经系统 AQP9在哺乳动物脑内主要分布于星形胶质细 胞及儿茶酚胺等神经元中,主要功能是参与脑内能 量代谢,对脑内水的转运和脑脊液循环具有重要作 用。Amiry等_7 通过实验推测AQP9可能与帕金 森病中易受损的神经有关。研究表明,AQP9与脑 水肿的形成密切相关,并且AQP9与水电解质平衡 调节和能量代谢调节有关I8]。通透性试验表明, AQP9对水、尿素、甘油、甘露醇、山梨糖醇、嘌呤、嘧 啶、乳酸、8一羟基丁酸以及氨都具有一定的通透性, AQP9还可以促进类金属材料的运输,可能是哺乳 动物细胞摄取亚酸盐的主要途径_g]。 2.2 AQP9与消化系统 通过克隆鼠肝细胞的原位杂交实验显示, AQP9在肝细胞的表达较强,主要分布在肝细胞的 基膜面和血窦面,而在胆小管面的质膜上无表 达l】。】。在胆汁的分泌中水需要跨细胞转运至胆管, 而AQP9是至今知道的唯一窦状隙的水通道,因此 AQP9对胆汁的转运起到重要作用 。有研究显 示,肝细胞表面甘油的摄入过程是由AQP9来完成 的。当脂肪分解在细胞膜之间形成甘油浓度梯度 时,AQP9开始转运甘油。脂肪细胞中脂肪动员产 生的甘油由AQP7将其输送到血液,再由AQP9来 完成甘油从血液到肝脏的摄取过程,从而作为糖异 生的原料补充血糖。因此认为,AQP7和AQP9共 同协调完成了甘油从脂肪细胞到肝脏的运输过程。 AQP9的功能异常将影响糖异生而导致低血糖的出 现,并且与胰岛素抵抗也密切相关_1 。AQP9除了 .I 52644498】 3 跫£2 墼;l 对水和甘油通透以外,对尿素也有很高的通透性。 肝脏是尿素生成和排出的主要器官,因此AQP9在 肝脏可能同时是一个尿素通道,并且与尿素的清除 有关。通过免疫组化检测AQP9在大鼠消化道的 分布情况,发现在大鼠消化道,AQP9在近端小肠、 远端小肠、近端结肠呈高表达,AQP9分布及表达强 度与各部位吸收分泌功能及水电解质转运活跃程度 有一定关系 1引。 2.3 AQP9与生殖系统 Pastor_1胡等研究发现,AQP9大量表达在附睾 和雄性生殖系与分泌和重吸收有关的上皮细胞的顶 膜。在受精和胚胎发生过程中,AQP9在胚泡内被 测出高表达口引。AQP9在生殖系统内环境的水和 溶质的转运过程中发挥重要作用。通过定量PCR 检测发现,大鼠前列腺组织中AQP9的表达受雄激 素的调控l1 。 2.4 AQP9与脂肪代谢 通过高脂高能膳食建立不同肥胖易感大鼠模 型,观察肥胖合并胰岛素抵抗敏感组织(。肾周脂肪、 肝脏和骨骼肌)中AQP7和AQP9 mRNA的表达情 况,实验结果表明,不同肥胖易感大鼠肾周脂肪 AQP7 mRNA表达水平一致,骨骼肌AQP7和肝脏 AQP9 mRNA表达水平存在差异_1 。已知AQP7 和AQP9共同协调完成甘油从脂肪细胞到肝脏的 运输。对AQP9基因敲除的小鼠进行研究,发现甘 油进出肝细胞受损,脂肪代谢障碍,出现了糖尿 病_1 。因此认为,AQP9参与体内甘油的转运,与 脂肪代谢、脂类在组织中的沉积有很大关系。 2.5 AQP9与其他组织 Northenr分析显示人类AQP9 mRNA在外周 白细胞和聚集白细胞的组织包括脾和骨髓均有表 达。在脾脏,AQP9主要分布于红髓的白细胞,白髓 中没有表达口 。黄德亮 叩通过荧光免疫测定出 第4期 张婧敏,等:水通道蛋白9的研究进展 41 AQP9在小鼠内耳组织中有分布,且主要存在与内 淋巴密切相关的组织结构中。AQP9在肺组织中也 有表达,但其细胞定位还尚不清楚。
3 结语 目前,随着分子生物学及基因工程技术的迅速 发展,研究人员对AQP9的基因、分子结构和生理 学功能的研究已经相当深入。这不仅为许多的生理 现象作出了科学的分子解释,并且为相关疾病的临 床治疗提供理论依据。水通道蛋白9参与体内甘油 的转运,与脂肪代谢、脂类在组织中的沉积有很大关 系。已有研究显示,AQP9基因的多态性与家畜的 生长性状有显著的相关性。因此,对该基因的研究 还将有助于阐明畜禽生长性状的分子机制,对提高 动物生产性能和维护动物机体健康等都具有很高的 实际应用价值。 参考文献: [1]Damiano AE.Review:water channel proteins in the human placenta and fetal membranes[J].Placenta,2011,2:207— 11 [2]
[3] [43 I-s] [6] Jung JS,Preston GM,Smith BL,et a1.Molecular structure of the water channel through aquaporin CHIP.The hourglass model[J].J Biol Chem,1994,269:14648—14654. Ren G,Cheng A,Melnyk P,et a1.Polymorphism in the pack— ing of aquaporin一1 tetramers in 2-Derystals[J].J Struct Biol, 2000,130(1):45—53. Sui HX,Han BG,Lee JK,et a1.Structural basis of water— specific transport through the AQP1 water channel[J].Na— ture,2001,414(6866):872-878. 隋海心,任罡.水分子通道蛋白的结构与功能[J].化学进展, 2004,l6(2):145-152. Kuriyama H,Kawamoto S,Ishida N,et a1.Molecular cloning and expression of a novel human aquaporin from adipose tissue
with glycerol permeability[J].Biochem Biophys Res Corn mun,1997,241(1):53-58. [7] ¨C,Hirooka Y,Honda R,et a1.Distribution of aquaporin 9 in the rat:an immunohistochemical study[J].International Journal of Tissue Reactions,2005,27(2):51—58. [8]邵宝平,余华晟,王建林.AQP9在脑疾病中的研究进展[J], 动物医学进展,2012,33(1):87—91. [9]刘健锋,丁艳平,王建林,等.脑水通道蛋白的分布、功能及 调控机制[J].中国组织工程研究,2014,18(2):314—320. [10]Elkjaer M,Vajda Z,Nejsum LN,et a1.Immunolcoalization 0f AQP9 in liver,epididymis,testis,spleen,and brain[J]. Bicohem Biophys Res Commun,2000,276(3):1118 1128. [11]李娥琼,王正平.AQP8和AQP9在胆汁转运中的作用研究 进展[J].国际消化病杂志,2013,33(5):307—310. [12]郭晓强.水甘油通道蛋白与甘油运输研究进展口].军事医学 科学院院刊,2007,31(5):487—489. [13]秦佳敏,梅浙川.AQP9在大鼠消化道不同部位的分布及差 异[J].重庆医学,2009,38(4):405—407. [14]Pastor-Soler N,Isnard—Bagnis C,Herak Kramberger C,et a1.Expression of aquaporin 9 in the adult rat epididymal epi thelium ismodulated by androgens[J].Biology of Reproduc— tion,2002,66(6):1716—1722. [15] 何荣环.水通道在生殖领域的研究进展[J].国外医学计划生 育/生殖健康分册,2006,25(2):64—67. [16]王建伯,宋希双,丹司望,等.雄激素对大鼠前列腺组织中 AQP9水通道蛋白表达的影响[J].大连医科大学学报, 2008,30(3):224—226. [17]赵健亚,王晓珂,刘天娥.水通道蛋白7、9在不同肥胖易感 大鼠组织中差异表达[J].扬州大学学报(农业与生命科学 版),2013,34(4):18—22. [18] 陈丽.水通道蛋白与脂肪代谢的研究进展[J].国际妇产科学 杂志,2008,35(6):418-422. [19] 骆世芳,孙善全.AQP9在组织中的分布和功能[J].解剖科 学进展,2004,10(3):253—256. [203 黄德亮.小鼠内耳水通道蛋白的定位及其意义[J].中华耳鼻 咽喉科杂志,2001,36(1):7-9.