
本章重难点专题突破
1各类烃的结构与性质归纳解读
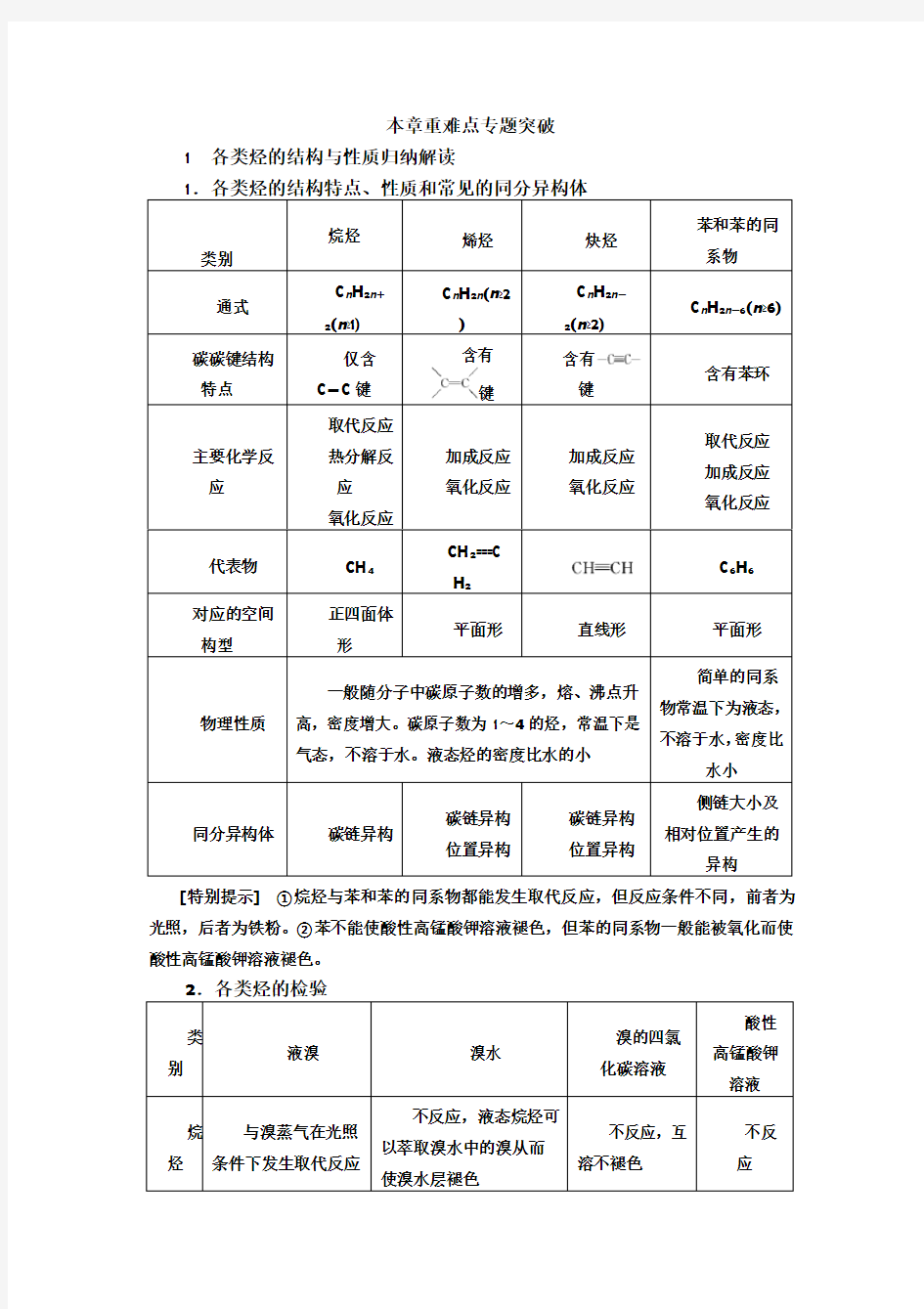
1.各类烃的结构特点、性质和常见的同分异构体
类别烷烃烯烃炔烃
苯和苯的同
系物
通式
C n H2n+
2(n≥1)C n H2n(n≥2
)
C n H2n-
2(n≥2)
C n H2n-6(n≥6)
碳碳键结构特点
仅含
C—C键
含有
键
含有
键
含有苯环
主要化学反应取代反应
热分解反
应
氧化反应
加成反应
氧化反应
加成反应
氧化反应
取代反应
加成反应
氧化反应
代表物CH4CH2===C
H2
C6H6
对应的空间构型正四面体
形
平面形直线形平面形
物理性质
一般随分子中碳原子数的增多,熔、沸点升
高,密度增大。碳原子数为1~4的烃,常温下是
气态,不溶于水。液态烃的密度比水的小
简单的同系
物常温下为液态,
不溶于水,密度比
水小
同分异构体碳链异构碳链异构
位置异构
碳链异构
位置异构
侧链大小及
相对位置产生的
异构
[特别提示]①烷烃与苯和苯的同系物都能发生取代反应,但反应条件不同,前者为光照,后者为铁粉。②苯不能使酸性高锰酸钾溶液褪色,但苯的同系物一般能被氧化而使酸性高锰酸钾溶液褪色。
类别液溴溴水
溴的四氯
化碳溶液
酸性
高锰酸钾
溶液
烷烃
与溴蒸气在光照
条件下发生取代反应
不反应,液态烷烃可
以萃取溴水中的溴从而
使溴水层褪色
不反应,互
溶不褪色
不反
应
[特别提示] 应用上述性质可以解决不同类型烃的鉴别问题,同时要特别注意条件(如液溴、溴水、溴的四氯化碳溶液、光照、催化剂等)对反应的影响。
2 烃类燃烧规律集锦
1.烃完全燃烧前后气体体积变化规律
烃完全燃烧的通式:C x H y +(x +y
4)O 2――→点燃
x CO 2+y
2H 2O
(1)燃烧后温度高于100 ℃,即水为气态 ΔV =V 后-V 前=y
4
-1
①y =4时,ΔV =0,体积不变②y >4时,ΔV >0,体积增大③y <4时,ΔV <0,体积减小 (2)燃烧后温度低于100 ℃时,即水为液态 ΔV =V 前-V 后=1+y
4,总体积减小
[特别提示] 烃完全燃烧时,无论水是气态还是液态,燃烧前后气体体积变化都只与烃分子中的氢原子数有关,而与烃分子中碳原子数无关。
2.烃完全燃烧时耗氧量规律
(1)等物质的量的烃(C x H y )完全燃烧时,其耗氧量的大小取决于(x +y
4)的值,其值越大,
耗氧
量越多。
(2)等质量的烃完全燃烧,其耗氧量大小取决于该烃分子中氢的质量分数,其值越大,耗氧
量越多。相同碳原子数的烃类,碳的质量分数越大,耗氧量越多。
(3)最简式相同的烃,不论它们以何种比例混合,只要总质量一定,完全燃烧时所消耗的氧
气为定值。
(4)
(1)质量相同的烃,碳的质量分数越大,完全燃烧生成的CO2越多。
(2)碳的质量分数相同的烃,只要总质量一定,以任意比混合,完全燃烧后,产生的CO2的量总是一个定值。
4.燃烧时火焰亮度与含碳量的关系比较规律
(1)含碳量越高,燃烧现象越明显,表现为火焰越明亮,黑烟越浓。如C2H2、苯、甲苯等燃烧时火焰明亮,并伴有大量浓烟;而含碳量越低,燃烧现象越不明显,无黑烟,如甲烷;对于C2H4及单烯烃的燃烧则是火焰较明亮,并伴有少量黑烟。
(2)含碳原子较少的各类烃,燃烧时的现象是不同的,烷烃无黑烟产生,烯烃有少量黑烟产生,炔烃及芳香烃有浓黑烟产生。应用燃烧来鉴别简单的烷烃、烯烃和炔烃是一种简单而有效的方法。
3、确定混合烃组成的四种方法
1.平均相对分子质量法
假设混合烃的平均相对分子质量为M,则必含相对分子质量比M小或相等(由同分异构体组成的混合气体)的烃。如M<26(烷、炔相混),则混合烃中一定有CH4,或M<28(烷、烯相混),则混合烃中一定有CH4,等等。
2.平均分子组成法
假设混合烃的平均分子式为C x H y,根据其平均分子组成情况有以下规律:若1 x =2且其中一种分子中含有两个碳原子,则另一种气体分子中也必含有两个碳原子。 3.根据烃燃烧规律分析 遇到烃类物质的燃烧问题时,有很多规律可直接应用于解题,如最简式相同的烃,无论以何种比例混合,当总质量一定时,耗氧量不变且生成CO 2和H 2O 的质量均不变;又如分子式为C x H y 的烃,当y =4时,完全燃烧反应前后物质的量相等,等等。 4.讨论法 当解决问题的条件不够时,可以从烃类物质的组成情况(如碳原子或氢原子多少关系)、结构特点(如是否饱和)、各类烃的通式等方面出发进行讨论,得出结果。 典例3 a mL 三种气态烃的混合物与足量氧气混合点燃充分反应后,恢复到原来的状况(常温、常压下),体积共缩小2a mL 。则这三种烃可能是( ) A .CH 4、C 2H 4、C 3H 4 B . C 2H 6、C 3H 6、C 4H 6C .CH 4、C 2H 6、C 3H 8 D .C 2H 4、C 3H 4、C 3H 6 解析 如果分别写出各选项中烃对应的燃烧反应的化学方程式,我们会发现只要烃分子中的氢原子数为4,a mL 该烃完全燃烧后恢复至常温常压就一定缩小2a mL 体积,实际上就是常温下水为液态,是水蒸气占有的体积,所以A 项为正确选项。答案 A 典例4 完全燃烧质量相同的:①甲烷 ②丙烷 ③乙烯 ④乙炔 ⑤苯 ⑥间二甲苯时,耗氧量由多到少的顺序是 (用序号表示)。 解析 先将各烃转化成CH y /x 的形式,①CH 4;②CH 8/3;③CH 2;④CH ;⑤CH ;⑥CH 5/4,因为等质量的烃燃烧时耗氧量取决于y /x 的大小,y /x 越大,耗氧量越多,所以耗氧量由多到少的顺序为①>②>③>⑥>④=⑤。答案 ①>②>③>⑥>④=⑤ 典例5 400 K 、101.3 kPa 时,1.5 L 某烃蒸气能在a L 氧气中完全燃烧,体积增大至(a +3) L(相同条件下)。请回答下列问题: (1)该烃在组成上必须满足的基本条件是 。 (2)当a =10 L 时,该烃可能的分子式为 。 (3)当该烃的分子式为C 7H 8时,a 的取值范围为 。 解析 (1)根据烃完全燃烧的通式和差量法可以求解,即: C x H y +(x +y 4)O 2――→点燃 x CO 2+y 2H 2O(g) ΔV =(y 4-1) L 1 L (y 4-1) L 1.5 L [a +3-(a +1.5)] L 根据正比关系解得y =8。 (2)由于该烃在O 2中完全燃烧,故O 2足量,即1.5(x +y 4)≤10,且y =8,解得x ≤14/3,且x 为整数,结合该烃中的氢原子数为8,可知该烃可能为C 4H 8或C 3H 8。 (3)当烃的分子式为C7H8时,烃完全燃烧,即:a≥1.5(x +y 4),且y=8,求得a≥13.5。 答案(1)该烃分子中氢原子数为8(2)C4H8、C3H8 (3)a≥13.5 典例6某温度和压强下,有三种炔烃(分子中均只含一个—CC—键)组成的混合气体4 g,与足量的H2充分加成后生成4.4 g三种对应的烷烃,则所得烷烃中一定有() A.乙烷B.异丁烷C.丁烷D.丙烷 解析设混合炔烃的平均相对分子质量为M,根据题设条件,可得以下关系式: C n H2n-2~2H2~C n H2n+2 M2×2 4 g 4.4 g-4 g 解得M=40 乙炔的相对分子质量为26,丙炔的相对分子质量为40,显然,混合气体中必含乙炔,其加成可得乙烷。答案A 典例8两种气态烃以任意比例混合,在105 ℃时,1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体的体积仍是10 L。下列各组混合烃中不符合此条件的是() A.CH4、C2H4 B.CH4、C3H4 C.C2H4、C3H4D.C2H2、C3H6 解析据题意,t>100 ℃(水为气态),在此状况下气态烃充分燃烧,混合气体的总体积始终为10 L(未变),即ΔV=0,故两种气态烃分子中的平均氢原子数均为4;又因为两种气态烃是以任意比例混合的,D选项中的两种烃除1∶1的情况外,氢原子的平均数都不为4,故D项符合题意。答案D 典例9常温下,一种烷烃A和一种单烯烃B组成混合气体;A和B分子最多只含有4个碳原子,且B分子的碳原子数比A分子的多。将1 L该混合气体充分燃烧,在同温、同压下得到2.5 L CO2气体。试推断原混合气体中A和B所有可能的组合及其体积比,并 组合编号 A的分 子式 B的分 子式 A和B的体积比 V(A)∶V(B) 解析设混合气体的平均分子式为C x H y,因为同温、同压下气体的体积之比等于物质的量之比。所以1 mol的混合烃充分燃烧后可生成2.5 mol CO2,即x=2.5,故混合烃的平均分子式可表示为C2.5H y。由于该混合气体是由烷烃A和单烯烃B组成,且B分子的碳原子数比A多。由此可推断,混合气体只能由碳原子数小于2.5的烷烃(CH4和C2H6)和碳原子数大于2.5的烯烃(C3H6和C4H8)组成。它们有四种可能的组合,根据每一种组合中烷烃和烯烃的碳原子个数及平均分子式中碳原子数,可以确定A和B的体积比。以第①组为例,用十字交叉法确定V A∶V B的大小: V A V B=1 3 其他组同样可以用十字交叉法确定V A∶V B大小。 组合编号 A的分 子式 B的分 子式 A和B的体积比 V(A)∶V(B) ①CH4C3H61∶3 ②CH4C4H81∶1 ③C2H6C3H61∶1 ④C2H6C4H83∶1 1.等质量的下列烷烃,完全燃烧消耗氧气最多的是() A.CH4B.C2H6C.C3H8D.C6H14 答案A解析判断等质量的不同烃燃烧时的耗氧量,可先简化其分子式为CH x,x越大,氢的质量分数就越大,耗氧量就越多。本题中A项最简式为CH4;B项最简式为CH3;C项最简式为CH2.7;D项最简式为CH2.3。故答案为A。 2.将1 mol两种气态烃组成的混合气体完全燃烧后得到1.5 mol CO2和2 mol H2O。下列说法正确的是( B )A.一定有乙烷B.一定有甲烷C.一定没有甲烷D.不一定有甲烷 3.一种气态烷烃和一种气态烯烃的混合物9 g,其密度是相同条件下氢气密度的11.25倍,当混合气体通过足量溴水时,溴水增重4.2 g,则这两种气态烃是() A.甲烷和乙烯B.乙烷和乙烯C.甲烷和丙烯D.甲烷和丁烯 答案C解析根据已知条件,先求出混合气体的平均相对分子质量,即11.25×2=22.5。由于烷烃中只有甲烷的相对分子质量小于22.5,则该混合物中一定含有甲烷。混合气体通过溴水时溴水增重,说明该混合气体中烯烃的质量为4.2 g,则甲烷的质量为9 g-4.2 g= 4.8 g,即n(CH4)=0.3 mol。设该不饱和烃的物质的量为x,则有 9 g 0.3 mol+x mol=22.5 g·mol -1,解得:x=0.1 mol,即该不饱和烃的摩尔质量为42 g·mol-1,为丙烯。 4.某一氯代烷1.85 g,与足量NaOH水溶液混合加热后用硝酸酸化,再加入足量的AgNO3溶液,生成白色沉淀2.87 g。 (1)通过计算,写出这种一氯代烷的各种同分异构体的结构简式。 (2)若此一氯代烷与足量NaOH水溶液共热后,不经硝酸酸化就加AgNO3溶液,出现的现象为,写出有关的化学反应方程式。 (3)能否用硝酸银溶液直接与卤代烃反应来鉴别卤代烷?为什么? (2)将会产生褐色沉淀AgNO3+NaOH===AgOH↓+NaNO3,2AgOH===Ag2O+H2O,AgNO3+NaCl===AgCl↓+NaNO3 (3)不能,因卤代烃中的卤素均是以卤原子的形式与碳原子结合的,不能与Ag+反应。 解析AgCl的物质的量为2.87 g 143.5 g·mol-1=0.02 mol,一氯代烷的相对分子质量为1.85 0.02=92.5, 设其分子式为C n H2n+1Cl,则12n+2n+1+35.5=92.5,n=4,该卤代烃为C4H9Cl。