大蒜鳞芽组培再生体系建立方法研究
- 格式:pdf
- 大小:1.44 MB
- 文档页数:3


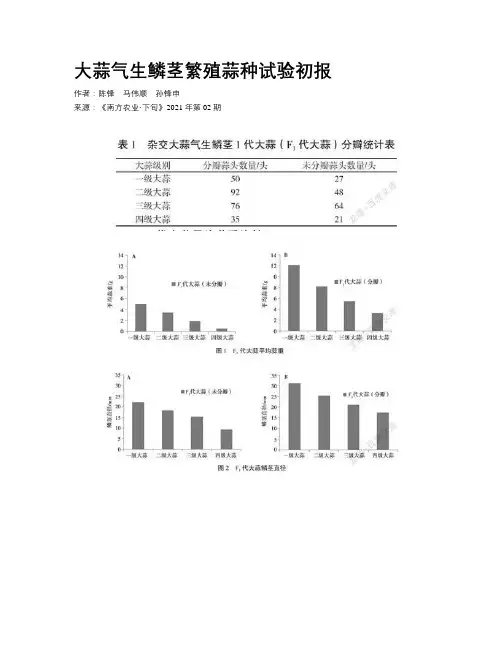
大蒜气生鳞茎繁殖蒜种试验初报作者:陈锋马伟顺孙锋申来源:《南方农业·下旬》2021年第02期摘要以雜交大蒜为试材,探讨利用大蒜气生鳞茎繁殖蒜种的技术。
研究发现,杂交大蒜气生鳞茎一代可以实现分瓣,分瓣蒜以二级以上大蒜为主,选择鳞茎直径大于18.36 mm的气生鳞茎二代大蒜(未分瓣)作为蒜种进行繁育,不影响平均蒜重和鳞茎直径,既可以提高繁殖系数,又能够促进大蒜高产。
关键词杂交大蒜;气生鳞茎;分瓣;大蒜分级中图分类号:S633.4 文献标志码:B DOI:10.19415/ki.1673-890x.2021.06.020大蒜属百合科葱属1~2年生草本植物,大蒜总苞中由于内部花发育不良,通常只生长一定数量的气生鳞茎,不结种子或只结少数发育不良、无活力的种子,故生产上大蒜多用蒜瓣进行无性繁殖。
但长期无性繁殖后,大蒜产量和品质显著下降,急需对大蒜进行提纯复壮。
利用气生鳞茎技术来繁殖蒜种,可以提高繁殖系数,且后代生长势强,抗病性强,适应性广,增产效果显著[1-3]。
但是气生鳞茎一代多数会形成独头蒜,再种植一年才能形成分瓣蒜,因此利用此技术育种周期较长。
但吴鹏1964年用早熟品种紫皮蒜为试材研究发现,大蒜气生鳞茎繁殖一年即可分瓣,分瓣率较高,独头率仅3%[4]。
而赵国庆等、周启江等指出,少数较大的气生鳞茎也能长成2~4个蒜瓣的蒜头,分瓣率较低[5-6]。
他们的研究结论是相互矛盾的,但可以肯定的是,气生鳞茎一代是可以分瓣的,当年就可以作为蒜种进行繁殖,以缩短气生鳞茎技术的育种周期。
但是当前,对于大蒜气生鳞茎一代分瓣的具体机制研究较少,生产实践上更是缺少指导标准,因此本研究选取山东省济南市莱芜区广泛种植的杂交大蒜为试材,对其气生鳞茎一代和二代大蒜分瓣现象进行研究,以期探索杂交大蒜气生鳞茎繁殖育种技术,提高气生鳞茎一代分瓣率,缩短育种周期,为选育大蒜新品种提供技术支持。
1 材料与方法1.1 试验设计试验于2018年10月—2020年6月在济南市莱芜区方下街道济南安信农业科技有限公司大蒜种植基地内进行,选用莱芜区广泛种植的杂交大蒜为试材,先采用混合选择法将2018年6月获得的杂交大蒜气生鳞茎撒播于土层深厚、土壤肥沃、地力均匀、地势平坦、水浇条件较好的试验地块(土壤类型为棕壤,播种前整好土地,每667 m2均施有机肥2 000 kg,复合肥50 kg),种植后一周内喷洒灭草剂,盖膜。

大蒜规模化脱毒快繁技术体系构建及应用高晖;王振英【摘要】大蒜为营养繁殖作物,主要依赖鳞芽或气生鳞茎进行繁殖,而大蒜种质的生物多样性和遗传特性不能得到应用,且种瓣中病毒大量积累,造成种性退化严重,影响了大蒜的品质和产量.目前获取大蒜新品种资源的方法包括组织培养技术、转基因技术、多倍体育种技术、人工诱变技术等.本文对大蒜规模化脱毒快繁技术体系构建的必要性、国内外研究进展进行了综述,结合我国大蒜育种的实际情况对大蒜规模化脱毒快繁技术体系的发展趋势进行了预测.【期刊名称】《天津师范大学学报(自然科学版)》【年(卷),期】2017(037)004【总页数】5页(P1-5)【关键词】大蒜;脱毒快繁;规模化;技术体系构建【作者】高晖;王振英【作者单位】天津师范大学生命科学学院,天津300387;天津师范大学天津市动植物抗性重点实验室,天津300387【正文语种】中文【中图分类】Q949.9大蒜(Allium sativum L.(garlic))为百合科(Liliaceae)葱属(Allium)植物,除了是重要的调味品外,因所含物质对菌类有显著抑制及杀灭作用也被誉为“天然广谱抗生素”,在全球范围内广泛栽培.近年来对大蒜活性物质的研究更加深入,如张彬等[1]发现大蒜素能够通过调节相应的细胞信号转导途径抑制子宫内膜癌细胞增殖并促进其凋亡;巩彪等[2]发现大蒜秸秆能够明显抑制土壤中的番茄根结线虫数量,调节植物根际微生态.大蒜虽然种质资源丰富,但由于花器官不能正常进行减数分裂[3],无法形成可育的种子,因此在生产实践中主要采用头年收获的蒜瓣作为营养体繁殖播种.一方面,常年无性繁殖的大蒜所感染的大蒜病毒通过亲代传递积累,品质退化严重,目前发现的危害大蒜的病毒主要有大蒜花叶病毒、洋葱黄矮病毒、大蒜潜隐病毒、大蒜褪绿条斑病毒等,田间发病率有的高达100%,严重影响大蒜生产[4];另一方面,采用蒜瓣繁殖的大蒜繁殖系数低下,占用了大量生产用地,同时蒜瓣作为“种子”,不便于贮存和运输.由这两个因素带来的对大蒜产量和品质的负面影响推高了大蒜生产成本,损害了蒜农利益,也限制了大蒜种植范围的进一步扩大,从而在大蒜产业化的上游造成严重阻碍,制约整个产业的健康发展.大蒜育种工作受大蒜不育的限制,无法采用杂交等技术改良品种,只能通过瓣型、瓣数等选择育种的传统方式,周期长且种性特点保持世代短[4].当前,大蒜育种工作已成为大蒜生产过程中的瓶颈,育种工作如能取得突破则将会直接服务于生产实践,带来巨大的经济和社会效益.对于无性繁殖的植物,组织培养是实现物种快速繁殖的重要手段,其理论基础是植物细胞的全能性[5-6].高等植物的组织和器官在一定条件下可以被不断分割至单个细胞,在适当培养条件下,单个细胞可以分裂和繁殖,进而发育成完整植株[7].通过组织培养手段进行脱毒的理论依据是利用病毒在植物体内的不均匀分布,病毒在植物体内传播主要依靠维管束系统,而生长旺盛的根尖、茎尖等生长点部位一般都无病毒或很少有病毒分布[8].通过组织培养方法实现植物快速繁殖的重点在于组培条件下离体培养材料的增殖不受环境限制,在短时间内获得大量再生植株.在实践中应用植物组织培养技术,一般都将病毒脱除和植株快繁相结合,构成脱毒快繁技术体系,在短时间内获取大量的脱毒再生植株,提高品质.目前,针对大蒜组织培养已进行了大量研究,也取得了一定成果[9-11].利用植物组织培养技术进行脱毒快繁,需经历外植体选择、脱分化、再分化组培苗生根、炼苗、移栽直至形成商品蒜等环节,每个环节都会影响整个脱毒快繁工作的效率.如何进一步优化、链接脱毒快繁的各个技术环节,构建完整的大蒜脱毒快繁技术体系,将成为完善大蒜育种工作的关键,从而突破当前大蒜生产实践的瓶颈.为解决大蒜脱毒快繁技术体系各个环节的问题,国内外学者开展了大量研究,近30年来,报道了许多从大蒜的茎尖、根、茎盘、叶片等部位诱导愈伤组织和植株再生以及从根尖、花苞等部位直接诱导生成不定芽和试管鳞茎的成果.2.1 再生途径的选择从脱毒快繁工作的整体设计来看,需要优先考虑再生途径的选择.应用组培技术的大蒜植株再生途径通常分为两种:①先经过脱分化形成愈伤组织并再分化建立植株的间接器官发生途径;②由外植体直接再生植株的直接器官发生途径.在间接器官发生途径方面,大部分研究集中在通过调整植物激素配比以提高外植体脱分化形成愈伤组织及再分化形成不定芽这两个环节的诱导率,并取得了一定成果[9,12].但经愈伤组织再分化后形成的再生植株染色体变异率较高,遗传稳定性不佳[13],无法长久保持愈伤组织的增殖能力和分化能力.基因型是愈伤组织诱导和植株再生的一个重要因素,不同品种之间的愈伤组织诱导率及其植株再生率有显著差异.直接器官发生途径是指在一定的培养条件下诱导外植体内潜在不定芽的萌发,这些诱导出的不定芽同经过脱分化的愈伤组织诱导产生的不定芽相比,遗传特性更稳定、很少发生变异[14].如张素芝等[10]利用大蒜花苞在一定的培养条件下获得了萌发的不定芽;张昌伟等[15]采用大蒜根尖做外植体诱导不定芽进而获得了试管苗.直接器官发生途径极大避免了间接途径中的染色体变异等问题,但因没有经过间接途径中愈伤组织的继代培养即材料的扩繁,在繁殖系数方面存在一定劣势.2.2 外植体的选择在确定再生途径的基础上,不同的外植体取材是脱毒快繁体系的另一个重要步骤.不同外植体的分化能力不同,当前大蒜脱毒快繁研究的外植体取材十分广泛,如茎尖、根尖、叶片、鳞茎、茎盘、花药、花序轴、总苞等,几乎涵盖了大蒜植株的各个部位[14-18].对于外植体取材的研究多集中在如何更高效地获得愈伤组织并力争减少脱分化与再分化过程中的遗传变异等方面.研究发现,大蒜花序轴顶端同属分生组织,具有与茎盘相似的萌发不定芽的潜力,在适宜的培养条件下,这些潜在的不定芽就会大量萌发,而病毒难以在花序轴萌发的不定芽中积累,从而达到脱毒效果[19].如刘伟伟等[20]发现,以大蒜花序轴为外植体可获取大量再生植株,并可以显著提高大蒜的繁殖系数,增强脱毒效果[20].此外,还有采用大蒜气生鳞茎繁殖的方式进行大蒜品种的提纯和复壮,也是应用了其位于蒜苔顶端的生长点一般不带病毒的特性,从而实现自然脱毒[21].但在实践中由于必须采用成熟的气生鳞茎作“种子”,而气生鳞茎的成熟过程会与地蒜争夺营养,影响地蒜产量,从而降低了收益[22].为避免对地蒜生长的影响,研究人员还尝试使用未成熟的大蒜气生鳞茎作外植体,在组培条件下诱导也获得了试管苗[11].关于大蒜不同外植体的再生特性目前已得到充分研究.在大蒜脱毒快繁技术体系的构建过程中,外植体的选择是一个重要环节,决定了技术体系是侧重于病毒脱除还是快速繁殖,或是二者兼顾.因此,明确脱毒快繁技术的方向,依据外植体特性进行合理选择是成熟脱毒快繁体系构建的前提条件.2.3 试管苗与试管鳞茎的培育大蒜的脱毒快繁技术最终要服务于生产实践,通过实验室的组培技术,不同的外植体无论是经直接或间接器官再生途径获得的再生植株即试管苗,都需要移栽大田.组培条件下的试管苗环境良好、营养丰富、水分充足、恒温、恒湿,导致其叶片发育不佳,抵抗力差,而通气组织发达,出现类似湿生植物的叶片结构特点,离开组培环境的试管苗很容易脱水,这就给田间移栽造成了困难.据徐培文等[23]报道,试管苗的根长及条数与成活率呈正相关,选择试管苗粗壮、不定根3条以上、根长2 cm以上的试管苗可获得约70%的成活率.还有研究证实,在12月中下旬将带有3条及以上根的试管苗直接栽植到日光温室土壤中,保障水分充足也可获得较高成活率[24].尽管目前学者们针对如何使试管苗尽快适应田间环境、提高移栽成活率开展了一系列有益尝试,一定程度上提高了试管苗的驯化成活率,但驯化过程繁琐且最终成活率依然不高,这是试管苗从异养状态向自养状态转变过程无法克服的障碍.此外还有研究指出,经驯化后的试管苗蒜瓣异常生长的现象增多,同时大蒜在大田的生长还具有很强的季节性,因此试管苗只能在适合于大蒜生长的季节移出试管以降低驯化成本[25].在提高试管苗驯化成功率的过程中,汤青林等[25]研究发现,带有小鳞茎的试管苗移栽成活率明显高于不带小鳞茎的试管苗.熊正琴等[26]尝试将试管鳞茎直接栽种到大田中,移栽成活率远高于试管苗.大量实践证实,试管鳞茎相比于试管苗具有更强的抗逆性且耐贮藏,无需驯化即可直接进行田间移栽,是解决脱毒快繁大蒜规模化、商品化的良方[27].Wu等[28]研究发现,影响大蒜试管鳞茎形成的因素很多,包括糖的浓度、外植体的选择、培养环境、培养基配比、植物内源激素的变化等.为了拓展试管鳞茎在大蒜脱毒快繁技术中的应用,还需要对试管鳞茎形成和膨大时植物内源激素的变化进行研究,以便更加深入地分析大蒜鳞茎的形成机理,从而进一步提高大蒜试管鳞茎的诱导率.2.4 技术体系完整性的评价植物的脱毒快繁技术建立已经有几十年的历史,在大蒜方面的应用也将近十几年,相关报道涵盖了大蒜脱毒快繁技术的各个环节,如外植体选择、再生途径选择、再生植株的移栽优化等,为构建完整的大蒜脱毒快繁技术体系打下了基础.目前研究大多集中在整个脱毒快繁体系的单个环节,缺乏关于经脱毒快繁处理后再生植株或商品种蒜的总糖、总蛋白、大蒜素、硒含量等生理生化指标的测定、遗传稳定性以及脱毒效果的评价.另一方面,关于大蒜从外植体选择到获得脱毒商品化种蒜的完整脱毒快繁体系的报道也较缺乏.迄今,关于大蒜脱毒快繁技术体系的研究已积累了大量可行的技术路径和数据,尚需进一步整合各个已有环节的研究优势,并对再生植株或商品种蒜加以检测和评价,形成完整的、可直接应用于生产实践的大蒜脱毒快繁技术体系.目前我国的大蒜产量占全球总产量的70%以上,种植面积达70万公顷左右,占全球大蒜种植面积的60%以上,这为大蒜脱毒快繁技术体系的应用提供了广阔平台,也吸引了众多国内学者开展此方面的研究,取得了一些成果[15-24].如徐培文等[23]探讨了脱毒大蒜的快繁途径和良繁体系的建立.任春雪等[16]在以鳞茎片为外植体构建脱毒快繁体系中,经不定芽分化、壮芽和炼苗,可在T0代收获分瓣率高达94%的再生地下鳞茎.徐李薇等[17]在以大蒜根尖为外植体构建脱毒快繁体系中,愈伤组织诱导率、再分化成苗率及试管苗诱导形成试管鳞茎率分别达到97.5%、62%和51.3%.这些研究构建的技术体系极大提高了大蒜的脱毒快繁效率,节省了培育时间,降低了生产成本.在解决生产实践的同时,有些研究对大蒜不育的原因也进行了探讨.如彭爱芳等[3]从细胞学角度探讨了大蒜的不育性,通过对大蒜气生鳞茎的发育、花粉母细胞的减数分裂过程及染色体异常行为的观察,发现花粉母细胞中高频率的染色体结构变异和花粉母细胞在形成花粉粒时的干枯可能是导致大蒜不育的重要原因.刘冰江等[29]认为大蒜不育的根本原因是染色体异常,不能进行正常配对.要从根本上解决大蒜育种面临的窘境,核心还是在恢复大蒜的育性.关于大蒜不育的机制,研究人员尚未达成共识,恢复大蒜育性的研究也较少[30-31].然而目前大蒜生产实践上对大蒜育种的要求并未减少,在恢复大蒜育性工作取得突破性进展之前,通过植物组织培养的脱毒快繁技术仍将是最有效的大蒜育种手段.大蒜的规模化脱毒快繁体系作为缓解当前大蒜生产实践问题的有效手段,在目前取得的成果基础上,要直接应用于生产,服务大蒜产业的健康发展,须在以下几个方面进行更深入的研究.(1)各环节完整性.鉴于目前大蒜脱毒快繁技术体系完整性的普遍不足,而生产上对于一套各个环节完整的脱毒快繁技术体系的需求越来越强烈.因此,整合现有研究成果,如外植体合理选择、提高愈伤组织诱导率、再生植株移栽成活率、试管鳞茎诱导率等,逐渐完善并形成完整的、可操作性强的大蒜脱毒快繁体系,将是今后研究与实践的重要方向.(2)高效率.同传统播种相比,大蒜脱毒快繁技术在很大程度上提高了繁殖系数,但仍然有潜力可挖,因为在脱毒快繁技术中存在多个环节,如能在其中的某一环节乃至多个环节继续提高材料的增殖系数,则将极大提高整个脱毒快繁技术体系的繁殖系数.因此,继续在大蒜脱毒快繁技术体系中深挖各个环节的细节,持续提高效率,也是未来的研究方向.(3)低成本.大蒜脱毒快繁技术的应用,最终目的还是降低生产成本,促进蒜农增收.因此,今后脱毒快繁技术的研究需要时刻与成本相联系,如不同的植物激素类似物可能在脱毒快繁技术环节中的作用与效果相似,需要综合考虑单位药品的使用量及价格,实现脱毒快繁技术在性价比上的最优,而不是简单的效率最优. (4)实用性.大蒜规模化脱毒快繁技术的推广及走向市场,最终还是要依托于具备大规模生产能力的一些种质开发及生产企业,除了技术体系的高效率和低成本,还要注重技术体系的实用性.如脱毒快繁技术中,某些组培环节操作的复杂性、结果的一致性、稳定性等都将成为制约脱毒快繁技术市场化规模化的因素,未来研究应注重优化这些操作细节,进一步提高可操作性以便于企业规模化生产.(5)促进开花、杂交、改变遗传特性.尽管目前关于大蒜育性恢复方面的报道仍然缺乏,但日臻成熟的杂交技术使得恢复大蒜育性成为可能.因此利用现代生物学技术恢复大蒜育性,通过有性杂交的方式改良大蒜品种,将是研究者长期专注的一个大蒜育种工作的重要方向[29-30].(6)细胞融合.细胞融合技术的出现为实现不同优良性状材料的核质重组提供了可能,也为大蒜的体细胞杂交育种奠定了理论基础,但现有的研究较少. Yamashita 等[30]成功获得了洋葱和大蒜的体细胞杂交种.在大蒜育性恢复取得突破性进展之前,对具有优良性状的品种采用细胞融合技术进行体细胞杂交,为大蒜育种工作开辟了新的可行之路.(7)多倍体育种.已有研究证实,多倍体植物在相对不稳定的环境中具有更强的生存能力,较二倍体祖先更能耐受恶劣环境,尤其在营养繁殖植物中具有明显优势.目前大蒜多倍体育种研究已取得了采用大蒜茎尖、根尖、花苞等为材料经秋水仙素处理后获得染色体加倍的效果,积累了大量数据,部分已获得染色体加倍的再生植株.但将相对成熟的多倍体诱导技术融入脱毒快繁技术体系中以获得用于大田种植的多倍体商品蒜,目前还未取得较大进展,这也是今后研究的一个重要方向.【相关文献】[1]张彬,陈丽红,陈秀慧,等.大蒜素促进人子宫内膜癌细胞株(RL-952)细胞凋亡的机制[J].中国老年学,2016,36(2):285-287. ZHANG B,CHEN L H,CHEN X H,et al.Garlicin promote human endometrial carcinoma cell line(RL-952)mechanism of apoptosis[J]. Chinese JournalofGerontology,2016,36(2):285-287(in Chinese).[2]巩彪,张丽丽,隋申利,等.大蒜秸秆对番茄根结线虫病及根际微生态的影响[J].中国农业科学,2016,49(5):933-941. GONGB,ZHANG L L,SUISL,etal.Effectsofgarlic straw application on controlling tomato root-knot nematode disease and rhizospheric microecology[J].Scientia Agricultura Sinica,2016,49(5):933-941(in Chinese). [3]彭爱芳,王珍,李转春,等.宝坻大蒜气生鳞茎和花粉母细胞发育的细胞学研究[J].天津师范大学学报:自然科学版,2014,34(2):66-70. PENG A F,WANG Z,LIZC,et al.Cytologicalobservation on aerial bulbsand pollenmothercellofBaodigarlic[J].JournalofTianjin Normal University:NaturalScienceEdition,2014,34(2):66-70(inChinese).[4]陈青奇,陈典,张海霞.大蒜育种研究现状[J].北方园艺,2006(2):40-41. CHENQQ,CHEN D,ZHANGH X.Research status of garlic breeding[J].Northern Horticulture,2006(2):40-41(in Chinese).[5]闫海霞,蒋月喜,王晓国,等.蝶豆的组织培养与快繁技术研究[J].西南农业学报,2016,29(8):1977-1981. YANH X,JIANGY X,WANGXG,etal.Study on tissue cultureand rapid propagation of Clitoriaternatea L.[J].Southwest China Journal of AgriculturalSciences,2016,29(8):1977-1981(in Chinese).[6]欧阳凡,董文宾,付瑜,等.铁皮石斛茎段快繁技术的研究[J].生物技术通报,2016,32(3):63-67. OUYANG F,DONGW B,FUY,etal.On the rapid propagation technique ofstem segmentsof Dendrobium officinale[J].Biotechnology Bulletin,2016,32(3):63-67(in Chinese).[7]梁一池,杨华.植物组织培养技术的研究进展[J].福建林学院学报,2002,22(1):93-96. LIANGYC,YANG H.Advances of plant tissue culture[J].Journalof Fujian Collegeof Forestry,2002,22(1):93-96(in Chinese).[8]孙琦,张春庆.植物脱毒与检测研究进展[J].山东农业大学学报:自然科学版,2003,34(2):307-310. SUN Q,ZHANG C Q.Progress in virus elimination and detection ofplant[J].JournalofShandong AgriculturalUniversity:Natural Science,2003,34(2):307-310(in Chinese).[9]唐巧玲,王旭静,王志兴.以根为外植体建立大蒜的组织培养体系[J].生物技术进展,2011,1(2):140-145. TANGQ L,WANG X J,WANG ZX.The developmentof a callus induction and plant regeneration system from garlic root[J].CurrentBiotechnology,2011,1(2):140-145(in Chinese).[10]张素芝,李纪蓉.一种新型的大蒜快繁体系—花苞不定芽再生体系的建立[J].山东农业大学学报:自然科学版,2007,38(2):159-162. ZHANG SZ,LIJR.Establishment of a novel rapid propagation sys-tem—adventious shoots regeneration system in the inflorescence of garlic(Allium sativum L.)[J].JournalofShandong AgriculturalUniversity:NaturalScience,2007,38(2):159-162(in Chinese).[11]王珍,范宝莉,任春雪,等.大蒜气生鳞茎快繁体系研究[J].北方园艺,2014(23):79-82. WANG Z,FAN B L,RENCX,etal.Research on the rapid propagation system of garlic bulbils[J].Northern Horticulture,2014(23):79-82(in Chinese).[12]张素芝,李纪蓉.植物激素配比对大蒜茎盘愈伤组织再生体系的影响[J].种子,2006,25(6):38-40. ZHANG SZ,LI JR.Effect of plant growth regulators combination to the stem disc callus regeneration system ofgarlic(Allium sativum L.)[J].Seed,2006,25(6):38-40(in Chinese).[13]徐培文,马伟青.大蒜组织培养材料染色体倍性变化研究[J].山东农业科学,1998(5):30-31.XU PW,MAW Q.Study on chromosome ploidy changesof tissue culturematerialsofgarlic[J].Shandong Agricultural Sciences,1998(5):30-31(in Chinese).[14]JANICK J.Flowering,Seed Production,and the Genesis of GarlicBreeding[M]//PHILIPPW S,MARIA M J.Plant Breeding Reviews. Hoboken:JohnWiley&Sons Inc,2010.[15]张昌伟,侯喜林,袁建玉,等.太仓大蒜根尖离体培养直接诱导不定芽及其试管鳞茎的形成[J].植物生理学报,2004,40(2):167-170. ZHANGCW,HOU X L,YUAN JY,etal.Direct induction of the adventitiousbud from the root tipsof“Taicang”garlic and formation ofits bulblet in vitro[J].Plant Physiology Communications,2004,40(2):167-170(in Chinese).[16]任春雪,王珍,范宝莉,等.以鳞茎片为外植体构建大蒜微繁技术体系[J].北方园艺,2015(16):101-106. RENCX,WANG Z,FAN B L,etal.Establishmentof a novelmicropropagation system usinggarlic slice as theexplants[J].Northern Horticulture,2015(16):101-106(in Chinese).[17]徐李薇,王宁宁,任春雪,等.宝坻大蒜根尖再生体系的建立[J].天津师范大学学报:自然科学版,2017,37(3):31-36. XU LW,WANGN N,RENCX,etal.Establishment of regeneration system from root-tips Baodigarlic[J].Journal of Tianjin Normal University:Natural Science Edition,2017,37(3):31-36(in Chinese).[18]薛万新,陆帼一.大蒜蒜瓣离体繁殖研究[J].西北农业学报,1994(3):62-66. XUEW X,LUGY.In vitro propagation of garlic cloves[J].Acta Agriculturae Boreali-OccidentalisSinica,1994,3(3):62-66(in Chinese).[19]龙玉娟,吴震,杨芸,等.大蒜花序轴离体培养器官发生途径的解剖学研究[J].西北植物学报,2008,28(3):470-474. LONG Y J,WU Z,YANG Y,et al.Anatomy of organogenesis from garlic(Allium sativum L.)Rachis in vitro culture[J].Acta Botanica Boreali-Occidentalia Sinica,2008,28(3):470-474(in Chinese).[20]刘伟伟,宋淑敏,潘静,等.大蒜花序轴离体再生体系的建立[J].北方园艺,2015(10):108-110. LIUW W,SONG SM,PAN J,et al.Establishment of regeneration system in the rachis of garlic[J].Northern Horticulture,2015(10):108-110(in Chinese).[21]强芳英,王转军.大蒜气生鳞茎繁种复壮效果与技术[J].上海蔬菜,2010(6):18. QIANG F Y,WANG Z J.The effect of propagation of garlic bulb gas and rejuvenationtechnology[J].Shanghai Vegetables,2010(6):18(in Chinese).[22]马雯,李唯,李金娟.贮藏时间和外源激素对大蒜气生鳞茎形成的影响[J].湖南农业科学,2011(19):41-44. MAW,LIW,LIJJ.Effects of storage time and exogenous phytohormoneon the formation of garlic aerialbulblets[J].Hunan Agricultural Sciences,2011(19):41-44(in Chinese).[23]徐培文,孙慧生,孙瑞杰,等.脱毒大蒜速繁途径探讨和良繁体系的建立[J].中国蔬菜,1993(5):9-13. XU PW,SUN H S,SUN R J,etal.Study on the rapid propagation of virusfree garlic and establishment of good and traditional system[J]. China Vegetables,1993(5):9-13(in Chinese).[24]李昌华,李小川,赵美华,等.大蒜茎尖脱毒技术及组织培养研究[J].华北农学报,1995,10(3):20-25. LICH,LIXC,ZHAOM H,etal.Studieson the virus-free technology of stemtip and tissue culture in Allium sativum[J].Acta Agriculturae Boreali-Sinica,1995,10(3):20-25(in Chinese).[25]汤青林,王志敏,宋明,等.大蒜不定芽的诱导及其增殖系数的调节[J].中国农学通报,2006,22(6):224-226. TANGQ L,WANG ZM,SONGM,et al.Study on multiplying buds induction and adjustmentofpropagation coefficient in garlic[J].Chinese Agricultural Science Bulletin,2006,22(6):224-226(in Chinese).[26]熊正琴,李式军,周燮,等.茉莉酸甲酯和水杨酸促进大蒜试管鳞茎的形成[J].园艺学报,1999,26(6):408-409. XIONG ZQ,LISJ,ZHOU X,etal.Stimulatory effectsof Me-JA and SA onbulb formation of Allium sativum L.in vitro[J].ActaHorticulturae Sinica,1999,26(6):408-409(in Chinese).[27]BAGHALIAN K,NAGHAVIM R,ZIAISA,etal.Post-plantingevaluation ofmorphological characters and allicin content in Iranian garlic(Allium sativum,L.)ecotypes[J].Scientia Horticulturae,2006,107(4):405-410.[28]WUW M,ZHU Y Y,LIH R,etal.Two new alkaloids from the bulbs of Lycoris sprengeri[J].Journal of Asian Natural Products Research,2014,16(2):192-199.[29]刘冰江,张海燕,孔素萍,等.大蒜的有性生殖研究进展[J].中国蔬菜,2008(8):41-44. LIUB J,ZHANGH Y,KONGSP,etal.Research progress in sexualreproductionofgarlic[J].ChinaVegetables,2008(8):41-44(inChinese).[30]YAMASHITA K I,HISATSUNEY,SAKAMOTOT,etal.Chromosome and cytoplasm analyses of somatic hybrids between onion(Allium cepa,L.)and garlic(A.sativum,L.)[J].Euphytica,2002,125(2):163-167.[31]SHEMESHM E,WINIARCZYKK,BŁASZCZYK L,etal.Malegametogenesis and sterilityin garlic(Allium sativum L.):Barriers on the way to fertilization and seedproduction[J].Planta,2013,237(1):103-120.。



矮壮素在大蒜试管苗生长和鳞茎形成上的应用研究刘伟伟;刘宇峰;宋淑敏;王晓楠;潘静【摘要】[目的]研究矮壮素在大蒜试管苗生长和鳞茎形成上的应用.[方法]用大蒜幼嫩气生鳞茎为外植体培养的试管苗为材料,以MS为基本培养基,系统研究不同浓度矮壮素(CCC)处理对大蒜试管苗生长和鳞茎形成的影响.[结果]在MS培养基中加入0.4 mg/L的矮壮素能有效使大蒜试管苗增高、增粗,叶色加深.在试管鳞茎诱导条件下,矮壮素对大蒜试管鳞茎形成和膨大作用显著(P<0.05),0.5mg/L矮壮素处理时鳞茎形成率为793%,鳞茎总诱导率为96.67%.当矮壮素浓度为0.6 mg/L时,试管鳞茎鲜重、平均直径都明显增加.[结论]试验研究了矮壮素在大蒜试管苗生长和鳞茎形成上的应用,为大蒜的栽培驯化提供了理论依据.【期刊名称】《安徽农业科学》【年(卷),期】2013(000)028【总页数】3页(P11291-11292,11316)【关键词】大蒜(Allium sativum L.);矮壮素;试管鳞茎【作者】刘伟伟;刘宇峰;宋淑敏;王晓楠;潘静【作者单位】黑龙江省科学院大庆分院,黑龙江大庆163319;黑龙江省科学院大庆分院,黑龙江大庆163319;黑龙江省科学院大庆分院,黑龙江大庆163319;黑龙江省科学院大庆分院,黑龙江大庆163319;黑龙江省科学院大庆分院,黑龙江大庆163319【正文语种】中文【中图分类】S633.4大蒜(Allium sativum L.)为百合科(Liliaceae)葱属(Allium)无性繁殖植物。
由于连年进行无性繁殖,病毒大量积累,导致产量和品质大幅下降。
大蒜花苞气生鳞茎具有体积小、数量多、发芽率高、发芽整齐和独立成苗的特性。
以往大量研究均采用大蒜幼嫩气生鳞茎作材料,而且发现发育早期的花序轴繁殖系数可高达76,至少是传统茎尖培养繁殖系数的25倍;同时方法操作简便,被认为是一种高效的大蒜脱毒种苗培育技术[1]。

实验七大蒜离体繁殖(理论)植物离体快速繁殖又称微体快繁,是指利用植物组织培养技术进行的一种营养繁殖的方法。
是常规营养繁殖的扩展和延伸。
特点:繁殖数量大,速度快一、意义与作用是改良品种、培育新品种的一种手段;获得大量优质苗木的有效方法。
1、繁殖系数高,繁殖周期短,繁殖速度快2、应用广泛3、材料用量少,不受季节限制,可工厂化生产4、能获得无毒苗木无性系5、木本植物应用潜力大二、基本程序分为5个时期1、稳定的无菌培养体系的建立时期指从外植体选择、采取、清洗、灭菌、接种和茎芽发生,直到获得茎芽稳定生长和增殖、茎芽扩繁数量可随意控制的时段。
本期目标:◆成功地无污染接种,并且诱导茎芽发生◆提供合适的试管环境使培养物的生长达到稳定过程包括:◆外植体选择、外植体灭菌、培养基选定和稳定化培养2、稳定培养系的增殖、生长和增壮时期◆达到稳定状态的培养物通过不断的继代培养进行增殖、到达需求数量◆是商品化组织培养的主要时期分为3个阶段:◆培养物保存阶段◆培养物大量增殖阶段◆培养物生长和增壮阶段基本目标:◆维持培养物的稳定状态◆不断增殖茎丛达到需要数量措施:◆调整培养基成分及含量◆以细胞分裂素为主,生长素为辅◆温度、光照的改变3、诱导茎芽生根形成小苗时期使上一期培养的微枝发出不定根,形成完整小苗,便于经过驯化、培养成商品苗。
功能:◆保证组织培养微枝的生根◆安全地从试管内无菌环境转移到试管外有菌环境茎芽生根诱导的途径:A、试管内生根培养基总盐浓度低,无机盐含量低,细胞分裂素可不含有,生长素有一定量,降低蔗糖浓度,琼脂含量高B、试管外生根优势:根系发育好,根毛多,木质化程度高,分生能力强,生长速度快,茎干皮层细胞个体较小、液泡小,叶片角质层发达、气孔内陷、抗蒸腾能力和适应能力强,光合能力强注意:试管外生根不是万能的,对于难生根植物,试管内生根还是唯一选择。
4、生根小苗移栽和驯化时期本阶段含两个过程:◆异养阶段过度到自养阶段◆人工环境过度到室外环境措施:◆将小苗分级◆炼苗:一般1周左右◆选定好植场所◆严格移栽技术,科学确定移栽时间◆移栽后管理5、商品苗培育时期经过驯化培养的小苗,可按照一般苗木的培育要求进行培养三、植物离体无性繁殖中的器官发生方式有五种方式:1、不定芽型a、繁殖率高b、能保持遗传稳定性c、缩短繁殖周期2、器官型a、繁殖率高,但速度慢b、遗传性稳定3、器官发生型a、繁殖速度快b、遗传性不稳定,易产生变异c、愈伤组织是遗传转化、细胞培养或原生质体培养的良好材料4、胚状体发生型a、数量多、速度快、繁殖系数高;b、遗传性稳定。
-67-农艺·园艺大蒜鳞芽组培再生体系建立方法研究
吐尔逊娜依·迪力夏提,刘旭新,石 强(新疆农业职业技术学院,新疆 昌吉 831100)[摘要]以山东和新疆白皮大蒜栽培品种为材料,建立了大蒜鳞芽为外植体的愈伤组织诱导再生体系。采用MS培养基,通过激素配比筛选试验,比较快速诱导愈伤组织激素配比与方案,为供试大蒜品种脱病毒苗的快速繁殖奠定了基础。筛选得到愈伤组织快速诱导与生长培养基与激素配比,结果表明:快速诱导愈伤组织最佳激素组合为:NAA 0.5mg/L+2,4-D 1.25mg/L+MS,愈伤组织继代生长与幼苗分化激素组合为:6BA 5mg/L+NAA0.3mg/L,环境温度25℃,光照16小时,8小时黑暗条件;所有这些结果为大蒜脱毒再生苗提纯复壮与转基因研究体系的建立都很有帮助。[关键词]大蒜;组织培养;再生体系[中图分类号]S633.4 [文献标识码]A
大蒜(Allium sativum L.)为百合科葱属植物蒜的鳞茎,是因其具有独特的风味和良好的药用价值而全球性食用并种植的蔬菜。我国栽培历史已达两千多年,是世界最大的大蒜种植国,全国各地都有栽培。栽培大蒜由于花器官败育,不能通过有性生殖形成种子,所以在生产中都是通过无性繁殖进行生产。大蒜在栽培过程中,常年无性繁殖过程使其出现容易染病毒、品种退化等问题,最终导致质量及产量下降,大家通常利用组织培养技术来进行大蒜组织脱毒,脱毒的分生组织再分化成无毒幼苗,这已经成为提升大蒜品质的一个手段。目前脱毒组织培养技术,已建立了以茎尖、根尖,真叶、贮藏叶、茎盘切块、花序轴顶端分生组织,花药和花原始体等为外植体的多种大蒜
组织培养再生体系。各种外植体与其分化再生效果都有差异,本实验利用大蒜鳞芽作为外植体选用不同植物激素之间优化配比,对大蒜愈伤组织诱导进行试验,研究对比提出了一种高效的大蒜组织培养体系,为进一步对大蒜进行深入研究,如大蒜脱毒愈伤组织快速诱导到再生植株的成功分化,以及建立大蒜转基因转化体系,做一些基础工作,得到了比较好的再生体系模式。
1 材料与方法1.1 材料供试材料是山东白皮大蒜(产地山东)和新疆白皮大蒜(吉
[收稿日期]2018-06-15[基金项目]新疆农业职业技术学院基金项目(XJNZKJ2014001)资助。[作者简介]吐尔逊娜依(1984—),女,新疆若羌人,博士,研究方向:植物生理、药理。[通讯作者]刘旭新(1971—),男,广东人,博士后,研究方向:植物分子生物学。
[参考文献][1] 段居琦,周广胜,等.中国双季稻种植区的气候适宜性研究[J].中国农业科学,2012,45(2):218-227.[2] 刘云涛,李铁男,李莹.林甸灌区水稻灌溉制度研究[J].现代农业科技,2012(6) :257-264.[3] 葛旭峰,徐莉平,孙铁蕾.龙塘水库灌区水稻灌溉制度设计浅析[J].陕西水利,2017,205(2) :183-184.[4] 叶廷平,周立华,汤英.宁夏青铜峡灌区主要农作物地面灌溉制度的分析研究[J].节水灌溉,2012(6):35-36.[5] 魏然,李智青.龙山灌区灌溉制度分区概述[J].水利科技与经济,2010,16(2): 188-189.[6] 王小林,刘云涛,张勇.三江平原地区水稻灌溉制度设计综述[J].黑龙江水利科技,2004(2) : 81-82.[7] 邹俏俏.辽宁省水稻灌溉制度分析[J].东北水利水电,2013(5):55-56.[8] 朱德峰.双季稻高效配套栽培技术[M].北京,金盾出版社,2010.[9] 钟爽,何应对,等.连作年限对香蕉园土壤线虫群落结构及多样性的影响[J].中国生态农业学报,2012,20(5):604-211.[10] 钱银飞,刘白银,彭春璀,等.不同耕作方式对南方红壤区双季稻周年产量及土壤性状的影响[J].应用生态学报,2004,15(7):1177-1181.[11] 谢晓金,申双和,李秉柏,等.抽穗期高温胁迫对水稻开花结实的影响[J].中国农业气象,2009,30(2):252-256.[12] 张桂莲,张顺堂,肖浪涛,等.抽穗开花期高温胁迫对水稻花药、花粉粒及柱头生理特性的影响[J].中国水稻科学,2014,28(2):155-166.[13] 李成德.高温导致水稻出现大量空壳分析[J].陕西农业科学,2003(5): 45-47.[14] 张建平,赵艳霞,等.气候变化对我国南方双季稻发育和产量的影响[J].气候变化研究进展.2005,l(4) :151-156.[15] 王斌,陈小敏,等.海南水稻生育期的时空变化特征及对气候变暖的响应[J].热带作物学报.2017,38(3) :415-420.[16] 郑世宗,柯惠英,陈雪,等.应用彭曼法推求水稻灌溉定额的分析[J].浙江水利科技,2003(2):55-56.[17] 欧建锋,金兆森.基于彭曼法计算水稻作物需水量的简化方法[J].扬州大学学报(自然科学版) ,2006(9):57-60.[18] 仇锦先,华黎利,等.Excel在水稻生育期灌溉制度计算中的应用[J].节水灌溉,2005(1):28-30.
吐尔逊娜依·迪力夏提,等:大蒜鳞芽组培再生体系建立方法研究-68-
农艺·园艺农村经济与科技2018年第29卷第17期(总第445期)
木萨尔县),从新疆昌吉市市场购买的当年新蒜。1.2 试验方法1.2.1 培养基配制及培养条件。基本培养基为MS固体培养基(M&S M519,Phytotechnology公司产品)含蔗糖30g/L,琼脂7g/L,pH值5.8,在培养箱中光照培养,培养温度(25±1)℃,光强4000~5000lux培养于光照24h/d。植物激素采用2,4-D,6BA,2IP,NAA等(SIGMA公司产品)。
1.2.2 外植体准备。取无病无霉变的大蒜瓣放入清水中浸泡l0min,然后用无菌水冲净,在超净台上将大蒜瓣横切成2段,将有鳞芽的一段放入培养皿,切开剥出鳞芽,切2~3块,10%的次氯酸钠溶液中浸泡2min,后用无菌水冲洗3~5次。1.2.3 愈伤组织诱导培养。将外植体接种在添加不同浓度配比激素组合(共42个处理)的MS培养基上,每瓶接种10个外植体,每个处理4~5瓶,接种15d后开始观察及统计直径超
表 1 不同激素组合处理对诱导愈伤组织的影响处理组编号激素配比山东大蒜新疆大蒜
NO.1NAA2,4-D总外植体数(个)愈伤团块数(个)诱导率(%)总外植体数(个)愈伤团块数(个)诱导率
(%)A10.25mg/L1mg/L471634 411434 A20.5mg/L1mg/L503774 393385 A30.75mg/L1mg/L432660 432865 A41mg/L1mg/L452658 452658 A51.25mg/L1mg/L481940 451738 A61.5mg/L1mg/L431330 491122 A71.75mg/L1mg/L461226 471123 NO.22,4-DNAA40410431023B10.25mg/L0.5mg/L482042461022B20.5mg/L0.5mg/L482246451738B30.75mg/L0.5mg/L453476491939B41mg/L0.5mg/L383489493469B51.25mg/L0.5mg/L432660503060B61.5mg/L0.5mg/L481123462146NO.32,4-D2ip4161538411C10.5mg/L0.1mg/L489194349C21mg/L0.1mg/L471328412356C31.5mg/L0.1mg/L492653462963C42mg/L0.1mg/L441739392564C52.5mg/L0.1mg/L451942472553C63mg/L0.1mg/L481429472043NO.42ip2,4-D44716391333D10.05mg/L2mg/L451431381950D20.1mg/L2mg/L451942352983D30.15mg/L2mg/L491735412663D40.2mg/L2mg/L473166442659D50.25mg/L2mg/L503468492755N0.56BAIAA31929291034E11mg/L1mg/L321134321031E21.5mg/L1mg/L372362361953E32mg/L1mg/L341956362364E42.5mg/L1mg/L322475392974E53mg/L1mg/L341647352057E63.5mg/L1mg/L33133934618NO.6IAA6BA341132391231F10.5mg/L3mg/L351234371849F20.75mg/L3mg/L321959372465F31mg/L3mg/L402870332679F41.25mg/L3mg/L322063403383F51.5mg/L3mg/L351029371438-69-
农艺·园艺过3mm的愈伤组织。40d后继代培养一次,使用相同的培养基,继代培养1~2次。1.2.4 数据记录与处理。 经不同配比的激素组合处理的大蒜鳞芽愈伤组织,不定芽和生根情况各在培养40d和20d后开始进行记录。通过目测法观测不同激素配比对大蒜鳞芽组织培养的影响,观察记录愈伤组织发生率来计算愈伤组织诱导率,统计方法如下式所示:愈伤组织诱导率=(产生愈伤组织的茎尖数/接种茎尖总数) ×100%(数据通过Microsoft Excel 和DPS 软件进行统计分析)
2 结果与分析2.1 不同激素配比处理对大蒜鳞芽愈伤组织诱导的影响以MS固体培养基为基本培养基进行生长素与细胞分裂素的不同配比组合(共42个处理,激素配比与组合见表1),研究不同组合对大蒜鳞芽愈伤组织诱导率影响的试验。大蒜愈伤组织在诱导培养20d左右开始出现,可以从外植体的一端或两端或者整个外植体上产生,25d左右达到计数水平。经观察计数得到各处理对大蒜鳞芽愈伤组织诱导率影响结果如表l。当2,4-D浓度为1mg/L时,大蒜鳞芽诱导率随NAA浓度的增加而降低;当NAA浓度为0.5mg/L时,诱导率随2,4-D浓度的增加而增加,但2,4-D浓度超过1.25mg/L开始诱导率反而不再上涨。当2iP浓度为0.1mg/L时2,4-D浓度为1.5mg/L时的山东大蒜鳞芽愈伤组织和2,4-D浓度为2mg/L时的新疆大蒜鳞芽愈伤组织诱导率效果最好。2.2 不同处理愈伤组织幼芽分化诱导的影响大蒜愈伤组织成功诱导出来后,选定不同浓度配比的激素(6BA)继续进行培养,能成功诱导分化出幼芽(图1),但是大蒜愈伤组织诱导成芽需要更长时间(表2)。表 2 6BA不同浓度组合处理对愈伤组织诱导分化成芽的影响