高考化学总复习 第六单元 铁、铜的获取及应用训练 新人教版
- 格式:doc
- 大小:209.50 KB
- 文档页数:5


高考化学总复习《铁、铜及其化合物》专项复习1.【2020新课标Ⅱ】北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。
挹其水熬之则成胆矾,烹胆矾则成铜。
熬胆矾铁釜,久之亦化为铜”。
下列有关叙述错误的是 A .胆矾的化学式为CuSO 4 B .胆矾可作为湿法冶铜的原料 C .“熬之则成胆矾”是浓缩结晶过程D .“熬胆矾铁釜,久之亦化为铜”是发生了置换反应 2.【2020江苏】下列有关化学反应的叙述正确的是A .室温下,Na 在空气中反应生成Na 2O 2B .室温下,Al 与4.0 mol ﹒L -1NaOH 溶液反应生成NaAlO 2C .室温下,Cu 与浓HNO 3反应放出NO 气体D .室温下,Fe 与浓H 2SO 4反应生成FeSO 43.(2019天津) 下列有关金属及其化合物的应用不合理...的是 A .将废铁屑加入2FeCl 溶液中,可用于除去工业废气中的2Cl B .铝中添加适量锂,制得低密度、高强度的铝合金,可用于航空工业 C .盐碱地(含较多23Na CO 等)不利于作物生长,可施加熟石灰进行改良 D .无水2CoCl 呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水 4.(2014·全国高考真题)下列反应中,反应后固体物质增重的是A .氢气通过灼热的CuO 粉末B .二氧化碳通过Na 2O 2粉末C .铝与Fe 2O 3发生铝热反应D .将锌粒投入Cu(NO 3)2溶液5.(2020·浙江高考真题)下列说法不正确的是( )A .()344Cu NH SO ⎡⎤⎣⎦可通过4CuSO 溶液与过量氨水作用得到B .铁锈的主要成分可表示为232Fe O nH O ⋅C .钙单质可以从4TiCl 中置换出TiD .可用2H 还原MgO 制备单质Mg6.(2014·上海高考真题)用FeCl 3溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉。
对加入铁粉充分反应后的溶液分析合理的是A .若无固体剩余,则溶液中一定有Fe 3+B .若有固体存在,则溶液中一定有Fe 2+C .若溶液中有Cu 2+,则一定没有固体析出D .若溶液中有Fe 2+,则一定有Cu 析出7.(2020·浙江高考真题)黄色固体X ,可能含有漂白粉、FeSO 4、Fe 2(SO 4)3、CuCl 2、KI 之中的几种或全部。

高三化学一轮总复习第六章大题冲关滚动练六电化学原理综合应用题新人教版1.铁和铁的化合物在工业生产和日常生活中都有广泛的用途。
请回答下列问题:(1)钢铁锈蚀是目前难以解决的现实问题,电化学腐蚀最为普遍。
写出在潮湿空气中钢铁锈蚀时发生还原反应的电极反应式:________________________________。
铁锈的主要成分是____________(填写化学式),将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液中并未检测出Fe3+,用离子方程式说明原因:_____________________。
(2)爱迪生蓄电池的反应式为Fe+NiO2+2H2O 放电充电Fe(OH)2+Ni(OH)2;高铁酸钠(Na2FeO4)是一种新型净水剂。
用如图装置可以制取少量高铁酸钠。
①此装置中爱迪生蓄电池的负极是________(填“a”或“b”),该电池工作一段时间后必须充电,充电时生成NiO2的反应类型是__________。
②写出在用电解法制取高铁酸钠时,阳极的电极反应式________________________________________________。
③你认为高铁酸钠作为一种新型净水剂的理由可能是________。
A.高铁酸钠溶于水形成一种胶体,具有较强的吸附性B.高铁酸钠具有强氧化性,能消毒杀菌C.高铁酸钠在消毒杀菌时被还原生成Fe3+,水解产生氢氧化铁胶体能吸附悬浮杂质答案(1)O2+4e-+2H2O===4OH-Fe2O3·x H2O2Fe3++Fe===3Fe2+(2)①a氧化反应②Fe-6e-+8OH-===FeO2-4+4H2O③BC解析(1)正极发生还原反应,在潮湿的空气中钢铁锈蚀正极反应式为O2+2H2O+4e-===4OH-,铁锈的主要成分为Fe2O3的水合物,可表示为Fe2O3·x H2O。
由于在生锈的钢铁中,Fe过量,当Fe2O3+6H+===2Fe3++3H2O反应后又发生2Fe3++Fe===3Fe2+反应,所以检测不到Fe3+。

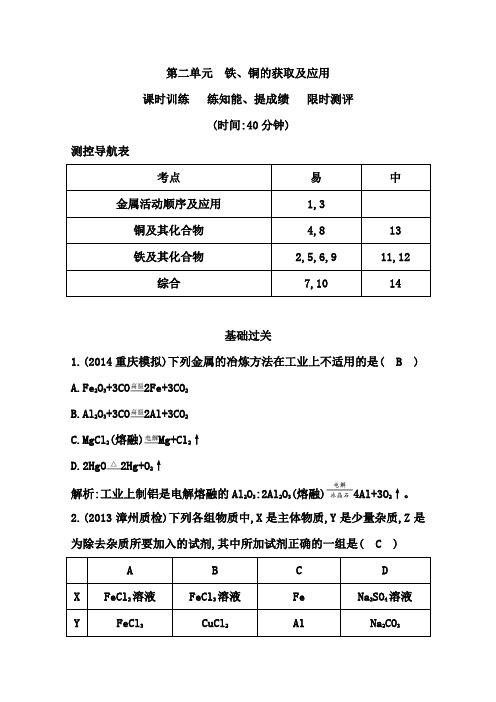
第二单元铁、铜的获取及应用课时训练练知能、提成绩限时测评(时间:40分钟)测控导航表考点易中金属活动顺序及应用1,3铜及其化合物4,8 13铁及其化合物2,5,6,9 11,12综合7,10 14基础过关1.(2014重庆模拟)下列金属的冶炼方法在工业上不适用的是( B )A.Fe2O3+3CO2Fe+3CO2B.Al 2O3+3CO2Al+3CO2C.MgCl 2(熔融)Mg+Cl2↑D.2HgO2Hg+O 2↑解析:工业上制铝是电解熔融的Al2O3:2Al2O3(熔融)4Al+3O2↑。
2.(2013漳州质检)下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一组是( C )A B C DX FeCl2溶液FeCl3溶液Fe Na2SO4溶液Y FeCl3CuCl2Al Na2CO3Z Cl2Fe NaOH溶液HCl溶液解析:A项,2FeCl2+Cl22FeCl3,除去了主体物质;B项,2FeCl3+Fe3FeCl2,CuCl2+Fe Cu+FeCl2,主体物质和杂质均被消耗;C项,2Al+2NaOH+2H2O2NaAlO2+3H2↑,NaAlO2易溶,过滤即可;D项,Na2CO3+2HCl 2NaCl+CO2↑+H2O,引入新的杂质NaCl。
3.(2014云南曲靖二模)部分氧化的FeCu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:下列说法正确的是( B )A.滤液A中的阳离子为Fe2+、Fe3+、H+B.样品中Fe元素的质量为2.24 gC.样品中CuO的质量为4.0 gD.V=896解析:因为氧化性:Fe3+>Cu2+>H+,还原性:Fe>Cu,有气体产生,则该气体是H2,所以滤液A中阳离子不可能有Fe3+,而是Fe2+、H+,则A项错误;最后的3.2 g固体为Fe2O3,其中Fe元素的质量为2.24 g,B项正确;样品中Cu元素和O元素共5.76 g-2.24 g=3.52 g,C项错误;2.24 g Fe元素不可能全是单质,故生成的H2的体积标准状况小于896 mL,D项错误。

2011年高考化学一轮精品讲练析铁、铜及其重要化合物1.理解铁单质及化合物的颜色.状态及性质。
2.通过合金材料理解铜及化合物的性质。
3.能用氧化复原反响的规律探究铁的化合物之间的互相转化。
4.能掌握氢氧化铁胶体制备,能列举合金材料的应用。
(1)NO 3-与Fe 2+在酸性条件下,不能共存。
(2)过量的Fe 与硝酸作用,或在Fe 和Fe 2O 3的混合物中参加盐酸,要留意产生的Fe 3+还能够氧化单质Fe 这一隐含反响:Fe+2Fe 3+=3Fe 2+。
(3)留意FeCl 3、Fe 2(SO 4)3的水溶液蒸干所得剩余固体的区别。
FeCl 3溶液加热浓缩时,因Fe 3+水解和HCl 的挥发,得到的固体为Fe(OH)3,如灼烧后得到红色的Fe 2O 3固体。
但Fe 2(SO 4)3溶液蒸干时,因硫酸是难挥发性酸,将不能得到Fe(OH)3固体。
(4)留意亚铁盐及Fe(OH)2易被空气中氧气氧化成三价铁的化合物。
如某溶液中参加碱溶液后,最终得到红褐色沉淀,并不能断定该溶液中一定含有Fe 3+,而也可能含有Fe 2+。
(5)留意铁单质与强氧化性物质反响时,也有生成二价铁化合物的可能性。
反响中假设铁为足量,最终铁元素将以二价铁方式存在,由于2Fe 3++Fe=3Fe 2+。
第1课时 铁和“铁三角”1.铁的氧化物的比拟 2.Fe 2+ 和Fe 3+ 的比拟3.Fe (OH )2与Fe (OH )3的比拟4.铁三角:注:(1)一般是指Zn .Al .CO. H 2. 等复原剂。
(2)是指H +. S. I 2. Cu 2+. Fe 3+.等氧化剂.(3)(5)是指Cl 2. Br 2. O 2. HNO 3. KMnO 4等氧化剂. (4)一般是指Fe. Cu. HI. H 2S.等复原剂. (6)是指Zn. Al. CO. H 2. 等复原剂。
依照铁三角有关(1)---(6)的化学方程式如下。
(1)FeCl 2+Zn=ZnCl 2+Fe 3FeCl 2+2Al=2AlCl 3+3FeFeO+CO===Fe+CO 2 FeO+H 2===Fe+H 2O (2)Fe+2H +=Fe 2++H 2↑ Fe+S===FeS Fe+I 2===FeI 2 Fe+Cu 2+=Fe 2++Cu Fe+2Fe 3+=3Fe 2+ (3)2Fe 2++Cl 2=2Fe 3++2Cl -2Fe 2++Br 2=2Fe 3++2Br -4Fe(OH)2+O 2+2H 2O=4Fe(OH)33Fe 2++4H ++NO 3-=3Fe 3++NO ↑+2H 2O 5Fe 2++MnO 4-+8H +=Mn 2++5Fe 3++4H 2O (4) 2Fe 3++Cu=Cu 2++2Fe 2+ Fe 3++Fe=3Fe 2+ 2Fe 3++2I 2Fe 3++H 2S=2Fe 2++S ↓+2H + 2Fe 3++Br 2==2FeBr 3Fe+4HNO 3=Fe(NO 3)3+NO ↑+2H 2O 4Fe+3O 2(纯)====2Fe 2O 3 (6) 2Fe 3++3Zn (足)=3Zn 2+2FeFe 3++Al=Al 3++FeFe 2O 3+2Al===Al 2O 3+2FeFe 2O 3+3CO====2Fe+3CO 2 Fe 2O 3+3H 2====2Fe+3H 2O3+.常用方法有:(1)向未知溶液滴入少量KSCN 溶液呈血红色。
排查落实练六 铁、铜及其化合物一、重要方程式的书写1.铁及其化合物(1)知识网络构建(2)重要反应必练写出下列反应的方程式,是离子反应的写离子方程式。
①Fe 和过量稀HNO 3的反应Fe +4H ++NO -3===Fe 3++NO↑+2H 2O②Fe 高温下和水蒸气的反应3Fe +4H 2O(g)=====高温Fe 3O 4+4H 2③Fe 2O 3和Al 的反应Fe 2O 3+Al=====高温2Fe +Al 2O 3④Fe 2O 3和CO 的反应Fe 2O 3+3CO=====高温2Fe +3CO 2⑤FeCl 3溶液和Cu 的反应2Fe 3++Cu===2Fe 2++Cu 2+⑥FeCl 3与KSCN 的反应Fe 3++3SCN -===Fe(SCN)3⑦向FeCl 2溶液中加入等物质的量的Na 2O 24Fe 2++4Na 2O 2+6H 2O===4Fe(OH)3↓+8Na ++O 2↑⑧向FeCl2溶液中加入NaClO2Fe2++ClO-+4OH-+H2O===2Fe(OH)3↓+Cl-⑨Fe(OH)2长时间置于空气中4Fe(OH)2+O2+2H2O===4Fe(OH)3⑩Fe3O4和HCl的反应Fe3O4+8H+===2Fe3++Fe2++4H2O⑪Fe3O4和稀HNO3的反应3Fe3O4+28H++NO-3===9Fe3++NO↑+14H2O⑫FeO和HCl的反应FeO+2H+===Fe2++H2O⑬FeO和稀HNO3的反应3FeO+10H++NO-3===3Fe3++NO↑+5H2O⑭Fe(OH)2和HCl的反应Fe(OH)2+2H+===Fe2++2H2O⑮Fe(OH)2和稀HNO3的反应3Fe(OH)2+10H++NO-3===3Fe3++NO↑+8H2O ⑯Fe(OH)3和HI的反应2Fe(OH)3+6H++2I-===2Fe2++I2+6H2O⑰FeBr2和少量Cl2的反应2Fe2++Cl2===2Fe3++2Cl-⑱FeBr2和Cl2等物质的量反应2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-⑲FeBr2和过量Cl2的反应2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-2.铜及其化合物(1)知识网络构建(2)重要反应必练写出下列反应的方程式,是离子反应的写离子方程式。
课后限时训练(时间:45分钟)必考强化1.(2014·浙江7月学考)铁元素是维持生命活动不可缺少的微量元素之一。
铁的元素符号是()A.Mg B.Ca C.Fe D.Zn解析铁的元素符号是Fe,C项正确。
答案 C2.(2015·浙江9月选考测试)下列有关Fe、Cu及其化合物的说法中,不正确的是()A.Fe、Cu元素在自然界中主要以化合态形式存在B.CO在高温下能将Fe2O3还原为FeC.Fe与盐酸、Fe与Cl2发生反应均生成FeCl2D.制作印刷电路板时,可用FeCl3溶液腐蚀Cu解析在自然界中,Fe元素主要以铁矿石形式、Cu元素主要以铜矿石形式存在,A项正确;工业炼铁原理就是在高温下用CO把Fe2O3还原为Fe,B项正确;Fe与Cl2发生反应生成FeCl3,C项错误;工业用FeCl3溶液腐蚀Cu来制作印刷电路板,D项正确。
答案 C3.(2016·浙江省宁波市九所重点校高一期末)下列物质不能通过化合反应制得的是()A.FeCl2B.Mg3N2C.Fe(OH)3D.BaSO4解析A项,Fe与氯化铁反应生成氯化亚铁,为化合反应,故A不选;B项,Mg与氮气反应生成氮化镁,为化合反应,故B不选;C项,氢氧化亚铁、氧气、水反应生成氢氧化铁,为化合反应,故C不选;D项,硫酸钡可利用复分解反应得到,不能利用化合反应生成硫酸钡,故D选。
答案 D4.(2016·浙江省师大附中高一期末)下列有关铜的说法中,不正确的是()A.铜是一种紫红色金属B.铜是热和电的良导体C.铜在自然界中主要以单质的形式存在D.铜是人类使用最早、应用最广泛的金属之一解析 铜是一种紫红色金属,是热和电的良导体,自然界中主要以化合态的形式存在,存在少量的天然铜,是人类使用最早、应用最广泛的金属之一,故C 项错误。
答案 C5.(2015·浙江宁波效实中学高二期中)下列说法正确的是( )A .高炉炼铁用于还原氧化铁的还原剂是焦炭B .炼铁时,加入石灰石的作用是促进氧化铁的还原C .我国最先应用的金属是铜D .用于电气工业的纯铜是由黄铜矿冶炼直接得到的解析 A 项,还原剂是CO 不是焦炭。
- 1 - 第六单元 铁、铜的获取及应用 1.下列铁的单质或化合物中,铁元素只有氧化性的是( ) A.Fe B.FeCl2 C.FeCl3 D.Fe3O4 解析 铁元素处于最高价态(+3价)的Fe3+只有氧化性,FeCl3符合题意;Fe3O4中含有+2价的铁,故C项正确。 答案 C 2.下列有关铜的说法中,不正确的是( ) A.铜是一种紫红色金属 B.铜是热和电的良导体 C.铜在自然界中主要以单质的形式存在 D.铜是人类使用最早、应用最广泛的金属之一 解析 铜是一种紫红色金属,是热和电的良导体,自然界中主要以化合态的形式存在,存在少量的天然铜,是人类使用最早、应用最广泛的金属之一,故C项错误。 答案 C 3.下列有关Fe2+和Fe3+的叙述中,错误的是( ) A.Fe2+的水溶液呈无色 B.Fe3+的水溶液呈黄色 C.Fe2+具有氧化性又有还原性 D.配制FeCl2溶液时加入铁粉是为了防止Fe2+被氧化 解析 Fe2+的水溶液呈浅绿色,A项错误。 答案 A 4.下列有关铁、铜的说法正确的是( ) A.宇宙中不存在游离态的铁 B.金属铁有导电性、导热性、延展性 C.铜是银白色金属,存在游离态的单质铜 D.铜与少量氯气反应生成棕黄色的CuCl 解析 自然界中存在游离态的陨铁,A项错误;金属铁具有导电性、导热性和延展性,B项正确;铜是紫红色金属,C项错误;铜被氯气氧化生成CuCl2,D项错误。 答案 B 5.下列反应不能通过化合反应直接制得的是( ) A.FeCl2 B.FeCl3 C.Fe(OH)3 D.Fe(OH)2
解析 2Fe+3Cl2=====点燃2FeCl3,Fe+2FeCl3===3FeCl2,4Fe(OH)2+O2+2H2O===4Fe(OH)3,Fe2++2OH-===Fe(OH)2↓,故能通过化合反应直接制得的是A、B、C。 答案 D - 2 -
6.在化学反应Fe2O3+3CO=====高温2Fe+3CO2中,还原剂为( ) A.Fe2O3 B.CO C.Fe D.CO2 解析 根据化合价的变化及还原剂的概念知,CO是还原剂,B项正确。 答案 B 7.苹果汁是人们喜爱的饮料。由于饮料中含有Fe2+,现榨的苹果汁在空气中由淡绿色变为棕黄色。若果汁中加入维生素C,可有效防止这种现象的发生。这说明维生素C具有( ) A.氧化性 B.还原性 C.碱性 D.酸性 解析 苹果汁在空气中由淡绿色变为棕黄色是由于苹果汁中的Fe2+被氧化成Fe3+,而加入维生素C可有效防止这种现象的发生,说明维生素C先被氧化了,从而说明维生素C具有还原性。 答案 B 8.(绍兴期末)除去铜粉中的少量铁粉,不可选用的试剂是( ) A.盐酸 B.稀硝酸 C.稀硫酸 D.硫酸铜 解析 根据铁和铜的性质,铜可与硝酸反应,铁可与盐酸、稀硝酸、稀硫酸和硫酸铜反应,故为除去铜粉中的少量铁粉,不可选用稀硝酸,B项符合题意。 答案 B 9.有关实验现象的描述中,正确的是( ) A.向氯化亚铁溶液中加入氢氧化钠溶液,有红褐色沉淀出现 B.将铜片放入氯化铁溶液,铜片表面生成银白色的铁 C.在氯化铁溶液中滴入氢氧化钠溶液,有红褐色沉淀出现 D.将铜粉加入冷的浓硝酸中会发生钝化 解析 向氯化亚铁溶液中加入氢氧化钠溶液,有白色沉淀出现,后立即变灰绿色,最终变红褐色,A项错误;将铜片放入氯化铁溶液,铜片逐渐溶解,氯化铁生成氯化亚铁,B项错误;氯化铁溶液中滴入氢氧化钠溶液,有红褐色沉淀出现,C项正确;铜粉加入冷的浓硝酸中会发生剧烈反应,而铁遇冷的浓硝酸会钝化,D项错误。 答案 C 10.下列有关铁及其化合物的说法不正确的是( ) A.工业上在高温下用CO还原含Fe2O3的铁矿石炼铁 B.铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe2O3 C.工业上可用铁容器储存、运输浓硝酸、浓硫酸 D.氯化铁溶液有较强氧化性,故可用于制作印刷电路板 解析 铁在纯氧中燃烧或高温下和水蒸气反应均能得到Fe3O4,B项错误。 答案 B 11.高炉炼铁生产中,下列说法正确的是( ) A.焦炭是炼铁的还原剂 B.采用富氧空气可以得到纯铁 C.加石灰石的目的主要是为了得到CO2 D.用于冶炼生铁的矿石主要有磁铁矿、赤铁矿 解析 焦炭在炼铁中的作用是为反应提供热量和提供反应所需的还原剂CO,它本身不能做炼铁的还原剂,A项错误;高炉炼铁得到的只是含碳量为2%~4.5%的生铁,不会得到纯铁,B项- 3 -
错误;加入石灰石的目的是它在高温下分解生成生石灰,继而再与SiO2反应生成CaSiO3炉渣,除掉杂质SiO2,故C项错误。 答案 D 12.下列说法正确的是( ) A.Fe与过量稀H2SO4反应可以生成Fe2(SO4)3 B.Cu与FeCl3溶液反应可以说明Cu比Fe活泼 C.Fe与少量的Cl2反应可以生成FeCl2 D.Cu插入到AgNO3溶液中Cu片的质量增加 解析 Fe与稀H2SO4、Cl2反应,无论Fe的量多少,产物都分别是FeSO4、FeCl3,A、C项错误;Cu+2Fe3+===Cu2++2Fe2+,不能说明Fe和Cu的活泼性强弱,B项错误;Cu+2Ag+===Cu2++2Ag,析出的Ag附着在Cu表面,质量增加,D项正确。 答案 D 13.(温州十校)能正确表示下列反应的离子方程式是( ) A.将铁粉加入稀硫酸中:2Fe+6H+===2Fe3++3H2↑ B.将磁性氧化铁溶于盐酸:Fe3O4+8H+===3Fe3++4H2O C.FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2===2Fe3++2H2O D.将铜屑加入含Fe3+溶液中:2Fe3++Cu===2Fe2++Cu2+ 解析 A项,铁与稀硫酸反应,铁元素被氧化为+2价,正确的离子方程式为Fe+2H+===Fe2++H2↑;B项,正确的离子方程式为Fe3O4+8H+===2Fe3++Fe2++4H2O;C项,得失电子不守恒、电荷不守恒;D项,三价铁离子具有强氧化性,能将铜氧化,自身被还原为二价铁离子,D正确。 答案 D 14.将铁片投入某溶液中,铁片质量减小,且没有气体产生,此溶液是( ) A.FeSO4 B.H2SO4 C.Fe2(SO4)3 D.AgNO3 解析 Fe+Fe2(SO4)3===3FeSO4,铁片质量减轻,Fe分别与H2SO4、AgNO3溶液反应,前者生成气体使铁片质量减小,后者析出银使铁片质量增加。 答案 C 15.向一定量的Cu、Fe2O3的混合物中加入300 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+。若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为( ) A.6.4 g B.4.8 g C.2.4 g D.1.6 g 解析 向混合物中加入盐酸时发生如下反应:Fe2O3+6HCl===2FeCl3+3H2O、2FeCl3+Cu===CuCl2
+2FeCl2,由题意可知:Cu与Fe2O3的物质的量相等,设二者的物质的量均为x,则有6x=0.3
L×1 mol·L-1=0.3 mol,x=0.05 mol;若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量即为氧原子的质量:0.05 mol×3×16 g·mol-1=2.4 g。 答案 C 16.火法炼铜首先要焙烧黄铜矿,其反应为2CuFeS2+O2===Cu2S+2FeS+SO2,下列说法正确的是( ) A.SO2既是氧化产物又是还原产物 B.CuFeS2仅作还原剂,硫元素被氧化 C.每生成1 mol Cu2S,有4 mol硫被氧化 D.每转移1.2 mol电子,有0.1 mol硫被氧化 - 4 -
解析 由反应方程式知在反应中CuFeS2中Cu化合价降低,被还原为Cu2S,CuFeS2中14的S化合价升高,被氧化为SO2;O2在反应后化合价降低,被还原为SO2,因此可知SO2既是氧化产物又是还原产物,A项正确;CuFeS2既是氧化剂又是还原剂,B项错误;每生成1 mol Cu2S,有1 mol硫被氧化,C项错误;利用反应知,每转移6 mol e-,有1 mol硫被氧化,即每转移1.2 mol电子,有0.2 mol硫被氧化,D项错误。 答案 A 17.铁和铜单质及其化合物在生活、生产中应用广泛。请回答下列问题: (1)铁在氧气中燃烧,现象为________________,其反应的化学方程式为_____________________________________________________________。 (2)铜在空气中加热,现象为________________,其反应的化学方程式为______________________________________________________________。 (3)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是___________________________________________________ ______________________________________________________________。
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4+4CO=====高温3Fe+4CO2,若有1.5 mol Fe3O4
参加反应,转移电子的物质的量是________。 解析 (1)铁在氧气中燃烧的现象为剧烈燃烧,火星四射,生成黑色固体,反应的化学方程式
为3Fe+2O2=====点燃Fe3O4;(2)铜在氧气中加热的现象为紫红色的铜变成黑色的氧化铜,反应的化学方程式为2Cu+O2=====△2CuO;(3)Fe3+氧化Cu而腐蚀印刷电路铜板:2Fe3++Cu===2Fe2++Cu2+;(4)1 mol Fe3O4参与反应时,需4 mol CO,转移8 mol电子,所以1.5 mol Fe3O4参加反应
时转移电子的物质的量为12 mol。
答案 (1)剧烈燃烧,火星四射,生成黑色固体 3Fe+2O2=====点燃Fe3O4 (2)紫红色的铜变成黑色的氧化铜 2Cu+O2=====△2CuO (3)2Fe3++Cu===2Fe2++Cu2+ (4)12 mol 18.在高温条件下铁与水能发生反应。资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570 ℃时,生成FeO,高于570 ℃时,生成Fe3O4。老师用下图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。
(1)实验中使用肥皂液的作用是__________________________________。 (2)某同学设计下列实验方案以确定实验后试管内的固体是否存在Fe3O4。